Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
熊本地方地震被災地の研究者支援 「緊急共同利用・共同研究」 のお知らせ
新たな抗がんメカニズムをもつ新規白金化合物
Chromatin folding and DNA replication inhibition mediated by a highly antitumor-active tetrazolato-bridged dinuclear platinum(II) complex
Ryosuke Imai, Seiji Komeda, Mari Shimura, Sachiko Tamura, Satoshi Matsuyama, Kohei Nishimura, Ryan Rogge, Akihiro Matsunaga, Ichiro Hiratani, Hideaki Takata, Masako Uemura, Yutaka Iida, Yuko Yoshikawa, Jeffrey C. Hansen, Kazuto Yamauchi, Masato T. Kanemaki, and Kazuhiro Maeshima
Scientific Reports 6, Article number: 24712 (2016) DOI:10.1038/srep24712
ゲノムDNAの正確な複製や分配、転写は、細胞が生きる上で必須の機構です。そのためこれらの機構はしばしば抗がん剤の標的となります。シスプラチンなどの白金製剤は「切れ味鋭い」抗がん作用をもち、現在、最もよく使われる抗がん剤のひとつです。これらの抗がん剤は、DNAに直接共有結合性の架橋を形成することで複製を阻害し、抗がん作用を示すことが知られていました。総研大遺伝学専攻大学院生・今井亮輔、国立遺伝研・前島一博教授らのグループは今回、近年開発された5-H-Yという新たな白金化合物が、シスプラチンなどの既存の白金製剤とは異なるメカニズムによって抗がん作用を示すことを明らかにしました。この5-H-Yはシスプラチンと同様に、DNAの複製やRNAの転写を阻害することによって細胞の増殖を抑制します。しかし、DNAへの架橋はほとんど起こさず、クロマチンを凝集させる作用があることを明らかにしました。実際に、シスプラチン耐性細胞においても5-H-Yは十分な抗がん作用を示すことも確認しています。この5-H-Yの抗がんメカニズムは、今後新たな抗がん剤を開発する上での重要な知見になると考えられます。
本研究成果は、国立遺伝研・今井亮輔総研大生、田村佐知子テクニカルスタッフ、前島一博教授、鈴鹿医療科学大学・米田誠治准教授、国立国際医療研究センター・志村まり室長、大阪大学・山内和人教授、国立遺伝研・鐘巻将人教授、東レリサーチセンター・飯田豊部長、立命館大学・吉川祐子客員教授、米国コロラド州立大・Hansen教授の各グループによる共同研究成果です。また、JST・CREST「コヒーレントX線による走査透過X線顕微鏡システムの構築と分析科学への応用」、および遺伝研・共同研究(A)の支援を受けました。
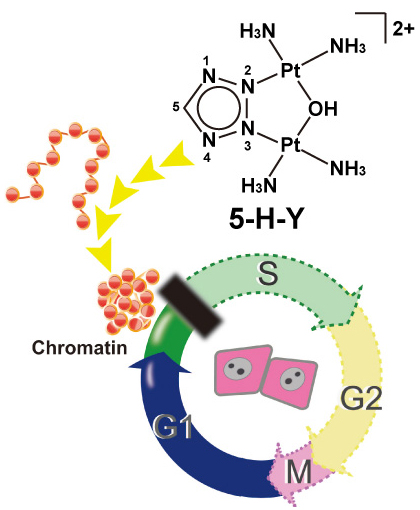
新規白金化合物5-H-YはDNA複製を阻害することで抗がん作用を示す。また、架橋はほとんど形成せず、in vitro およびin vivoでクロマチンを凝集させる。
進化的に保存された非コード塩基配列のゲノム上の位置とその機能との関連
Genomic locations of conserved noncoding sequences and their proximal protein-coding genes in mammalian expression dynamics
Isaac Adeyemi Babarinde and Naruya Saitou
Molecular Biology and Evolution DOI:10.1093/molbev/msw058
哺乳類において進化的に保存された配列 (CNS)を、特にそのゲノム上の位置について調べました。ニワトリと4種の哺乳類(ヒト、マウス、イヌ、ウシ)で保存されているCNSを抽出し、これらがヒトで現在でも淘汰上の制約を受けていることを確認しました。分布パターン、ChIP-SeqとRNA-Seqデータを調べたところ、これらのCNSが制御因子であることが示唆されました。CNSとそのもっとも近傍の遺伝子のあいだの物理距離は、ヒトとマウスのゲノムで高く保存されていました。ChIP-Seqシグナルと遺伝子の発現パターンはCNSが近傍遺伝子の発現を制御していることを示していました。CNSをより多く持つ遺伝子の方がCNSが少ない遺伝子よりも、その発現は進化的により保存的でした。これらの解析結果は、CNSのゲノム上の位置がその遺伝子発現調節機能にとって重要であることを示唆しています。本論文の筆頭著者、ババリンデ博士は総研大遺伝学専攻から博士(理)を授与されたばかりです。彼は森島賞も遺伝研から受賞しています。
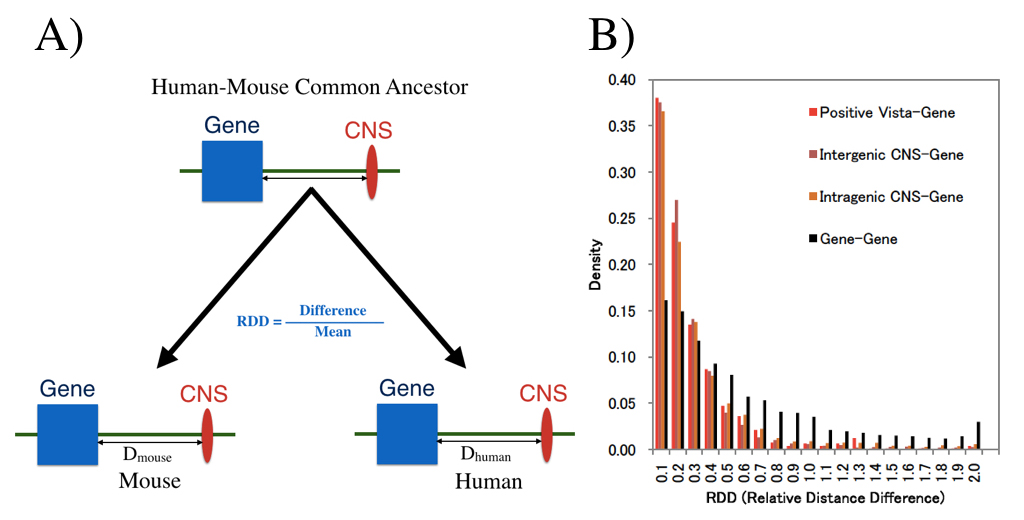
ヒトとマウスの共通祖先で存在していた遺伝子とCNSのあいだのゲノム距離が現在でも保存されているかどうかを調べました。(A)は距離保存の尺度であるRDDの定義を、(B)はRDDの分布を示しています。CNSと遺伝子のあいだの距離が遺伝子間の距離よりもずっと高く保存されています。
生体高分子研究室の前島一博教授が第24回(平成27年)木原記念財団学術賞を受賞

構造遺伝学研究センター 生体高分子研究室の前島一博教授が第24回(平成27年度)木原記念財団学術賞を受賞しました。本賞は、生命科学の分野で特に優れた独創的な研究を行っている50歳未満の研究者に授与されるものです。
受賞課題:細胞内ゲノムDNAの折り畳み構造の解明
マウス生殖細胞のオス化の鍵となる仕組みを解明
![]()
Dazl is a target RNA suppressed by mammalian NANOS2 in sexually differentiating male germ cells
Yuzuru Kato, Takeo Katsuki, Hiroki Kokubo, Aki Masuda, Yumiko Saga
Nature Communications 7, Article number: 11272 DOI:10.1038/NCOMMS11272
国立遺伝学研究所の相賀裕美子教授、加藤譲助教らはマウス生殖細胞のオス化の鍵となるタンパク質Nanos2が働く仕組みを明らかにしました。
ヒトを含め哺乳動物が子孫を残すためには、精子と卵子を作り出すことが必要です。精子も卵子も元は始原生殖細胞という未分化な細胞に由来していますが、生まれる前に、将来精子を作るか卵子を作るかの運命が決まります。この時、生殖細胞のオス化の鍵となるのがNanos2タンパク質です。Nanos2はメッセンジャーRNA(mRNA)に結合し、タンパク質への翻訳を抑制することが知られていました。しかし、Nanos2がどのmRNAを抑制し、オス化に関わるのか長い間謎でした。
今回の研究ではNanos2によって抑制されるmRNAを特定したことにより、世界で初めてNanos2による生殖細胞のオス化の仕組みを明らかにすることに成功しました。
ヒトと同じ哺乳動物であるマウスにおけるオス化の仕組みの解明はヒトの男性不妊の原因解明や、治療法の確立に繋がることが期待される基盤的な知見となります。
本研究成果は、平成28年4月13日(グリニッジ標準時)に英国オンラインジャーナルNature Communications に掲載されました。
今回の研究は国立遺伝学研究所 系統生物研究センター 発生工学研究室の加藤譲助教が中心となり、Kavli Institute for Brain and Mind, University of Californiaの勝木健雄博士との共同研究により行われました。また、この研究は科学研究費補助金若手B (25840091)、基盤S(21227008)の支援により行われました。
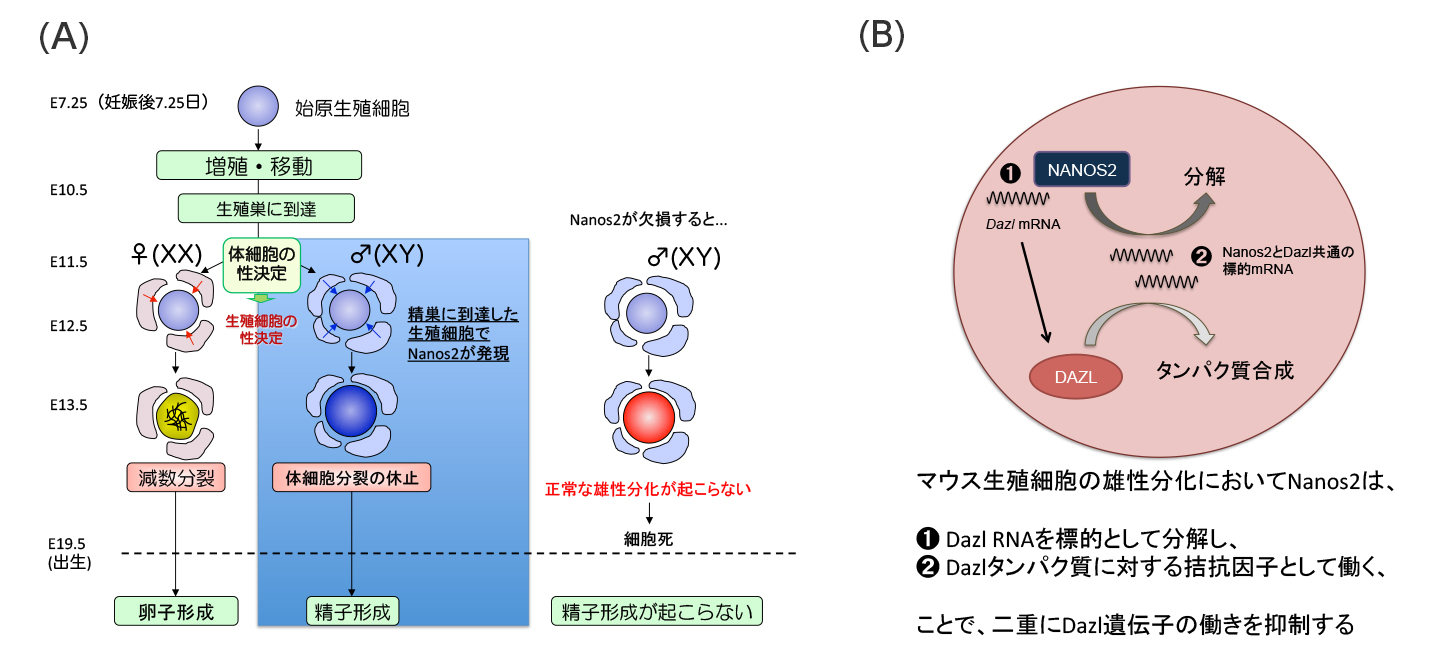
(A)精巣に入った生殖細胞でのみNanos2が働き、生殖細胞に雄としての性質が備わる。遺伝子破壊によりNanos2タンパク質が働かなくなると、雄としての性質が備わらず、細胞は死んでしまう。
(B)Nanos2タンパク質によるDazl遺伝子機能の抑制モデル。
細胞空間制御研究室 小田祥久准教授が平成28年度文部科学大臣表彰 若手科学者賞を受賞

新分野研究センター細胞空間制御研究室の小田祥久准教授が平成28年度文部科学大臣表彰 若手科学者賞を受賞しました。
本賞は、萌芽的な研究、独創的視点に立った研究等、高度な研究開発能力を示す顕著な研究業績をあげた40歳未満の若手研究者に授与されるものです。
授賞式日時:平成28年4月20日(水)
授賞式場所:文部科学省3階 講堂
受賞名:平成28年度文部科学大臣表彰 若手科学者賞
受賞テーマ:細胞の形態形成を導く空間シグナルの研究
平成28年度科学技術分野の文部科学大臣表彰受賞者等の決定について
生命の設計図DNAは、不規則に折り畳まれる性質をもつ!
![]()
Nucleosomal arrays self-assemble into supramolecular globular structures lacking 30-nm fibers
Kazuhiro Maeshima, Ryan Rogge, Sachiko Tamura, Yasumasa Joti, Takaaki Hikima, Heather Szerlong, Christine Krause, Jake Herman, Erik Seidel, Jennifer DeLuca, Tetsuya Ishikawa, and Jeffrey C. Hansen
The EMBO Journal Published online 12.04.2016 DOI:10.15252/embj.201592660
国立遺伝学研究所の前島一博教授、米国コロラド州立大J. Hansen教授らのグループは、人工的に作成したヌクレオソームを国立研究開発法人理化学研究所(理研)の大型放射光施設スプリング8の理研構造生物学Iビームライン(BL45XU)の強力なX線を用いて、構造解析しました。ヌクレオソームを様々な塩(イオン)濃度の条件下で観察したところ、教科書に載っている規則的な構造は試験管内の特別な条件下(低塩) でしか作られないことが分かりました。そして生体内の条件下では、ヌクレオソームは染色体のような大きな構造を作るため、不規則に折り畳まれる性質を持っていることを明らかにしました(図)。
全長2メートルにもおよぶ長いヒトDNAは細い糸が「ヒストン」タンパク質に巻かれて「ヌクレオソーム」を作ります。1980年代から生物学の教科書では、このヌクレオソーム線維が規則正しく束ねられて「クロマチン線維」となり、更なる階層構造ができ、細胞のなかに収納されている様子が図示されてきました。2012年、前島教授らは規則正しく束ねられたクロマチン線維は存在せず、不規則に凝縮した状態で細胞のなかに収められていることを突き止めました。さらに、今回のDNAの不規則に折り畳まれる性質の発見によって、教科書に長年にわたって記載されてきた「規則正しいクロマチン線維」の改訂が進むことも期待されます。また今回の成果は、必要な遺伝情報が細胞の中でどのように検索され、読み出されるのかを理解するうえでの手がかりになります。
本研究成果は、平成28年4月12日(中央ヨーロッパ時間)にヨーロッパ分子生物学機構雑誌EMBO Journalオンライン版(オープンアクセス) に掲載されました。
本研究成果は、米国コロラド州立大Jeffrey C. Hansen教授、Ryan Rogge大学院生らのグループ、 理化学研究所 放射光科学総合研究センター 石川哲也センター長、引間孝明研究員、高輝度光科学研究センター 城地保昌チームリーダー、国立遺伝学研究所 前島一博教授、田村佐知子テクニカルスタッフの共同研究成果です。 JST・CREST「コヒーレントX線による走査透過X線顕微鏡システムの構築と分析科学への応用」、文部科学省科研費・新学術領域「少数性生物学」の支援を受けました。
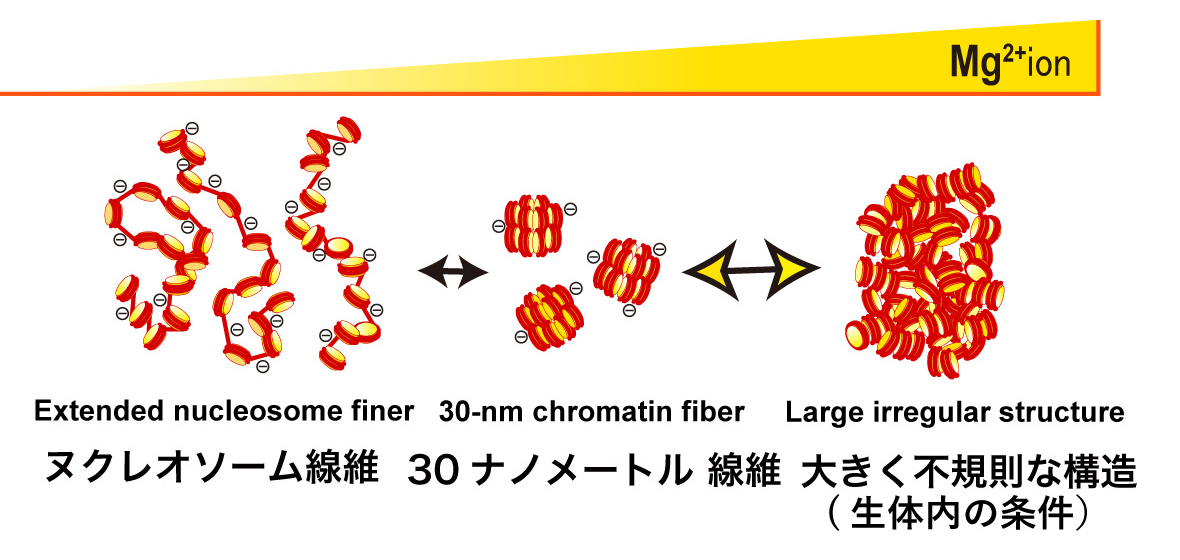
マイナス電荷を持ったヌクレオソーム線維(左)はプラス電荷の塩(Mg2+イオン)が無い状況では互いに反発して伸びる。低塩濃度では反発が少なくなり、教科書に載っている規則正しいクロマチン線維を作る(中央)。塩を更に加えると、反発がなくなり、どのヌクレオソームとの結合も可能になり、不規則で大きな構造を作る(右)。これが細胞内の染色体に相当すると考えられる。
子宮内膜症の仕組みの一端が見えてきた
![]()
Allelic Imbalance in Regulation of ANRIL through Chromatin Interaction at 9p21 Endometriosis Risk Locus
Hirofumi Nakaoka, Aishwarya Gurumurthy, Takahide Hayano, Somayeh Ahmadloo, Waleed H Omer, Kosuke Yoshihara, Akihito Yamamoto, Keisuke Kurose, Takayuki Enomoto, Shigeo Akira, Kazuyoshi Hosomichi, Ituro Inoue
PLOS Genetics Published: April 7, 2016 DOI:10.1371/journal.pgen.1005893
国立遺伝学研究所 人類遺伝研究部門 井ノ上逸朗教授らのグループは子宮内膜症のリスクとなる遺伝子多型(SNP)について、どのような分子的なメカニズムで病気が発症するのか、その一端を明らかにしました。
子宮内膜症は不妊の原因にもなりうる病気ですが、これまで発症メカニズムが不明であり、効果的な治療法がありませんでした。
本研究では、次世代シーケンサーを用いた研究により、子宮内膜症の発症リスクとなるSNPが遺伝子の調節領域に存在することを発見しました。さらに、このSNPが細胞増殖制御に重要な遺伝子、ANRILの遺伝子発現に影響することを発見しました。
本研究により、子宮内膜症の発症メカニズムの理解が深まり、治療法の確立につながることが期待されます。
本研究成果は、平成28年4月7日午後2時(米国東部時間)に米国オンラインジャーナルPLOS Genetics に掲載されました。
本研究は日本医大産婦人科と新潟大学医学部産婦人科との共同研究です。文部科学省科研基盤研究A(15H02373)の支援を受けて研究を進めました。
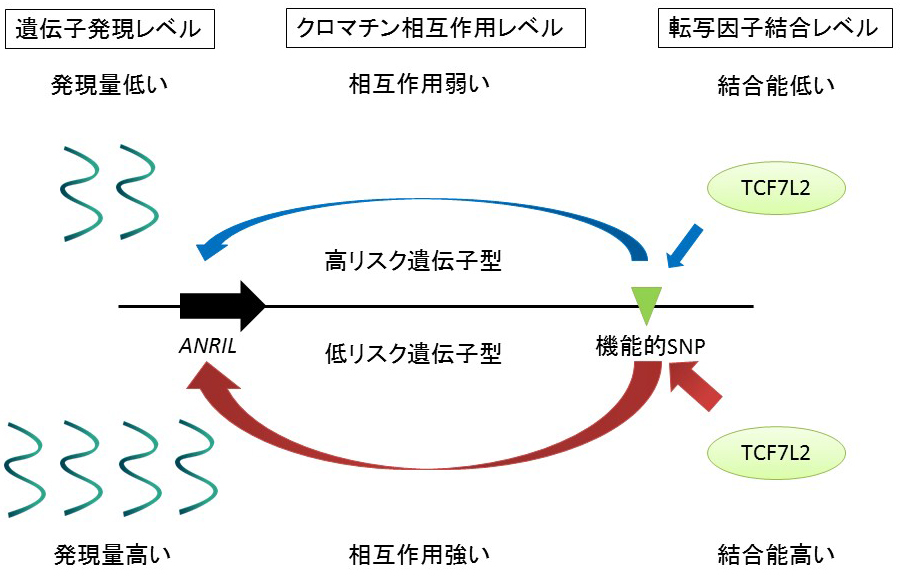
子宮内膜症の原因SNPのアレル特異的な機能的変化.子宮内膜症の低リスク遺伝子型は高リスク遺伝子型に比べて、転写因子TCF7L2の結合能が強く、ANRILプロモーターとのクロマチン相互作用が強いため、エンハンサー機能が高く、ANRIL発現量が高くなる.
細胞核が細胞の真ん中に移動するしくみ
Shape–motion relationships of centering microtubule asters
Hirokazu Tanimoto, Akatsuki Kimura*, and Nicolas Minc*
J. Cell Biol. 212: 777-787, 2016. DOI:10.1083/jcb.201510064
(* corresponding authors)
フランス・ジャック=モノー研究所のNicolas Minc博士と国立遺伝学研究所 細胞建築研究室の木村暁教授(総研大 教授兼任)らは、細胞核が細胞の中央に移動するメカニズムについて精緻な実験解析を行い、定量的なモデルを構築することに成功しました。この研究は、木村教授が、総研大若手教員海外派遣事業によってMinc研究室に滞在していた時の成果です。
細胞核が細胞の中央に移動する様子は、100年以上前から観察されており、そのしくみについては様々な説が提唱されていました。30年ほど前に日本のグループにより、細胞質が核を中央へと引っ張る「細胞質引きモデル」が提案されました(Hamaguchi & Hiraomoto, 1986)。木村教授らは、線虫(C. elegans)を用いた解析でこのモデルを支持する実験証拠や数理モデルを報告してきましたが(Kimura A & Onami, 2005; Kimura K & Kimura A, 2011)、現在でも核が「押されている」とする説や「細胞表層から引っ張られている」とする説を支持する研究者も多く、実験・理論両面でより強い証拠を得ることが求められていました。そこで、ウニ胚を変形させて細胞に加わる力を解析する技術(Minc et al. 2011)を有するMinc博士の研究室に滞在し、「細胞質引きモデル」を実証する共同研究を開始しました。
本研究で、Minc研究室の谷本博一研究員を筆頭著者とする研究グループはウニの受精卵において、精子核が細胞の端から中央まで長距離を移動することに着目し、多面的な解析を行いました。細胞へのレーザー照射や薬剤添加実験から細胞核が「押されている」のではなく、「引っ張られている」ことを示す証拠を得ました。また、細胞核を引っ張っている微小管という繊維状の構造物が進行方向側の細胞表層に到達していないことから、引っ張りの原動力は細胞表層ではなく、細胞質であることを示し、「細胞質引きモデル」を支持しました。移動速度が(線虫とは異なり)移動中ほぼ等速で、しかも、その速度が微小管の伸長速度と等しいという意外な測定結果に着目して、この現象を説明する数理モデルを構築しました。この数理モデルは、薬剤添加や微細加工技術で細胞を変形させた際の核の移動も見事に再現しました。以上の結果は、長い間続いている細胞核の中央配置に関する論争を「細胞質引きモデル」の支持へと大きく進展させる成果です。
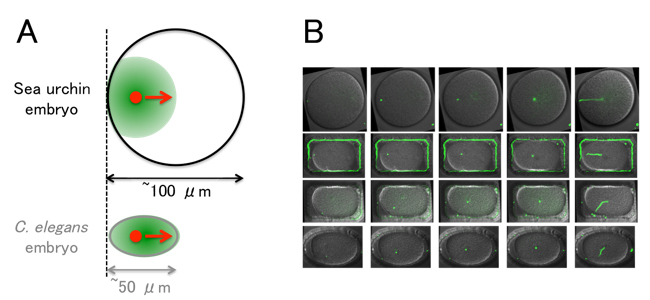
(A) ウニ(Sea urchin)受精卵における精子核の中央化:ウニの卵は線虫(C. elegans)の卵などに比べて細胞のサイズが大きいのが特徴で、核の移動中、微小管(緑)は細胞の全体をカバーしません。核(赤)は、微小管の伸長速度とほぼ同じ速度で中央化することがわかりました。
(B) 微細加工を用いた細胞の変形例:精子核(緑)が細胞の中央へ移動する様子がわかります(右端の写真は移動の軌跡を表しています)。本研究では、様々な形状に変形した細胞においても核の中央化を再現する数理モデルを構築することに成功しました。
「生命科学の新分野創造若手育成プログラム」事後評価結果
科学技術人材育成費補助事業「若手研究者の自立的研究環境整備促進」の支援を受けて実施した「生命科学の新分野創造若手育成プログラム」(2010年7月 – 2015年3月)の事後評価結果が発表されました.
http://www.mext.go.jp/a_menu/jinzai/hyouka/1368603.htm
このプログラムは「生命科学分野で新分野創造のポテンシャルを持つ若手研究者を養成する」という目標のもと,2002年以来行ってきた「新分野創造独立准教授制度」を基にテニュアトラック制を新しく展開したものです.事後評価では,採用審査での工夫や自立性を重視した育成環境など,「新分野創造」をキーワードにした養成システムが高く評価されました(総合評価:A).
遺伝研は、本プログラム終了後もテニュアトラック制を活用して、新しい遺伝学の研究分野の創成を目指す人材の養成を継続します.2016年度にも新分野創造センターでの新たな公募が予定されています.
遺伝研 一般公開2016 – 講演会の動画を配信中
4月1日付け新任教員の着任とテニュア獲得
2016年4月1日付けで2人の教授と3人の助教が遺伝研に着任しました.
教授

- 佐藤 豊 教授

- 黒川 顕 教授
助教
また,新分野創造センターの鐘巻将人准教授がテニュアを獲得するとともに、教授に昇任しました。

- 鐘巻 将人 教授















