Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
藻類のオイル生産を制御する因子を同定-有用脂質生産の自在制御に向け大きな一歩-
Press release
LIPID REMODELING REGULATOR 1 (LRL1) is differently involved in the phosphorus-depletion response from PSR1 in Chlamydomonas reinhardtii
Nur Akmalia Hidayati, Yui Yamada-Oshima, Iwai Masako, Takashi Yamano, Masataka Kajikawa, Nozomu Sakurai, Kunihiro Suda, Kanami Sesoko, Koichi Hori, Takeshi Obayashi, Mie Shimojima, Hideya Fukuzawa, Hiroyuki Ohta
The Plant Journal 27 July 2019 DOI:10.1111/tpj.14473
東京工業大学 生命理工学院のNur Akmalia Hidayati(ヌル アクマリア ヒダヤティ)博士後期課程3年、堀孝一助教、太田啓之教授、下嶋美恵准教授、岩井雅子特任助教と京都大学 福澤秀哉教授、東北大学 大学院情報科学研究科 大林武准教授、かずさDNA研究所 櫻井望チーム長(現所属・国立遺伝学研究所)らの研究グループは、バイオ燃料をはじめとする有用脂質生産に活用が期待される藻類の一種「クラミドモナス」(用語1)で、リンや窒素の栄養欠乏時に起こるオイルの蓄積を制御する因子の同定に成功しました。またこの制御因子は、特に栄養欠乏時の細胞内にオイルが大量に蓄積する時期に機能する主要な制御因子であることも突き止めました。
今回、種々の藻類で広く見られる栄養欠乏時のオイルの大量蓄積を制御する制御因子を見出したことで、明らかになった脂質蓄積の制御の機構や制御因子自体を、藻類で生産する有用脂質の種類や生産の時期を自在にコントロールするための仕組みづくりに活用することが期待されます。
藻類はリンや窒素などの栄養欠乏時に細胞内にオイルを多量に蓄積することが広く知られています。この仕組みの解明が藻類で様々な有用脂質を自在に生産するための大きな手掛かりになると考えられていました。
研究成果は7月27日発行の英国科学雑誌「プラント ジャーナル(The Plant Journal)」に掲載されました。
本研究は、科学研究費基盤研究A、科学技術振興機構 産学共創プラットフォーム共同研究推進プログラム(OPERA) 「ゲノム編集による革新的な有用細胞・生物作成技術の創出」研究領域(研究総括:山本卓(広島大学教授))における研究の一環として行われました。
本成果におけるメタボローム解析の基盤となった解析ツールやデータベースは下記のサイトから入手できます。
KOMICS (The Kazusa Metabolomics Portal)
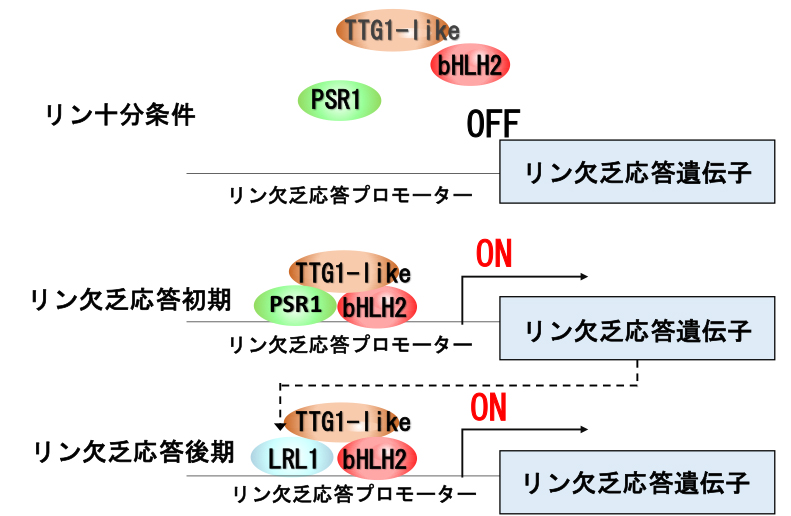
図: リン欠乏時におけるLRL1の機能のモデル
LRL1は、他の転写因子bHLH2や、制御因子の連結に関わる因子TTG1と共同してリン欠乏応答遺伝子の発現誘導に直接働いていることが明らかになった。
夏季休業のお知らせ(8/15,16)
本研究所は、下記のとおり夏季一斉休業を実施します。
ご不便をおかけいたしますが、ご理解とご協力のほどお願いいたします。
令和元年8月15日(木)、16日(金)
危険な光合成に依存しながら安全に増殖する細胞
Day/Night Separation of Oxygenic Energy Metabolism and Nuclear DNA Replication in the Unicellular Red Alga Cyanidioschyzon merolae.
Shin-ya Miyagishima, Atsuko Era, Tomohisa Hasunuma, Mami Matsuda, Shunsuke Hirooka, Nobuko Sumiya, Akihiko Kondo, Takayuki Fujiwara
mBio 10(4), e00833-19, 2019 DOI:10.1128/mBio.00833-19
光合成は約30億年前にシアノバクテリアにおいて誕生し、その後シアノバクテリアが真核細胞内に共生して葉緑体となることで真核細胞に導入され種々の藻類と植物が進化しました。さらに単細胞の真核藻類が様々な系統の真核細胞内に共生することで光合成は真核生物の複数の系統に広がりました。
光合成は地球上の生命の生育を支える一方で、高濃度の活性酸素種を生じDNA、タンパク質、脂質などを損傷します。陸上植物においては、細胞増殖は茎頂および根端等の光合成を行わない分裂組織に限定され、「危険な光合成」と「DNAを安全に複製すべき細胞増殖と次世代個体の創出」は場所(組織)によって分業されています。一方で、陸上植物よりも先に地球上に出現し、陸上植物の祖先でもある単細胞藻類では、同一細胞が光合成を行い分裂増殖しますが、光合成の危険性にどの様に対処しながら増殖しているかは不明でした。
国立遺伝学研究所の宮城島教授・恵良元研究員らと神戸大学の蓮沼教授・近藤教授らの共同研究グループは、単細胞紅藻を用いた解析を行い以下のことを明らかにしました。(1)葉緑体の光合成とミトコンドリアの呼吸(光合成ほどでは無いがこちらも活性酸素種を生じる)活性が朝方最大となり夕方に向けて低下する、(2)光合成・呼吸に比べるとエネルギー変換効率が低い解糖・発酵系が夕方から夜に活性化される、(3)核のDNA複製と細胞分裂は夜間におこる、(4)夜間の細胞に光を当てて光合成を行わせるとDNAの損傷頻度が高くなる。
以上の結果、活性酸素種を生じる光合成と、葉緑体と同様にバクテリアの細胞内共生によって誕生したミトコンドリアにおける呼吸活性が低下する夕方から夜間にDNA複製を行うことで「安全な」細胞増殖が行われていることが明らかとなりました。同様の結果は葉緑体成立後間もなく紅藻と分岐した緑藻でも見られました。
つまり宿主であると真核細胞と共生体である葉緑体・ミトコンドリアの時間分業により、お互いの対立が回避されることで光合成真核細胞が成立したと考えられます。 本研究は、科研費(基盤A、17H01446)とJST・未来社会創造事業などの支援を受けて行われました。
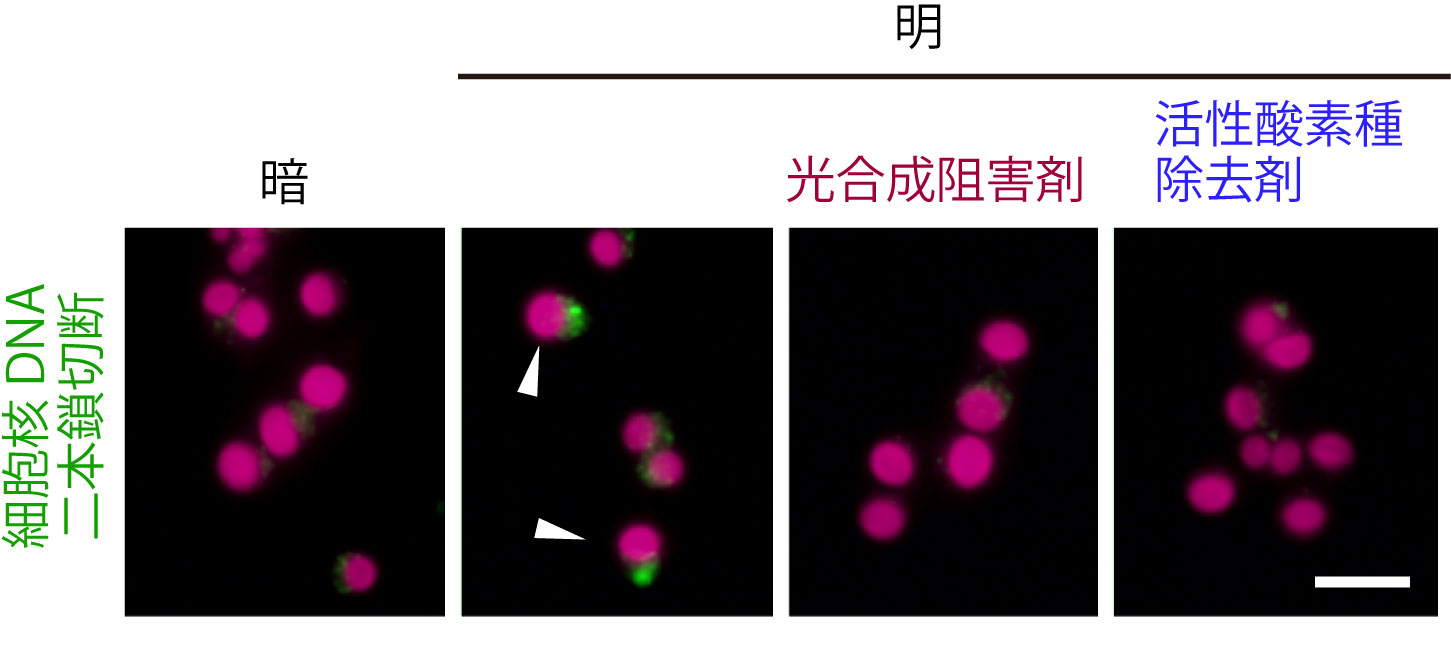
図1:単細胞紅藻Cyanidioschyzon merolaeを明暗周期培養し、夜の初期の細胞(暗)に光を当てて光合成を行わせた(明)場合と、さらにDCMU(光合成阻害剤)またはTEMPOL(活性酸素種除去剤を)加えた上で光を当てた場合。赤は葉緑体の蛍光、緑はMRE11タンパク質(DNA二本鎖切断)を示す。夜間の細胞が光合成を行うと酸化ストレスにより核DNAが高頻度に損傷する(矢尻)。
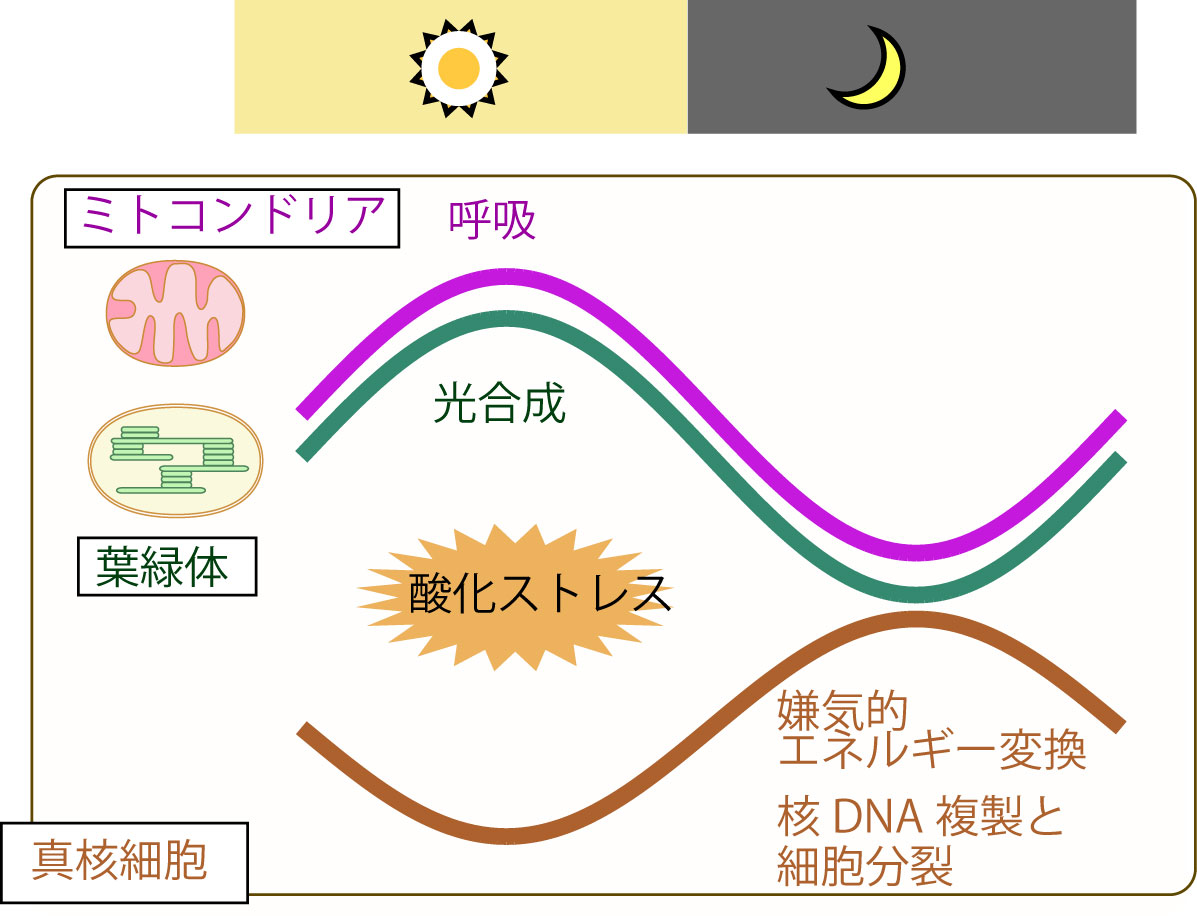
図2:真核細胞(宿主)と葉緑体(共生体・光合成)・ミトコンドリアの呼吸(共生体・呼吸)の時間分業による真核藻類細胞の安全な分裂増殖
創立70周年 特設ページを開設しました
創立70周年 特設ページを開設しました
大脳皮質の神経細胞が秩序正しく配置するしくみ
Press release
Memo1 Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development
Naoki Nakagawa, Charlotte Plestant, Keiko Yabuno-Nakagawa, Jingjun Li, Janice Lee, Chu-Wei Huang, Amelia Lee, Oleh Krupa, Aditi Adhikari, Suriya Thompson, Tamille Rhynes, Victoria Arevalo, Jason L. Stein, Zoltán Molnár, Ali Badache, E. S. Anton
Neuron Published:July 02, 2019 DOI:10.1016/j.neuron.2019.05.049
哺乳類の大脳皮質では、神経細胞の層構造が高度な情報処理に重要です。この層構造の形作りには、胎児期において、神経細胞の生みの親である神経幹細胞が重要な役割を果たします。神経幹細胞が伸ばす放射状突起が「ガイド役」として、神経細胞の移動に使われるのです。放射状突起は、それぞれの神経幹細胞から一本ずつ出ていて、互いに交わらず、脳表面に向かって等間隔に伸びています。この放射状突起が層構造づくりの「足場」の役割を果たすのです(図)。しかしながら、この「足場」がつくられるしくみはよくわかっていませんでした。
情報・システム研究機構 国立遺伝学研究所の中川直樹助教らと米国ノースカロライナ大学Eva S. Anton博士らの共同研究グループは、マウスを用いた研究で、層構造の「足場」作りに関与する遺伝子を明らかにし、層構造が作られるしくみの一端を明らかにしました。 細胞骨格の制御因子のMemo1遺伝子をマウスでノックアウトすると、神経幹細胞が伸ばす突起が過剰に枝分かれしたり、間隔にばらつきが生じたりして、「足場」が不完全になったのです。このため、神経細胞の動きが乱れて、結果として神経細胞の移動が異常になり、神経細胞の層構造に乱れが生じました。
神経幹細胞が規則的に配列し、神経細胞層づくりの足場となるためには、Memo1遺伝子が重要だったのです。
本研究は、科研費(19K16281)、早石修記念海外留学助成、米国国立衛生研究所研究費、North Carolina大学IDDRC研究費の支援を受けて実施されました。
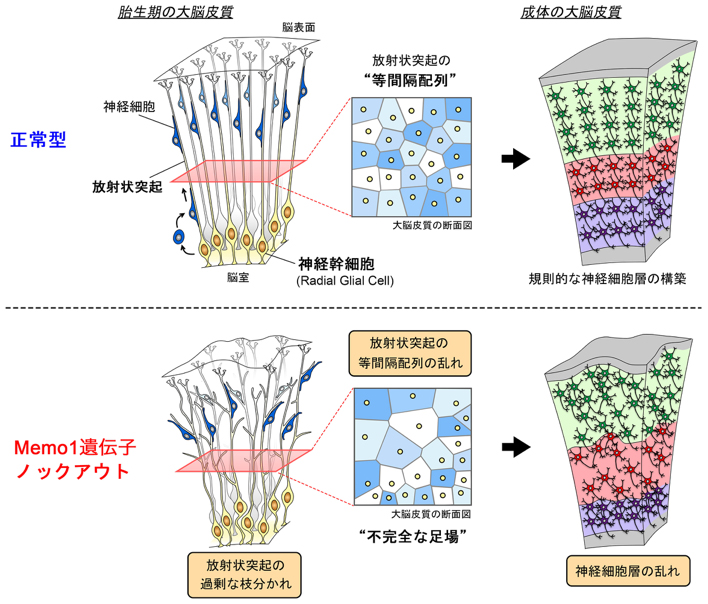
図:神経幹細胞の放射状突起にみられる等間隔配列と神経細胞層の構築
(上)胎児期の大脳皮質では、神経幹細胞は脳室を覆うシートのように局在し、それぞれ一本の放射状突起を脳表面まで伸ばしている。各神経幹細胞の放射状突起は互いに交わらず、等間隔を維持している(タイリング)。神経細胞は、等間隔に並んだ放射状突起の「足場」に沿って移動することで、規則的な層構造を構築する。
(下)今回の研究で明らかとなった、Memo1遺伝子の働きを示した模式図。Memo1の機能が無いことで、放射状突起の過剰な枝分かれと間隔のばらつきが生じ、神経細胞層の乱れにつながると考えられる。
「夏休み子ども遺伝学講座」を開催
顕微鏡で植物プランクトンを観察しよう
対象:
三島市内の小学生4年生から6年生 30名
(申込者多数の場合は抽選)
日時:
令和元年7月30日(火)
午前9時30分~午前12時00分(予定)
場所:
国立遺伝学研究所(三島市谷田1111)本館3FA316
持ち物:
筆記用具
講師:
宮城島進也 教授(国立遺伝学研究所)
申込:
三島市政策企画課まで電話か電子メールでお申込みください。
申込時に ①氏名 ②学年 ③住所 ④電話番号 をお伝えください。
申込み締切は令和元年7月16日(火)です。
E-mail: seisaku@city.mishima.shizuoka.jp
新分野創造センターのテニュアトラック教員がテニュア獲得
2019年7月1日付けで新分野創造センターの准教授がテニュアを獲得しました。
遺伝研の新分野創造センター(Center for Frontier Research)は,「あたらしい人材」と「あたらしい分野」を同時に育成するためのインキュベーションセンターです。遺伝研の卓越した研究環境や様々なサポートを活用して若手の優れた研究者がテニュアトラック独立准教授として研究室を運営し、遺伝学とその周辺領域に新しい分野を開拓する研究を行っています。テニュアを獲得した教員は遺伝研に新しい研究部門を創り、自らが創成に貢献している新分野を牽引していきます。

- 島本 勇太 准教授
















