Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
年末年始の帰省、忘年会、新年会等についての国立遺伝学研究所の取り組み
早いもので今年も余すところ10日弱となり、年末年始に合わせて帰省を予定されている方もいらっしゃるかと思います。また年の区切りに忘年会や新年会を計画されている方もおられるかもしれません。
残念ながら新型コロナウイルス感染のいわゆる第三波は衰えるどころか益々深刻さを増しており、年末年始に帰省した場合、高齢者や普段会っていない人々と会ったり会食をしたりと感染リスクが高くなります。忘年会や新年会も、当然ながらマスクを外して会話する時間が増え、感染の危険性が大幅に増えます。
今は特別な時期です。遺伝研では、年末年始の帰省は出来る限り控えますが、どうしても必要な場合には、往復の交通機関や帰省先でのマスクの着用、手指の消毒や大声、3密(密閉、密集、密接)を避けることや換気などの基本的な感染防止対策を徹底します。また、施設等を訪ねる場合も感染防止に極力配慮し、屋外でもマスクをすることを徹底します。併せて健康観察票による日々の健康観察も励行します。
新型コロナウイルスに年末年始はありません
私たちは気を抜かずに、慎重な判断と行動をおこないます。そして健康な体で新たな年を迎える所存です。
2020年12月23日
情報・システム研究機構
国立遺伝学研究所長
花岡 文雄
マウスの家畜化には脳の遺伝子発現の変化が関わる
Combined Change of Behavioral Traits for Domestication and Gene‐Networks in Mice Selectively Bred for Active Tameness
Yuki Matsumoto, Hiromichi Nagayama, Hirofumi Nakaoka, Atsushi Toyoda, Tatsuhiko Goto, Tsuyoshi Koide
Genes Brain Behav. 2020 December 13 DOI:10.1111/gbb.12721
動物の家畜化に重要な役割を果たす従順性は、能動的従順性と受動的従順性の2つの要素に分けることができます。8系統の近交系を遺伝的に混ぜた野生由来の混合集団を使用して、より高い能動的従順性を示す個体の選択交配を実施しました(図1A)。従順性を定量化する行動テストにより得られる9つの行動特性について分析したところ、5つの特性が世代を通じて対照群と比較して選択群で変化したことがわかりました。
そこで、 9つの特性間の関係を評価するためのクラスター分析を実施しました。その結果、選択対象とした能動的従順性は、対照群において他の行動特性に隠れてみられなかったものの、選択集団では顕著にみられるようになりました。このような能動的従順性の変化に関連する分子ネットワークを明らかにするために、家畜化に関連すると考えられる脳の海馬領域における遺伝子発現の解析を実施しました。その結果、高い能動的従順性を示す選択群と対照群では、136の遺伝子で発現量の違いが検出され、それにより遺伝子ネットワークの変化がみられることが分かりました(図1B)。
この結果は、選択交配によるマウスの家畜化で、脳の遺伝子発現の変化が生じて、それにより高い能動的従順性を示すようになったことを示唆しています。
本研究は、国立遺伝学研究所マウス開発研究室(小出研究室)の元大学院生松本悠貴(現アニコム先進医療研究所株式会社)と他の共著者らが行いました。科学研究費補助金15H01298, 15H05724, 16H01491, 15H04289, 24658240、日本学術振興会特別研究員奨励費(15J03197)などの助成により実施されました。
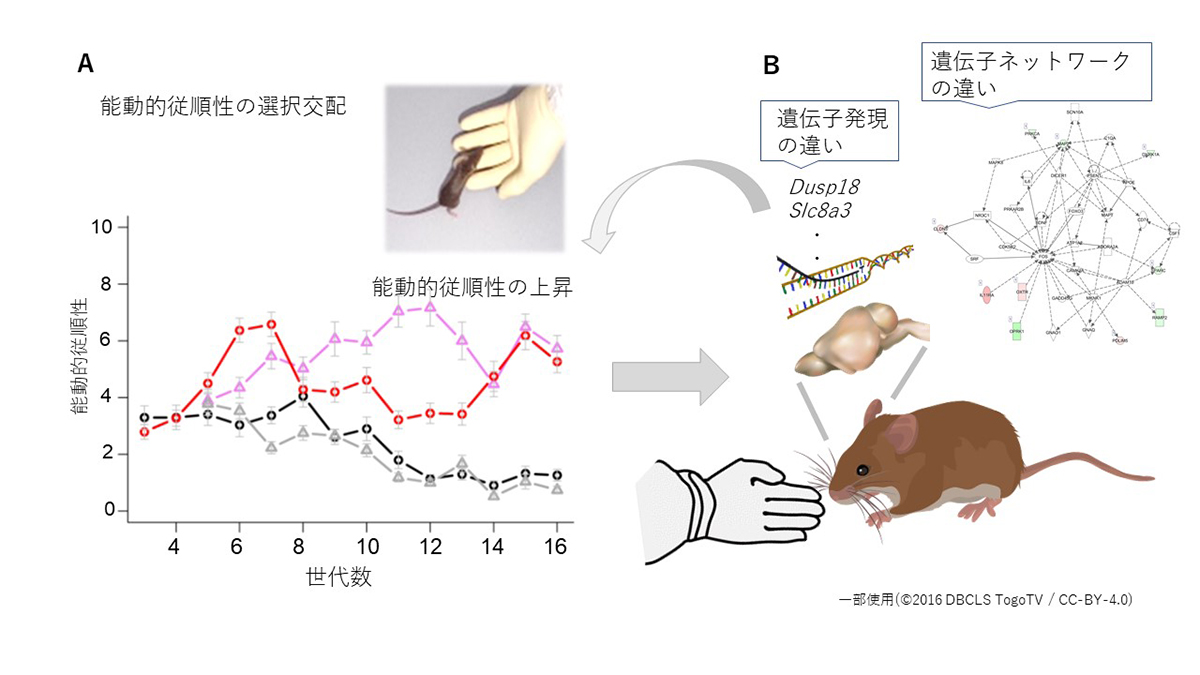
図:野生由来の遺伝的混合集団を4つの集団に分けて、2つの集団について能動的従順性について選択し、他の2つの集団は選択をしない対照群としました。A:世代が進むにしたがって、2つの選択集団では能動的従順性が増加していくのに対して、2つの対照群では顕著な増加は見られませんでした。B:選択群と対照群のマウスの脳(海馬)から採取したサンプルを用いてRNA-seq解析を行いました。その結果、選択群と対照群で発現量の異なる遺伝子が見いだされ、遺伝子ネットワークの違いも見出されました。
オンライン大学院見学会を2月17日(水)に開催(申込〆切:2月16日)
植物ミトコンドリアと葉緑体の傷ついたDNAを修復する仕組みの一端を解明
Holliday junction resolvase MOC1 maintains plastid and mitochondrial genome integrity in algae and bryophytes
Yusuke Kobayashi, Masaki Odahara, Yasuhiko Sekine, Takashi Hamaji, Sumire Fujiwara, Yoshiki Nishimura, Shin-ya Miyagishima
Plant Physiology 184, 1870-1883 (2020) DOI:10.1104/pp.20.00763
地球上の多くの生命を支える植物細胞には、呼吸を行うミトコンドリアと光合成を行う葉緑体という細胞内小器官があります。これらは、今から10〜20億年前にプロテオバクテリアとシアノバクテリアが細胞内に共生することによって誕生したと考えられており、それぞれ独自のゲノムDNAを持っています。ミトコンドリアと葉緑体のDNAには呼吸や光合成に重要な遺伝子がコードされており、DNAに傷が蓄積すると呼吸や光合成ができなくなり、最終的には植物は死んでしまいます。しかしながらこれまで、植物のミトコンドリアや葉緑体のDNAに生じた損傷がどのように修復されるのか、よくわかっていませんでした。今回、茨城大学大学院理工学研究科理学野の小林優介助教(前遺伝研 学術振興会特別研究員)を中心とした、茨城大学、国立遺伝学研究所、理化学研究所、京都大学、産業技術総合研究所からなる研究グループは、植物のミトコンドリアと葉緑体のDNAの傷を修復する仕組みの一端を明らかにしました。
傷ついたDNAを修復する代表的な機構として、相同組換え経路があります(図1A)。相同組換えでは、傷ついたDNAを同じ情報を持つDNA(相同DNA)を鋳型として利用することで修復します。相同組換えはRECAと呼ばれる組換え酵素がHollidayジャンクションと呼ばれる組換え中間体を形成することで開始され、さらにこのHollidayジャンクションが、ハサミとして機能する酵素によって切断されることで終結します(図1A)。我々は最近、葉緑体DNAが不均等分配される変異体の解析から、真核藻類と植物のみが有する葉緑体局在型のHollidayジャンクション切断酵素MOC1を発見しました (Kobayashi et al., Science 2017)。(1)しかしながら、MOC1が葉緑体DNAの相同組換え修復に関わるかどうか不明でした。(2)さらに、酵母では、ミトコンドリア型のHollidayジャンクション切断酵素CCE1が見つかっていましたが、他の生物においてはCCE1をはじめとするミトコンドリア型のHollidayジャンクション解消酵素は見つかっておらず、植物ミトコンドリアにおけるHollidayジャンクション解消機構は謎のままでした。
(1)我々はまず単細胞性藻類のクラミドモナスを用いて、MOC1が葉緑体DNAの相同組換えによる修復に寄与していることを明らかにしました。また、(2)シャジク藻類、苔類、蘚類、シダ類に加えて一部の種子植物において、MOC1が葉緑体だけでなくミトコンドリアにも局在することを示唆する結果を得ました。さらに、蘚類ヒメツリガネゴケにおいてMOC1が葉緑体とミトコンドリアの両方に局在すること、葉緑体とミトコンドリア双方のにおいてDNA修復に関与することを明らかにしました。一方で、MOC1がミトコンドリアに局在しない植物種もあり、植物ミトコンドリアの相同組換え機構が多様化していることも明らかになりました(図1B)。
本研究は、科学研究費補助金、日本学術振興会特別研究員奨励費(18J01993)、若手研究(20K15812)と基盤研究A(17H01446)などの助成によって実施されました。
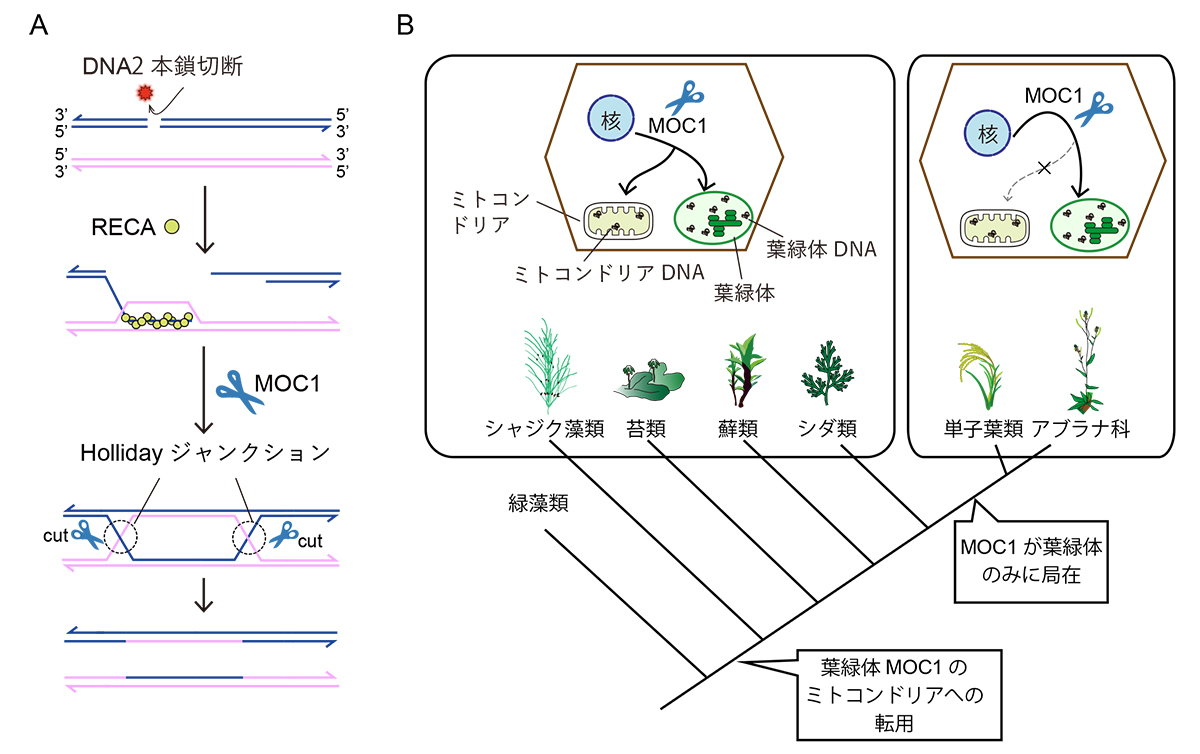
図:植物ミトコンドリアと葉緑体のDNA修復機構とその進化。A、DNA 相同組換えとHollidayジャンクション形成過程の模式図。MOC1はHollidayジャンクションを切断するハサミとして機能する。B,本研究の結果から示唆される、植物ミトコンドリアと葉緑体における相同組換え機構の進化。陸上植物進化の初期に分岐した植物種では、MOC1はミトコンドリアと葉緑体の相同組換えに必要であるが、その後、ミトコンドリアの相同組換えにMOC1を必要としない植物種が誕生したと考えられる。一方で、MOC1の葉緑体局在は藻類から植物まで観察されたことから、葉緑体におけるHollidayジャンクション解消機構は高度に保存されていると考えられる。
ヒレのリズミカルな運動をコントロールする神経回路
Neuronal Circuits That Control Rhythmic Pectoral Fin Movements in Zebrafish
Yuto Uemura, Kagayaki Kato,Koichi Kawakami, Yukiko Kimura, Yoichi Oda, and Shin-ichi Higashijima
The Journal of Neuroscience 40, 6678-6690 (2020). DOI:10.1523/JNEUROSCI.1484-20.2020
1. 背景
中枢パターン生成器(セントラルパターンジェネレータ;CPG)は、外部からのリズミックな入力なしに、脊椎動物における歩行や遊泳の際の左右交互の動きのような、リズミックな運動出力パターンを形成する回路です。CPGは脊髄に局在しており、興奮性ニューロンと抑制性ニューロンで構成され、興奮性ニューロンがリズムそのものを駆動し、抑制ニューロンが出力のタイミングおよび活動パターンを形成していると考えられていますが、その実体―神経回路―は、よくわかっていません。
2. 結果
魚類は左右のヒレを交互に動かします。ゼブラフィッシュの幼生の胸鰭(むなびれ)の動きは、リズミカルな付属肢の動きの原型と考えることができます。片側のひれにおいては外転筋と内転筋の交互の運動(屈筋と伸筋の動きに対応)が見られ、両側のひれにおいては左右の交互の運動が見られます。本研究では、リズミカルな胸鰭の動きの基盤となる神経回路を解析しました。私たちは、外転筋と内転筋の両方の運動神経が、それぞれ活動期と非活動期にリズミカルな興奮性シナプス入力と抑制性シナプス入力を受け取ることを明らかにしました。これは、運動神経の活動がプッシュプル方式で制御されていることを示しています。さらに、dmrt3aを発現する交叉型抑制性ニューロンが外転筋運動神経に対して抑制的にはたらくことを明らかにしました。
3. 今後の期待
本研究の成果により、リズミカルなひれの動きを作り出す中枢パターン生成器(セントラルパターンジェネレータ)の神経基盤の実体についての理解が進みました。また、四肢動物の歩行の際の左右の四肢の交互の動きを生み出す神経回路の実体の解明にもつながることが期待できます。
本研究は、基礎生物学研究所 神経行動学研究部門/生命創成探究センター 東島眞一教授との共同研究として行われました。本研究は部分的に、NBRPおよびNBRP基盤技術整備プログラムに支援されました。
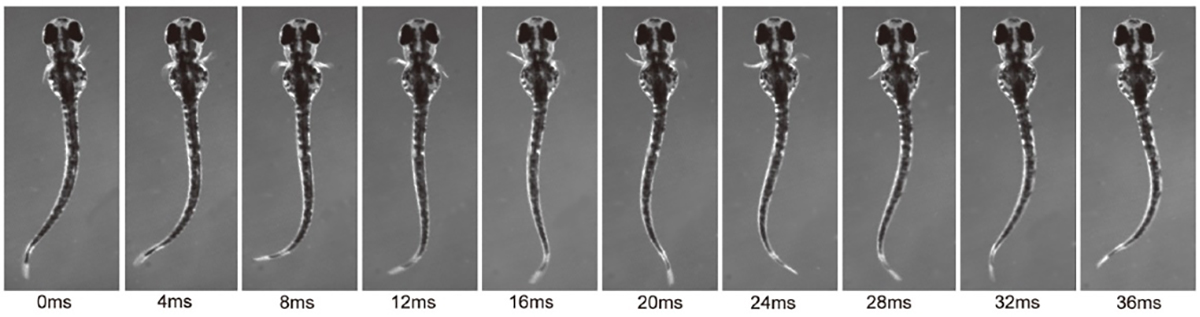
図1:ゼブラフィッシュ幼生の遊泳時における左右交互の胸鰭の動き。
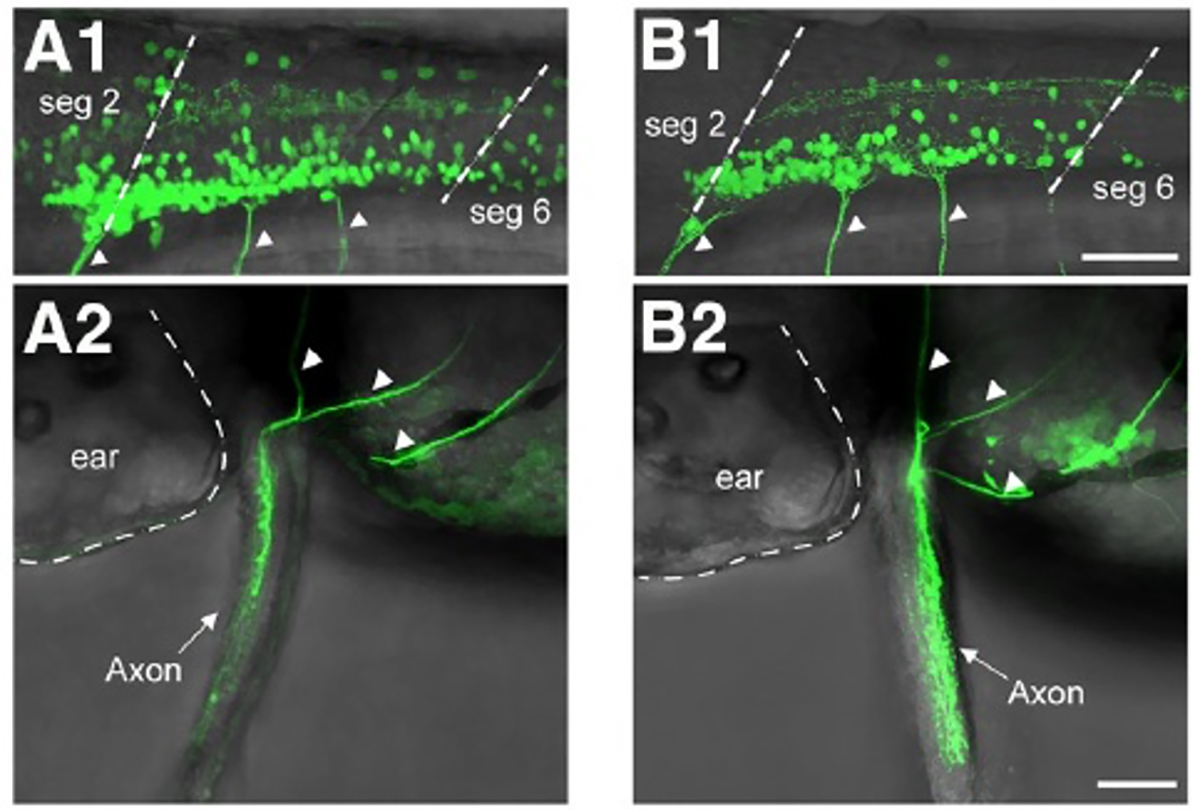
図2:A1、A2 胸鰭の外転筋を支配する運動神経をラベルしたトランスジェニックフィッシュ。
B1、B2 胸鰭の内転筋を支配する運動神経をラベルしたトランスジェニックフィッシュ。
ゲノムの可動性DNAを鎮静化する機構
RNA interference-independent reprogramming of DNA methylation in Arabidopsis
Taiko Kim To, Yuichiro Nishizawa, Soichi Inagaki, Yoshiaki Tarutani, Sayaka Tominaga, Atsushi Toyoda, Asao Fujiyama, Frédéric Berger, Tetsuji Kakutani
Nature Plants 2020 November 30 DOI:10.1038/s41477-020-00810-z
動物や植物のゲノムは、可動性で増殖する性質のDNA(transposable element: 以下TEと略する)を多量に含み、これがゲノムの不安定化や癌などの疾病の原因になります。TEを不活性化する機構として、ヒストンH3のリジン9(H3K9)のメチル化やDNAのシトシンメチル化などが知られています。このような抑制目印は、細胞分裂後にもエピジェネティックに継承、維持されます。「維持」に加え、抑制目印を「確立」するための機構として、短いRNAによるRNA干渉という機構が動物でも植物でもよく研究され、その重要性が示されてきました。
本研究では、抑制目印の「維持」に必要な因子におけるシロイヌナズナの変異体を用いて、ゲノム中のTEからこれら抑制目印が喪失した後に、抑制修飾をになう酵素を再導入することで、抑制目印の「確立」を直接調べました。その結果、驚いたことに、TE中の遺伝子コード領域(TEの増殖に必要な酵素などをコードする遺伝子領域)においては、良く知られたRNA干渉経路とは独立の経路によって、抑制目印が正確、かつ効率的に回復することがわかりました。さらに、抑制目印が回復しない少数のTEを調べることで、ヒストンH3K9meの除去に関わる酵素、ヒストンH2Aバリアント、 転写開始点付近のCG配列のメチル化、およびこれらの目印への転写からのフィードバックが抑制修飾の新規確立に重要なことが示唆されました。これらの因子は植物のみならず動物にも保存されています。本研究から明らかとなりつつある植物の抑制目印を確立する機構が、他の生物にも保存されている可能性があります。
本研究は、情報・システム研究機構 新領域融合研究プロジェクト「生命システム」として実施しました。
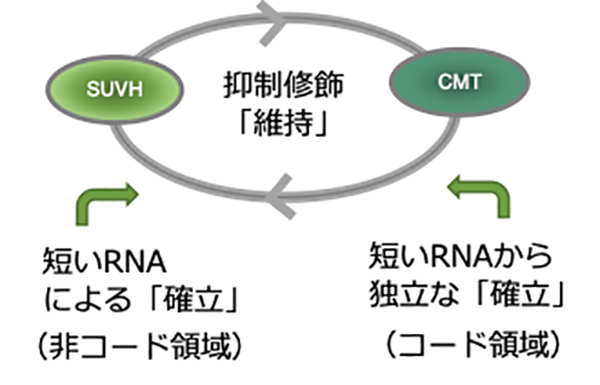
図:転移因子を抑制する機構のモデル図
SUVH(H3K9メチル化酵素)とCMT(非CG配列のDNAメチル化酵素)との相互増強によって抑制修飾が維持される。一方、抑制修飾の確立は、RNA干渉の経路に加え、これとは独立の経路がコード領域で働く。維持経路は修飾を拡張するため、RNA干渉による経路とよらない経路とが相互に補いあう。
2021年度第1回「先進ゲノム支援」支援課題の公募について
「子ども遺伝学講座」を開催
「ひとの遺伝子のふしぎ」
~君は自分の家系図を作れるかな?~
日時: 令和3年1月23日(土曜日) 午前9時30分~午前12時00分
場所: 三島市生涯学習センター3階 講義室
講師: 斎藤 成也 教授(国立遺伝学研究所 集団遺伝研究室)
対象: 三島市内の小学生4年生から6年生
定員: 30名(応募者多数の場合、抽選)
持ち物: 筆記用具
締め切り: 12/21(月)
申し込み先:
三島市政策企画課 まで お電話・電子メール・電子申請でお申込みください。
①氏名(読み仮名必須) ②通学する小学校 ③学年 ④郵便番号 ⑤住所 ⑥電話番号
をお伝えください。
ポスターのQRコード、以下の三島市ページから電子申請もできます。
E-mail: seisaku@city.mishima.shizuoka.jp
三島市ページ:https://www.city.mishima.shizuoka.jp/ipn044058.html
















