Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
満腹と空腹が食欲をコントロールするメカニズム
A bidirectional network for appetite control in zebrafish. Caroline Lei Wee
Erin Yue Song, Robert Evan Johnson, Deepak Ailani, Owen Randlett, Ji-Yoon Kim, Maxim Nikitchenko, Armin Bahl, Chao-Tsung Yang, Misha B Ahrens, Koichi Kawakami, Florian Engert, and Sam Kunes.
eLife 8:e43775 (2019). DOI:10.7554/eLife.43775
視床下部内側部および外側部は、それぞれ食欲を抑制および増強することが知られていますが、それらの相互作用のダイナミクスと機能的意義はよくわかっていませんでした。今回、我々はゼブラフィッシュ(稚魚)を用いて、飢餓状態では、主に視床下部腹内側尾部(cH)のセロトニン作動性ニューロンが活発に活動するのに対し、視床下部外側部(LH)のニューロンの活動が減少することを見出しました。これら2つの神経核の活動パターンは、食物の視覚刺激あるいは食物の摂取により逆転しました。すなわち、cHとLHの活動パターンは、飢餓と満腹という内的状態とよく一致しました。さらに我々は、cHの活性化がLHの活性を抑え食欲を減衰させること、cHの不活化が食欲を増強することを光遺伝学と遺伝学的除去実験により示し、cHとLHの活動パターンの拮抗関係と機能的重要性を明らかにしました。このことから我々は、これらの異なる視床下部の神経核の活動が、空腹と満腹の異なる内的状態を反映し、異なる行動出力を制御することにより、個体のエネルギーバランスを調整するというモデルを提唱します。
本研究は、国立遺伝学研究所川上研究室とハーバード大学Engert研究室の共同研究としておこなわれました。また、NBRP、NBRP基盤技術整備プログラムおよび科研費(JP18H04988)に部分的にサポートされました。
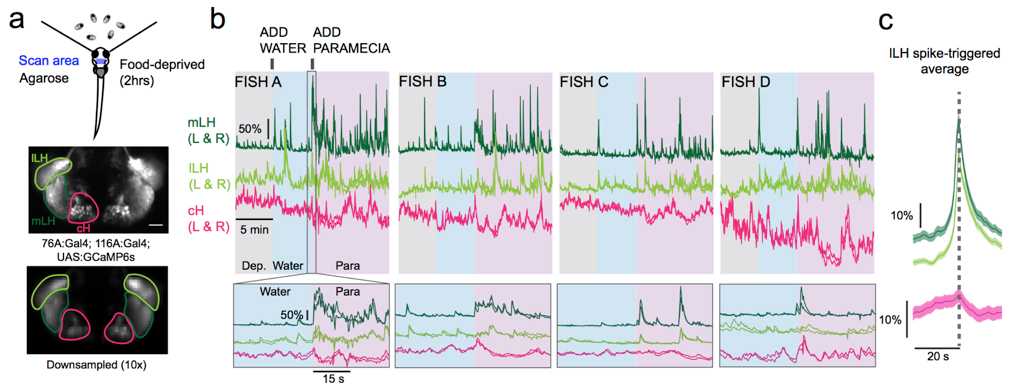
図:トランスジェニックゼブラフィッシュを用いたcHとLHのカルシウムイメージング。餌(PARAMECIA)の添加により、cHの活動が抑えられLHの活動が上昇する。
▶この研究の基盤となった研究はこちらです。
DNAの2本鎖切断を起こさないゲノム編集方法
~安全なゲノム編集治療への応用に期待~
Press release
先端ゲノミクス推進センター
Tandem paired nicking promotes precise genome editing with scarce interference by p53
Toshinori Hyodo, Md. Lutfur Rahman, Sivasundaram Karnan, Takuji Ito, Atsushi Toyoda, Akinobu Ota, Md Wahiduzzaman, Shinobu Tsuzuki, Yohei Okada, Yoshitaka Hosokawa, Hiroyuki Konishi
Cell Reports 30, 1195–1207 (2020) DOI:10.1016/j.celrep.2019.12.064
従来のDNA2本鎖切断を利用したゲノム編集方法は、高効率ですが、DNA配列の書き換えエラーも多いという問題点がありました。愛知医科大学医学部生化学講座の小西裕之教授(特任)、兵頭寿典講師らの研究グループは、高いDNA配列書き換え効率を維持しつつ、書き換えエラーの発生を劇的に抑えるゲノム編集方法の研究を行いました。 本研究は、愛知医科大学医学部内科学講座(神経内科)、国立遺伝学研究所との共同研究として行われました。
研究成果は2020年1月28日、米国科学誌「Cell Reports」(電子版)に掲載されました。 本研究は、日本学術振興会科学研究費助成事業(18K14703、18K08342、18H02645、17H05707、17K19465、17K07263)、文部科学省科学研究費助成事業・新学術領域研究「学術研究支援基盤形成」先進ゲノム解析研究推進プラットフォーム(先進ゲノム支援;16H06279)、日本医療研究開発機構・難治性疾患実用化研究事業(19ek0109243h0003)、公益財団法人ヒロセ国際奨学財団、公益財団法人武田科学振興財団の支援を受けて行われました。
遺伝研の貢献
次世代シーケンサーを用いて、ゲノム編集の評価を行うことにより、書き換え効率と書き換えエラー発生率の基盤情報を提供しました。
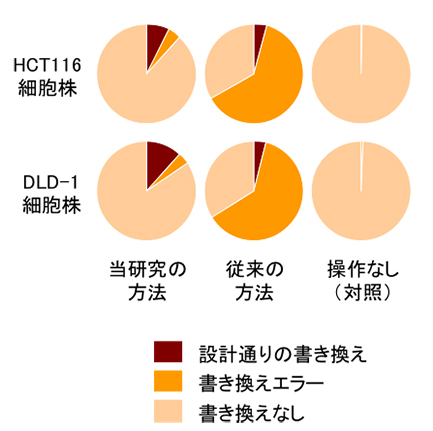
図: 当研究の方法によるゲノム書き換えの結果。従来法の結果と合わせて示す。
遺伝子回路研究室 宮崎研究員が 第48回内藤コンファレンスにおいて優秀ポスター賞を受賞

遺伝子回路研究室の宮崎隆明研究員は、2019年10月8 ~ 11日に北海道で開催された「第48回内藤コンファレンス“Integrated Sensory Sciences ― Pain, Itch, Smell and Taste”」 に於いてポスター発表を行い、優秀ポスター賞を受賞しました。
受賞名:Poster Award for Excellence
受賞ポスタータイトル:
「Comprehensive set of genetic drivers to label gustatory second-order neurons in Drosophila」第48回内藤コンファレンス “Integrated Sensory Sciences
― Pain, Itch, Smell and Taste”お米の成熟と品質制御にオートファジーが果たす役割
Essential roles of autophagy in metabolic regulation in endosperm development during rice seed maturation
Yuri Sera, Shigeru Hanamata, Shingo Sakamoto, Seijiro Ono, Kentaro Kaneko, Yuudai Mitsui, Tomoko Koyano, Naoko Fujita, Ai Sasou, Takehiro Masumura, Hikaru Saji, Ken-Ichi Nonomura, Nobutaka Mitsuda, Toshiaki Mitsui, Takamitsu Kurusu, Kazuyuki Kuchitsu
Scientific Reports 9, 18544 (2019) DOI:10.1038/s41598-019-54361-1
オートファジー(細胞内自食作用)は、真核生物に普遍的な細胞構成要素の分解や栄養リサイクルシステムです。動物などでは、発生、生殖、感染免疫・ストレスへの応答等に重要な役割を果たしますが、植物での役割の多くはよくわかっていません。
本研究では、オートファジー能を欠損したイネ変異体で、種子の胚乳(用語解説)がくず米のように白濁することを発見しました(図A)。電子顕微鏡などを用いた解析から、胚乳の白濁は、微細化に伴う澱粉粒の空隙や小孔の増加であることがわかりました(図B)。変異体の胚乳では、澱粉分解に関与する酵素の発現と活性が高まり、逆に合成酵素群の量が低下した結果、澱粉量が低下する可能性が示唆されました。また、熱ショックタンパク質(用語説明)、酸化ストレス・高温ストレス応答関連因子などが増加していました。これらの結果は、オートファジーがイネの種子登熟過程において高温など環境ストレスと関連する可能性を示唆します。
本研究成果から、将来的には植物のオートファジー活性の制御技術を開発することで、環境ストレスによる作物の収量・品質低下の防止に役立つと期待されます。
本研究は東京理科大学を中心として、公立諏訪東京理科大学、新潟大学、産業技術総合研究所、国立遺伝学研究所、秋田県立大学、京都府立大学、国立環境研究所との共同研究で得られた成果であり、NIG-JOINT (84A2018)の支援を受けました。
用語解説
胚乳(はいにゅう):植物の種子を構成する組織の一つで、イネなどでは発芽に際して胚の成長に必要な養分を供給する。外表面を湖粉層(アリューロン層)に包まれ、内部は澱粉貯蔵細胞の柔組織となっている。
熱ショックタンパク質:細胞が熱ストレスなどを受けたときに発現が上昇し、細胞をストレスから保護する役割を果たすタンパク質の一群。他のタンパク質の構造形成を助ける分子シャペロンなどの機能が知られる。

図:オートファジーが欠損したイネの種子でみられる胚乳の異常
(A) オートファジー欠損イネの種子は白濁し、品質が低下したくず米と同様の状態になる。(B) 米粒の断面図。オートファジー欠損イネの胚乳では、澱粉粒の微細化に伴う空隙や小孔(赤矢印)が多数観察される。
▶東京理科大のプレスリリース記事
「米の品質制御(イネ種子の発達・登熟)における細胞内自食作用(オートファジー)の役割を発見」
〜悪環境下における穀物の品質・収量向上技術の開発に向けた一歩〜
細胞外空間を制御するシグナルを開始する分子機構の構造的基盤
Molecular mechanism for the recognition of sequence-divergent CIF peptides by the plant receptor kinases GSO1/SGN3 and GSO2
Satohiro Okuda*, Satoshi Fujita*, Andrea Moretti, Ulrich Hohmann, Verónica G. Doblas, Yan Ma, Alexandre Pfister, Benjamin Brandt, Niko Geldner, Michael Hothorn
*These authors are equally contributed to this work
Proceedings of the National Academy of Sciences PNAS first published January 21, 2020 DOI:10.1073/pnas.1911553117
植物の根はその体を支えるだけでなく、土壌から無機栄養を吸収するために重要な器官である。根で吸収された無機栄養は維管束に濃縮されるが、濃縮された無機栄養物が自由拡散によってふたたび土の中に流出しないように、植物は維管束の外側にある内皮細胞層の細胞壁にカスパリー線と呼ばれる疎水性の障壁を形成する。
本論文ではカスパリー線の形成過程を理解するため、その形成に必要なシグナル伝達の開始点であるGSO1(SGN3)細胞膜受容体の細胞外ドメインとそのリガンドであるCIFペプチドが結合した複合体の立体構造を決定した。その結晶構造から、CIFペプチドとGSO1(SGN3)受容体複合体形成に重要なアミノ酸を同定し、さらに新たに同定した共受容体(SERKタンパク質)と三者複合体を形成するのに必須のアミノ酸も加えて同定した。
さらにCIF3/4を同定した。CIF3/4はCIF1/2同様に生理活性をもち、GSO1(SGN3)受容体とそのホモログであるGSO2とに結合することが明らかとなった。しかしながら、その結合の程度には組み合わせによって明確な差が見られ、発現部位も異なることからそれぞれのCIFペプチドと受容体の組み合わせが異なる発生イベントの制御に関わっていると推測された。本研究は、カスパリー線形成過程の分子機構の理解に寄与しただけではなく、配列が異なるペプチドがどのようにして同じ受容体に作用するかを示したものといえる。
本研究は、奥田哲弘 博士(ジュネーブ大学博士研究員)、藤田智史 博士(当時ローザンヌ大博士研究員、現遺伝研博士研究員)を中心として、ジュネーブ大Prof. Michael Horthonとローザンヌ大Prof. Niko Geldnerのグループで行われた。
本研究はSNFグラント (no. 31003A_176237 and 31CP30_180213 (M.H.), 31003A_156261 and 310030E_176090 (N.G.))、ERCグラント (616228-ENDOFUN, N.G.)、HHMIグラントおよびHFSP fellowship (no. LT000567/2016-L, S.O.), 日本学術振興会海外特別研究員制度(S.F.)の援助により行われた。
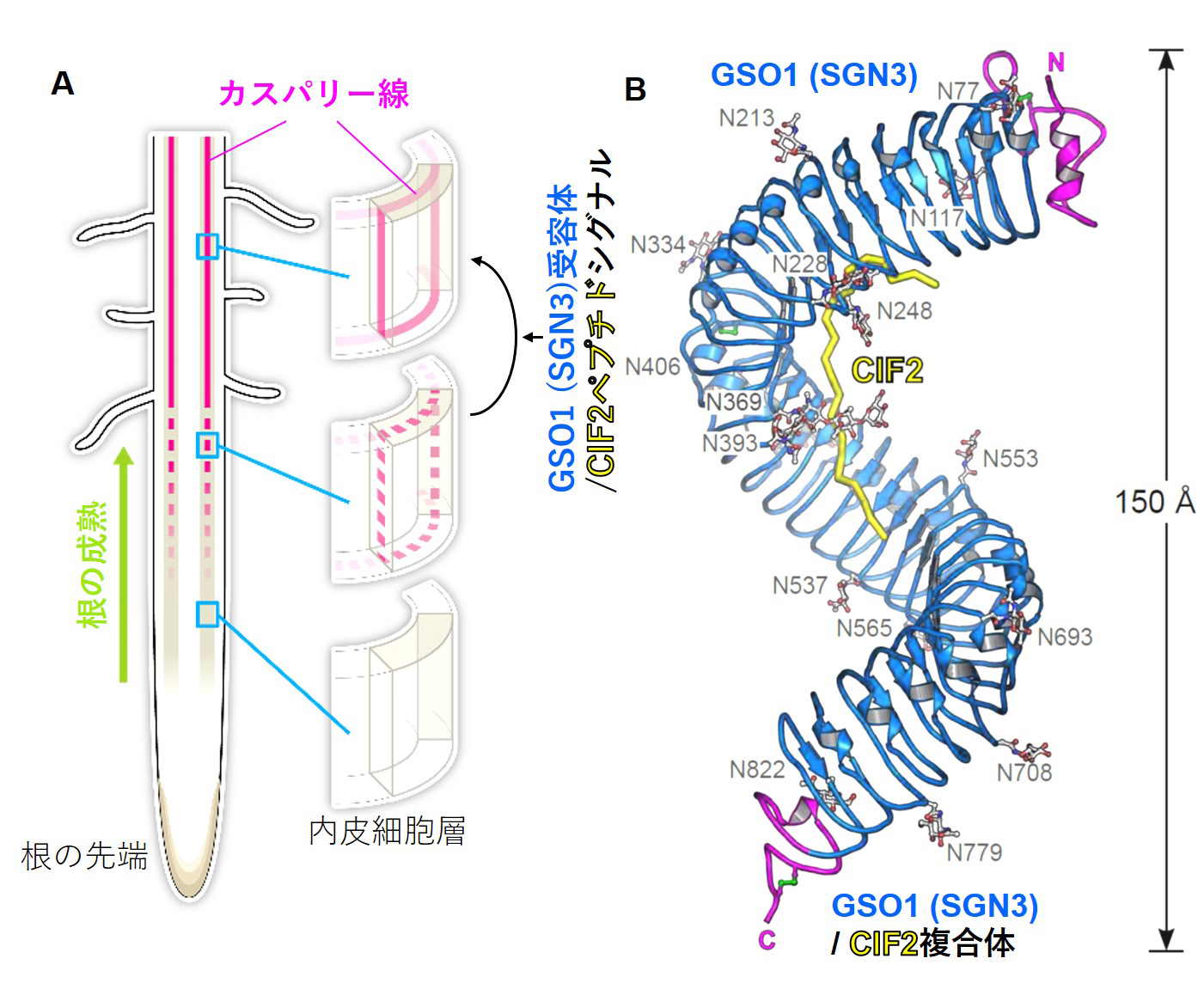
図:(A) 植物の根にみられるカスパリー線(ピンク)。完全につながると(三段目)細胞外での自由拡散に対するバリアとして機能する (図は内田博子氏による http://uchidahiroko.com/)
(B) GSO1(SGN3)/CIF2複合体の結晶構造















