Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
三島市主催 太田朋子国立遺伝学研究所名誉教授クラフォード賞受賞記念講演会 開催
「遺伝研メソッドで学ぶ科学英語プレゼンテーション」dZEROより出版

dZEROより「遺伝研メソッドで学ぶ科学英語プレゼンテーション」が1月28日に出版されました。詳細は下記および出版社ホームページをご覧ください。
- タイトル:
- 遺伝研メソッドで学ぶ科学英語プレゼンテーション[動画・音声付き]
感じる力、考える力、討論する力を育てる - 著者:
-
平田 たつみ 教授(脳機能研究部門)
タジ・ゴルマン 講師(英語専任講師)
広海 健 室長(リサーチ・アドミニストレーター室 ) - 価格:
- 3888円(税込)
クロマチンの「液体」のようなふるまい。
Liquid-like behavior of chromatin
Kazuhiro Maeshima, Satoru Ide, Kayo Hibino, and Masaki Sasai.
Current Opinion in Genetics & Development, 2016, 37: 37-45. DOI:10.1016/j.gde.2015.11.006
全長2mにもおよぶヒトゲノムDNAは人体の設計図であり、直径約10µmの細胞核のなかに折り畳められています。教科書などでは、直径2nmのDNAはまずヒストンに巻かれ、ヌクレオソームと呼ばれる構造体になり、さらに折り畳まれて直径約30nmのクロマチン線維になると長年紹介されてきました。しかしながら、最近の知見では、細胞のクロマチンが従来考えられてきたような、いわば結晶のように規則正しく折り畳まれた階層構造ではなく、「液体」のように不規則で流動的な構造であることを明らかになってきました。このようなクロマチンの「液体」のようなふるまいは、規則性を持つ構造に比べて、物理的な束縛が少なく、より動きやすいという利点を持っていると考えられます。この総説においては、クロマチン構造とダイナミクスの最近の知見に基づき、クロマチンの「液体」様ふるまいの物理的意味や、このふるまいが遺伝子の発現、DNA複製/修復などのゲノム機能に果たしている役割を論じました。
本研究は名古屋大工学研究科・笹井理生教授との共同研究としておこなわれました。JST CREST、遺伝研・共同研究(A)の研究成果です。
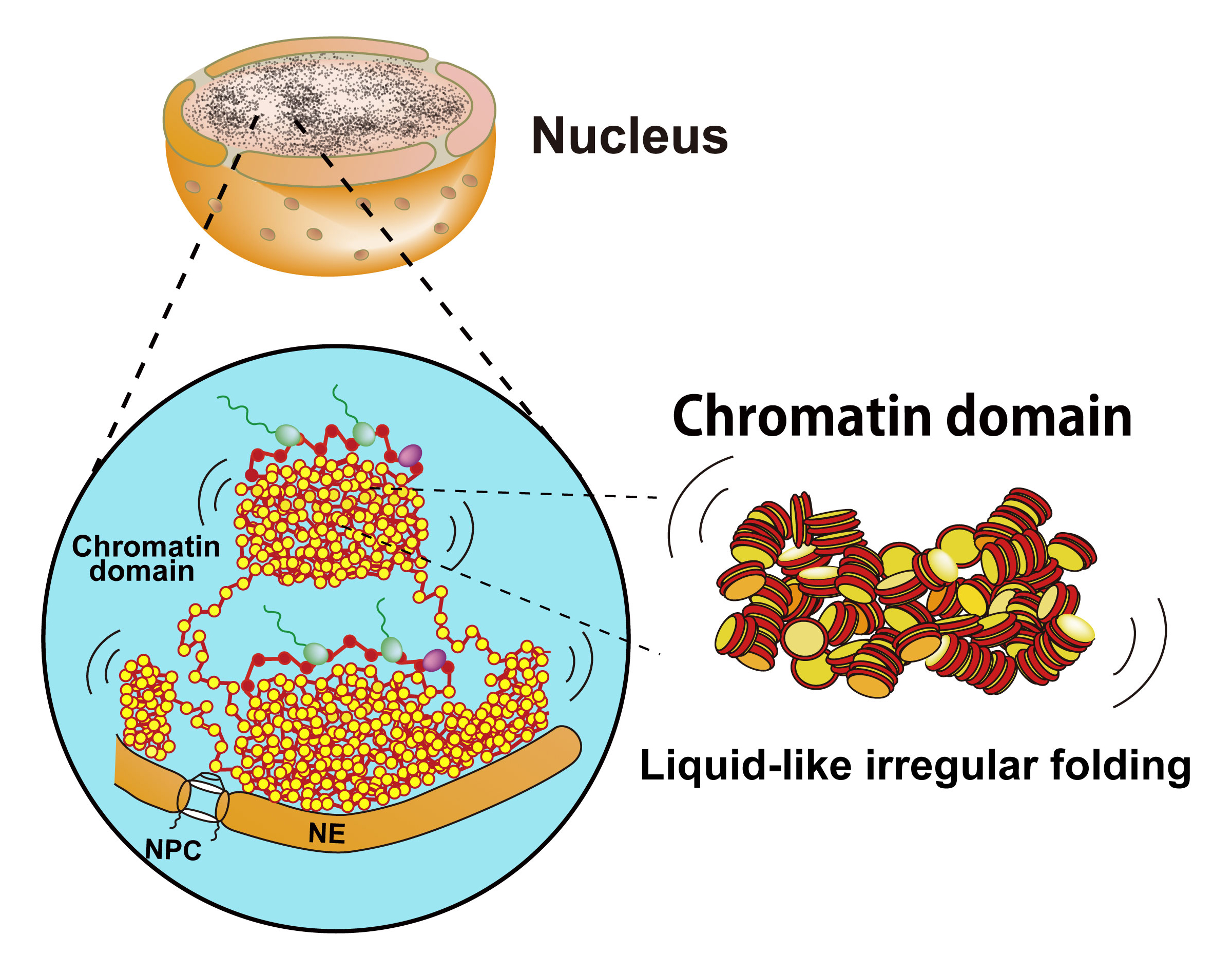
ヌクレオソーム線維(10-nm線維)がとても不規則な形で折り畳まれ、ドメインを形成している。クロマチンの「液体」のようなふるまいは、規則性を持つ大きな構造に比べて、物理的な束縛が少なく、より動きやすい。NPC, 核膜孔; NE, 核膜
従来の約100倍のサイズのゲノム編集が可能に! マウス・ラット等の遺伝子改変効率を向上させる新しい技術を開発
![]()
ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes
Kazuto Yoshimi, Yayoi Kunihiro, Takehito Kaneko, Hitoshi Nagahora, Birger Voigt, Tomoji Mashimo
Nature Communications Published 20 January 2016. DOI:10.1038/ncomms10431
大阪大学大学院医学系研究科附属動物実験施設の真下知士(ましも ともじ)准教授、情報・システム研究機構国立遺伝学研究所マウス開発研究室の吉見一人(よしみ かずと)助教らの研究グループは、ゲノム編集技術‘CRISPR/Cas システム’と一本鎖オリゴ(ssODN)を利用する二つの新しい遺伝子改変技術の方法(「lsODN(長鎖一本鎖DNA)法」と「2H2OP(2ヒット2オリゴ)法」)を開発しました。
‘CRISPR/Casシステム’は、マウスやラットにおける新しい遺伝子改変技術として注目されている技術です。DNAを切断する酵素Cas9と、ゲノム上の編集箇所を見つけ出すgRNAを動物の受精卵に注入することで、特定の遺伝子を破壊(ノックアウト)したり、特定の箇所へ導入(ノックイン)することができます。しかしながらこれまで動物の受精卵では、遺伝子などの大きなDNA配列の導入効率が低く、ノックイン動物を作製することが困難でした。
本研究で開発した二つの新しい遺伝子改変技術の方法により、GFP遺伝子の効率的かつ正確なノックインに加え、これまで不可能だった大きなサイズのゲノム領域(約200 kbp)の導入、ラット遺伝子のヒト由来遺伝子への置き換え(遺伝子ヒト化動物)に成功しました。
今後、これら二つのノックイン法は、マウスやラットなどのみならず様々な生物種における遺伝子改変操作の効率を向上させ、新しい遺伝子組み換え生物の作製に非常に有用な技術になることが期待されます。また、作製された遺伝子改変動物は、創薬研究、トランスレーショナル研究、再生医療研究などへの幅広い利用が期待されます。
本研究成果は英国ネイチャー出版グループ オープンアクセス誌「Nature Communications」から公開されました。
本研究の一部は独立行政法人日本学術振興会 科学研究費助成事業(基盤研究(B))「実験用ラットにおけるゲノム編集基盤技術の開発」(課題番号:26290033、代表:真下知士)、 独立行政法人日本学術振興会 科学研究費助成事業(研究活動スタート支援)「CRISPR/Cas9を用いた多重遺伝子ノックアウトラット作製技術の開発」(課題番号:25890011、代表:吉見一人)の事業の助成を受けておこなわれました。
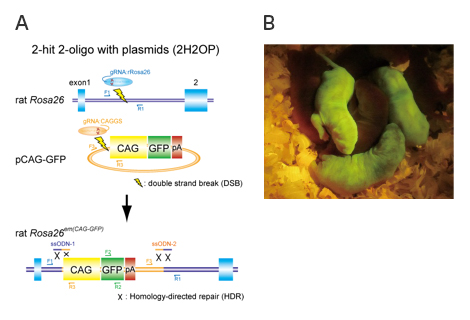
(A) 2H2OP法の略図
一本鎖DNA(ssODN)を‘のり’として利用することで、プラスミドを標的部位へ効率的にノックインできる。
(B) 2H2OP法により作製されたGFPノックインラット。
ノックイン個体は全身で緑色蛍光タンパク質を持つため、緑色に光る。
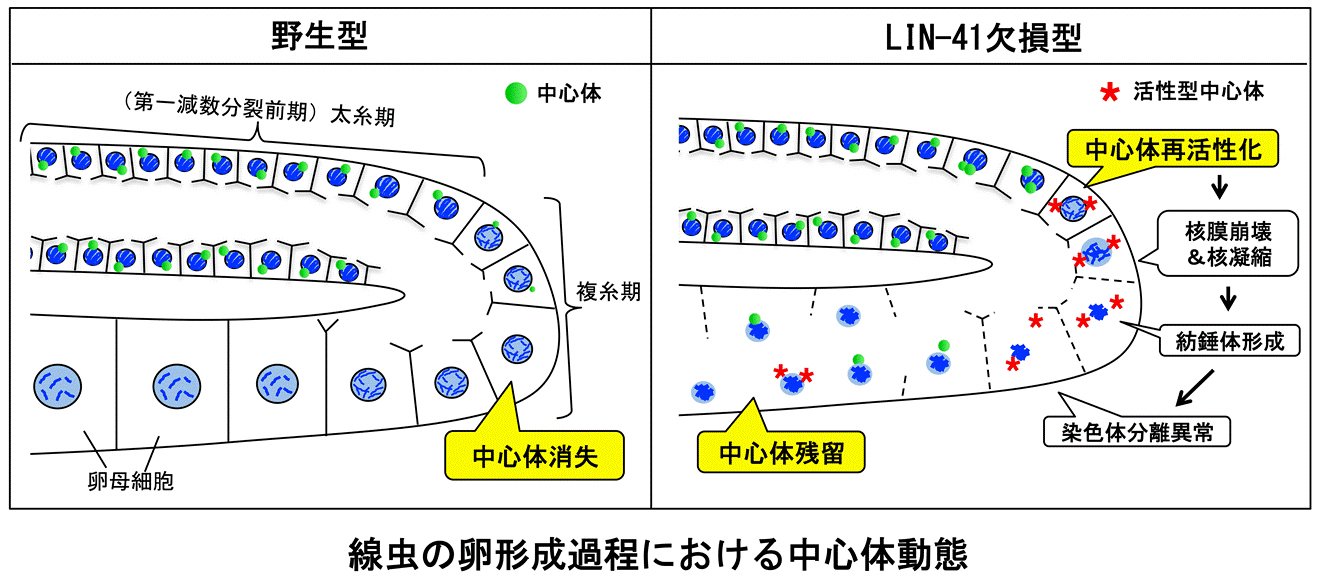
卵母細胞からの中心体消失〜減数分裂時の中心体動態を司るLIN-41〜
LIN-41 inactivation leads to delayed centrosome elimination and abnormal chromosome behavior during female meiosis in Caenorhabditis elegans
Rieko Matsuura, Tomoko Ashikawa, Yuka Nozaki and Daiju Kitagawa
Molecular Biology of the Cell, 2016 DOI:10.1091/mbc.E15-10-0713
中心体は生命現象の様々な局面で司令塔として働く細胞小器官です。その主な役割は、微小管形成中心(=中心体活性)として機能し、娘細胞へ染色体を均等に分配することです。中心体の複製や機能に異常が生じると染色体分配に影響を及ぼしますので、がんや不妊症などの原因にもなりえます。
興味深いことに、動物の受精卵には精子中心体が継承され、卵中心体は受精前に消失することがわかっています。この「卵中心体の消失」は後生動物に共通した現象ですが、メカニズムはほとんど研究されていません。
そこで我々は 、線虫の胚発生に重要な遺伝子約500個をノックダウンし、卵成熟過程における中心体動態の表現型を観察することで、卵中心体消失を積極的に誘導する因子を探索しました。左図のように、野生型では、減数分裂期に入った中心体は不活性化しており、卵が成長する過程(第一減数分裂前期複糸期)で次第に消失します。しかし、lin-41 遺伝子の発現を抑制すると、減数分裂中にも関わらず中心体の再活性化が見られ、最終的に中心体消失が抑制されることを見出しました。さらに興味深いことに、活性化された中心体は二極化した紡錘体を形成するものの、全ての染色体が片方の紡錘体極のみに引き寄せられるという奇妙な現象が見られることがわかりました。
今回の研究では、LIN-41が減数分裂時において中心体活性及び動態を制御することで、適切な減数分裂進行を担っていることが明らかにされました。
本研究は、学術振興会 科研費(24687026 24113003)、武田科学振興財団、内藤記念科学振興財団の支援を受けました。