Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
イネ減数分裂染色体のヒストンH3修飾リプログラムに関与するアルゴノート蛋白質
Histone H3 modifications are widely reprogrammed during male meiosis I in rice dependently on MEL1 Argonaute protein
Hua Liu, Ken-Ichi Nonomura
Journal of Cell Science, Published online, 12 August, 2016 DOI:10.1242/jcs.184937
減数分裂は、複製を介さない2回の連続した分裂により、染色体数を半減させる特殊な分裂であり、遺伝情報の次世代への「安定的伝達」に加え、両親から受け継いだ1対の相同染色体の対合・組み換えを通じた「遺伝的多様性の創出」に不可欠の仕組みです。
今回は、染色体の構造や遺伝子発現の制御に重要なヒストン修飾(用語解説)と減数分裂の関係に着目しました。ヒストンH3の9番目のリジン残基のジメチル化(H3K9me2)は植物では一般的に遺伝子発現を抑制し、クロマチン構造を密にするよう働くと考えられています。同じ位置のアセチル化(H3K9ac)は逆に遺伝子発現を活性化します。そこでH3K9me2およびH3K9acに対する抗体を用いて、H3修飾を減数分裂の異なる時期で比較しました。すると減数分裂移行期の前後で、H3K9me2は広範囲で増加し、H3K9acは逆に激減していました。この現象は、減数分裂を支える仕組みの一つと考えられます。
減数分裂におけるヒストンH3修飾のリプログラミング(LMR)は、以前に私たちが同定した生殖細胞特異的Argonaute蛋白質(用語解説)MEL1の突然変異体で欠損していました(図1B)。今回の結果はイネMEL1が、LMRの制御を介して減数分裂の進行を促進している可能性、そして植物の減数分裂におけるRNAサイレンシング機構の重要性を示すものです。
本成果は、学術振興会科学研究費基盤研究 (A) (25252004) および遺伝研博士研究員制度の支援を受けて実施しました。
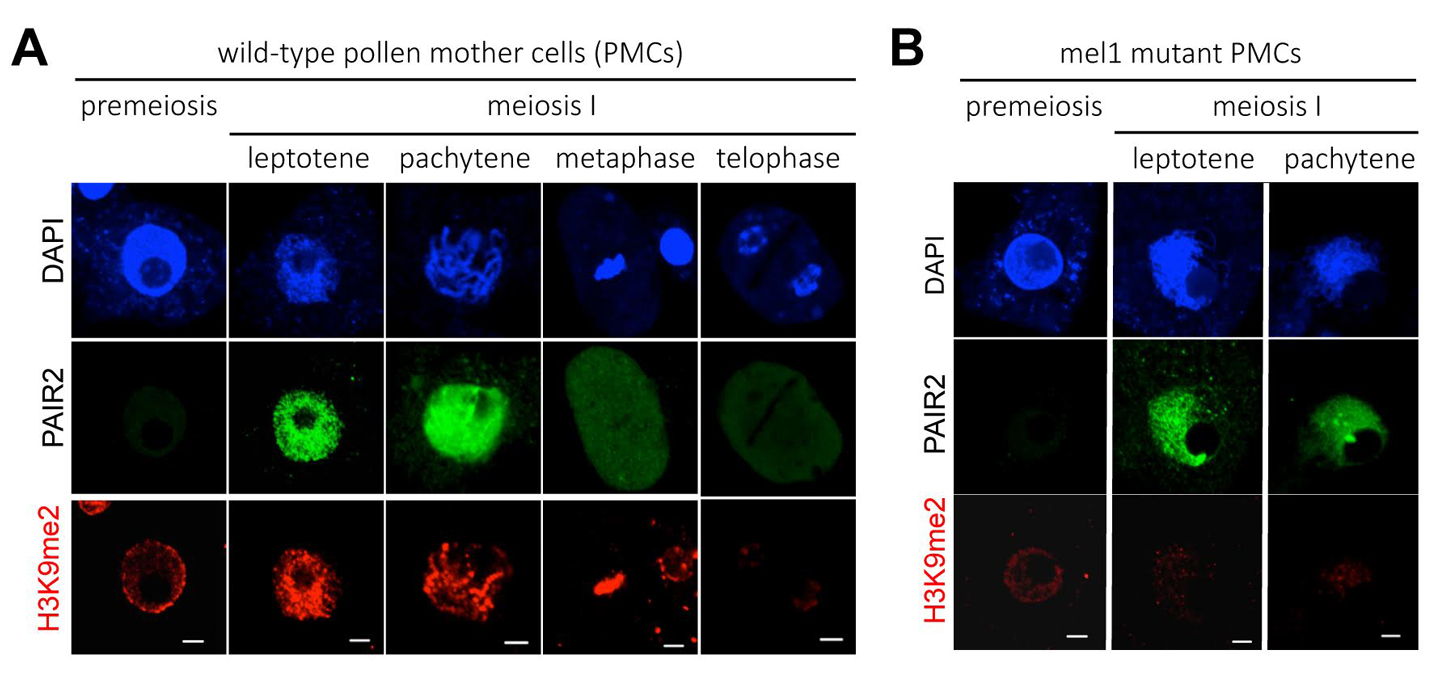
減数分裂におけるヒストンH3K9me2は MEL1依存的にリプログラムされる
(A) 正常なイネの花粉母細胞(減数分裂細胞)では、減数第一分裂に移行する過程で、H3K9me2を示すシグナル(赤)が染色体全域で顕著に増加する。染色体DNAはDAPI(青)で染色。PAIR2(緑)は減数分裂の相同染色体対合に必須のタンパク質であり、この細胞が確かに減数分裂期にあることを示している。スケールバーは5 µm。
(B) mel1突然変異体の花粉母細胞。PAIR2シグナル(緑)から細胞が減数分裂に入っていることがわかるが、H3K9me2の蓄積がほとんど起こっていない。
<用語解説>
- ヒストン修飾:
- 真核生物の染色体を構成するクロマチンは、ヒストンH2A、H2B、H3、H4の8量体にDNAが巻きついたヌクレオソームの繰り返し構造からなる。ヒストンのN末端はヒストンテールと呼ばれ、ヌクレオソームコアから飛び出している。ヒストンテールのアミノ酸が様々な修飾(アセチル化、メチル化、リン酸化など)を受けることで、DNAとヒストンの状態に変化が生じ、遺伝子発現やクロマチン構造などに様々な影響を及ぼすことが知られる。
- Argonaute蛋白質:
- 20-30塩基長程度の小分子RNAをガイド分子として、相補的な配列を持つ標的RNAに結合し、mRNAの分解や翻訳抑制、遺伝子の転写抑制、トランスポゾンの抑制、そしてウィルス防御など、RNAサイレンシングと呼ばれる機構の中で中心的な役割を果たす蛋白質。
2016年度日本育種学会春季大会で実験圃場の津田勝利助教、 小野聖二郎さんが優秀発表賞を同時受賞
2016年日本育種学会春季大会(第129回講演会)における日本育種学会優秀発表賞が発表されました。
実験圃場・野々村研究室から津田 勝利助教、小野 聖二郎さんの2名が受賞されました。
津田助教の発表は、カリフォルニア大学バークレー校のヘイク研究室および遺伝研城石研究室との共同研究の成果です。
小野さんの発表は、総研大博士論文研究の内容が土台となって得られた成果です。

実験圃場に凱旋 左:津田助教 右:小野研究員
受賞テーマ:
・津田 勝利:トウモロコシKNOTTED1の共役因子 BEL1‒like homeobox転写因子のシュート形成における機能
・小野 聖二郎:イネ減数分裂期タペート組織におけるsmall RNA生合成関連遺伝子の転写制御因子
遺伝研 新分野創造センター 10周年シンポジウム
「データ同化技術」を用いて細胞質流動の原動力を推定
Bayesian Inference of Forces Causing Cytoplasmic Streaming in Caenorhabditis elegans Embryos and Mouse Oocytes.
Niwayama R., Nagao H., Kitajima T. S., Hufnagel L., Shinohara K., Higuchi T., Ishikawa T., Kimura A.
PLoS ONE, Vol 11, e0159917 (2016). DOI:10.1371/journal.pone.0159917
国立遺伝学研究所と統計数理研究所、東北大学、理化学研究所、大阪大学、欧州分子生物学研究所の共同研究チームは、統計数理研究所で研究・開発されてきた「データ同化技術」を遺伝学に適用し、測定が困難な細胞内の力を推定することに成功しました。本研究で庭山律哉博士(総研大遺伝学専攻・日本学術振興会特別研究員、現・欧州分子生物学研究所研究員)らは、細胞内での大規模な物質の流動現象である細胞質流動に着目し、線虫(C. elegans)とマウスの細胞内の流動の方向性や速さを詳細に定量化しました。この計測データと流体力学シミュレーションモデルを統合したデータ同化によって、流動を引き起こす原動力の強さと分布を推定しました。推定された力の分布は、力の発生に重要な分子の分布と一致し、本手法の妥当性が支持されました。マウスと線虫では原動力の分布が異なっていましたが、その違いはそれぞれの細胞での流動の機能と合致していて、機能に適した力の分布をそれぞれの細胞がとっていることが示唆されました。本手法は生体内で生じる様々な流れの解析に適用可能で、今後多くの研究者に活用されることが期待されます。
本研究は情報・システム研究機構の「新領域融合センター」および「データ中心科学リサーチコモンズ」のプロジェクトとして遂行されました。新領域融合センターの合宿型会議である「クロストーク」で異分野の研究者が出会い、同センターの萌芽的研究を促進する「育成融合プロジェクト」の支援を受けて共同研究を開始しました。この間、生命科学および統計数理の両者の観点から魅惑的かつ適切な問題を探索し、取り組んできました。その後、データ中心科学リサーチコモンズ内の「データ同化」プロジェクトのサブ研究テーマとして共同研究を継続し、今回の成果発表につながりました。このプロジェクトの実施により、融合研究を開始するためのノウハウをよく理解し、高度な統計数理技術を習得した生命科学分野の若手研究者を育成し、広範な学術コミュニティに送り出してきました。長い時間はかかりましたが、情報・システム研究機構が推進する新領域創造型研究の好例となりました。この経験は「データサイエンス共同利用基盤施設」のデータ融合計算プロジェクトの運営に引き継がれています。
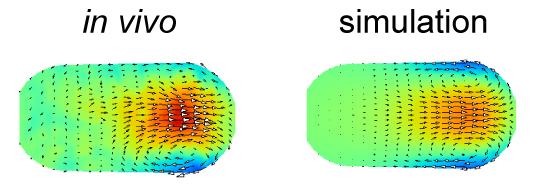
本研究で推定された原動力を用いた流体シミュレーション(右)は、実際の細胞内の流動(左)をよく再現しました。図は線虫胚での結果を示しており、色は流動の速さ、矢印は向きを表します。
細胞分裂の司令塔「中心体」の成熟過程を解明
![]()
Cep295 is a conserved scaffold protein required for generation of a bona fide mother centriole
Yuki Tsuchiya, Satoko Yoshiba, Gupta Akshari, Koki Watanabe, Daiju Kitagawa.
Nature Communications 2016 Aug 26;7:12567 DOI:10.1038/ncomms12567.
細胞が分裂するとき、染色体は糸のような繊維によってそれぞれ引っ張られ、2つの細胞に分配されます。その繊維の伸びる起点となるのが、中心体と呼ばれる細胞内小器官です。通常、1つの細胞に中心体は1つしかありません。しかし、細胞分裂時には中心体が「複製」されて2つになり対極に分かれることで、染色体を引っ張ることができます。もし中心体の複製が失敗すると、染色体を適切に分配できず、細胞分裂に支障が出ることによって、がんなどの病気になりかねません。中心体が適切に複製される仕組みの全容解明が求められています。
中心体は、柱状の部品である「中心小体」が2個組み合わさって形作られています。2個の中心小体のうち、片方が「完成された」母中心小体で、もう一方が「未完成の」娘中心小体です。中心小体の複製では、母中心小体の根元から生み出された娘中心小体が母中心小体へと成熟することが不可欠でした。
今回、国立遺伝学研究所の北川大樹教授、土屋裕樹大学院生らのグループは、娘中心小体の成熟を制御する最上流因子(Cep295)を発見しました。この因子は中心小体の成熟の初期段階で働いていて、Cep295の活性がその後の主な成熟過程に必須であること、Cep295は成熟過程に必要な既知の因子Cep192と結合することで機能することが明らかになりました。
中心体が複製される仕組みの解明は、中心体の異常に起因する様々な病気の原因解明に役立つことが期待されます。今後は、これらの知見をもとにがんの阻害剤となる化合物を探索し、新しい作用機序をもつ抗がん剤の開発を目指します。
本研究は、日本学術振興会 特別研究員奨励費、科学研究費補助金・新学術領域研究(研究領域提案型)、科学研究費補助金・若手研究(A)、JST(生命科学の新分野創造若手育成プログラム)、武田科学振興財団、内藤記念科学振興財団の支援により行われました。
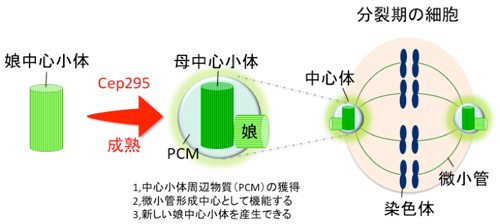
図1. 本研究成果の概略図:中心体は分裂期に対極に分かれて紡錘体と呼ばれる糸状の微小管束を生成し、染色体を引っ張ることで細胞分裂を正しく導きます。本研究では、娘中心小体が成熟し中心体としての機能を獲得する過程を明らかにしました。
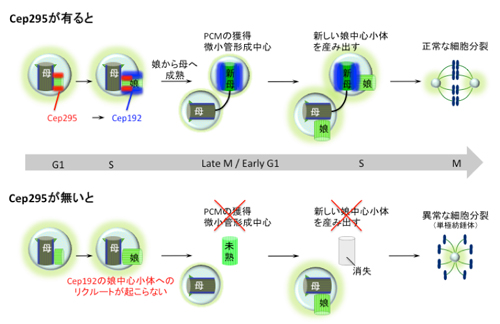
図2. モデル図:Cep295は物理的な相互作用を介してCep192を娘中心小体へとリクルートする。その後、娘中心小体は成熟し、中心体としての機能を獲得する。Cep295がない場合、未熟な中心小体はPCMや微小管形成中心としての機能、さらに新しい中心小体を産み出す能力を獲得できずにやがて消えてしまう。
遺伝研と東京農業大学は連携協定を締結しました
遺伝研から、桂所長、藤山特任教授らが東京農業大学を訪れ、東京農業大学から、髙野学長や夏秋副学長を始めとする関係者の皆様方に迎えられ、締結式を行いました。
桂所長及び髙野学長から、遺伝研と東京農業大学とは、特にゲノム関連において、以前から関係が深かったこと、また、東京農業大学においては、平成29年度に生命科学部が新設されることもあり、研究面のみならずあらゆる面において、今後連携を深めていく取組を検討していきたい旨のお話がありました。



締結式の様子















