Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
コンデンシンIIが細胞核内の染色体テリトリーをつくる
3D genomics across the tree of life reveals condensin II as a determinant of architecture type
Hoencamp, C., Dudchenko, O., Elbatsh, A. M.O., Brahmachari, S., Raaijmakers, J. A., van Schaik, T., Cacciatore, Á. S., Contessoto, V., van Heesbeen, R. G.H.P., van den Broek, B., Mhaskar, A. N., Teunissen, H., St Hilaire, B. G., Weisz, D., Omer, A. D., Pham, M., Colaric, Z., Yang, Z., Rao, S. S.P., Mitra, N., Lui, C., Yao, W., Khan, R., Moroz, L. L., Kohn, A., St. Leger, J., Mena, A., Holcroft, K., Gambetta, M. C., Lim, F., Farley, E., Stein, N., Haddad, A., Chauss, D., Mutlu, A. S., Wang, M. C., Young, N. D., Hildebrandt, E., Cheng, H. H., Knight, C. J., Burnham, T. L.U., Hovel, K. A., Beel, A. J., Mattei, P.-J., Kornberg, R. D., Warren, W. C., Cary, G., Gómez-Skarmeta, J. L., Hinman, V., Lindblad-Toh, K., di Palma, F., Maeshima, K., Multani, A. S., Pathak, S., Nel-Themaat, L., Behringer, R. R., Kaur, P., Medema, R. H., van Steensel, B., de Wit, E., Onuchic, J. N., Di Pierro, M., Lieberman-Aiden, E., Rowland, B. D.
Science 372, 984-989 (2021) DOI:10.1126/science.abe2218
染色体が細胞の核のなかでどのように配置されるのかは、細胞生物学の古典的な問題であり、19世紀から議論がありました。染色体の核内配置は、各染色体が核内にそれぞれの領域を保持する「染色体テリトリー」型と、各染色体のセントロメアやテロメアが核内の一部分に集合して配置される「Rabl」型の2つに分けることができます (図A)。例えば、菌類の細胞はRabl型で、ヒト細胞はテリトリー型であることが知られています。しかしながら、両者がどのような分子メカニズムで作り出されるのかは全く不明でした。
オランダガン研究所B.D. Rowlandとベイラー医科大学E. Lieberman-Aiden(遺伝研・国際戦略アドバイザー)率いる国際共同研究チームは、真核生物全体をほぼカバーする24種の生物のゲノム配列とその核内3次元構造をHi−C法を用いて決定しました (図B)。その結果、染色体の核内配置でRabl型をとる多くの生物は、コンデンシンIIのサブユニットが欠損していることを見出しました。コンデンシンは染色体形成に必須なタンパク質複合体であり、5個のサブユニットから出来ています。セキツイ動物ではコンデンシンIとIIの二種類が存在することが知られています。
実際、国際共同研究チームがヒト培養細胞で、コンデンシンIIを除去すると、各染色体のセントロメアが集合するようになり、Rabl型に近い核内配置となりました (図C)。コンデンシンIIは細胞分裂時の染色体形成において、染色体の長さを短くする機能を持ちます。さらに、計算機シミュレーションをおこない、細胞分裂時に染色体を短くすると、染色体テリトリー型の配置になりやすくなることを示しました。一方、染色体が短くならないと、染色体分配後、セントロメアが集合したままになり、それに付随してテロメアも集合しやすくなり、Rabl型になります(図C)。
またE. Lieberman-Aidenと国立遺伝研の共同研究より、近縁で染色体の長さが大きく異なるホエジカのHi-Cゲノム解析をおこないました。その結果、長い染色体をもつインドホエジカはRabl型で、短い染色体をもつ中国ホエジカはテリトリー型の配置であることが分かり、染色体の長さが核内配置に重要であることのさらなる示唆が得られました。遺伝研の貢献部分は文部科学省科研費 学術変革領域A「ゲノムモダリティ」(20H05936)の支援を受けています。
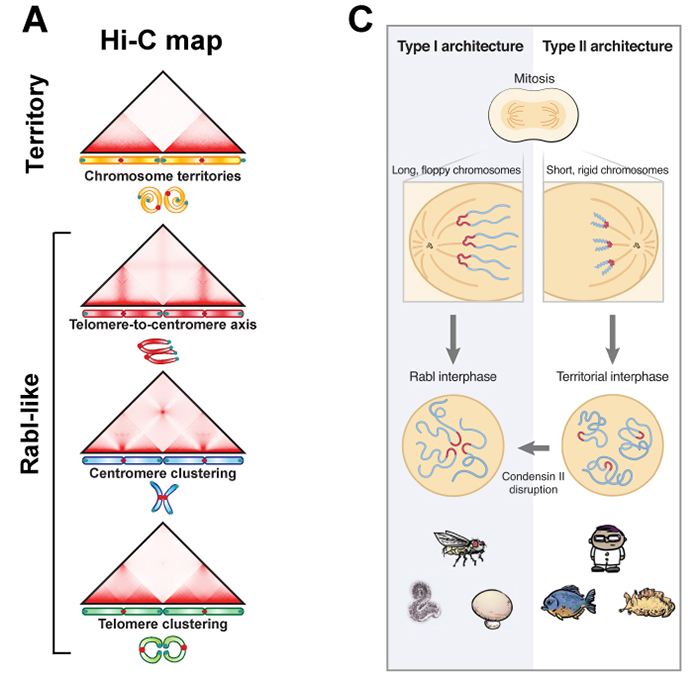
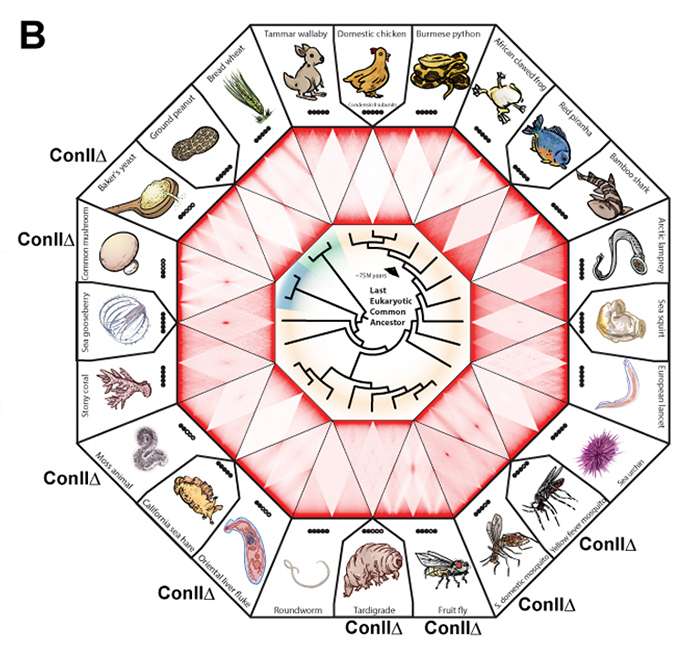
図:(A) Hi-Cマップによる染色体の核内配置の分類。一番上は染色体テリトリー型、下の3つはRabl型で個々の染色体のセントロメア(テロメアの場合もある)が集合している特徴をもつ。(B)真核生物をカバーする24種の生物 (動物 (中央の系統樹の黄領域)、植物(緑)、菌類(青)のHi-Cマップとその生物におけるコンデンシンIIの5つのサブユニットの有無(○有り、●なし)。欠損サブユニットがある場合、Con IIΔと表示している。(C) モデル図。Condensin IIによって細胞分裂中、染色体が短くなるとテリトリー型の配置となり、短くならないとRabl型の配置となる。
遺伝研ウェブサイトのメンテナンス
本日5月27日15:00より翌28日9:00まで、遺伝研ウェブサイトのメンテナンスを予定しています。メンテナンス時間においてもウェブサイトは利用できますが、断続的に利用できない場合があります。
皆様のご理解とご協力をお願いいたします。
Our website will be under maintenance from 3:00 p.m. on May 27 to 9:00 a.m. on May 28. The website will be basically available during the maintenance period, but may be intermittently unavailable.
Thank you for your understanding and cooperation.
“誕生日タグづけ”マウスの脳画像データベース「NeuroGT」を公開 -神経細胞の誕生日を利用した神経細胞サブセットの分類と操作が可能に-
Press release
NeuroGT: A brain atlas of neurogenic tagging CreER drivers for birthdate-based classification and manipulation of mouse neurons
T Hirata*, Y Tohsato, H Itoga, G Shioi, H Kiyonari, S Oka, T Fujimori, S Onami *Corresponding author/責任著者
Cell Reports Methods 1, 100012 (2021) DOI:10.1016/j.crmeth.2021.100012
動物の発生過程では、多くの神経領域において個性の異なる神経細胞が異なるタイミングで発生することが知られています。情報・システム研究機構 国立遺伝学研究所の平田たつみ教授は、マウスにおいて神経細胞の発生タイミング(神経細胞の「誕生日」)の違いを利用して細胞特異的に遺伝子組換えを誘導する「誕生日タグづけ法」を開発しました。誕生日タグづけ法によって、神経細胞の分類と分類した細胞の実験操作が可能になりました。
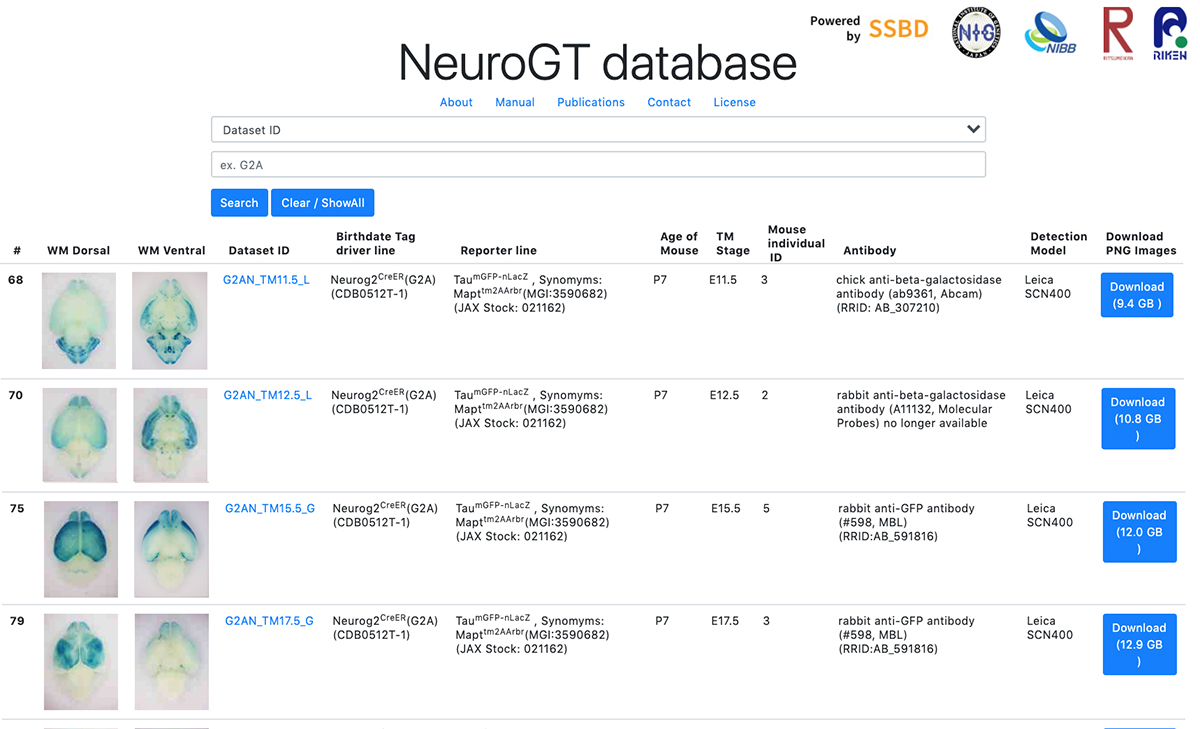
今回、誕生日タグづけ法を用いる上で必要となる、マウス系統のカタログ的な全脳切片画像のデータベース 「NeuroGT (Brain Atlas of Neurogenic Tagging Mouse Lines)」 を公開しました。本データベースでは、タグづけされた神経細胞の細胞体や軸索が脳切片上で可視化されており、脳全体を前後軸に沿って見渡しながら、特定の脳領域をズームアップして極めて高解像度で観察できます。
個々の研究者が本データベースにアクセスし、自らの研究目的に適したマウス系統やタグづけステージを選び出し、そのマウス系統をバイオリソースセンターから取り寄せて自身の研究に利用することで、各研究への貢献が期待できます。
本データベースは、マウス発生工学(理化学研究所 生命機能科学研究センター 生体モデル開発チーム)、神経科学(国立遺伝学研究所 平田研究室)、イメージング(基礎生物学研究所 藤森研究室)、画像情報処理(立命館大学 遠里研究室、理化学研究所 生命機能科学研究センター 発生動態研究チーム)など専門の異なる研究グループが連携して開発しました。
本データベースは、ROIS未来投資型プロジェクト、科研費研究成果公開促進費(データベース、19HP7002)の支援を受けて作成及び公開しました。切片画像の高解像度デジタル化については、先端バイオイメージング支援プラットフォーム(ABiS)の支援を受け (JP16H06280)、平田(20H03345)と大浪(JP18H05412)に対する科研費の支援も受けています。
本研究成果は、米国科学雑誌「Cell Reports Methods」に2021年5月25日(日本時間)に掲載されました。
- 本データベースはこちらでご利用いただけます
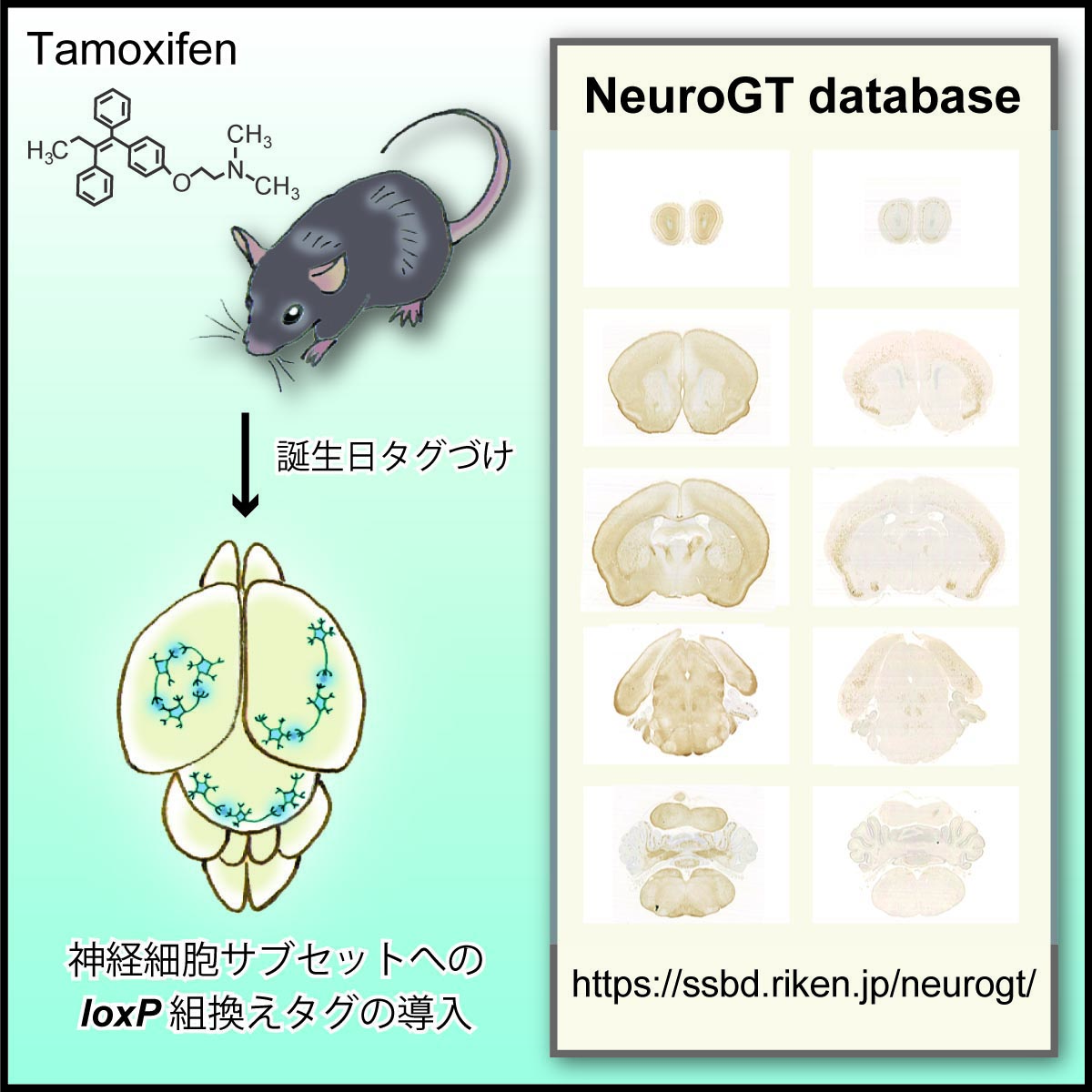
図: 脳画像データベース「NeuroGT」の概念図
動画: 上部のスライダーを操作することで、切片のサムネイル画像を脳の前後軸に沿って動かしながら観察できる。膜移行型mGFPレポーターと核移行型βGALレポーターを用いた染色は異なるスタックになっており、上部の「sync」ボタンを押すことで両方のスタックの切片位置を揃えることができる。
新型コロナウイルス感染症に関する遺伝研の対応について
国立遺伝学研究所が取り組む新型コロナウイルス・全ゲノム解析の紹介
発生遺伝学研究室 川上浩一教授がChristiane Nüsslein-Volhard Awardを受賞
ショウジョウバエの遺伝学研究でノーベル賞を受賞しゼブラフィッシュ研究にも多大な貢献をしたNüsslein-Volhard博士の名前を冠した本賞は、European Zebrafish Society(欧州ゼブラフィッシュ学会)から、毎年ゼブラフィッシュの研究分野で、新技術による革新的な進歩を成し遂げた、ゼブラフィッシュコミュニティに多大な貢献をした、などの卓越した業績に対して授与されるものです。2021年が第5回目になります。
川上教授の受賞理由には、トランスポゾンを用いたトランスジェニックゼブラフィッシュ作製法を開発したこと、およびその方法を用いて様々な組織・細胞を可視化し自由自在に操作できるトランスジェニックゼブラフィッシュを2000系統以上作製し、世界中の研究者と共同研究を展開してきたこと、などがあげられています。2021年6月の国際ゼブラフィッシュ学会(バーチャル)において表彰式と受賞記念講演が行われます。

染色体の誤った結合を“ふるい落とす”
染色体数を正確に保つための新たなしくみの発見
Press release
Chromosome oscillation promotes Aurora A-dependent Hec1 phosphorylation and mitotic fidelity
Kenji Iemura, Toyoaki Natsume, Kayoko Maehara, Masato T. Kanemaki, Kozo Tanaka
Journal of Cell Biology 220 , e202006116 (2021) DOI:10.1083/jcb.202006116
染色体数が細胞分裂を通じて正確に保たれるには、紡錘体上で染色体が微小管と正しく結合する必要があります。東北大学加齢医学研究所・分子腫瘍学研究分野の家村顕自助教、田中耕三教授らの研究グループは、国立遺伝学研究所の夏目豊彰助教・鐘巻将人教授、畿央大学の前原佳代子教授と共同して、染色体オシレーションとして知られている染色体の紡錘体上での反復運動が、染色体と微小管との誤った結合を解消することで、染色体が不均等に分配されるのを防いでいることを明らかにしました。がん細胞株では正常細胞株と比較して染色体オシレーションが減弱しており、このことが多くのがん細胞で見られる染色体異常の一因ではないかと考えられます。
本研究は、日本学術振興会科学研究費補助金、文部科学省科学研究費補助金、NIG-JOINT、武田科学振興財団医学系研究助成金、上原記念生命科学財団研究奨励金、かなえ医薬振興財団研究助成金、艮陵医学振興会研究助成金の支援を受けて行われました。
本研究成果は、5月14日に学術誌Journal of Cell Biology誌に発表されました。
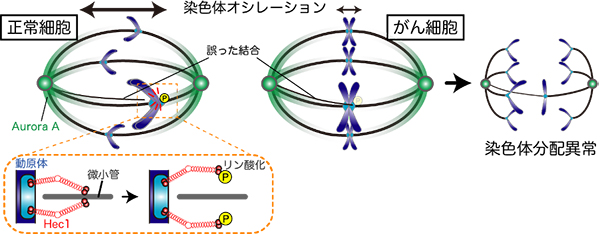
図: 染色体オシレーションによる動原体と微小管の誤った結合の解消 (左)動原体が紡錘体極に近づくと、Hec1が紡錘体上のAurora Aによってリン酸化され、誤った結合が解消される。(右)がん細胞では染色体オシレーションが減弱しているため、誤った結合が解消されず、染色体の不均等な分配が起こる。
2021年度夏に実施する入学者選抜試験に関する重要なお知らせ
2021年度夏に実施する入学者選抜試験における英語能力評価に関するお知らせ
原始卵胞形成過程における顆粒膜細胞の遺伝子発現を解析
Decoding the transcriptome of pre-granulosa cells during the formation of primordial follicles in the mouse
Kurumi Fukuda, Masafumi Muraoka, Yuzuru Kato, and Yumiko Saga
Biology of Reproduction 2021 April 13 DOI:10.1093/biolre/ioab065
ヒトを含む哺乳動物のメスが長期に渡り卵子を作り続けるためには、その元となる原始卵胞を十分な数形成することが重要です。原始卵胞は一つの”卵母細胞”とそれを取り巻く顆粒膜細胞と呼ばれる体細胞から構成されています。原始卵胞の形成には、卵母細胞と顆粒膜細胞の前駆体である顆粒膜前駆細胞との相互作用が必要だと考えられますが、そのメカニズムについてはほとんど知られていませんでした。そこで本研究では原始卵胞の形成過程における顆粒膜細胞前駆体の遺伝子発現変化を読み解くことで、この謎に挑みました。その結果、原始卵胞の形成に伴い、細胞外マトリックス、細胞接着、数種類のシグナル伝達経路等に関する遺伝子の顕著な発現変動が起きていることが明らかになりました。また、生殖細胞が正常に発生しない変異マウスでは顆粒膜前駆細胞から顆粒膜細胞への分化が遅れ、分化に関わる遺伝子発現変化も阻害されていることが分かりました。これらの結果は、卵母細胞の適切な発生が顆粒膜前駆細胞の分化に必要であることを示唆しています。また、本データは、原子卵胞形成に関わる遺伝子制御ネットワークを理解するための貴重なリソースになることが期待されます。
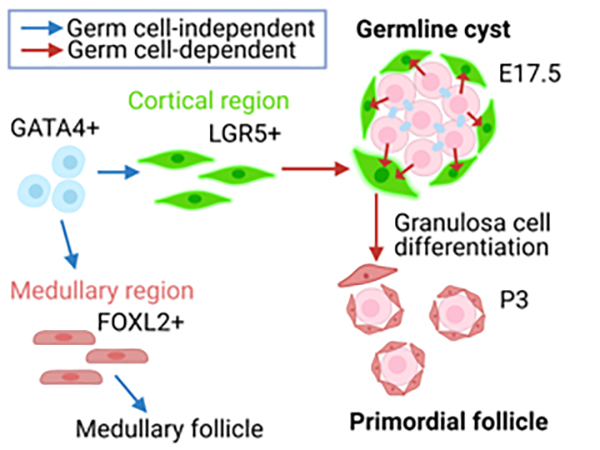
図:原始卵胞を構成する顆粒膜細胞前駆体(緑)はそのGATA4陽性の細胞(青)から分化する。この分化過程に生殖細胞は必要ではないが(青矢印)、顆粒膜細胞への分化に卵母細胞が必要である(赤矢印)。















