Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
大量のオイルを生産する‶最強藻類″の秘密を解明-バイオ燃料の実用化に向け有力な手がかり得る-
![]()
Differently Localized Lysophosphatidic Acid Acyltransferases Crucial for Triacylglycerol Biosynthesis in the Oleaginous Alga Nannochloropsis
Takashi Nobusawa, Koichi Hori, Hiroshi Mori, Ken Kurokawa, Hiroyuki Ohta
The Plant Journal Accepted manuscript online: 20 February 2017 DOI:10.1111/tpj.13512
東京工業大学生命理工学院の信澤岳特任助教、太田啓之教授らと情報・システム研究機構国立遺伝学研究所ゲノム進化研究室の黒川顕教授、森宙史助教らの研究グループは、バイオ燃料生産に最有望とされるオイル生産藻の一種「ナンノクロロプシス」の突出して高いオイル生産能力を可能にしている仕組みを解明した。生物が作り出すオイルは油滴とよばれるオイル蓄積に必要な細胞内構造に蓄積される。今回、ナンノクロロプシスが持つ高いオイル生産能力には、この油滴の表面で直接的にオイル合成を行う仕組みが重要な役割を果たしていることを発見した。しかもこの仕組みは二次共生とよばれる複雑な進化過程において獲得したものであることを突き止めた。
藻類が高いオイル生産能力を発揮するうえで重要な仕組みを解明したことは、藻類改良のポイントを明示する成果といえる。ナンノクロロプシス油滴表面でのオイル合成能をさらに強化・改変させることで、藻類によるバイオ燃料などの有用脂質生産実用化に向けて大きく前進することが期待される。
研究成果は2月20日、英国科学雑誌「プラント ジャーナル(The Plant Journal)」のオンライン版に公開された。
本研究は東工大の太田教授が科学技術振興機構 戦略的創造研究推進事業(CREST) 「藻類・水圏微生物の機能解明と制御によるバイオエネルギー創成のための基盤技術の創出」研究領域(研究総括:松永是(東京農工大学学長))における研究課題「植物栄養細胞をモデルとした藻類脂質生産系の戦略的構築」の一環として、東工大生命理工学院の堀孝一助教と国立遺伝学研究所の黒川顕教授、森宙史助教との共同で行った。
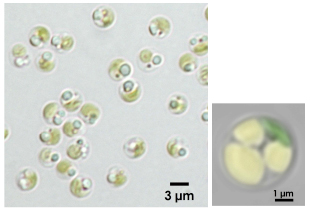
図1.オイル高生産藻ナンノクロロプシス
(左)ナンノクロロプシスの光学顕微鏡像。光の屈折により、すこし青みがかって見えるのが油滴。緑に見えるのは葉緑体。
(右)油脂を大量に蓄積したナンノクロロプシスの蛍光顕微鏡像。緑は葉緑体、黄色は油滴を示す。(色は疑似色)
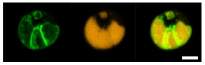
図2.ナンノクロロプシスの油滴表面に局在するオイル合成酵素
(左)GFP(緑色蛍光タンパク質)を融合させたオイル合成酵素
(中央)蛍光染色した油滴
(右)重ね合わせ像
油滴の表面に酵素が局在しているのがわかる。スケールバーは2 µmを示す。
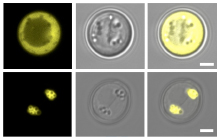
図3.ナンノクロロプシスの油滴局在シグナルは出芽酵母でも機能する
蛍光タンパク質そのものは油滴に局在しない(上段)。一方、ナンノクロロプシスの油滴局在シグナル配列を蛍光タンパク質に付与すると、油滴表層に局在するようになった(下段)。
(左)YFP(黄色蛍光タンパク質)の蛍光
(中央)明視野像,粒状に見えるものが出芽酵母の油滴
(右)重ね合わせ像
スケールバーは2 µmを示す。
情報・システム研究機構シンポジウム「分野を超えたデータサイエンスの広がり」
鳥類の進化に関わったDNA配列群を同定―鳥エンハンサーの発見―
![]()
Functional roles of Aves class-specific cis-regulatory elements on macroevolution of bird-specific features
Ryohei Seki*, Cai Li*, Qi Fang, Shinichi Hayashi, Shiro Egawa, Jiang Hu, Luohao Xu, Hailin Pan, Mao Kondo, Tomohiko Sato, Haruka Matsubara, Namiko Kamiyama, Keiichi Kitajima, Daisuke Saito, Yang Liu, M. Thomas P. Gilbert, Qi Zhou, Xing Xu, Toshihiko Shiroishi, Naoki Irie#, Koji Tamura#, Guojie Zhang#
(* co-first authors, # co-corresponding authors)
Nature Communications 8, Article number: 14229 (2017) DOI:10.1038/ncomms14229
鳥が恐竜の一部から進化したことは確実視されていますが、羽毛やクチバシなどの鳥らしい特徴をもつようになった仕組みはほとんどわかっていませんでした。東北大学生命科学研究科の田村宏治教授のグループは、東京大学の入江直樹准教授、情報・システム研究機構 国立遺伝学研究所の関亮平研究員・城石俊彦教授、ならびに中国BGI・コペンハーゲン大学らの国際共同チームにおいて、48種の鳥の全ゲノムDNAを他の動物のゲノムと比較することにより、鳥らしさをもたらしているDNA配列を探しました。解析の結果、鳥へと進化する過程において、新しいタンパク質を作る配列(または遺伝子)の獲得はほとんどなく、鳥への進化には、むしろ遺伝子の使い方を変えたことが決定的な役割を果たしたことが明らかになりました。遺伝子の使い方を決めるDNA配列のことを一般的に「制御配列」と呼び、遺伝子のスイッチをオンにしたりオフにしたりします。研究チームが見つけたのは、スイッチをオンにする鳥特有の制御配列、すなわち鳥エンハンサーと言えます。例えば、今回見つけた鳥エンハンサーの1つは、ある遺伝子(Sim1遺伝子)を、風切羽の作られる翼(前肢)ではたらくようにしていることが明らかになりました。さらなる解析の結果、Sim1遺伝子が翼の風切羽だけでなく尾羽が形成される領域でもはたらいていることもわかりました。Sim1鳥エンハンサーはまだ恐竜がいた頃の時代に獲得されていた可能性が高く、風切羽と尾羽が同時に恐竜で進化していたというこれまでの知見と合わせて考えると、このような鳥エンハンサーを使って恐竜も風切羽や尾羽を進化させていた可能性があります。
このように、鳥の進化過程において新しい遺伝子の獲得はほとんどなく、既にもっていた遺伝子の使い方を変えることで、鳥らしい特徴を進化させてきたことがわかりました。鳥の進化に決定的に重要だったのは、新しい遺伝子ではなく、既にもっていた遺伝子の新しい使い方だったのです。
本研究は、科研費(基盤研究B、特別研究員奨励費)、最先端・次世代研究開発支援プログラム(ライフ・イノベーション)、ナショナルバイオリソースプロジェクト(ニワトリ・ウズラ)などの支援を受けて実施されました。
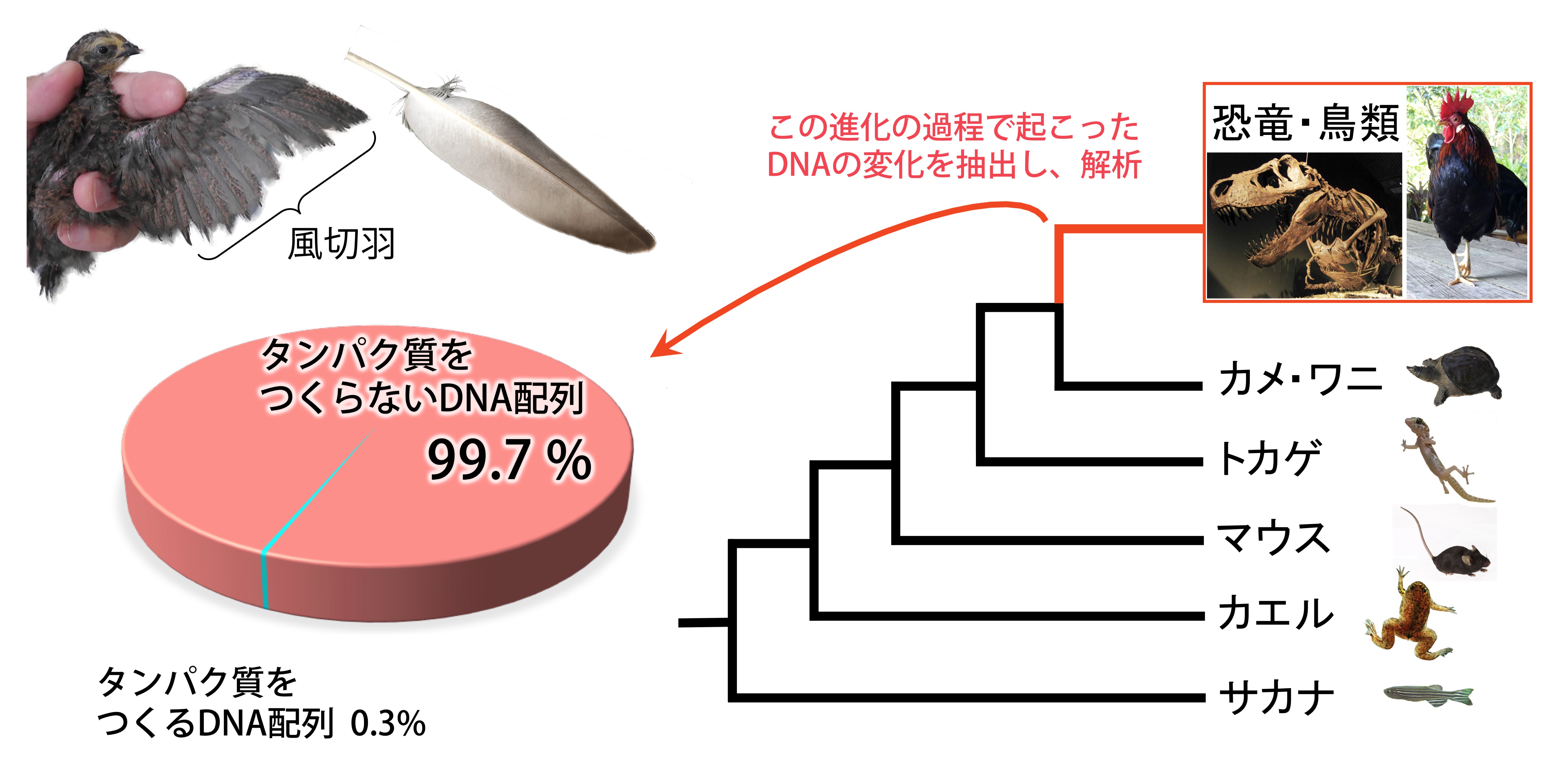
鳥類48種のゲノムと鳥類以外の動物9種のゲノムを比較することで、鳥だけがもっているDNA配列を特定したところ、そのほぼ全て(99.69%)がタンパク質を作らないものであった。 また、そうした DNA配列の1つが鳥の飛翔能力に重要な風切羽の形成に関与していることが明らかになった。
魚の浮き袋という進化上の発明のカギは、「腹側」から「背側」への遺伝子スイッチの切り替えだった
![]()
Evolution of Shh endoderm enhancers during morphological transition from ventral lungs to dorsal gas bladder
Tomoko Sagai, Takanori Amano, Akiteru Maeno, Tetsuaki Kimura, Masatoshi Nakamoto, Yusuke Takehana, Kiyoshi Naruse, Norihiro Okada, Hiroshi Kiyonari, Toshihiko Shiroishi
Nature communications 8, Article number: 14300 (2017) DOI:10.1038/ncomms14300
情報システム研究機構国立遺伝学研究所 哺乳動物遺伝研究室 嵯峨井知子博士研究員と城石俊彦教授らのグループは、遺伝子のスイッチであるエンハンサーの進化、つまりアミノ酸配列にかかわらないゲノムDNA塩基配列のわずかな変化が、陸生動物の肺から魚の浮袋という大きな形態進化の背景にあったことを明らかにしました。
生物の形態進化には、アミノ酸配列の変化よりも、遺伝子の発現を調節するエンハンサーなどの変化のほうが深く関わっていると考えられていますが、そのような例が実際に示されたことはほとんどありませんでした。研究グループは、魚の浮き袋が原始的な肺から進化したという説に着目し、陸生動物と魚類のゲノム配列を比較解析した結果、形態形成に働くShh遺伝子を調節するエンハンサー配列が、肺を持つ陸生動物では体軸の腹側で活性を持つことを示しました。一方、浮き袋を持つ真骨魚類では、このエンハンサーが働かなくなっていて、別のエンハンサー配列が体軸の背側で活性を持つことを明らかにしました。これらのことから、肺から浮き袋への形態進化に伴ってエンハンサーの活性の腹側から背側へ転換が生じていたことがわかりました(図)。
ゲノムデータベースの充実やゲノム編集技術の発展などにより、任意の遺伝子の発現調節を自由に改変することが可能となっています。本研究のように、長い時間をかけて一度だけ起こった進化を実験によって検証する「実験進化学」は、これから急速に伸展することが期待されます。
本研究は情報・システム研究機構 国立遺伝学研究所哺乳動物遺伝研究室 嵯峨井知子、天野孝紀、前野哲輝、城石俊彦、自然科学研究機構基礎生物学研究所バイオリソース研究室 木村哲晃、中本正俊、竹花佑介、成瀬 清、理化学研究所ライフサイエンス技術基盤研究センター生体モデル開発ユニット 清成 寛、Department of Life Sciences, National Cheng Kung University 岡田典弘によって遂行されました。
本研究の一部は、科研費(基盤研究A)「クロマチンループ構造変換による組織特異的Shh発現制御システム」、文部科学省・日本医療研究開発機構「ナショナルバイオリソースプロジェクト」の支援を受けておこなわれました。
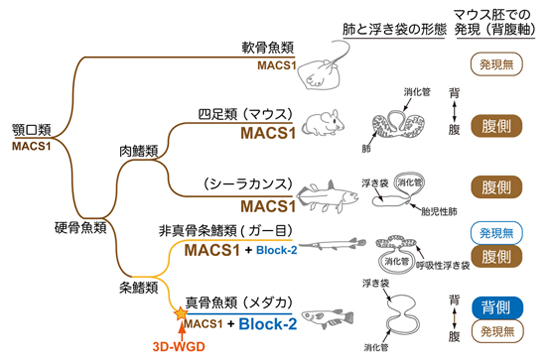
図.脊椎動物における二つのShhエンハンサーの進化
祖先型MACS1は、軟骨魚類と硬骨魚類が分かれる以前に出現し、陸生動物、非真骨条鰭類で腹側喉頭にShh遺伝子発現を誘導する機能を獲得した。真骨魚類では、その配列が大きく壊れ、エンハンサー活性が失われたと考えられる。一方、非真骨条鰭類で出現した祖先型配列(Block-2と命名)が、真骨魚類の系譜で消化管の背側上皮にShh遺伝子発現を誘導する活性を獲得した。
※本研究成果にはマイクロCTスキャンの技術が貢献しています















