X線マイクロCT装置を用いた3次元可視化解析
担当:木村暁 (細胞建築研究室 フェノタイプ研究推進センター)
前野哲輝 (技術課 細胞建築研究室 フェノタイプ研究推進センター)
生物学は博物学的な形態観察や形態の違いによる系統分類を中心に発展してきました。現代の分子生物学においても様々な生命現象を観察して記述することはとても重要なことで、生物学と「観察」は切っても切れない縁にあります。その要求から、様々な観察技術が目覚しい発展を遂げ、高倍率、高感度などの多種多様な高機能観察が可能となっています。
その技術の中のひとつであるCTスキャンは、X線によるレントゲン撮影の技術を応用して、様々な方向から撮影した画像データをコンピュータ処理により立体的に構築し、対象物の構造を3次元的に捉えることを可能にします。このCTスキャンの技術は特に医療の分野で力を発揮しています。しかし、これまでの生物学研究におけるCTスキャンの用途は、骨などの硬部組織の観察に限定されており、また、その解像度や感度は小型生物を研究するには十分ではありませんでした。
国立遺伝学研究所・生物遺伝資源センターでは、軟部組織を染色する最新技術をいち早く導入し、固定法、造影剤の活用法、撮影条件、画像データの活用方法の全行程にわたり、対象となる生物種や組織に応じて、様々な検討を重ねてきました。これらの経験から、CT装置の特徴を生かし、多様な研究目的に応じた至適条件を見出し、生物の複雑な構造を生物学の研究に十分な解像度、精度、感度で3次元的に解析する技術を確立しました。現在、その技術により、海洋小型生物、昆虫、魚類、マウスなど、生物種の枠を超えた多岐にわたる生物の観察が可能となっており、国立遺伝学研究所ではCTスキャン装置を駆使した多彩な研究支援を行っています。フェノタイプ研究推進センターでは、本技術を用いた撮影支援を受益者負担の受託型事業として提供しています。
国立遺伝学研究所のX線マイクロCT装置を用いた生物の三次元可視化についての相談は、microct@nig.ac.jp
までご連絡ください。
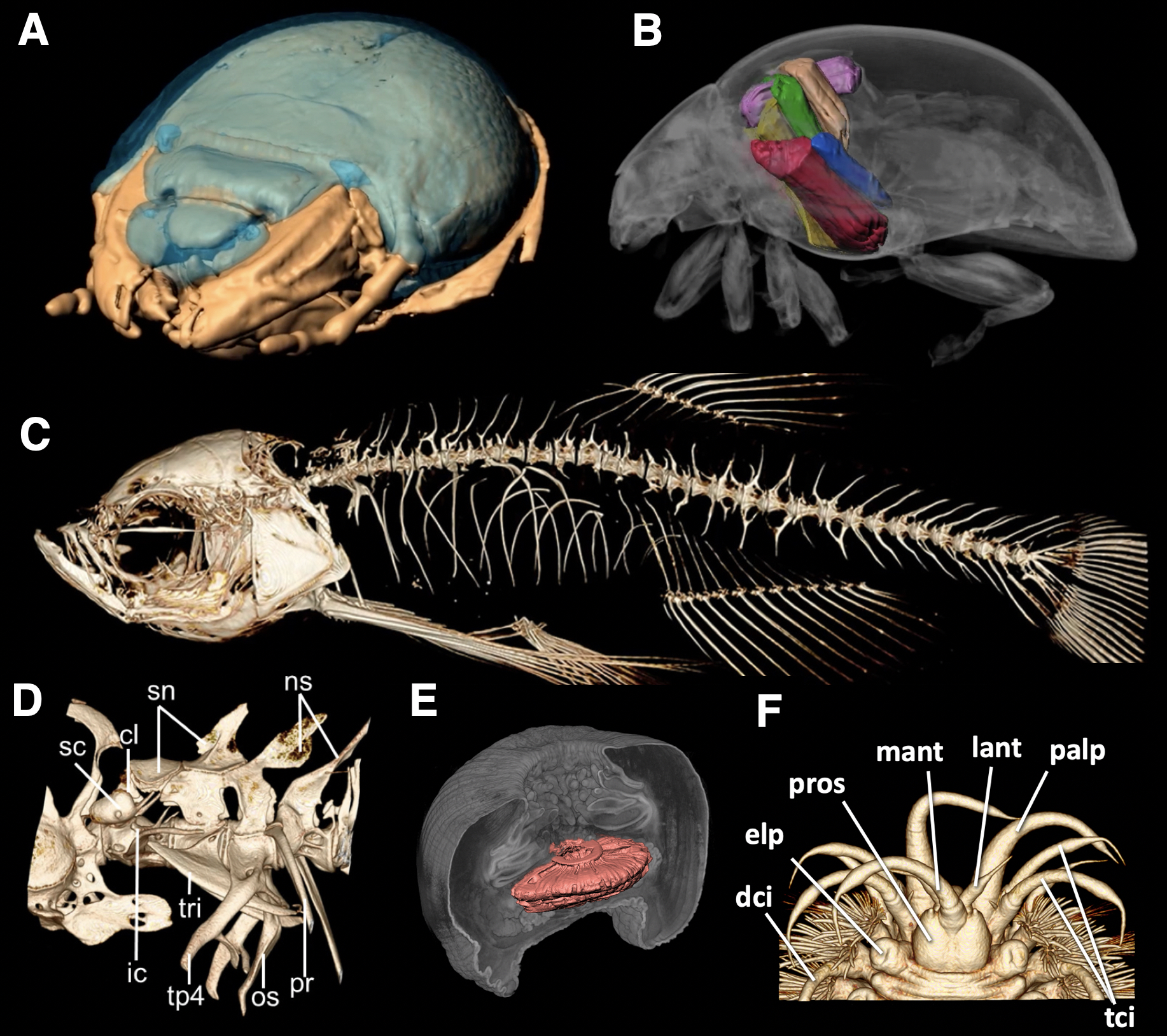
A. カブトムシ幼虫の頭部
B. テントウムシ。色がついているのは飛翔筋。
C. 骨格異常を示すゼブラフィッシュの全身骨格。
(3Dモデルでご覧いただけます。→ sketchfab)
D. 正常なゼブラフィッシュ のウェーバー器官。
(3Dモデルでご覧いただけます。→ sketchfab)
E. ウメボシイソギンチャク(刺胞動物門)。
F. ウロコムシ(環形動物門)の頭部。
(FaceBookページの記事で全身をご覧いただけます。→ facebook)
【リンク】
・FaceBook 『国立遺伝学研究所 3d Imaging Room 』 ![]()
※遺伝研CT技術のPRを目的としたFacebookページ。
・Sketchfab(3Dモデル投稿サイト)『3D Imaging Room in NIG』 ![]()
※遺伝研CT技術で得られた3Dモデルを投稿したサイトのページ(英語)。
パスワードを設定して共同研究者と共有することでCTデータのディスカッションにも使用している。
・生物の複雑な構造を3次元で解き明かす
※遺伝研のCTの技術を紹介したページ。
これまでの実績(論文発表)
※2024年5月現在の情報
【1】マウス【2】ゼブラフィッシュ【3】植物【4】昆虫【5】海生無脊椎動物
【1】マウス
SHH signaling mediated by a prechordal and brain enhancer controls forebrain organization.
Sagai T, Amano T, Maeno A, Ajima R, Shiroishi T.
Proc Natl Acad Sci U S A. 2019 Nov 19;116(47):23636-23642.
※国立遺伝学研究所からプレスリリースが行われました:
ヒト先天異常「全前脳胞症」の発症にかかわる制御配列を発見
Enhancer adoption caused by genomic insertion elicits interdigital Shh expression and syndactyly in mouse.
Mouri K, Sagai T, Maeno A, Amano T, Toyoda A, Shiroishi T.
Proc Natl Acad Sci U S A. 2018 Jan 30;115(5):1021-1026.
※国立遺伝学研究所からプレスリリースが行われました:
遺伝子スイッチの「移設」が手に水かきを作る
SHH signaling directed by two oral epithelium-specific enhancers controls tooth and oral development.
Sagai T, Amano T, Maeno A, Kiyonari H, Seo H, Cho SW, Shiroishi T.
Sci Rep. 2017 Oct 11;7(1):13004.
※国立遺伝学研究所 リサーチハイライトで紹介されました:
歯の本数は、複数のエンハンサーによるShh遺伝子の発現調節によって決まる
Evolution of Shh endoderm enhancers during morphological transition from ventral lungs to dorsal gas bladder.
Sagai T, Amano T, Maeno A, Kimura T, Nakamoto M, Takehana Y, Naruse K, Okada N, Kiyonari H, Shiroishi T.
Nat Commun. 2017 Feb 3;8:14300.
※国立遺伝学研究所 プレスリリースで紹介されました:
魚の浮き袋という進化上の発明のカギは、「腹側」から「背側」への遺伝子スイッチの切り替えだった
【2】ゼブラフィッシュ
Teleost Hox code defines regional identities competent for the formation of dorsal and anal fins.
Adachi U, Koita R, Seto A, Maeno A, Ishizu A, Oikawa S, Tani T, Ishizaka M, Yamada K, Satoh K, Nakazawa H, Furudate H, Kawakami K, Iwanami N, Matsuda M, Kawamura A.
Proc Natl Acad Sci U S A. 2024 Jun 18;121(25):e2403809121.
※2019〜2023年度国立遺伝学研究所共同研究(NIG-JOINT2019-2023)採択課題による成果
※国立遺伝学研究所からプレスリリースが行われました:
「魚のヒレ」 長かったり、短かったり⁉ 仕組みを解明 ―ヒレの多様な形成位置をもたらす単純なシステム―
An atlas of seven zebrafish hox cluster mutants provides insights into sub/neofunctionalization of vertebrate Hox clusters.
Yamada K, Maeno A, Araki S, Kikuchi M, Suzuki M, Ishizaka M, Satoh K, Akama K, Kawabe Y, Suzuki K, Kobayashi D, Hamano N, Kawamura A.
Development. 2021 Jun 1;148(11):dev198325.
※2019,2020年度国立遺伝学研究所共同研究(NIG-JOINT2019,2020)採択課題による成果
※国立遺伝学研究所からプレスリリースが行われました:
動物の発生を司るHoxクラスターは脊椎動物の進化過程で機能が多様化した
Zebrafish stm is involved in the development of otoliths and of the fertilization envelope.
Pachoensuk T, Fukuyo T, Rezanujjaman M, Wanlada K, Yamamoto C, Maeno A, Rahaman MM, Ali MH, Tokumoto T.
Reprod Fertil. 2021 Feb 16;2(1):7-16.
※論文ページ(free access)![]()
Development and growth of organs in living whole embryo and larval grafts in zebrafish.
Kawasaki T, Maeno A, Shiroishi T, Sakai N.
Sci Rep. 2017 Nov 28;7(1):16508.
※国立遺伝学研究所 リサーチハイライトで紹介されました:
ゼブラフィッシュ胚/稚魚全個体移植による個体形成
【3】植物
YABBY and diverged KNOX1 genes shape nodes and internodes in the stem.
Tsuda K, Maeno A, Otake A, Kato K, Tanaka W, Hibara KI, Nonomura KI.
Science. 2024 Jun 14;384(6701):1241-1247. doi: 10.1126/science.adn6748. Epub 2024 Jun 13.
※国立遺伝学研究所からプレスリリースが行われました:
茎の節と節間ができるしくみを解明 ~植物科学の未踏の地「茎の発生学」に挑む~
Heat shock-inducible clonal analysis reveals the stepwise establishment of cell fate in the rice stem.
Tsuda K, Maeno A, Nonomura KI.
Plant Cell. 2023 Nov 30;35(12):4366-4382.
※国立遺伝学研究所からプレスリリースが行われました:
茎の節間は最後に生まれてくる-茎の発生学への挑戦-
Reduction in organ-organ friction is critical for corolla elongation in morning glory.
Shimoki A, Tsugawa S, Ohashi K, Toda M, Maeno A, Sakamoto T, Kimura S, Nobusawa T, Nagao M, Nitasaka E, Demura T, Okada K, Takeda S.
Commun Biol. 2021 Mar 5;4(1):285.
※2018年度国立遺伝学研究所共同研究(NIG-JOINT2018)採択課題による成果
※国立遺伝学研究所からプレスリリースが行われました:
アサガオの花びら(花冠)がまっすぐに伸びる力学的な仕組みを解明
Micro-computed Tomography to Visualize Vascular Networks in Maize Stems.
Maeno A, Tsuda K.
Bio Protoc. 2018 Jan 5;8(1):e2682.
※論文ページ(free access)![]()
KNOTTED1 Cofactors, BLH12 and BLH14, Regulate Internode Patterning and Vein Anastomosis in Maize.
Tsuda K, Abraham-Juarez MJ, Maeno A, Dong Z, Aromdee D, Meeley R, Shiroishi T, Nonomura KI, Hake S.
Plant Cell. 2017 May;29(5):1105-1118.
※国立遺伝学研究所 リサーチハイライトで紹介されました:
単子葉植物の茎に特徴的な形態形成を制御するメカニズム
BELL1-like homeobox genes regulate inflorescence architecture and meristem maintenance in rice.
Ikeda T, Tanaka W, Toriba T, Suzuki C, Maeno A, Tsuda K, Shiroishi T, Kurata T, Sakamoto T, Murai M, Matsusaka H, Kumamaru T, Hirano HY.
Plant J. 2019 May;98(3):465-478.
※2017年度国立遺伝学研究所共同研究(NIG-JOINT2017)採択課題による成果
※論文ページ(free access)![]()
【4】昆虫
Yeast associated with flower longicorn beetle Leptura ochraceofasciata (Cerambycidae: Lepturinae), with implication for its function in symbiosis.
Kishigami M, Matsuoka F, Maeno A, Yamagishi S, Abe H, Toki W.
PLoS One. 2023 Mar 22;18(3):e0282351.
※2022年度国立遺伝学研究所共同研究(NIG-JOINT2022)採択課題による成果
※国立遺伝学研究所からプレスリリースが行われました:
カミキリムシと酵母の共生関係を特定 ~酵母は特殊な器官で運ばれ、親から子へ受け継がれる~
Precise staging of beetle horn formation in Trypoxylus dichotomus reveals the pleiotropic roles of doublesex depending on the spatiotemporal developmental contexts.
Morita S, Ando T, Maeno A, Mizutani T, Mase M, Shigenobu S, Niimi T.
PLoS Genet. 2019 Apr 10;15(4):e1008063.
※2017年度国立遺伝学研究所共同研究(NIG-JOINT2017)採択課題による成果
※基礎研(基礎生物学研究所)からプレスリリースが行われました:
カブトムシの角(ツノ)にオスとメスとの違いが現れる時期の特定に成功
Unveiling the role of differential growth in 3D morphogenesis: An inference method to analyze area expansion rate distribution in biological systems.
Morikawa K, Morita S, Sakura K, Maeno A, Gotoh H, Niimi T, Inoue Y.
J Theor Biol. 2023 Nov 7;575:111650.
※2019,2020年度国立遺伝学研究所共同研究(NIG-JOINT2019, 2020)採択課題による成果
※論文ページ(free access)![]()
【5】海生無脊椎動物
Induced spawning with gamete release from body ruptures during reproduction of Xenoturbella bocki.
Nakano H, Nakano A, Maeno A, Thorndyke MC.
Commun Biol. 2023 Feb 17;6(1):172
※国立遺伝学研究所からプレスリリースが行われました:
珍渦虫は体が破れて卵を産む ~生殖過程の新仮説を提唱~
Ceratosomicola oki n. sp., a New Species of Copepod (Cyclopoida: Splanchnotrophidae) Parasitic on the Chromodoridid Nudibranch Glossodoris misakinosibogae Baba, 1988 Off the Oki Islands, Japan, with Microanatomical Observation Using Micro-CT.
Uyeno D, Kohtsuka H, Maeno A.
Zoolog Sci. 2022 Feb;39(1):115-123.
※2018年度国立遺伝学研究所共同研究(NIG-JOINT2018)採択課題による成果
※論文ページ(free access)![]()
Microfocus X-ray CT (microCT) Imaging of Actinia equina (Cnidaria), Harmothoe sp. (Annelida), and Xenoturbella japonica (Xenacoelomorpha).
Maeno A, Kohtsuka H, Takatani K, Nakano H.
J Vis Exp. 2019 Aug 6;(150).
※国立遺伝学研究所 リサーチハイライトで紹介されました:
マイクロフォーカスX線CT装置による海産無脊椎動物の解析方法
A new species of Xenoturbella from the western Pacific Ocean and the evolution of Xenoturbella.
Nakano H, Miyazawa H, Maeno A, Shiroishi T, Kakui K, Koyanagi R, Kanda M, Satoh N, Omori A, Kohtsuka H.
BMC Evol Biol. 2017 Dec 18;17(1):245.
※2014, 2015, 2016年度国立遺伝学研究所共同研究(NIG-JOINT2014, 2015, 2016)採択課題による成果
※筑波大学・国立遺伝学研究所・北海道大学・東京大学から共同プレスリリースが行われました:
日本近海で初の珍渦虫の新種を発見 ―動物の起源や進化過程を探る糸口に―















