Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
細胞分裂期の染色体凝縮はマグネシウムイオンの増加によって起こる ―生細胞イメージングにより新たなメカニズムを検証―
![]()
A transient rise in free Mg2+ ions released from ATP-Mg hydrolysis contributes to mitotic chromosome condensation
Kazuhiro Maeshima, Tomoki Matsuda, Yutaka Shindo, Hiromi Imamura, Sachiko Tamura, Ryosuke Imai, Syoji Kawakami, Ryosuke Nagashima, Tomoyoshi Soga, Hiroyuki Noji, Kotaro Oka, Takeharu Nagai
Current Biology Published Online January 18, 2018 DOI:10.1016/j.cub.2017.12.035
細胞が分裂する際、ヒトでは全長2メートルにもおよぶゲノムDNAからコンパクトに凝縮した「染色体」と呼ばれるDNAの束が作られ、2つの細胞に正確に分配されていきます。半世紀以上前、細胞に大量に存在するマグネシウムイオン(Mg2+)がゲノムDNA凝縮の鍵となりうることが提唱されたことがありましたが、当時は細胞内Mg2+濃度を測定する手段が無かったため証明されぬまま忘れられていました。
国立遺伝学研究所の前島一博 教授、大阪大学の永井健治 教授、慶應義塾大学の岡浩太郎 教授、京都大学の今村博臣准教授らの共同研究グループは、蛍光タンパク質技術を駆使してMg2+濃度の変化を高感度で感知できる蛍光センサー MARIO を開発し、生細胞内のMg2+濃度を蛍光イメージングにより可視化することに成功しました。そして細胞分裂の際にMg2+濃度が一過的に上昇することを示すとともに、負の電気を帯びているDNA同士の反発を弱め、染色体の凝縮を促進していることを明らかにしました(図1)。本研究によって、実際にMg2+が細胞のなかで染色体の凝縮にかかわっていることが初めて証明されました。また、Mg2+は通常ATPと結合していますが、細胞分裂でのATPの消費により放出されることで、Mg2+濃度が上昇することも分かりました(図1)。
染色体の形成の失敗はゲノムDNAの損傷を引き起こし、細胞に「死」や「がん化」などのさまざまな異常、さらには疾病をもたらすと考えられています。また細胞のなかに多量に存在するMg2+は多くのタンパク質の働きを助けており、欠乏するとさまざまな細胞異常が現れることが知られています。今回の蛍光センサー開発と生物学的知見の発見は、このような細胞の異常が起こるしくみの解明につながると期待されます。
本研究成果は、2018年1月19日(金)午前2時(日本時間)に「Current Biology」に掲載されました。 Dispatchesセクションにおいてハイライトされています。
本研究は、国立遺伝学研究所・前島一博教授・田村佐知子テクニカルスタッフグループ、大阪大学産業科学研究所・ 永井健治教授・松田知己准教授グループ、慶應義塾大学理工学部・岡浩太郎教授・新藤豊特任助教グループ、京都大学生命科学研究科・今村博臣准教授・東京大学工学研究科・野地博行教授グループ、慶應義塾大学環境情報学部・曽我朋義教授グループの共同研究成果です。
なお、本研究は文部科学省科学研究費・新学術領域「少数性生物学」(領域代表:大阪大学 永井健治教授)、科学技術振興機構 戦略的創造研究推進事業(CREST) (JPMJCR15G2, JPMJCR15N3)、および科学研究費(16H04746)、日本医療研究開発機構の革新的先端研究開発支援事業 AMED-CRESTの支援を受けました。
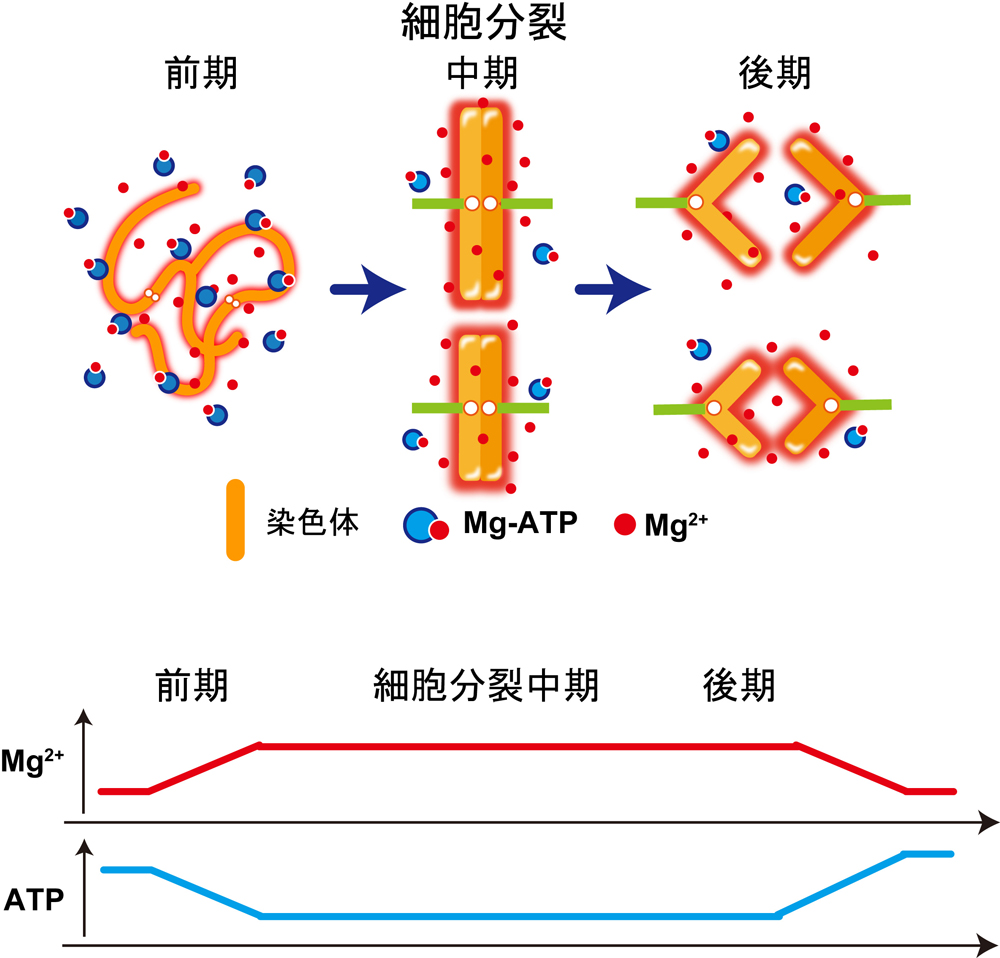
図1:細胞が分裂する際にMg2+が増加し、染色体の凝縮が促進される。ATPの減少によりMg-ATPから遊離したMg2+が供給される。
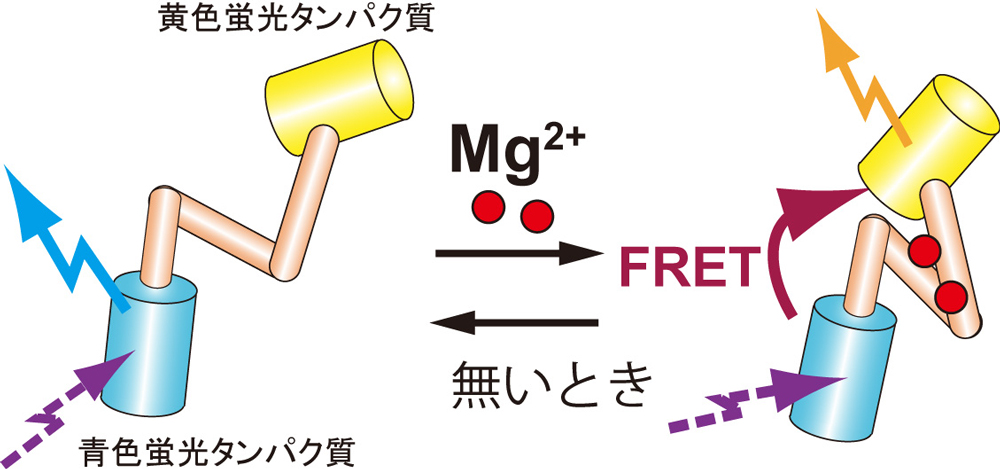
図2:新しい蛍光Mg2+センサーMARIOの検出原理 青色と黄色の2種類の蛍光タンパク質が、検出タンパク質(肌色)でつながれている。Mg2+が検出タンパク質に結合すると、2種類の蛍光タンパク質が引き寄せられ、FRETと呼ばれるエネルギーの移動が起こり、紫の光を照射したときに放射される蛍光の色が青から黄にシフトする。
APCは紡錘体を引っ張る力のブレーキ がん抑制遺伝子APCの新しい機能の発見
![]()
Tumor suppressor APC is an attenuator of spindle-pulling forces during C. elegans asymmetric cell division
Kenji Sugioka, Lars-Eric Fielmich, Kota Mizumoto, Bruce Bowerman, Sander van den Heuvel, Akatsuki Kimura, Hitoshi Sawa
PNAS January 18, 2018 DOI:10.1073/pnas.1712052115
大腸ガン患者では高頻度でがん抑制遺伝子APCに変異があることが知られています。これは、Wntシグナルという細胞内シグナル伝達経路が過剰に活性化することが主な原因です。これに加えて、APCタンパク質は微小管を制御する働きが知られていますが、その働きと細胞のがん化との関係はよくわかっていませんでした。
本研究では、細胞の表層に局在したAPCタンパク質が、染色体の分配を担う紡錘体を構成する微小管の末端に結合して、微小管の安定性を制御していることが明らかになりました。APCタンパク質の微小管への結合は、微小管を引っ張る力を弱めることによって、染色体の移動を制御していたのです。
APC遺伝子が変異した大腸がん細胞では染色体異常が頻繁に観察されます。また、染色体異常は染色体の分配をおこなう紡錘体にかかる力の異常によっても引き起こされることが指摘されています。本研究で明らかになったAPCタンパク質の紡錘体を引っ張る力を制御する働きががん化に関与している可能性があります。
本研究は、情報・システム機構国立遺伝学研究所の元研究員杉岡賢史、澤斉教授と同研究所細胞建築研究室およびユトレヒト大学、オレゴン大学との国際共同研究の成果です。
本研究成果は、米国科学誌「米国科学アカデミー紀要(PNAS)」に平成30年1月18日(米国東部標準時間)に掲載されました。
本研究は、科学研究費補助金(JP22127005、JP15H04732 、JP15KT0083)上原記念生命科学財団および遺伝学研究所共同研究(NIG-JOINT:2013-A60)の支援を受けておこなわれました。
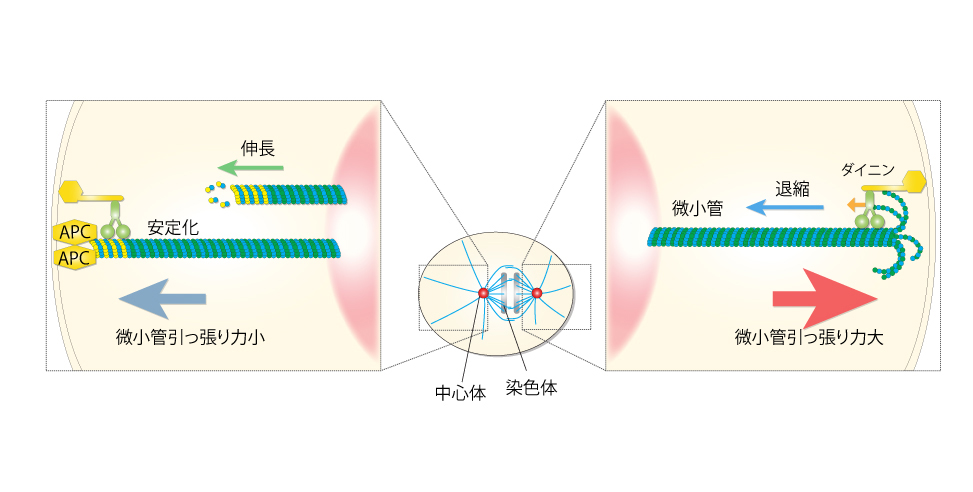
図:APCタンパク質による微小管引張り力の抑制機構
微小管が細胞表層に到達した後、退縮する際に、モータータンパク質であるダイニンの働きで引っ張る力が発生する。APCタンパク質が微小管の末端に結合することで退縮を阻害し、引っ張る力を弱める。
線虫の非対称分裂の動画をこちらでご覧いただけます
右:野生型では後極から強く引っ張られるため紡錘体が後方に移動する。この際、後ろ側の中心体は、強い力を受けて縦方向に振動する。前極に局在するAPCが引っ張る力を抑制するため前側の中心体はほとんど動かない。左:APCを阻害すると、前方の中心体も振動する。
姉妹染色分体間接着の形成機構を解明〜コヒーシンはDNAの結束バンド !?〜
![]()
Establishment of DNA-DNA Interactions by the Cohesin Ring
Yasuto Murayama, Catarina P. Samora, Yumiko Kurokawa, Hiroshi Iwasaki and Frank Uhlmann
CellPublished Online January 18, 2018 DOI:10.1016/j.cell.2017.12.021
生命の設計図であるDNAは非常に長い“糸”で、細胞核の中で様々なタンパク質と結合し、染色体を形成しています。染色体は細胞が分裂する毎にコピーされ、分配されます。染色体はコピーされた直後、物理的に接着しています(姉妹染色分体間接着)。この染色体の物理的接着がなくなると染色体が正確に分配されなくなることがわかっています。この染色体の物理的接着には「コヒーシン」と呼ばれるリング状のタンパク質の働きが重要です(図)。コヒーシンはDNAと直接結合することがわかっていますが、姉妹染色分体を接着する仕組みはわかっていませんでした。
情報・システム研究機構 国立遺伝学研究所の村山泰斗准教授と東京工業大学の岩崎博史教授らの研究グループは、コヒーシンを細胞から分離精製し、コヒーシンとDNAの複合体の形成を試験管内で再現することにより、コヒーシンによる姉妹染色分体接着の仕組みの一端を明らかにしました。コヒーシンは「結束バンド」のように2本のDNAを束ねることがわかったのです(図)。
本成果によりコヒーシンの性質を詳細に明らかにしたことが、コヒーシンの機能欠損が原因とされている様々な疾患や不妊の原因解明に繋がると期待されます。
本研究成果は、平成30年1月18日 (米国東部時間) に米国科学雑誌 Cell に掲載されました。
本研究は、情報・システム研究機構・村山泰斗准教授、黒川裕美子研究員、東京工業大学・岩崎博史教授、英国フランシスクリック研究所・Frank Uhlmann グループとの共同研究としておこなわれました。
本研究は、科学研究補助金 (16H06160、16H01404、15H059749)、日本分子生物学会若手研究助成富沢純一・圭子基金の支援を受けておこなわれました。
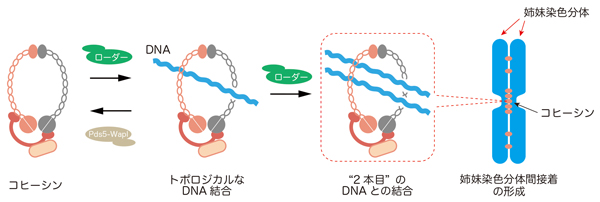
図:コヒーシンによる姉妹染色分体間接着の形成モデル。
コヒーシンは、自身のリングの一部を開いて、その内側に通すようにしてDNAと結合し、“2本目”のDNAと結合する。これにより、DNA−コヒーシン−DNAの構造をつくって、2つの姉妹染色分体の間に接着を形成すると考えられる。
斎藤成也 教授が機構合同シンポジウム「人文知による情報と知の体系化」で講演
マウス「ミシマバッテリー」10系統の全ゲノム配列をNIG_MoG2より公開
このたび、国立遺伝学研究所(遺伝研)が運営・公開しているマウスゲノム多型情報データベースNIG_MoG(National Institute of Genetics_Mouse Genome Database)に、新たに8種類の野生由来マウス近交系統のリシーケンス情報を追加し、実験動物「マウス」の成立にかかわったと考えられている4つの亜種全てのゲノム配列情報を含む新しいバージョン「NIG_MoG2」として公開することになりました。
基礎医学・生物学研究に大きな貢献をしている実験用マウスの成立には、世界中に分布する複数の亜種が関与しています(図1)。これまでのゲノム解析研究などにより、西欧に分布するドメスティカス、東ヨーロッパから極東地域まで広く分布するムスクルス、揚子江以南の東南アジアに分布するキャスタネウス、さらには日本に分布するムスクルスとキャスタネウスの雑種であるモロシヌスなどの亜種が深く関わっていることがわかっています。
遺伝研は、1970年代から森脇和郎博士を中心としたグループにより、世界各地で捕獲された4亜種に属する野生マウスから近交系統を樹立してきました。特に、現在も生体で維持している10系統については「ミシマバッテリー」と呼ばれ、ヒトをはじめとした哺乳動物の「個性」に関わる「体質」や「気質」、さらには疾患発症に関わる遺伝子の探索研究に広く利用されています。例えば、「ミシマバッテリー」の中でも、モロシヌス亜種由来のMSM/Ms(MSM)系統は、世界で多用される近交系C57BL/6J(B6)との交配によりコンソミック(染色体置換)系統群が樹立され、個性や疾患に関わる遺伝子の探索研究を行うためのリソースとして、遺伝研から研究コミュニティに提供され、様々な研究活動に貢献しています。また、MSMと同様にモロシヌス亜種に属する愛玩マウス由来のJF1/Ms(JF1)系統は、全ゲノム配列解析から、その祖先が複数の基準的な実験用マウス系統の成立に直接的に寄与し、それらの表現型に大きくかかわっていると考えられています。MSMおよびJF1は、これ以外にも、豊富なゲノム多型情報を利用して、エピジェネティック研究などで利用されています。
今回改訂されたNIG_MoG2(図2)には、「ミシマバッテリー」10系統全てのゲノム情報が含まれるとともに、MSMについては、新たなデータの追加により、以前より高精度な多型情報を取得することが可能になっています。また、NIG_MoGに引き続き、“実験生物学者 (wet-lab biologists)”が直感的に使用できるように設計されています。ユーザーは、必要に応じて1塩基から数メガベースに渡るゲノム領域の亜種間ゲノム多型を簡単に観察することができます。個々の遺伝子についても、エクソンやアミノ酸配列、およびイントロンについて相互比較を行うことができ、任意の塩基配列も検索・取得可能です。これら以外にも、マウス亜種間ゲノム多型情報を利用した機能ゲノム研究を効果的に行うための情報やツールが拡充され、実験動物マウスを利用した各種の研究に欠かせないゲノム多型情報が一層効果的に探索できるようになりました。
このデータベースの構築と公開は、遺伝研の生物遺伝資源事業の一環として推進しています。なお、ミシマバッテリーのゲノム解析は、遺伝研の比較ゲノム解析研究室の豊田 敦博士、藤山秋佐夫博士(現情報・システム研究機構データサイエンス共同利用基盤施設長)、および先端ゲノミクス推進センターの福多賢太郎博士、野口英樹博士と共同で実施しました。また、このデータベースの構築と公開は、遺伝研の哺乳動物遺伝研究室(高田豊行、城石俊彦)および系統情報研究室(川本祥子博士)の共同事業です。
このデータベースについての質問やリクエストは下記にご連絡ください。
- 情報・システム研究機構国立遺伝学研究所
哺乳動物遺伝研究室 - 高田豊行 ttakada@nig.ac.jp
- 城石俊彦 tshirois@nig.ac.jp
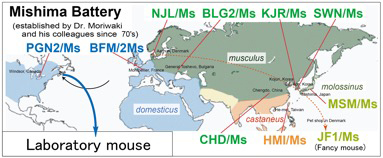
図1. 国立遺伝学研究所で樹立された10種類のマウス近交系統「ミシマバッテリー」(系統名は太字で表示)。
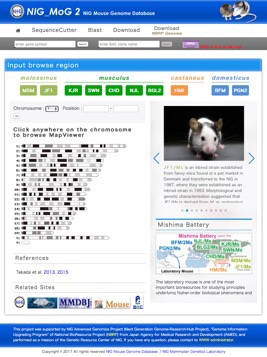
図2. NIG_MoG2のトップページ(http://molossinus.lab.nig.ac.jp/mog2)。
マウス各系統の写真と解説はデータベースをご覧ください。
成長期の神経の「試運転」を可視化 ―赤ちゃんマウスの脳で発見された新しいタイプの自発神経活動―
![]()
Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections
Hidenobu Mizuno, Koji Ikezoe, Shingo Nakazawa, Takuya Sato, Kazuo Kitamura, Takuji Iwasato
Cell Reports Volume 22, Issue 1, p123–135, 2 January 2018 DOI:10.1016/j.celrep.2017.12.012
ヒトをはじめとする哺乳動物の脳では多数の神経細胞がネットワークを形成し、様々な情報処理をおこなっています。神経細胞のネットワークは、胎児期に遺伝情報によって大まかに作られた後、子供の時期に「試運転」(使いながら調整)するステップを経て完成します。しかしながら、試運転の実態はよくわかっていませんでした。
情報・システム研究機構 国立遺伝学研究所の水野秀信助教、岩里琢治教授らの研究グループは、マウスのヒゲの感覚を処理する神経回路をモデルとして、この課題に取り組みました。マウスをはじめとするげっ歯類のヒゲの感覚を処理する神経は、脳内で対応するヒゲごとに集まって「バレル」とよばれるクラスターを形成しています(図1a,b)。バレルの神経の興奮状態を蛍光タンパク質によって可視化したところ、ネットワークの調整が活発におこなわれる生後5日目の赤ちゃんマウスで、同じバレルに属する神経細胞が「ヒゲの刺激なし」で同時に興奮(自発発火)し、全体では「パッチワーク状」に見えることがわかりました(図1c,d)。一方、ネットワーク完成後の生後11日目では同じバレルに属する神経細胞であってもばらばらに興奮(発火)するようになったことから、パッチワーク状の発火はネットワークの試運転中にだけみられる特徴でした。
本研究成果が、子供の脳の発達、および、その破綻による発達障害や精神疾患の理解の基盤になることが期待されます。
本研究成果は、米国科学誌「Cell Reports」に平成30年1月2日(米国東部標準時間)に掲載されました。
本研究は、国立遺伝学研究所形質遺伝研究部門 岩里琢治研究室にて、山梨大学医学部・大学院総合研究部生理学講座神経生理学教室 喜多村和郎研究室との共同研究としておこなわれました。
科学研究費補助金(15K14322, 16H06143, 16K14559, 15H04263, 15H01454)、新学術領域「スクラップ&ビルドによる脳機能の動的制御」(16H06459)、武田科学振興財団、新潟大学脳科学研究所共同利用・共同研究(2017-2923)からのご支援に感謝いたします。
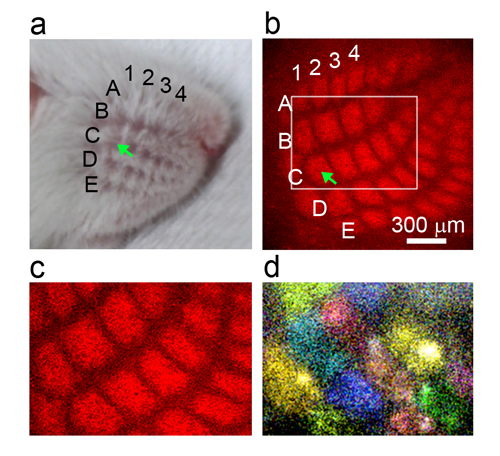
- 図:マウスのヒゲの感覚を処理する神経回路の地図
- (a)マウスの頬の拡大図。それぞれのヒゲには名前が付いており、上から順にAからE、左から順に数字が割り当てられる。例えば矢印はヒゲC1と呼ばれる。
- (b)マウスのヒゲの感覚を処理する脳内の神経回路。写真で赤く光ってみえるクラスターがバレルと呼ばれる神経集団。バレルは、頬でのヒゲと同じ位置関係で配置している。例えば矢印はバレルC1と呼ばれ、ヒゲC1からの感覚情報の処理を行う数百個の神経細胞が集まってできている。このマウスではバレルが赤色タンパク質で標識されている。
- (c)bの一部を拡大したもの
- (d)生後5日目のマウスの脳で神経細胞がバレル単位でパッチワーク状に自発発火する様子。経時的に発火を観察し、同時に発火した神経に同じ疑似カラーをつけた。















