Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
サーチュイン遺伝子は、本当に長寿遺伝子だった -ゲノムを安定化することで老化を防ぐ作用機序を解明-
![]()
Cellular senescence in yeast is regulated by rDNA noncoding transcription.
Kimiko Saka, Satoru Ide, Austen R.D. Ganley, and Takehiko Kobayashi
Current Biology, 29 August 2013 doi:10.1016/j.cub.2013.07.048
寿命を延ばす働きをすると信じられているサーチュイン遺伝子(SIR2)。社会的な注目度も高く、関連した健康補助食品が販売されているくらいです。サーチュイン遺伝子の作用を解き明かそうと世界中の研究者が挑戦し、いろいろな仮説は得られてきましたが、詳しい作用メカニズムが明らかになっていませんでした。サーチュインはどんな仕組みで働くのでしょうか。そもそも、サーチュインの長生き効果は本当なのでしょうか。
今回、国立遺伝学研究所の小林武彦教授らは、その質問に答える決定的な発見をしました。さまざまな仮説を一掃する発見です。サーチュイン遺伝子の作用する反応経路を明らかにすることに成功したのです。それによると、サーチュイン遺伝子には、ある遺伝子の数を一定に保つという作用があり、それがゲノムの安定性へ通じ、確かに寿命を延ばすことにつながっていたのでした。そしてこれこそが、長生き効果における唯一の反応経路であることを実証しました。
ある遺伝子とは、リボソームRNA遺伝子です。この遺伝子は、ゲノム中にたくさんのコピーが含まれていますが、そのコピー数が変動しやすい、つまり不安定な性質をもつ遺伝子なのです。小林教授は、ヒト老化研究のモデル生物である酵母による研究を長年続け、データを積み上げてきました。そうした研究がジグソーパズルのピースの1片、1片を明らかにすることとしたら、今回の小林教授の研究は、そのジグソーパズル全体を完成させたようなものです。つまり、全体像が見えるようになり、そのことで、サーチュイン遺伝子が寿命を延長する効果を発揮するには、何が真に必要なのかが見えるようになったのです。決定的に必要なのはリボソームRNA遺伝子のコピー数の維持であること。具体的には、E-proというプロモーターを制御することだということです。実験では、サーチュイン遺伝子のノックアウト酵母株において、リボソームRNA遺伝子のコピー数を制御することにより、酵母菌の寿命を自由に操作することさえ可能でした。今後、このリボソームRNA遺伝子のコピー数の維持、つまりゲノムの安定性の維持が、老化や寿命の制御にどのように具体的にかかわっているか、さらに突き止めていくことが望まれています。それはヒトの老化機構の解明や、健康寿命の延長につながっていくでしょう。
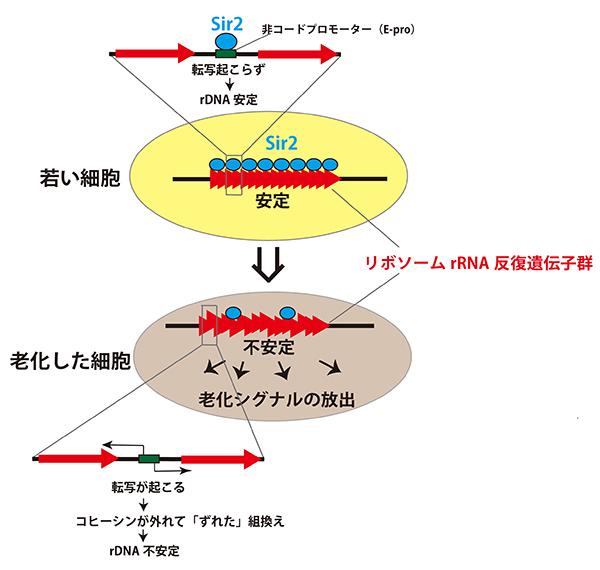
若い細胞ではSir2タンパク質が非コードプロモーター(E-pro)の発現を抑えているが、細胞が分裂を繰り返すとその抑えが徐々に弱くなり、E-proからの転写が起こり、リボソームRNA遺伝子の安定性が低下する。その結果何らかの老化シグナルがリボソームRNA遺伝子から発せられ、細胞が老化する。今回E-proからの転写を人為的にON、OFFできるようにしたところ、SIR2の有る無しに関わらず、ON時は酵母が短寿命で、OFFでは長寿命になることを見つけた。
遺伝性筋疾患の新たな原因遺伝子Stac3
運動神経回路研究室・平田研究室
Horstick, E. J., Linsley, J. W., Dowling, J. J., Hauser, M. A., McDonald, K. K., Ashley-Koch, A., Saint-Amant, L., Satish, A., Cui, W. W., Zhou, W., Sprague, S. M., Stamm, D. S., Powell, C. M., Speer, M. C., Franzini-Armstrong, C., Hirata, H.* and Kuwada, J. Y.* (*Corresponding authors)
Nature Communications 4: 1952 (2013). doi:10.1038/ncomms2952
私たちはゼブラフィッシュ稚魚の動きを指標に運動・行動に関わる遺伝子のスクリーニングを行い、Stac3 (SH3 and cysteine rich domain 3)という遺伝子の変異が運動障害を引き起こすことを見出しました。Stac3はSH3ドメインとシステインリッチドメインを有すること以外に何も知られていない機能不明遺伝子でしたが、私たちの解析からStac3が骨格筋に発現し、Stac3タンパクがT管(transverse tubule)という部位で電位センサー分子とカルシウム放出チャネルに結合し、筋収縮時の小胞体カルシウム放出を制御することを明らかにしました。
Stac3遺伝子は脊椎動物で保存されており、ヒトのSTAC3遺伝子は12番染色体上12q13.3部位にありますが、近年この領域にアメリカ先住民ミオパチー(Native American myopathy)という遺伝性疾患の責任領域がマップされました。この疾患はアメリカ先住民ラムビー族で報告された、筋力低下、筋痙攣、呼吸困難の症状を伴う筋疾患で、ラムビー族では5,000人に1人の高頻度で罹患すると推察されています。しかし、その原因はこれまで不明で、治療法も確立されていませんでした。私たちはアメリカ先住民ミオパチーの原因遺伝子がSTAC3であるという仮説のもと、患者のSTAC3遺伝子を解析しました。予想通り、患者のSTAC3遺伝子には変異があり、STAC3がアメリカ先住民ミオパチーの原因遺伝子であることが証明されました。さらに、その変異により運動時のカルシウム放出量が少なくなること、骨格筋の収縮力が低下することも分かりました。
本研究でアメリカ先住民ミオパチーの原因が明らかになりましたので、今後は効果的な治療法の開発が期待されます。本研究で開発されたゼブラフィッシュStac3変異体はアメリカ先住民ミオパチーの病態モデルとして有用で、症状を軽減する治療薬の開発にも使われています。
本研究はミシガン大学のジョン・クワダ教授らとの共同研究で行われました。
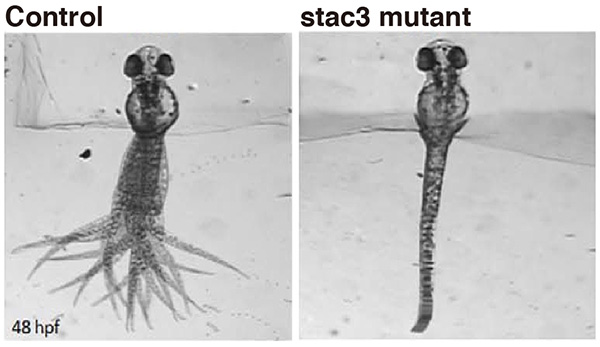
正常なゼブラフィッシュ(Control)は尾を大きく左右に振り泳ぐことができますが、アメリカ先住民ミオパチーの病態モデルのゼブラフィッシュ(stac3 mutant)は筋力が弱く、ほとんど尾を振れません。 尾の動きを見やすくするため、ゼブラフィッシュの前半身は動かないように固定してあります。
多発性関節拘縮と知的障害の原因遺伝子
運動神経回路研究室・平田研究室
Hirata, H.*, Nanda, I.*, van Riesen, A.*, McMichael, G.*, Hu, H.*, Hambrock, M., Papon, M.-A., Fischer, U., Marouillat, S., Ding, C., Alirol, S., Bienek, M., Preisler-Adams, S., Grimme, A., Seelow, D., Webster, R., Haan, E., MacLennan, A., Stenzel, W., Yap, T. Y., Gardner, A., Nguyen, L. S., Shaw, M., Lebrun, N., Haas, S. A., Kress, W., Haaf, T., Schellenberger, E., Chelly, J., Viot, G., Shaffer, L. G., Rosenfeld, J. A., Kramer, N., Falk, R., El-Khechen, D., Escobar, L. F., Hennekam, R., Wieacker, P., Hübner, C., Ropers, H.-H., Gecz, J., Schuelke, M., Laumonnier, F. and Kalscheuer, V. M. (*Equal contribution)
American Journal of Human Genetics 92: 681-695 (2013). doi: 10.1016/j.bbr.2011.03.031
私たちはゼブラフィッシュ稚魚の動きを指標に運動・行動に関わる遺伝子の研究を行い、ジンク・フィンガー型転写因子Zc4h2の発現を阻害した個体では泳動が遅くなることを見出しました。Zc4h2遺伝子は脊椎動物で高度に保存されており、ヒトのZC4H2遺伝子はX染色体上Xq11.2部位にあります。私たちはヒトのZC4H2遺伝子がヒトの運動・行動疾患にかかわる可能性を視野に、ヒトのZC4H2遺伝子の研究も行いました。
多発性関節拘縮は上肢や頸部などの関節周りの組織が固まり、運動が制限される難病で、先天性・遺伝性のものと、後天性のものがあります。私たちは次世代シーケンサーを用いた患者ゲノムの解析から、ZC4H2遺伝子が知的障害を併発する遺伝性多発性関節拘縮の原因遺伝子であることを突き止めました。さらにゼブラフィッシュを用いた多発性関節拘縮の病態モデルの解析から、Zc4h2が神経系に広く発現すること、Zc4h2を欠く個体では運動ニューロンの筋投射に異常が見られることも明らかになりました。これらの発見は多発性関節拘縮の原因を解明するとともに、その生前診断を可能にし、さらに治療法確立に貢献するものであります。
本研究はマックスプランク分子遺伝学研究所のVera M. Kalscheuer博士、ベルリン大学附属シャリテ病院のMarkus Schuelke博士らとの共同研究で、遺伝研共同研究の支援を受けて行われました。
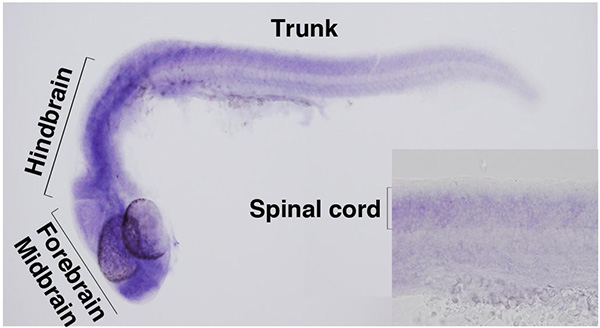
ZC4H2遺伝子は前脳、中脳、後脳、脊髄など神経系に広く発現する。
遺伝子内ヘテロクロマチンへの対処
Hidetoshi Saze, Junko Kitayama, Kazuya Takashima, Saori Miura, Yoshiko Harukawa, Tasuku Ito and Tetsuji Kakutani
Nature Communications, 4, Article number:2301 doi:10.1038/ncomms3301
動物や植物のゲノムにはトランスポゾンが多数存在します。これらの生物は、エピジェネティックな機構を用いてトランスポゾンを不活性なヘテロクロマチン状態にすることで、その増殖を抑制しています。 一方、トランスポゾンは活発に転写されている遺伝子の内部にも見つかりますが、遺伝子内のトランスポゾンの制御機構についてはほとんど理解されていませんでした。
他の多くの生物と同様に、モデル植物であるシロイヌナズナやイネのゲノムにはヘテロクロマチンを内包した遺伝子が数多く存在します。こうした遺伝子内ヘテロクロマチンは多くがトランスポゾンの挿入により形成されたものでした。今回、ヘテロクロマチンをもつ遺伝子を適切に転写するのに必要な新しい因子IBM2(Increase in Bonsai Methylation 2)を発見し、その働きを調べました(図)。この研究により、生物がトランスポゾンの抑制を保ちつつ適切な遺伝子発現を保障する仕組みを進化させてきたことが明らかになりました。これは生物の集団中の遺伝的多様性とその影響を理解する上で重要な知見になると考えます。(この研究はOIST佐瀬研究室との共同研究です。)
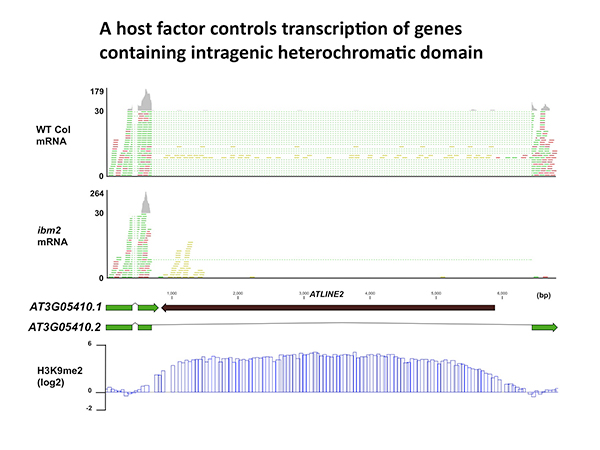
テロクロマチンをもつ遺伝子(AT3G05410.2)の転写がibm2変異体では阻害される。緑と赤が転写されたmRNAを、点線がスプライシングされている領域を示す。 遺伝子内にはトランスポゾン(ATLINE2)の挿入があり、H3K9メチル化を受けてヘテロクロマチン化されている(再下段)。
嗅覚入力に依存した脳左右半球での非対称的な神経細胞細胞の特異化
Kishimoto, N., Asakawa, K., Madelaine, R., Blader, P., Kawakami, K., and Sawamoto, K.
Nature Neuroscience 16, 884-888, 2013 doi:10.1038/nn.3409
脊椎動物の脳は左右非対称です。今回私たちは、モデル脊椎動物ゼブラフィッシュにおいてトランスポゾンを用いた遺伝子トラップ法による大規模なスクリーンを行い、脳の左右半球において非対称的にGFP(Gal4)を発現するトランスジェニックゼブラフィッシュを見出しました。このトランスジェニックフィッシュにおいては、zinc finger蛋白質をコードするMyt1遺伝子内にトランスポゾンが挿入され、Myt1発現神経細胞を可視化することができました。Myt1発現細胞は、脳室帯—脳室下帯で新生され嗅球に移動する一群の細胞に含まれており、左半球により多く存在していました。私たちは、Notchシグナルが右側の脳室帯—脳室下帯におけるMyt1陽性神経細胞の産生を負に制御していること、ゼブラフィッシュの左側の鼻を塞ぐと左半球におけるNotchシグナリングが亢進しMyt1陽性神経細胞が減少すること、Notchシグナリングを阻害すると左側の鼻に依存した行動に異常が見られること、を明らかにしました。このことから、嗅覚入力がNotchシグナルを介して機能的神経細胞の左右脳半球における非対称的な新生を制御しているモデルを提唱しました。
この研究は名古屋市立大学・岸本博士、澤本博士との共同研究として行なわれました。
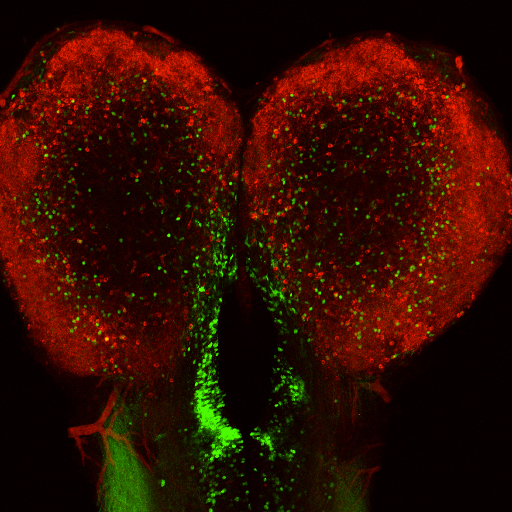
ゼブラフィッシュ終脳、脳室帯—脳室下帯において新生されるMyt1陽性細胞の左右非対称な分布。
血流により誘導されるマイクロRNAが心臓弁形成を制御する
Toshihiro Banjo,Janin Grajcarek,Daisuke Yoshino,Hideto Osada,Kota Y. Miyasaka,Yasuyuki S. Kida,Yosuke Ueki,Kazuaki Nagayama,Koichi Kawakami,Takeo Matsumoto,Masaaki Sato & Toshihiko Ogura
Nature Communications 4,Article number:1978,2013 doi:10.1038/ncomms2978
心拍や血流は、正常な心臓形成のために重要なはたらきをしています。発生過程において、心拍を停める、あるいは血流を攪乱すると心臓形成に異常を生じます。今回私たちはモデル脊椎動物ゼブラフィッシュを用いて研究を行い、マイクロRNAのひとつ、miR-21が血流依存的に心臓内皮に発現していることを見出しました。さらに、miR-21の機能を阻害すると心臓の弁形成が正常に行なわれないこと、miR-21の新しいターゲットのひとつがSprouty2であることを明らかにし、miR-21は、MAPキナーゼカスケードの阻害活性をもつSprouty2の発現を抑制することにより、正常な心臓弁形成に重要な役割を果たしている、というモデルを提唱しました。
本研究は、東北大学加齢医学研究所・小椋博士との共同研究として行なわれました。
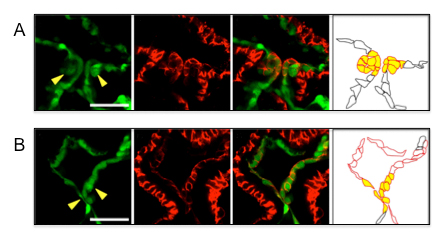
A:ゼブラフィッシュ野生型胚における正常な心臓弁形成。
B:miR-21の機能が阻害されたゼブラフィッシュ胚における異常な心臓弁形成。
細胞分裂のタイミングの調節による球菌から桿菌への復帰
Daisuke Shiomi, Hironori Niki
MicrobiologyOpen (DOI: 10.1002/mbo3.116)
細菌ごとに形や大きさは決まっている。大腸菌や枯草菌は、長楕円の形、すなわち桿状をしており「桿菌」と呼ばれている。そして桿状の形態は、細胞壁により維持されている。細胞壁は抗生物質の標的であることから、細菌の形態維持の機構は盛んに研究されるようになった。私達の研究室では桿状形態を制御する因子であるRodZについて研究を行なってきた。RodZが欠損した大腸菌は、球状の形態に変化する。この球状に変化した大腸菌から、再び桿状に戻った復帰変異体を分離し調べることによって、桿状形態の制御の仕組みについて調べている。今回、復帰変異体の一つが細胞分裂の制御に関わるZipA蛋白質の発現変異により、球状から桿状に戻ることを明らかにした。ZipAは細胞分裂の際に、分裂面の形成時期を決める。ZipA蛋白質の発現が増加すると、分裂面の形成が遅れるのである。しかし、遅れている間も細胞の伸長はつづき、分裂が遅れた分だけ通常よりも長い細胞になるのである。このように細胞分裂の遅延により、球菌から桿菌への形態の復帰が起きたのである。自然界にはストレプトコッカスのような極性をもったレンサ球菌がいるが、今回の発見はこのタイプの球菌から桿菌は生じる仕組みとして適用できるものである。
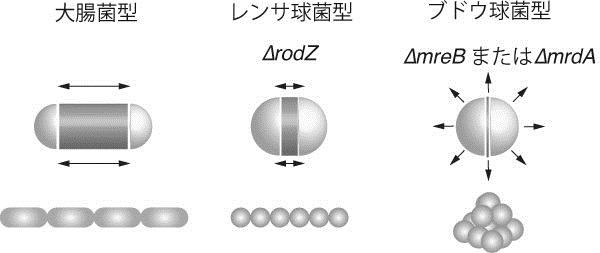
大腸菌型は、細胞の中央領域の細胞壁が伸長する。また細胞極性は常に一定であるため、分裂した細胞は直鎖上に並ぶ。レンサ球菌型は半球の間の細胞壁がわずかに伸長するだけである。RodZ欠損株もこの型である。他方、ブドウ球菌型は細胞全体が膨らみ、また細胞極性も変わるため分裂した細胞は固まりとなる。大腸菌でもMreBやMrdAの欠損株がこの型となる。
細胞核内のDNAの濃度が染色体の凝縮に影響する
Yuki Hara, Mari Iwabuchi, Keita Ohsumi, Akatsuki Kimura
Mol. Biol. Cell August 1, 2013 vol. 24(15) 2442-2453 doi: 10.1091/mbc.E13-01-0043
私たちヒトをはじめとする真核生物において、遺伝情報を担う染色体は、細胞が分裂する際には凝縮し、一本一本の染色体が「分裂期染色体」と呼ばれる棒状の構造を形成します。同じ個体の中でも、DNAの塩基配列の長さは変わらないのに、分裂期染色体の長さは変わることが知られています。その理由としてこれまで、発生ステージによって染色体を凝縮させる蛋白質の種類や量がかわることによることがわかっていました。今回、細胞建築研究室の原裕貴(総研大遺伝学専攻、現在はドイツEMBL研究員)と木村暁は、名古屋大学の大隅圭太博士、岩渕万里博士との共同研究により、染色体凝縮が「細胞核内のDNAの濃度」により制御されるとする新しいメカニズムを提唱しました。まず、線虫C. elegansを用いて、初期胚発生過程において、細胞核が徐々に小さくなる過程で、分裂期染色体の長さも徐々に短くなることを見いだしました。遺伝子操作により細胞核を大きくしたり小さくしたりすると、それに相関して同じ発生ステージでも分裂期染色体も長くなったり短くなったり変化しました。さらには、細胞核内のDNAの量を減らすと分裂期染色体は長くなり、DNA量を増やすと分裂期染色体は短くなることも明らかにしました。このことは、間期核内で染色体一本あたりの核の大きさが大きいほど分裂期染色体は長くなることを示しています。この制御の一般性を検討するためにカエル卵の無細胞系を利用して細胞核の大きさを小さくしてから分裂期染色体を形成させると、やはり分裂期染色体は通常よりも短くなることを見いだしました。以上の観察は、染色体の凝縮が核の大きさやDNAの量と言った物理的な制約に影響をうけることを示す新たな知見です。
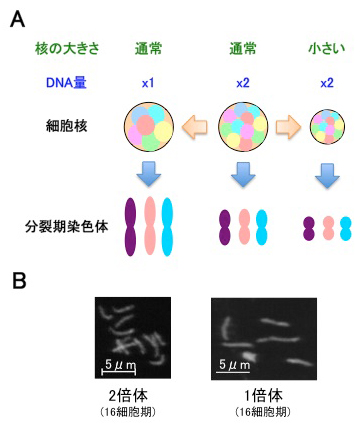
(A)細胞核内DNA濃度が染色体凝縮に影響する。核が小さくなると分裂期染色体も短くなる。核内の染色体DNAの量が減ると、分裂期染色体は長くなる。
(B)分裂期染色体の例(線虫のサンプル)。















