Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
藻類から陸上植物への進化をつなぐ車軸藻植物のゲノム配列を解読
![]()
Klebsormidium flaccidum genome reveals primary factors for plant terrestrial adaptation
Koichi Hori, Fumito Maruyama, Takatomo Fujisawa, Tomoaki Togashi, Nozomi Yamamoto, Mitsunori Seo, Syusei Sato, Takuji Yamada, Hiroshi Mori, Naoyuki Tajima, Takashi Moriyama, Masahiko Ikeuchi, Mai Watanabe, Hajime Wada, Koichi Kobayashi, Masakazu Saito, Tatsuru Masuda, Yuko Sasaki-Sekimoto, Kiyoshi Mashiguchi, Koichiro Awai, Mie Shimojima, Shinji Masuda, Masako Iwai, Takashi Nobusawa, Takafumi Narise, Satoshi Kondo, Hikaru Saito, Ryoichi Sato, Masato Murakawa, Yuta Ihara, Yui Oshima-Yamada, Kinuka Ohtaka, Masanori Satoh, Kohei Sonobe, Midori Ishii, Ryosuke Ohtani, Miyu Kanamori-Sato, Rina Honoki, Daichi Miyazaki, Hitoshi Mochizuki, Jumpei Umetsu, Kouichi Higashi, Daisuke Shibata, Yuji Kamiya, Naoki Sato, Yasukazu Nakamura, Satoshi Tabata, Shigeru Ida, Ken Kurokawa, & Hiroyuki Ohta Nature communications 10.1038/ncomms4978東京工業大学、かずさDNA研究所、理化学研究所、国立遺伝学研究所を含む研究グループは、藻類と陸上植物の中間的な存在である車軸藻植物門「クレブソルミディウム」に着目してゲノム解読を行い、藻類から陸上植物に至る遺伝子の進化過程を解明しました。それを他の藻類や陸上植物と比較して、藻類から陸上植物に至る過程でどのように遺伝子が多様化したのかを明らかにしました。またクレブソルミディウムの祖先が陸上環境に適応するための原始的なストレス応答システムを獲得していたことを突き止めました。
解読したゲノム情報は生命が陸上に進出し発展を遂げた過程を詳細に解明するための重要な基盤となります。また、クレブソルミディウムは藻類と陸上植物の中間的な性質を持つため、両方の架け橋として、その遺伝子情報を藻類の培養技術、物質生産技術に応用することも期待されます。
この研究はかずさDNA研究所、国立遺伝学研究所、理化学研究所、東京大学などと共同で行いました。成果は、平成26年5月28日付で英国科学誌「ネイチャー・コミュニケーションズ」に掲載されました。
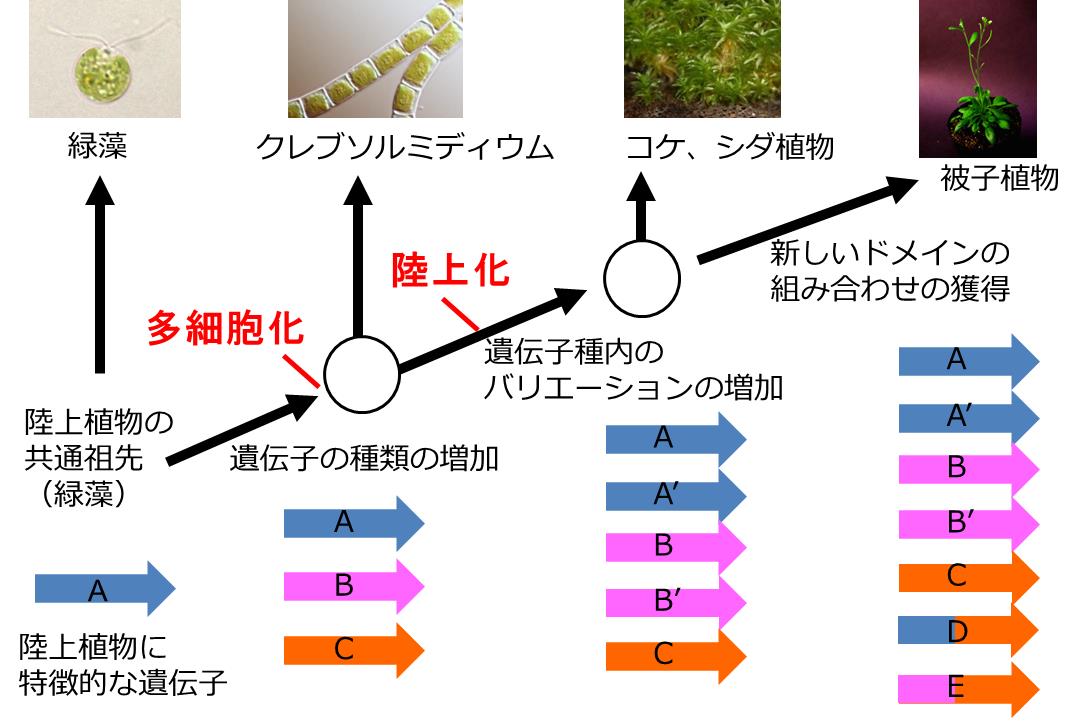
他生物とのゲノム比較から推定される遺伝子の多様性の獲得 植物が陸上化し、遺伝子の多様性が獲得される過程を示しました。クレブソルミディウムの祖先が生まれた段階で、陸上環境に適応するために必要であろう基本的な遺伝子パーツの多くをすでに獲得しており、陸上に進出する原動力となった事が推定されました。
高度な脳機能を担う『層構造』の起源に新しい光
A common developmental plan for neocortical gene-expressing neurons in the pallium of the domestic chickenGallus gallus domesticus and the Chinese softshell turtle Pelodiscus sinensis.
I. K. Suzuki and T. Hirata Front. Neuroanat.(2014) 8 20 doi: 10.3389/fnana.2014.00020哺乳類の際立った特徴は、大脳皮質の高度な発達です。後から生まれた神経細胞が上へ上へと重層されることで、みごとな層構造を作りあげます。この哺乳類固有の脳構造がどのように進化してきたのかは、古くから興味を持たれてきた大きな謎です。我々は、以前の研究で、層状の大脳皮質を持たないニワトリの脳にも、哺乳類大脳皮質の上層細胞と下層細胞に類似した神経細胞が存在することを報告しました。しかし、ニワトリと哺乳類の比較だけでは、進化の過程で起きた変化を予測できず、他の動物種の解析が待望されていました。今回、我々は、より原始期的な脳だといわれるカメの大脳皮質相同領域を用いて、遺伝子発現解析を行いました。カメの脳は一層の神経細胞層をもち、ニワトリの脳とは形態が大きく異なります。しかし、大脳皮質層マーカー遺伝子オーソログの発現を調べると、カメとニワトリの神経細胞の分布パターンは、極めて良く似ている事がわかりました。具体的には、いずれの動物においても、下層細胞は内側に、上層細胞は外側に分布しており、これが非ほ乳類羊膜類における基本型であると考えられました。この結果は、我々が提唱する「大脳皮質神経細胞の古い起源」を支持します。そして、その背後には、誕生時期依存的に神経細胞の個性を決める機構の普遍性があるだろうと考えています。
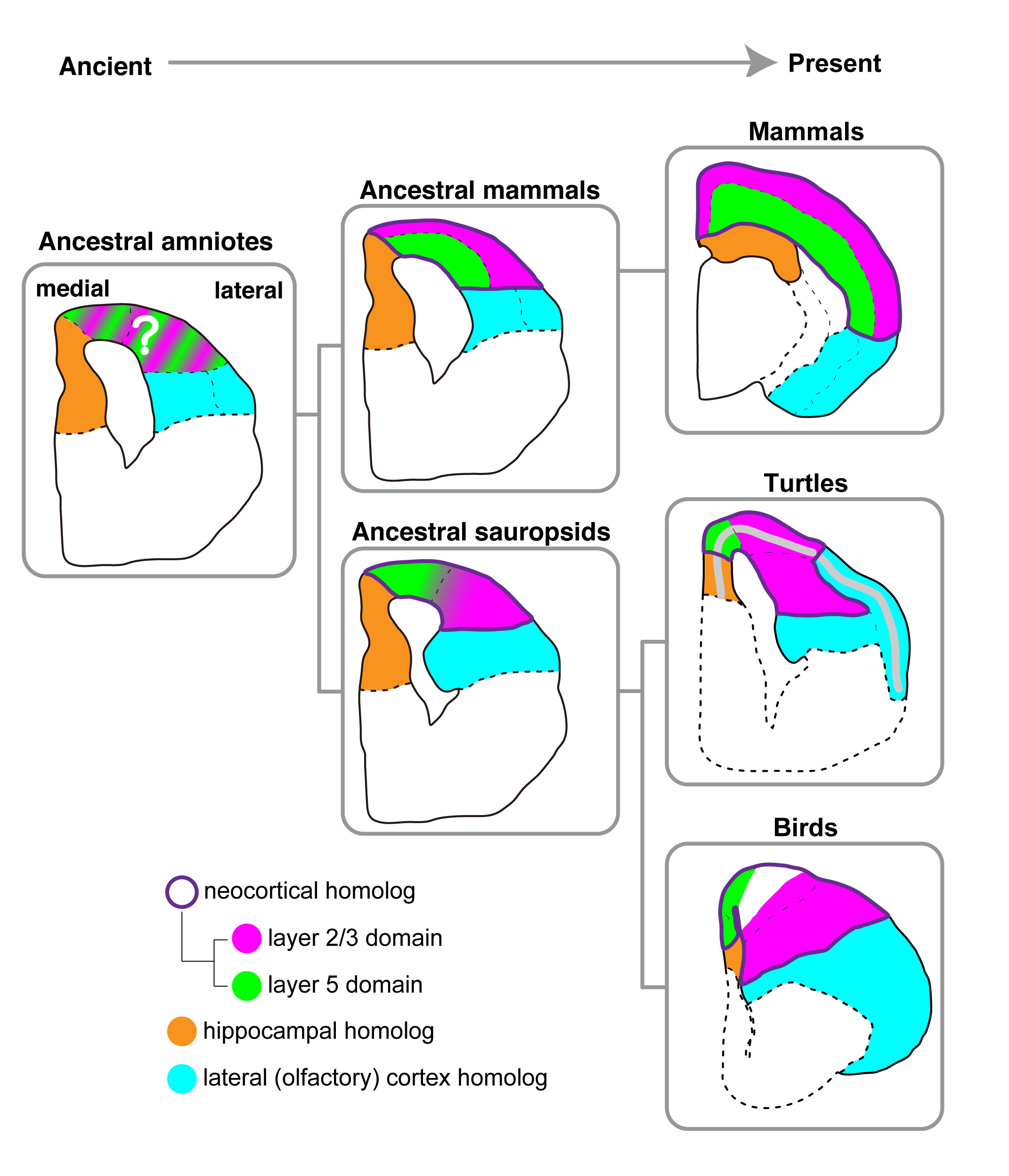
羊膜類における脳進化のモデル
社会行動を自動解析するフリーウェアを新たに開発
A male-specific QTL for social interaction behavior in mice mapped with automated pattern detection by a hidden Markov model incorporated into newly developed freeware
Toshiya Arakawa1, Akira Tanave1, Shiho Ikeuchi, Aki Takahashi, Satoshi Kakihara, Shingo Kimura, Hiroki Sugimoto, Nobuhiko Asada, Toshihiko Shiroishi, Kazuya Tomihara, Takashi Tsuchiya, Tsuyoshi Koide. ※1 equally contributed. Journal of Neuroscience Methods Available online 21 April 2014 doi:10.1016/j.jneumeth.2014.04.012マウスの社会行動の解析はヒトの社会性関連疾患の理解の上でも重要な研究ですが、その解析手法は主に実験者による行動観察に依存しており、膨大な時間と労力を要することが研究上の大きな支障となっています。
大学院生の田邉彰さんと小出剛准教授らは共同研究者らと共に、隠れマルコフモデルを用いて、2個体のマウスの様子を撮影したビデオ画像から、実験者による行動観察に準じたレベルで社会行動を自動推定するプログラムを作製しました。さらに、このプログラムを組み込み、社会行動の動画撮影記録からその位置情報のトラッキング、社会行動の自動推定、さらにその解析結果の出力までを行うフリーウェアソフト DuoMouseを新たに開発しました。
また、DuoMouseを用いて実際にマウス社会行動にかかわる遺伝子座のマッピングに成功し、DuoMouseが遺伝子マッピングや薬理効果の解析など、多数の個体の解析が要求される実験に有効に利用できることを示しました。
このDuoMouseは研究所のホームページより公開しており、今後社会行動の解析に取り組む多くの研究者の研究活動に貢献するものと期待されます。 (http://www.nig.ac.jp/labs/MGRL/DuoMouse.html)
本研究は情報・システム研究機構新領域融合プロジェクト(遺伝機能システム学)、科学研究費補助金(23650243, 25116527)、国立遺伝学研究所共同研究(2010-A40, 2012-A85)の支援を受けて行われました。
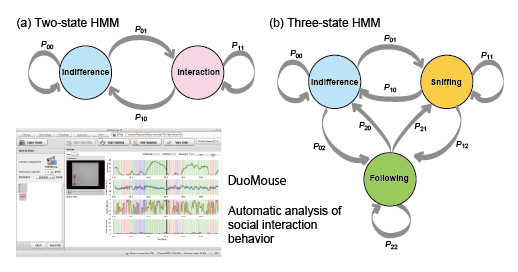
社会行動を自動解析するための隠れマルコフモデルの概念図とDuoMouseの解析結果表示ページ
骨リモデリングによるゼブラフィッシュ側線器官の形成メカニズム
Development of the lateral line canal system through a bone remodeling process in zebrafish.
Hironori Wada, Miki Iwasaki, Koichi Kawakami Dev. Biol., in press, doi: 10.1016/j.ydbio.2014.05.004動物の皮膚はさまざまな組織からなる複雑な構造をしています。皮膚の感覚器(神経組織)は、決まった位置に決まったパターンで存在することによって、適切な感覚受容を行っています。これらの感覚器は、どのように形成されるのでしょうか。
ゼブラフィッシュの側線器官(感丘)は、稚魚期には体表にありますが(図A)、魚の成長過程において、骨組織であるウロコの中に取り込まれます(管器、図C)。我々は、この移行過程において、骨形成と骨吸収(骨リモデリング)が行われていることを明らかにしました(図B)。さらに、ウロコの移植実験と突然変異体解析から、(1)側線器官が骨リモデリングに必要であること、また、(2)骨リモデリングは側線器官の成長に必要であること、を示しました。これらの結果は、感覚器(神経組織)と骨(結合組織)は、密接に相互作用しながら、形態形成を行っていることを示しています。
骨組織の恒常性の維持は、生体にとって重要な役割を持っています。骨形成と骨吸収のバランスが崩れることによって、骨粗鬆症などの骨疾患が生じます。魚のウロコは、体表近くに存在する骨組織であるため、その形成・吸収過程を生きたまま観察することができます。骨リモデリング過程における組織間の相互作用を明らかにすることが今後の課題です。
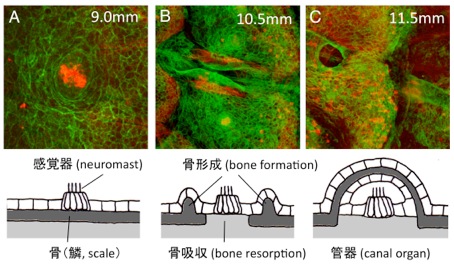
(A)稚魚において、側線器官は体表に存在する。(B)魚の成長過程で、側線器官の周囲の骨が隆起する。同時に側線器官の下の骨が吸収される。(C)側線器官は、骨に取り囲まれ、皮膚(ウロコ)の下に埋没する。
トムソン・ロイター論文引用度指数(2008~2012年)で総合2位にランクイン
「2015年版大学ランキング」(朝日新聞出版)で紹介の、トムソン・ロイター論文引用度指数(2008~2012年)ランキングで、遺伝研が総合2位にランクされました。また、同分野別ランキングでは、微生物学と動植物学で1位にランクされました。
論文引用度指数(国内2008~2012年)
総合
| 大学・機関 | 論文数 | 引用度指数 | |
|---|---|---|---|
| 1 | 分子科学研究所 | 1,162 | 138.4 |
| 2 | 国立遺伝学研究所 | 656 | 132.6 |
| 3 | 国立天文台 | 1,674 | 130.8 |
| 4 | 生理学研究所 | 600 | 130.1 |
| 5 | 立教大学 | 707 | 126.4 |
| 6 | 東京大学 | 36,938 | 125.7 |
| 首都大学東京 | 2,859 | 125.7 | |
| 8 | 東京工業大学 | 11,669 | 125.6 |
| 9 | 高エネルギー加速器研究機構 | 2,605 | 124.0 |
| 10 | 京都大学 | 27,234 | 122.6 |
分野別、論文引用度指数(国内2008~2012年)
微生物学
| 大学・機関 | 論文数 | 引用度指数 | |
|---|---|---|---|
| 1 | 国立遺伝学研究所 | 82 | 154.1 |
| 2 | 順天堂大学 | 122 | 152.4 |
| 3 | 慶応義塾大学 | 228 | 140.7 |
| 4 | 東京医科歯科大学 | 172 | 138.3 |
| 5 | 宮崎大学 | 169 | 137.6 |
| 6 | 京都大学 | 976 | 137.2 |
| 7 | 金沢大学 | 117 | 132.7 |
| 8 | 熊本大学 | 203 | 130.5 |
| 9 | 東京大学 | 1,670 | 129.5 |
| 10 | 東京工業大学 | 221 | 126.7 |
動植物学
| 大学・機関 | 論文数 | 引用度指数 | |
|---|---|---|---|
| 1 | 国立遺伝学研究所 | 52 | 146.7 |
| 2 | 基礎生物学研究所 | 161 | 121.2 |
| 3 | 横浜市立大学 | 102 | 116.8 |
| 4 | 総合研究大学院大学 | 108 | 116.7 |
| 5 | 金沢大学 | 101 | 115.3 |
| 6 | 宇都宮大学 | 110 | 114.5 |
| 7 | 名古屋大学 | 474 | 113.9 |
| 8 | 奈良先端科学技術大学院大学 | 185 | 113.3 |
| 9 | 大阪大学 | 172 | 110.5 |
| 10 | 東京大学 | 1,464 | 108.5 |
※このデータは「大学ランキング2015」(朝日新聞出版)の承諾を得て転載しています。無断で転載、送信するなど
朝日新聞社など著作権者の権利を侵害する一切の行為を禁止します。
昼に光合成、夜に細胞分裂が起こるのはなぜか?その謎を解明!
![]()
Translation-independent circadian control of the cell cycle in a unicellular photosynthetic eukaryote.
Shin-ya Miyagishima, Takayuki Fujiwara, Nobuko Sumiya, Shunsuke Hirooka, Akihiko Nakano, Yukihiro Kabeya, Mami Nakamura Nature Communications 5,Article number:3807 doi:10.1038/ncomms4807生物のある活動が、一日のうちの決まった時間帯に起こるという現象は、自然界でよく観察されることです。細胞レベルでもそのことは当てはまり、細胞分裂の起こる時間帯が生物によって限定されていることは、これまでにも観察されてきました。では、なぜ、そのような時間帯の制限が存在するのでしょうか。それはどのような仕組みによるのでしょうか。遺伝学研究所の宮城島進也特任准教授らは、細胞分裂の観察が容易な単細胞性の藻類(真核生物の紅藻)を用いて、その謎を突き止めることに成功しました。
紅藻は、光合成を行う水生生物で、夜、細胞分裂が起こることが知られています。宮城島特任准教授らは、まず、細胞分裂の進行をオンにするスイッチは何かを調べました。生物の細胞内に、概日リズムを刻む生物時計(細胞内時計)が存在することはよく知られているのですが、その時計に連動したスイッチがあるはずなのです。そして、詳しく解析した結果、E2Fと呼ばれるタンパク質がスイッチとしてはたらくことで、細胞分裂は夜引き起こされることが明らかになりました。
次に、そのスイッチを壊す実験を行って、時間帯の制限を解除しました。すると、細胞は昼夜問わず分裂するようになりましたが、それにもかかわらず、全体の細胞分裂数は若干減少しました。そればかりか、活性酸素が引き起こす酸化ストレスが昂進していることがわかりました。活性酸素は、細胞内のミトコンドリアの呼吸や葉緑体の光合成がエネルギーを作り出すときに発生する有害な副産物です。このことから、細胞分裂が起こる時期として、活性酸素のストレスが最も少ない時間帯が選ばれているという事実が見えてきました。すなわち、光合成を行う生物の細胞では、ミトコンドリアや葉緑体が活動する時間帯と細胞分裂が起こる時間帯が分けられることで、活性酸素の子孫細胞に与えるダメージが、最小限にとどめられているのではないかという推測が得られたのです。
宮城島特任准教授らの研究は、今後、さまざまな生物での細胞内時計と酸素毒性対応機構の研究の端緒となるものと期待されます。さらに今回、生物時計の研究においても重要な発見がもたらされました。E2Fスイッチは、従来の細胞内時計と異なる、遺伝子発現に依存しない新規の時計機構に誘導されている初の事象と考えられるのです。新たな時計機構の解明への期待も高まります。
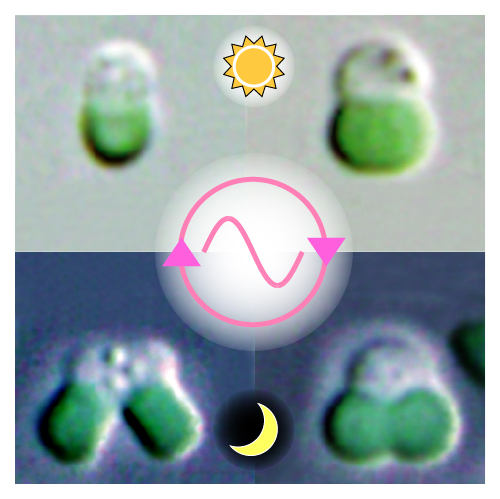
概日リズムによる真核藻類の細胞分裂制御。真核藻類は昼間葉緑体(細胞内の緑の部分)による光合成により成長し、夜間に分裂する。
Mudi•ワンクリックで酵母の変異点を同定
大量遺伝情報研究室・中村研究室 細胞遺伝研究部門・小林研究室
Mudi, a web tool for identifying mutations by bioinformatics analysis of whole-genome sequence.
Naoko Iida, Fumiaki Yamao, Yasukazu Nakamura, and Tetsushi Iida Genes to Cells 28 APR 2014 DOI:10.1111/gtc.12151遺伝学は、変異株を単離することで未知の生命現象の分子機構や遺伝子機能を明らかにできる強力な手法です。しかし従来のクローニング法は、手間がかかり網羅的な変異同定が困難でした。近年、次世代シークエンサー(NGS)の進歩により、実験室単位での全ゲノムシークエンスが可能になってきました。NGSによる全ゲノムシークエンスとバイオインフォマティクス解析を取り入れた変異点同定法は、高速で強力なアプローチです。
一般の実験研究者自身が、全ゲノムシークエンス解析を行う際、バイオインフォマティクス解析の敷居が高いという問題があります。今回、私たちは、「Webからワンクリックで変異同定解析が出来るバイオインフォマティクスツール”Mudi”」を構築•公開しました。 (Mudi; http://naoii.nig.ac.jp/mudi_top.html)
Mudiは、戻し交配により分離した変異株プールと野生型株のゲノムリシークエンスデータをWebサイトからアップロードすれば、ワンクリックで解析が実行でき、短時間で変異点リストを得ることができるシステムです。現在、Mudiはゲノム情報がよく整備されたモデル生物として、出芽酵母(S. cerevisiae)と分裂酵母(S. pombe, S. japonicus)を対象に公開していますが、他生物への応用も可能です。このシステムによって、遺伝学的解析の高速化が期待されます。
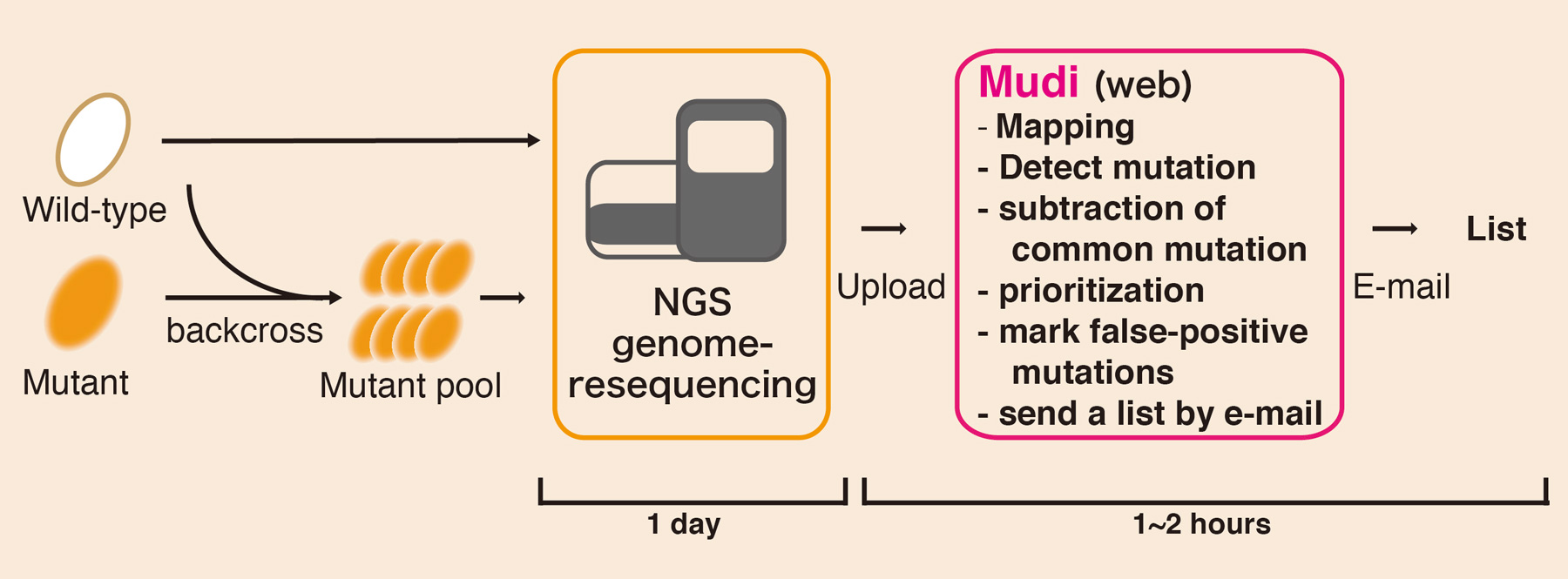
Webツール”Mudi”による変異点同定。戻し交配により分離した変異体プールからサンプル調整を行い、NGSによるゲノムリシークエンスを行う。Mudiツールによるバイオインフォマティクス解析により変異点を検出する。
「消えた遺伝率」の謎に迫る研究成果を発表
Segregation of a QTL cluster for home-cage activity using a new mapping method based on regression analysis of congenic mouse strains
Shogo Kato, Ayako Ishii, Akinori Nishi, Satoshi Kuriki, Tsuyoshi Koide Heredity. advance online publication 30 April 2014; doi:10.1038/hdy.2014.42行動などのありふれた表現型にかかわる遺伝子座(QTL)の効果を示すためには、コンジェニックマウス系統と呼ばれる、QTLを含む染色体領域を他の系統の遺伝的背景に導入した系統を作製することが効果的です。しかし、このようにして特定の系統に導入されたQTL領域は、狭めるにしたがって効果が消えてしまったり効果が変化したりする現象がよくみられ、「消えた遺伝率」と呼ばれる遺伝学の大きな問題となっています。
小出剛准教授らの研究室は、統計数理研究所の加藤昇吾助教および栗木哲教授との新領域融合プロジェクト研究で、QTLとしてマップされた領域に複数の独立のQTLが存在してクラスターを作っていることを明らかにしました。方法としては、多くの部分的に重なり合ったコンジェニック系統のホームケージ活動性の行動データについて、そのゲノムの重なり合った位置情報と行動データから、回帰モデルを用いて、どのゲノム領域がどのような効果を持っているか解明する方法を開発しました。その結果、全体として活動量を下げる効果を持っていたQTL領域は、実は4つのQTLからなるクラスターを構成し、低活動にするQTLが2か所、高活動にするQTLが1か所、その高活動の効果を打ち消す活性をもったQTLが1か所あることが分かりました。
この結果は、今後ありふれた行動などの表現型にかかわる遺伝子の分子メカニズムを正確に理解し、「消えた遺伝率」の謎に迫る上で重要な情報をもたらしてくれると期待できます。
この研究は情報・システム研究機構新領域融合プロジェクト(遺伝機能システム学)、科学研究費補助金(23650243, 25116527)、山田科学振興財団の支援を受けて行われました。
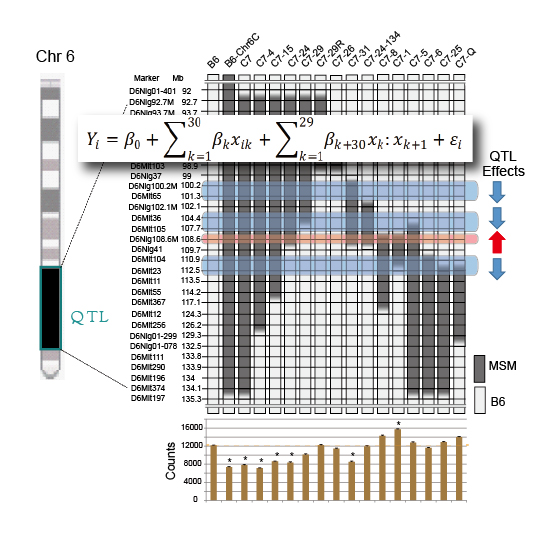
コンジェニック系統のホームケージ活動性から回帰モデルで判明した4つのQTL.各コンジェニック系統はそれぞれ異なった領域を持っていますが、各系統が示すホームケージ活動性はそれぞれ持っている領域により異なります。このデータを用いて、ゲノム領域の情報とともに回帰モデルによりホームケージ活動性にかかわる遺伝子領域を詳細にマッピングしました。















