Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
「Fission Yeast: A Laboratory Manual」Cold Spring Harbor Laboratory Pressより出版
Cold Spring Harbor Laboratory Pressから実験書「Fission Yeast: A Laboratory Manual」が発行の運びとなりました。単細胞真核生物の分裂酵母は遺伝学、細胞生物学の分野で広く研究され、細胞周期、分化、エピジェネティクスなどの基礎研究で多くの成果を上げています。
分裂酵母の研究で培われてきた実験プロトコールを第一線で研究している研究者が解説し新たに書き下ろしたものです。培養法からイメージジング、また研究に有用なデータベースまでも紹介されています。
分裂酵母といえば Schizosaccharomyces pombeですが、本実験書では最近モデル分裂酵母と利用され始めたS. japonicusの解説と実験プロトコールも収められています。これを国立遺伝学研究所系統生物研究センター、仁木宏典教授、青木敬太助教、京都大学放射線生物研究センター 古谷寛治講師で担当しました。
- タイトル:
- Fission Yeast: A Laboratory Manual
- 編集:
- Iain Hagan, Cancer Research UK Manchester Institute, University of Manchester; Antony M. Carr, University of Sussex; Agnes Grallert, Cancer Research UK Manchester Institute, University of Manchester; Paul Nurse, The Francis Crick Institute
- 価格:
- $150
Cold Spring Harbor Laboratory Press
Schizosaccharomyces japonicus: A Distinct Dimorphic Yeast Among the Fission Yeasts
Keita Aoki, Kanji Furuya, and Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.top082651
Mating, Spore Dissection, and Selection of Diploid Cells in Schizosaccharomyces japonicus
Kanji Furuya and Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.prot091843
Transformation of Schizosaccharomyces japonicus
Keita Aoki and Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.prot091850
Induction of Hyphal Growth in Schizosaccharomyces japonicus
Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.prot091868
蛍光顕微鏡画像の簡便かつ非裁量的な定量解析法を開発
GBIQ: a non-arbitrary, non-biased method for quantification of fluorescent images
Youichirou Ninomiya*, Wei Zhao and Yumiko Saga*
Scientific Reports 6, Article number: 26454 (2016) DOI:10.1038/srep26454
(* corresponding authors)
国立遺伝学研究所の二宮洋一郎融合プロジェクト特任研究員、相賀裕美子教授らは、蛍光顕微鏡画像を簡便かつ非裁量的に定量解析する新しい方法を開発しました。
従来、細胞や組織の蛍光顕微鏡画像を定量解析するには、まず、画像内の細胞を細胞核や細胞膜などの染色像を利用して一つ一つ同定する処理cell segmentationが必要でした。この、同定された個々の細胞の蛍光強度を計測し、定量解析を行います。従って、ノイズやゴミなどの人為産物を取り除き、cell segmentationで適切に個々の細胞を同定することが重要となり、cell segmentationのアルゴリズムやパラメータセットを最適化する必要があります。
これは、画像定量化の最初の過程で多くのパラメータを裁量的に調整しなくてはならず、同じ画像を定量化しても、術者の選ぶパラメータセットやアルゴリズムが変わると異なった解析結果が得られることを意味します。また、現在のcell segmentationの各アルゴリズムには汎用性がなく、個々の解析対象に応じてアルゴリズムとパラメータセットを選択・最適化する必要がありました。
そこで、画像を規則的な碁盤の目状のグリッドで機械的に仕切り、各グリッドの蛍光強度の基本統計量でグリッドの蛍光特性を代表させる、簡便なアルゴリズムGBIQ (Grid Based Image Quantification)を開発しました。ただし、このままでは、一つのグリッドに核と細胞質の両方が含まれるような解析には不適切なグリッドが混在するため、例えば核のみが含まれるグリッドを選択する何らかの方法が必要です。そのため、混合正規分布を個々の正規分布に分離する統計的クラス分類の手法を適用し、特定の要件を満たすグリッドのみを精度良く選択する方法(Median IQR filter)を実装しました。その結果、一つのパラメータ(グリッドの大きさ)を設定するだけで画像の定量化と解析を非裁量的に実行することに成功しました。このことは、どのような蛍光顕微鏡画像でも、GBIQを適用してパラメータを一つ決めれば、術者が誰であるかに関わらず同じ画像からは常に同じ結果が得られることを意味します。
今後、GBIQをハイスループット・スクリーニングなどの大量の顕微鏡画像データの処理に応用することで、表現型の非裁量的な定量化を実現し、データ中心的な生命科学の進展に大きく寄与することが期待されます。
この研究は情報・システム研究機構 新領域融合プロジェクト 統計数理基盤「データ同化」の一環として行われました。
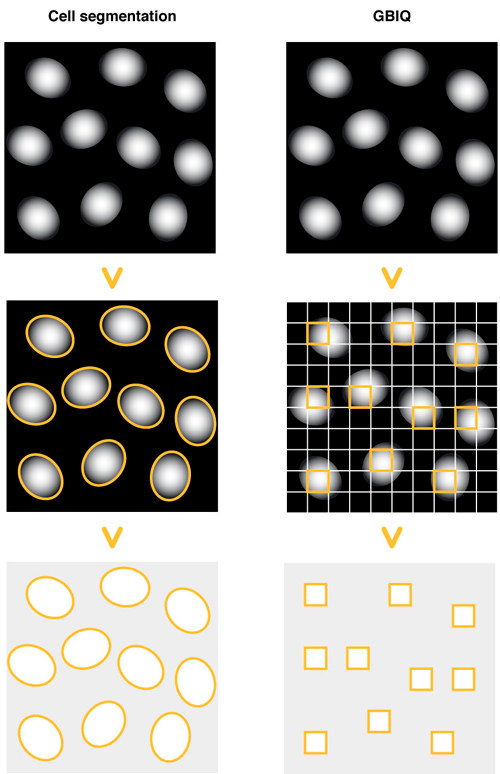
Cell segmentation: 核染色像を指標に、細胞核の輪郭像を描出する。輪郭像を認識・同定し、細胞単位の蛍光特性を計測する。
GBIQ: 画像を一律に同じ大きさのグリッドで区切る。細胞核のみを含むグリッドを選択し、グリッド単位の蛍光特性を計測する。
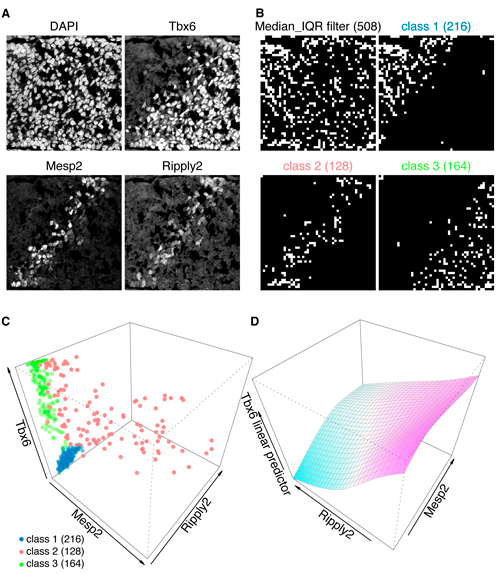
A: マウス胚尾芽の組織切片の三重蛍光染色像。DAPIは核染色。Tbx6の発現境界に一致して、Mesp2/Ripply2の帯状の発現が観察される。
B: Median_IQR filterによって核のみを含む508グリッドを抽出し、Tbx6/Mesp2/Ripply2の染色強度によって3つのクラス(class 1〜3)に分類した。
C: それぞれのクラスの3次元散布図。class 2 (red)のグリッドはMesp2とRipply2の両方を発現する。
D: class 2のグリッドを用いて一般化加法モデルによる解析を行った。Ripply2とTbx6の間には強い負の相関が観察され、Tbx6を実際に分解するのはRipply2であることが強く示唆された。















