Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
新型コロナウイルスの全ゲノム解析実施に関する覚書を静岡県と締結
国立遺伝学研究所は新型コロナウイルス感染症(COVID-19)の拡大に際して、昨年4月以降、静岡県への協力を申し出るとともに調査協力に関する契約も締結してきました。今回、新型コロナウイルス変異株の感染拡大に伴い、新型コロナウイルスの全ゲノム解析による分子疫学調査(SARS-CoV-2 RNA全ゲノム解析)を静岡県と連携・協働して進めることについて、静岡県庁にて川勝平太静岡県知事と覚書を取り交わしました。
覚書では、「静岡県が実施する積極的疫学調査(SARS-CoV-2 RNA全ゲノム解析)の支援」、「新型コロナウイルス感染症に罹患した患者の治療及びまん延防止に資すること」、「新型コロナウイルス感染症の克服に資するため検査検体の分子疫学情報を公開すること」、「分子疫学情報の公開にあたっては、個人情報に十分配慮すること」などを定めています。国立遺伝学研究所では、覚書に基づき本格的にSARS-CoV-2 RNAの全ゲノム解析の支援業務を実施します。
2021年4月30日
国立遺伝学研究所
染色体の進化を解析するための新しいモデルを確立
Tempo and mode in karyotype evolution revealed by a probabilistic model incorporating both chromosome number and morphology
Yoshida, K. and Kitano, J.
PLOS Genetics 2021 April 16 DOI:10.1371/journal.pgen.1009502
染色体の数や形すなわち核型は、遺伝物質としてのDNAが発見される以前から、さまざまな生物で観察されてきました。核型の進化は、種分化、組換え率の進化、ゲノムワイドの転写発現制御の進化など多くの進化過程に影響を与える可能性があります。しかし、ここ数十年は、塩基配列を中心とした研究の影で核型進化の研究はあまり注目されてきませんでした。その理由の一つは、塩基配列に関する分子進化モデルが遺伝研の先人たちを中心に確立されてきた一方、核型進化を解析するための適切なモデルがなかったことに起因します。
この度、生態遺伝学研究室の吉田恒太研究員(現・マックスプランク研究所)と北野潤教授は、核型進化を解析するための新しいモデルの構築に挑みました。まず彼らが着目したのは、遺伝研の元助教授の今井弘民らが提唱したkaryographです。karyographとは、ハプロイド(半数体)の核型の染色体の腕数をX軸に、染色体の数をY軸にプロットしたグラフであり(図1)、染色体の進化を、このグラフ上での左右・上下の移行として捉える考えです(図2)。
吉田研究員らは、移行の速度に関わるパラメーターを設定し、生物の系統樹の上でどのような核型の進化が起こったのかを調べることができる核型の確率的な進化モデルを構築しました。それを使い、魚類やアブラナ科植物において、祖先の核型の推定や現存する生物の核型の分布をより確かに説明することができる進化のパラメータの推定に成功しました。さらに、核型によって種分化や絶滅率が異なりうるモデルを構築し解析したところ、真鰭類 (Eurypterygii) では腕数が24で染色体数が24の核型で絶滅率が有意に低いこと、骨鰾上目の骨鰾系 (Otophysi)の魚類では腕数が47で染色体数が25、あるいは、腕数が54で染色体数が27の核型で絶滅率が有意に低いことなどを見出しました。
以上の結果は、生物によって最適な核型が存在し、核型が生物の絶滅率に寄与する可能性を提示する成果です。
本研究は、科研費基盤AとJST CRESTの支援を得て行われました。
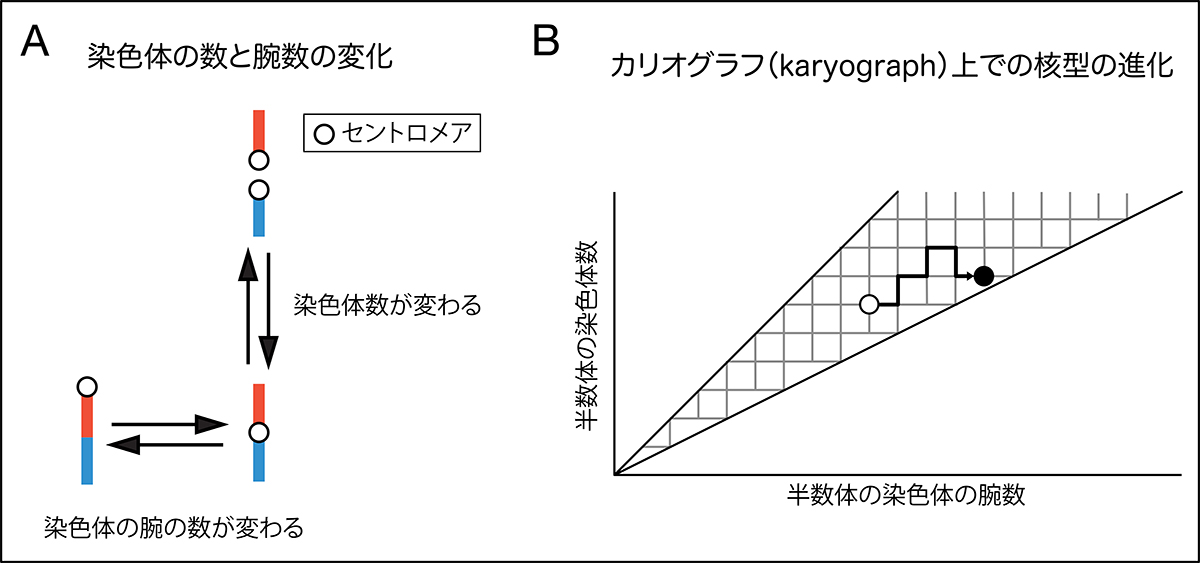
図:A.染色体の数や腕数が変化する様子の模式図。
B.国立遺伝学研究所の今井らが提唱したカリオグラフ上での核型の進化。例として、白丸から黒丸への進化の過程を図示。
60年来の疑問、DNA複製タイミングの意味がついに理解できた!
Replication timing maintains the global epigenetic state in human cells
Kyle N Klein, Peiyao A Zhao, Xiaowen Lyu, Takayo Sasaki, Daniel A Bartlett, Amar M Singh, Ipek Tasan, Meng Zhang, Lotte P Watts, Shin-Ichiro Hiraga, Toyoaki Natsume, Xuemeng Zhou, Timour Baslan, Danny Leung, Masato T Kanemaki, Anne D Donaldson, Huimin Zhao, Stephen Dalton, Victor G Corces, David M Gilbert
Science 372, 371-378 (2021) DOI:10.1126/science.aba5545
細胞のゲノムDNAが複製される時には、複製される場所と時間に順番があることが知られており、これをDNA複製タイミングと呼びます。DNA複製タイミングは出芽酵母からヒト細胞まで知られている現象ですが、その生物学的な意味は長年不明なままでした。近年の研究から、RIF1は複製タイミング制御に重要な役割を担っており、これを失った細胞では複製タイミングがおかしくなることが知られています。本研究では、RIF1を失った細胞では、DNA複製に伴いエピジェネティック修飾を持つヒストンの娘染色体への分配が異常になり、エピゲノムの維持や染色体構造に変化をきたすことが明らかになりました。すなわち、DNA複製タイミングは、エピゲノムの維持や変化に重要な役割を担っていることが明らかになりました。
本研究において、鐘巻研究室はオーキシンデグロン法でRIF1を分解制御できる細胞株の樹立に協力しました。
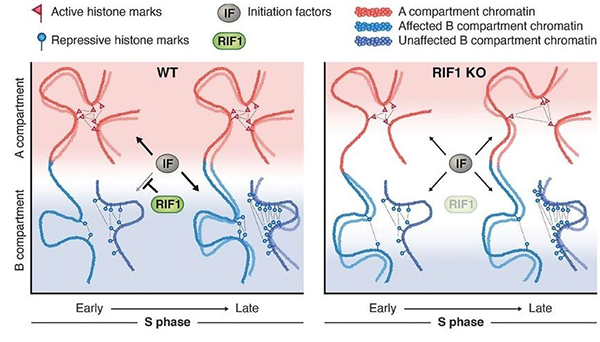
図:DNA複製タイミングがエピゲノム維持に果たす役割のモデル図
- EurekAlert!記事はこちら
静岡県の協力要請に基づく新型コロナウイルスの全ゲノム解析の開始
新型コロナウイルス(SARS-CoV-2)の変異株の感染が大都市を中心に広がっています。国立遺伝学研究所は新型コロナウイルス感染症(COVID-19)の拡大に際して、昨年4月に静岡県への協力を申し出るとともに、7月には調査協力に関する契約を締結しました。
この度、さらなる静岡県の協力要請に基づき、今月中にも県内新型コロナ感染者検体のゲノム情報(全遺伝子情報)解析を実施することになりました。県から提供される検体サンプル(核酸物質)は感染性がなく安全なものです。国立遺伝学研究所では迅速に、検体のゲノム情報を解析し変異型の有無を判定し、県に報告いたします。
これらサンプルのゲノム解読によって、県内で感染しているSARS-CoV-2の変異を高精度で明らかにすることが可能となり、ゲノム配列情報を利用した県のCOVID-19対策に貢献できます。
本調査研究で解読したSARS-CoV-2ゲノム配列は、国際塩基配列データベース(INSD)、及びGISAIDを通して公開します。国立遺伝学研究所はオープンサイエンスの枠組みのもと、国が実施する他の感染症対策事業等にも積極的に協力していきます。
2021年4月26日
国立遺伝学研究所 所長 花岡 文雄
2021年5月20日追記
シクリッドゲノム中に適応進化の痕跡を発見
-祖先から受け継いだゲノム多様性が急速な進化の鍵-
Press release

Genomic Signatures for Species-Specific Adaptation in Lake Victoria Cichlids Derived from Large-Scale Standing Genetic Variation
Haruna Nakamura, Mitsuto Aibara, Rei Kajitani, Hillary D. J. Mrosso, Semvua I. Mzighani, Atsushi Toyoda, Takehiko Itoh, Norihiro Okada, Masato Nikaido
Molecular Biology and Evolution 2021 March 21 DOI:10.1093/molbev/msab084
東京工業大学 生命理工学院 生命理工学系の二階堂雅人准教授、中村遥奈大学院生、相原光人研究員、伊藤武彦教授、梶谷嶺助教、岡田典弘名誉教授およびタンザニア水産研究所、国立遺伝学研究所、北里大学の共同研究チームは、進化研究のモデル生物と称されるシクリッドの全ゲノム配列の解析を通じて、急速な適応進化には祖先から受け継いだゲノムの多様性(祖先多型)が重要な役割を果たしたことを明らかにしました。
本研究では短期間に適応進化を遂げたビクトリア湖産シクリッドの中から、特に3種に着目してその全ゲノム配列を決定し(各種6個体/計18個体)、それらを網羅的に集団遺伝解析することで、シクリッドの適応進化に関わったと考えられる遺伝子を数多く単離することに成功しました。そして、さらなる詳細な系統解析により、これら適応遺伝子には古い祖先種から受け継がれてきたゲノムの多様性が、大規模な「祖先多型」として存在することが明らかになったのです。
一般に生物のゲノム中において、祖先多型は時間と共に失われてしまうと考えられており、シクリッドが進化の過程で失わずに受け継いできた、この例外的に大規模な祖先多型こそが、適応放散を可能にしたゲノム基盤であることを示唆しています。
この研究成果は3月22日(日本時間)に米国の学術誌『Molecular Biology and Evolution』電子版にて公開されました。
遺伝研の貢献
illumina社のHiSeq2500システムを用いて、シクリッド3種
18個体のゲノム情報を整備しました。本解析は、2014年度ゲノム支援の支援課題としておこなわれたものです。
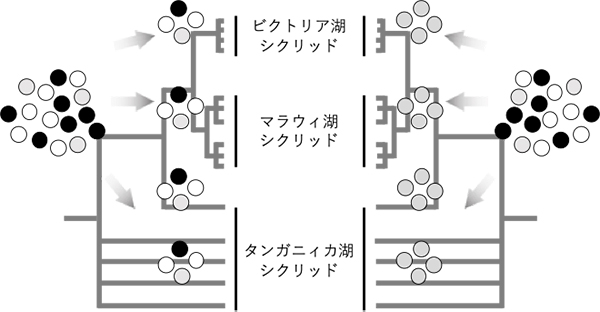
図: 東アフリカ産シクリッドの系統樹と祖先多型の分配(モデル)
今回の研究で、ビクトリア湖のシクリッド種間で分化した複数のアリルが、マラウィ湖やタンガニィカ湖のシクリッドにも共有されていたことから、その多様性は東アフリカ産シクリッドの共通祖先までさかのぼることが示唆された(左)。一般的には、複数存在するアリルは時間の経過と共にどれか1つに固定すると予想されるが(右)、シクリッドではそれらのアリル多様性が何らかの機構で祖先多型として維持されたと考えられる。この多様なアリルに自然選択が働くことで、急速な適応が可能になったと予想される。色のついた丸印は集団中に存在する異なるアリルを示す。
転写における相分離の役割に対する前島一博教授(ゲノムダイナミクス研究室)のコメントがMolecular Cell誌に掲載されました。
 遺伝メカニズム研究系・ゲノムダイナミクス研究室 前島一博教授の転写における相分離の役割に対するコメント “New door to understanding transcription, open with caution.” がMolecular Cell誌(Cell Press)4月15日号 に掲載されました。
遺伝メカニズム研究系・ゲノムダイナミクス研究室 前島一博教授の転写における相分離の役割に対するコメント “New door to understanding transcription, open with caution.” がMolecular Cell誌(Cell Press)4月15日号 に掲載されました。
![]() https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00267-7
https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00267-7
近年、細胞生物学において、「液―液相分離(liquid-liquid phase separation)」と呼ばれる原理が脚光を浴びています。液―液相分離によって細胞内の特定分子の濃度を高め、膜の無い構造体「液滴」を作ることができ、細胞の機能を時間的・空間的に制御することが可能になると考えられています。この概念に同調して多くの研究者が様々な分子の細胞内集合を液滴と主張しています。
今回、前島教授は、液―液相分離による液滴形成が細胞生物学においてとてもエキサイティングな概念である一方、「液滴」の存在を細胞内で証明するためのツールが不足しており、「個々の分子の振る舞いの観察に立脚した慎重な研究」が必要であると論じています。
クロマチンリモデリングによるゲノム安定化の仕組み
角谷研究室・エピゲノム研究室
The chromatin remodeler DDM1 prevents transposon mobility through deposition of histone variant H2A.W
Akihisa Osakabe, Bhagyshree Jamge, Elin Axelsson, Sean A. Montgomery, Svetlana Akimcheva, Annika Luisa Kuehn, Rahul Pisupati, Zdravko J. Lorković, Ramesh Yelagandula, Tetsuji Kakutani, and Frédéric Berger
Nature Cell Biology 23, 391-400 (2021) DOI:10.1038/s41556-021-00658-1
動物や植物のゲノムは、可動性で増殖する性質の配列(トランスポゾンと呼ばれる)を多量に含み、これがゲノムの不安定化や癌などの疾病の原因になります。このように潜在的に有害なトランスポゾンを鎮静化する機構として、DNAやヒストンのメチル化による抑制が知られています。これらの抑制目印を維持するために、クロマチンリモデリング因子Decrease in DNA methylation 1 (DDM1)が必要であることが、シロイヌナズナを用いた遺伝学的解析によって20年以上前に明らかにされました。DDM1機能を喪失した変異体植物では、さまざまなトランスポゾンの脱抑制や可動化、および隣接遺伝子の発現撹乱が観察されます。一般にクロマチンリモデリング因子は、ATP依存的に、ヌクレオソームの交換や移動などを行います。しかしながら、DDM1がどのようにしてトランスポゾンを鎮静化しているのか、その分子機構はながらく不明でした。また、このクロマチンリモデリングの直接の標的も不明でした。
本研究では、トランスポゾン上に特異的に蓄積することが知られているヒストンの亜種(バリアント)に着目し、DDM1の機能喪失植物を用いてゲノムワイドの解析を行いました。その結果、DDM1の機能喪失によって、凝集したクロマチンに分布するヒストンバリアントH2A.Wがトランスポゾンから失われることを見出しました。さらに、DDM1がこのH2A.Wと直接結合すること、その結合領域がDDM1によるトランスポゾンの鎮静化に重要であることがわかりました。DDM1やこのH2Aバリアントと似た構造のタンパク質が哺乳類でも似た働きを持つことがわかっており、本研究によって明らかになった新規経路は動植物に共通していることが示唆されます。
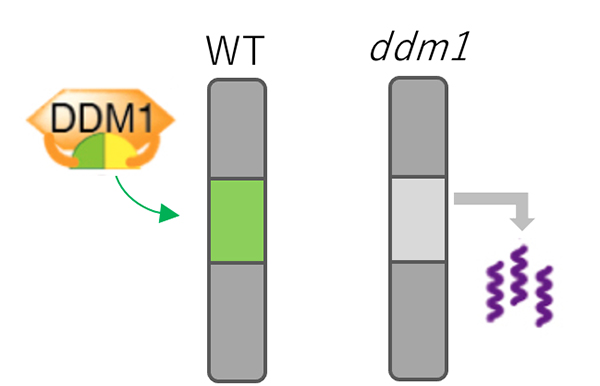
図:DDM1によるトランスポゾンの抑制機構
野生型植物(左)においてDDM1タンパク質はトランスポゾンを含むゲノム領域へH2A.W(緑)を運び込み、トランスポゾンの発現が抑制されている。一方、ddm1変異体(右)ではH2A.Wがヘテロクロマチン領域から失われ、トランスポゾンが脱抑制される。
2021年度第2回「先進ゲノム支援」支援課題の公募について(公募締切5月27日)
日本人類学会の機関誌Anthropological Scienceの「ヤポネシアゲノム特集号」に掲載された6論文のご紹介
Press release
■ 概要
日本列島人(ヤポネシア人)の起源と形成を文理融合で研究する、文部科学省新学術領域研究「ヤポネシアゲノム」の特集号が、日本人類学会の機関誌であるAnthropological Scienceに刊行され、そこに6編の論文が掲載されました。今回はそれらをまとめてご報告します。これらの研究は、青山学院大学、国立遺伝学研究所、国立科学博物館、国立国際医療研究センター研究所、佐賀市教育委員会、東京大学、新潟医療福祉大学、北海道大学、山梨大学の研究グループ(所属機関名五十音順)の成果です。
■ 成果掲載誌
以下の6論文(原著論文が4編、総説論文が2編)が、Anthropological Scienceに2021年3月31日にオンライン(オープンアクセス)で公開されました。原著論文1:
Modern human DNA analyses with special reference to the inner-dual structure model of Yaponesian
(ヤポネシア人の内なる二重構造モデルにもとづく現代人のDNA解析)
Timothy A. Jinam, Yosuke Kawai, and Naruya Saitou (ティモシー・A・ジナム、河合洋介、斎藤成也)
原著論文2:
Ancient genomes from the initial Jomon period: new insights into the genetic history of the Japanese archipelago
(縄文早期からの古代ゲノム:日本列島の遺伝史への新しい見解)
Noboru Adachi, Hideaki Kanzawa-Kiriyama, Takashi Nara, Tsuneo Kakuda, Iwao Nishida, and Ken-ichi Shinoda (安達 登、神澤秀明、奈良貴史、角田恒雄、西田 巌、篠田謙一)
原著論文3:
The time-dependent evolutionary rate of mitochondrial DNA in small mammals inferred from biogeographic calibration points with reference to the late Quaternary environmental changes in the Japanese archipelago
(日本列島における第四紀後期の環境変化に考慮した生物地理学的補正から推定された小型哺乳類のミトコンドリア DNA(3)の時間依存性進化速度)
Hitoshi Suzuki (鈴木 仁)
原著論文4:
Geographical distribution of certain toponyms in the Samguk Sagi
(三国史記のいくつかの地名の地理的分布)
Mitsuaki Endo (遠藤光暁)
総説論文1:
Exploring models of human migration to the Japanese archipelago using genome-wide genetic data
(ゲノム規模の遺伝子データを用いて日本列島への人類の移動モデルを探索する)
Naoki Osada and Yosuke Kawai (長田直樹、河合洋介)
総説論文2:
Paleogenomics of human remains in East Asia and Yaponesia focusing on current advances and future directions
(現在の進展と将来の方向に焦点をあてた東アジアとヤポネシアのヒト遺物の古代ゲノム学)
Kae Koganebuchi and Hiroki Oota (小金渕佳江、太田博樹)
■ 研究の詳細
● 研究成果
原著論文1:
3種類のデータセット(1642人の日本人のミトコンドリアDNAゲノム配列データ、ジェネシスヘルスケア社から提供をうけた47都道府県総計6万人のミトコンドリアDNAハプロタイプ頻度データ、およびヤポネシアとその周辺6集団(アイヌ人、オキナワ人、ヤマト人、韓国人、北方中国人、南方中国人)の19万カ所のゲノム規模SNPデータ)を解析した結果、どの結果も「うちなる二重構造」モデルを支持していました。
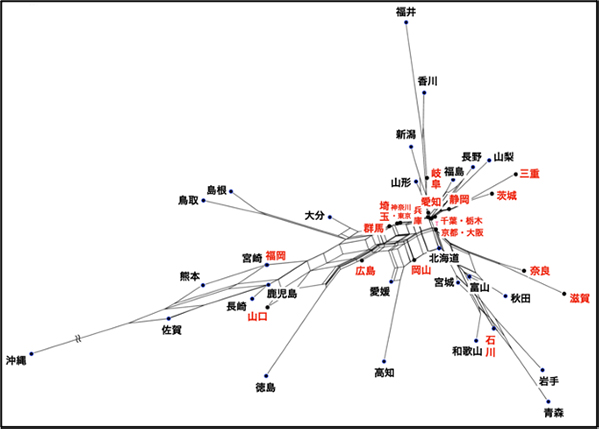
原著論文1の図: ミトコンドリアDNAデータからみた47都道府県の位置関係
原著論文2:
これまで確実に縄文時代のものと言える古代人ゲノムは、三貫地貝塚(福島県)と船泊遺跡(北海道)という東日本からの報告だけでしたが、本論文では、はじめて九州の縄文時代早期(8000年前)の東名遺跡出土の縄文人ゲノムを報告しました。その結果、東名の縄文人も現代日本人とは大きく異なり、東日本の縄文人や、弥生時代になっても縄文文化を継承していた人々のゲノムに類似することが分かりました。このことは、縄文時代を通じて、全国に遺伝的にはひとつのグループとしてまとめることができる集団(縄文人)が住んでいたことを示しています。
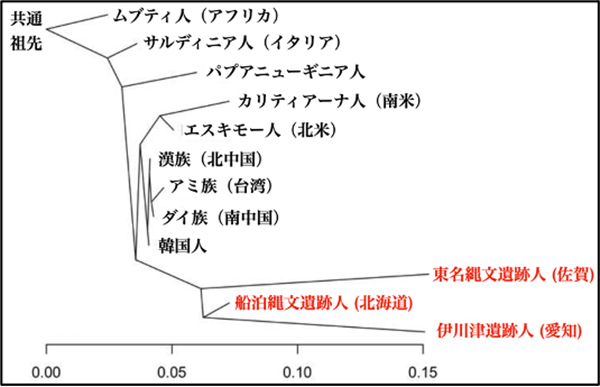
原著論文2の図: 東名・船泊・伊川津の3縄文系がまとまっている様子
原著論文3:
分子進化速度の推定は、ヤポネシアに渡来した系統の正しい分岐年代を得るために重要です。ハツカネズミを代表とする小型哺乳類のミトコンドリアDNA配列データと環境変動の情報から、過去1万年における進化速度がそれ以前よりもずっと高かったという以前の推定を確認しました。
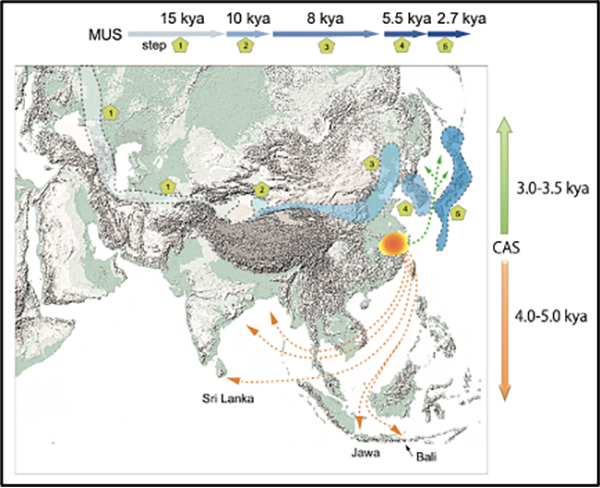
原著論文3の図: ミトコンドリアDNA からみたハツカネズミ2亜種系統の移動経路と移動年代
原著論文4:
三国史記(紀元前1世紀から紀元後7世紀に朝鮮半島に鼎立した高句麗・新羅・百済の歴史書)に登場する地名のなかから、日本語で理解できる4種類(川、谷、山、城)の地理的分布を調べ、漢語・ツングース語・韓国語などの成分も区別し、各語ごとに異なるパターンが示されました。
総説論文1:
東アジアにおける現代・古代のヒトゲノムデータを概観するとともに、これらの再解析をおこないました。その結果、縄文時代人のゲノムが弱いながら古代北シベリア集団のゲノムからの影響を受けていたことを発見しました。
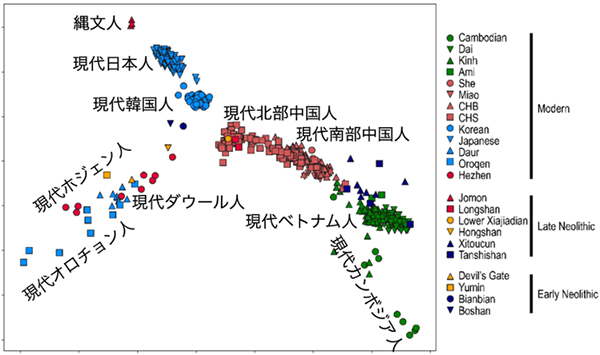
総説論文1の図: 現代人と古代人のゲノムを主成分分析で比較した結果
総説論文2:
ハイスループット配列解析技術が古代DNAの配列解析に適用されてから、古代DNA解析は古ゲノム学となりました。東ユーラシアにおける研究は、地理的・環境的条件から、西ユーラシアに比べて遅れをとっていました。しかし近年では、古代DNAを濃縮することができるキャプチャシーケンス技術が用いられ、古ゲノム学がさらに発展してきています。そこでこの総説では、古ゲノム学につながる古代DNA解析の歴史を紹介し、3つの配列解析の段階(部分的、ドラフト、完全ゲノム)とキャプチャシーケンス法の概要を説明し、東ユーラシアの古ゲノム学には高品質な配列解析が必要であることを論じました。

総説論文2の図: 三段階で示した古代DNAの量
● 今後の展望
新学術領域研究「ヤポネシアゲノム」は2018年度にはじまりました。5年計画ですので、2022年度末(2023年3月)まで、あと2年間あります。この3年間に多くの結果を生み出しましたが、残りの2年間のあいだに、6計画研究と20以上の公募研究が、さらに多くの結果を発表してゆきます。ご期待下さい。
■ 研究体制(所属機関名五十音順)
遠藤光暁: 青山学院大学 経済学部 教授
斎藤成也: 国立遺伝学研究所 集団遺伝研究室 教授
ティモシー・ジナム: 国立遺伝学研究所 集団遺伝研究室 助教
篠田謙一: 国立科学博物館 人類研究部 部長(2021年3月31日まで)、同博物館 館長(2021年4月1日より)
神澤秀明: 国立科学博物館 人類研究部 研究員
河合洋介: 国立国際医療研究センター研究所 ゲノム医科学プロジェクト 副プロジェクト長
西田 巌: 佐賀市教育委員会 文化振興課 主査
太田博樹: 東京大学 大学院理学系研究科 生物科学専攻 ゲノム人類学研究室 教授
小金渕佳江: 東京大学 大学院理学系研究科 生物科学専攻 ゲノム人類学研究室 助教
奈良貴史: 新潟医療福祉大学 リハビリテーション学部理学療法学科 教授
鈴木 仁: 北海道大学 大学院地球環境科学研究院 教授
長田直樹: 北海道大学 大学院情報科学研究院 准教授
安達 登: 山梨大学 大学院総合研究部医学域 法医学講座 教授
角田恒雄: 山梨大学 大学院総合研究部医学域 法医学講座 助教
本研究は、文部科学省科学研究費補助金 新学術領域研究(複合領域)「ヤポネシアゲノム」の支援を受けて行われました。
骨代謝を制御する因子を発見
Chemokine ligand 28 (CCL28) negatively regulates trabecular bone mass by suppressing osteoblast and osteoclast activities
Rina Iwamoto, Takumi Takahashi, Kazuto Yoshimi, Yuji Imai, Tsuyoshi Koide, Miroku Hara, Tadashi Ninomiya, Hiroaki Nakamura, Kazutoshi Sayama, Akira Yukita
Journal of Bone and Mineral Metabolism 2021 March 15 DOI:10.1007/s00774-021-01210-9
健康な成人期の骨量は、骨の形成と吸収を調節する因子 (骨代謝調節因子)によって緻密にコントロールされており、このバランスが乱れることによって骨粗鬆症が引き起こされてしまいます。近年では骨代謝調節因子としてケモカインが注目されているものの、未だ多くのケモカインと骨との関連は調べられていません。
CCケモカインリガンド28 (CCL28)は腸管免疫などに寄与するケモカインですが、CCL28の受容体であるCCR3が骨代謝を制御することから、骨代謝におけるCCL28の役割を解明することを目的とし、実験を行いました。
Ccl28 欠損マウスの骨組織を解析したところ、Ccl28欠損により骨量が増加し、骨形成を担う骨芽細胞と骨吸収を担う破骨細胞が活性化していることが明らかになりました。これらの結果はCcl28を欠損マウスが骨形成優位の高回転型骨代謝状態にあることを示しています。加えて、培養細胞実験において、リコンビナントCCL28処理により骨芽細胞及び破骨細胞の活性化が直接抑制され、Ccl28欠損マウスを用いた実験結果と矛盾しない結果となりました。
CCL28が骨芽細胞及び破骨細胞の活性化を抑制する骨代謝調節因子であることがはじめて明らかになり、CCL28は生体内で骨代謝回転の制御に寄与する因子であると考えられます。
本研究は、静岡大学教育学部の雪田聡准教授、大学院生の岩本莉奈さんらとの共同研究で、遺伝研側はゲノム編集でCcl28遺伝子欠損マウスの作製を行いました。
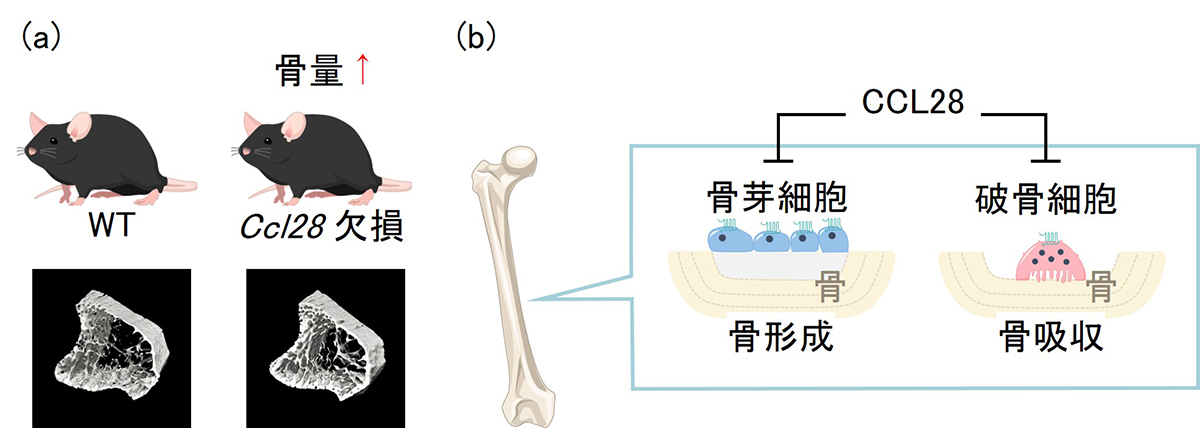
図:(a)μCTによって骨構造を解析した結果、Ccl28欠損によって海綿骨量が増加していることが明らかになりました。 (b)生体内及び培養細胞実験により、CCL28は骨組織において骨芽細胞及び破骨細胞の活性化を抑制することで、骨量を負に制御していることが見いだされました。
テロメアの近くで起こる組換えとシナプシスの関係
Sycp1 Is Not Required for Subtelomeric DNA Double-Strand Breaks but Is Required for Homologous Alignment in Zebrafish Spermatocytes
Yukiko Imai, Kenji Saito, Kazumasa Takemoto, Fabien Velilla, Toshihiro Kawasaki, Kei-ichiro Ishiguro and Noriyoshi Sakai
Front Cell Dev Biol 9, 664377 (2021) DOI:10.3389/fcell.2021.664377
“性”を持つ生き物は、減数分裂によって精子や卵などを作り、次世代を生み出します。減数分裂では、父親と母親それぞれに由来する相同染色体が“組換え”によって切り貼りされ、遺伝情報の混ぜ合わせが起こります。ヒトやゼブラフィッシュのオスでは、組換えが染色体末端(テロメア)近傍で起こりやすいことが知られていますが、このような極性を持った組換えが起こる仕組みはわかっていません。
本研究では、相同染色体間の物理的な接着(シナプシス)がテロメア近傍での組換えに果たす役割を、ゼブラフィッシュを用いて解析しました。その結果、シナプシスが起こらないゼブラフィッシュでも、テロメア近くで組換えが始まり、これらの領域では相同染色体が近づく“ペアリング”が見られました。しかしながら、ペアリングの多くはその後失われてしまい、精子も作られませんでした。つまり、シナプシスはテロメア近くで組換えの開始には重要ではありませんが、正常に終わらせるために必要であることがわかりました。
テロメア近傍での組換えはヒトの男性にも見られる特徴ですが、ヒトをモデルとした減数分裂の研究は難しいのが現状です。類似した特徴を持つゼブラフィッシュを解析することで、不妊や遺伝的疾患の理解にもつながる減数分裂のメカニズムが明らかになると期待されます。
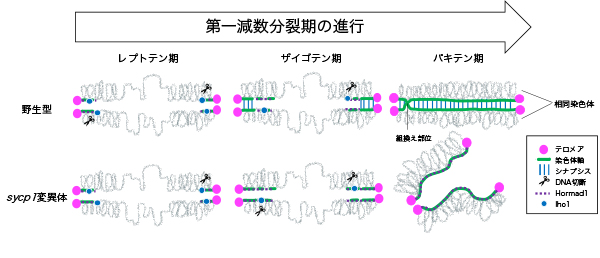
図:野生型ゼブラフィッシュのオスでは、テロメア近傍のDNA切断により組換えが始まる。ザイゴテン期には、シナプシスがテロメア近傍から始まり、パキテン期には相同染色体が完全にペアリングする。sycp1変異体では、テロメア近傍でDNA切断と局所的なペアリングが起こるが、完全なペアリングは起こらない。
新型コロナウイルス(SARS-CoV-2)のゲノム配列に関する調査研究協力について
新型コロナウイルス感染症(COVID-19)は第四波が懸念されており、全国的に厳しい状況が続いています。国立遺伝学研究所は、最先端のゲノム配列読取り技術と情報解析技術を有する研究所として、我が国の生命科学を支えております。COVID-19の拡大に際して、昨年4月に静岡県への協力を申し出るとともに、7月には調査協力に関する契約を締結、さらに8月からはゲノム解読によるSARS-CoV-2変異株の検出を東京都内の病院等と連携して実施してきました。今後も、自治体や公的研究機関からの要請に対して「調査研究」という立場から、ゲノム解読を実施しCOVID-19対策に貢献します。
本調査研究で解読したSARS-CoV-2ゲノム配列は国際塩基配列データベース(INSD)、及びGISAIDを通して公開します。オープンサイエンスの枠組みのもと、国が実施する他の感染症対策事業等にも積極的に協力していきます。
2021年4月7日
国立遺伝学研究所 所長 花岡 文雄
ゼブラフィッシュ光遺伝学でALSの謎を照らす
Illuminating ALS Motor Neurons With Optogenetics in Zebrafish
Kazuhide Asakawa, Hiroshi Handa, Koichi Kawakami
Frontiers in Cell Developmental Biology 9, 640414 (2021) DOI:10.3389/fcell.2021.640414
意識や五感が保たれたまま身体が動かなくなる難病、筋萎縮性側索硬化症(きんいしゅくせいそくさくこうかしょう、または、ALS)は、筋肉の収縮をコントロールする神経細胞「運動ニューロン」が、際立って機能を失うことが原因で発症します。ALSにおいて運動ニューロンが機能を失う根本的な原因は解明されておらず、現在、効果的な治療法が存在しません。運動ニューロンは、背骨の中を通っている脊髄の中に遺伝情報を維持し、そこから軸索(じくさく)とよばれる細長いケーブルを伸ばして筋肉と連結する大きく複雑な形をもった細胞です。このような運動ニューロンの性質から、ALSの発症に関連すると予想されるタンパク質のダイナミックな性質を生体内の運動ニューロンで研究することが困難であり、病態の解明の大きな障壁になっています。
この総説では、身体の組織が透明に近いので運動ニューロンの細胞全体をリアルタイムで詳しく観察できるという利点を備えたゼブラフィッシュの運動ニューロンと筋肉との接続様式について解説します。次に、このようなゼブラフィッシュの特性を活かして我々が近年開発した、生体内の運動ニューロンでALSに関連するタンパク質を光を使って会合させ、多量体化、相転移、凝集をコントロールする新しい技術について紹介します。この光遺伝学ALSモデルによって明らかにされたALSの謎や、治療戦略の可能性について議論します。
この総説は、国立遺伝学研究所発生遺伝学研究室(浅川和秀 客員研究員、川上浩一 教授)と東京医科大学ケミカルバイオロジー講座(浅川和秀 准教授、半田宏 特任教授)の共同研究として、せりか基金、文部科学省科研費 (JP19K06933 and JP20H05345)の支援を受けて行われました。
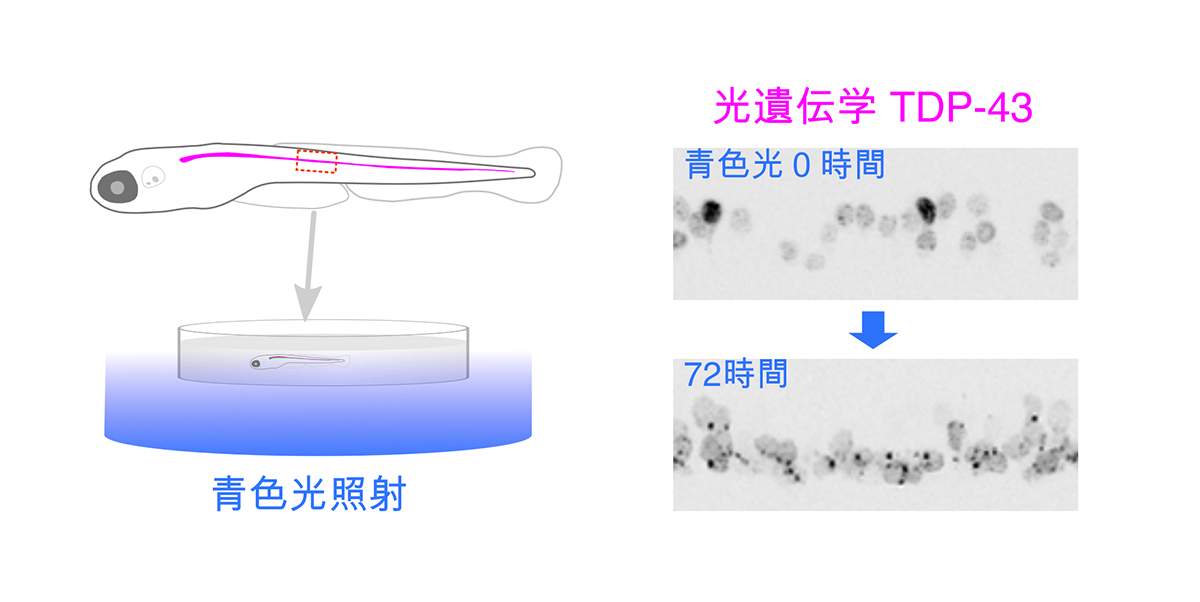
図:ゼブラフィッシュ運動ニューロンにおいて、ALS関連タンパク質TDP-43の相転移を誘導。光遺伝学型TDP-43は、青色光の照射によって凝集体を形成する。
細胞核内のクロマチンの物理的性質
Physical nature of chromatin in the nucleus
Kazuhiro Maeshima, Shiori Iida, and Sachiko Tamura
Cold Spring Harbor Perspectives in Biology The Nucleus (2nd edition) 13, a040675 (2021) DOI:10.1101/cshperpsect.a040675
論文全文はこちら
ゲノム情報は、DNAの長い鎖にコード化され、折りたたまれてクロマチンとして小さな核に保存されています。核クロマチンは、DNA、ヒストン、およびさまざまな非ヒストンタンパク質で構成される負に帯電したポリマーです。クロマチンは非常に帯電しているため、周囲の環境(陽イオン、分子混雑など)によってその構造は大きく異なります。過去10年間に開発された生細胞内のクロマチンを理解するための新しい技術によって、クロマチンorganizationの捉えかたは、規則的で静的なものから、より不規則でダイナミックに動くものへと劇的に変化しました。また、このクロマチンの動きは陽イオン、クロマチン結合タンパク質、転写装置など、細胞内の様々な因子で規定されており、この動的な性質が、ゲノムDNAの様々な機能に重要であることがわかってきました。本論考ではゲノミクスと高度なイメージング研究からの新しい証拠に基づいて、混雑した核環境におけるクロマチンの物理的性質とそれがどのように調節されているかについて論じました。Cold Spring Harbor Perspectives in BiologyでFeatured Articleとしてオンライン出版され、モノグラフ「The Nucleus」第二版の第9章としても出版されます。カバーイラストにもなっています。国立遺伝学研究所・ゲノムダイナミクス研究室の前島一博 教授、飯田史織 総研大生、田村佐知子 テクニカルスタッフの共同成果です。
文部科学省科研費 学術変革領域A「ゲノムモダリティ」(20H05936)、科学技術振興機構 (JST) 戦略的創造研究推進事業 (CREST) (JPMJCR15G2)、武田科学振興財団、上原記念生命科学財団の支援を受けました。
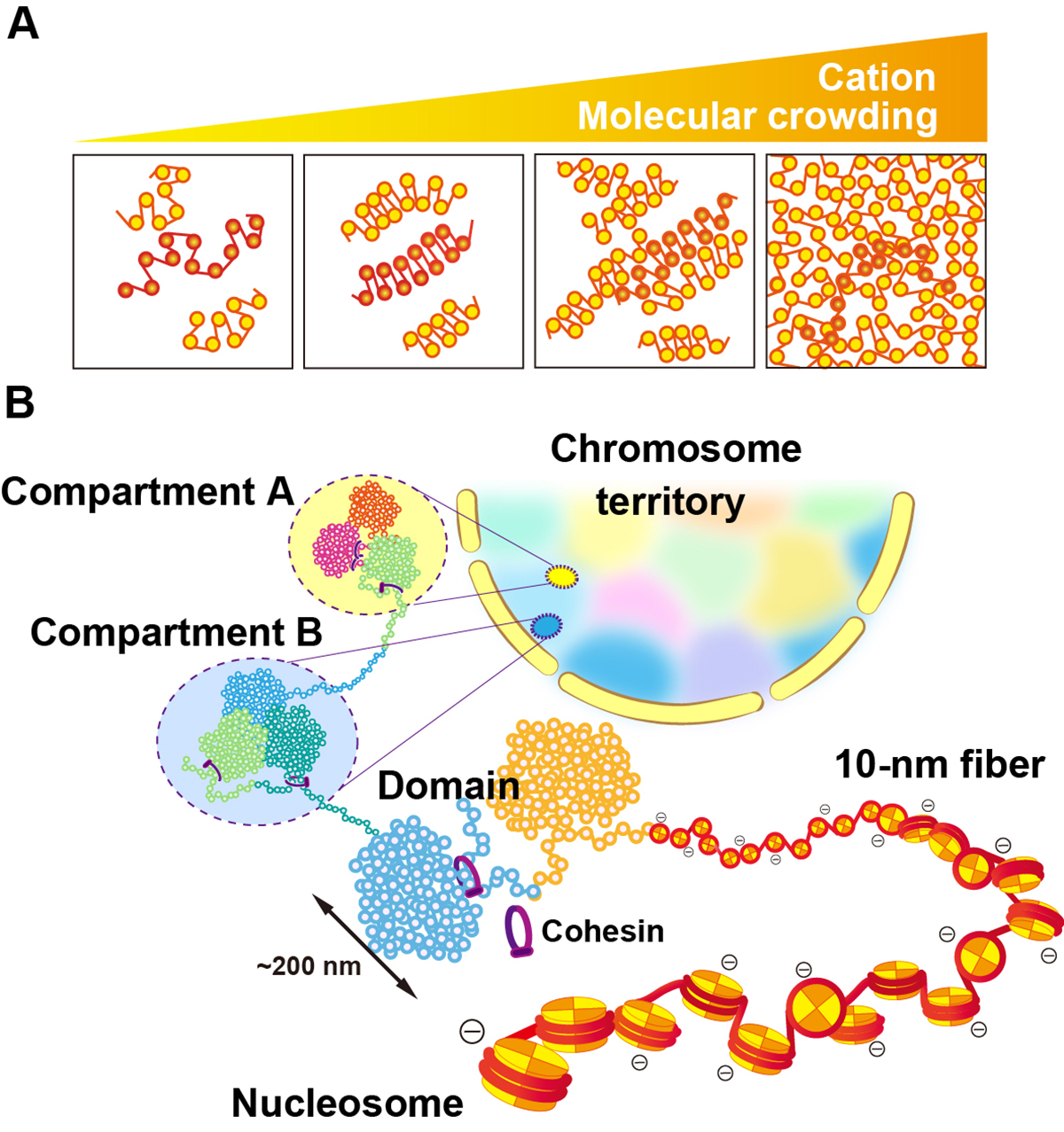
図:(A)クロマチンは陽イオン濃度や周囲の分子の混雑具合によって大きく構造を変化させる。生理的条件下では、クロマチン線維は溶けたような構造になる(メルト構造)。細胞内のクロマチンはこの溶けた構造をとると考えられる。(B) 細胞内のクロマチンの単純化した模式図。ヌクレオソーム、10-nm線維、クロマチンドメイン、コンパートメント、染色体と階層構造を形成するが、局所的に大きく揺らぎダイナミックに変化しうる。
【復旧】セミナー・ミーティングが表示されない不具合
2021年4月5日、国立遺伝学研究所ウェブサイトのセミナー・ミーティングが表示されない不具合が発生しておりましたが、4月6日13:00現在復旧しております。
どうぞご利用下さい。
DSCR4 (ダウン症重要領域4) 遺伝子のもつ役割の可能性
Possible roles for the hominoid-specific DSCR4 gene in human cells
Morteza M. Saber, Marziyeh Karimiavargani, Takanori Uzawa, Nilmini Hettiarachchi, Michiaki Hamada, Yoshihiro Ito and Naruya Saitou
Genes and Genetic Systems 2021 March 24 DOI:10.1266/ggs.20-00012
人間のダウン症は、21番染色体のトリソミーによって生じます。DSCR4 (ダウン症重要領域4)は、ヒトの21番染色体と類人猿の相同染色体だけに存在する、あらたに誕生したタンパク質コード遺伝子です。医学的に重要なゲノム領域に位置しており、その機能を示唆する多くの証拠があるにもかかわらず、人間の細胞におけるDSCR4遺伝子の役割は不明です。われわれはこの遺伝子の生物学的重要性と細胞内での役割を推定するためにバイオインフォマティクス解析を用いました。その結果、DSCR4遺伝子は、細胞移動、凝固、免疫系に関係する相互に結びついた生物学的パスウェイの制御におそらく関与していることがわかりました。またこれらの予想された生物学的機能は、ヒト胚における顔面形態をかたちづくる神経堤細胞 (NCC)と移動性の免疫系白血球でのDSCR4の組織特異的な発現と一致していることも示しました。免疫系とNCCはどちらもDSCR4の発現異常を生じるダウン症個体が影響を受けることが知られており、このことはさらにわれわれの発見を支持します。人間の細胞におけるDSCR4の重要な役割について、証拠を指摘したことにより、われわれの発見はダウン症の病因におけるDSCR4遺伝子の役割を確認するのに必要となる、さらなる実験研究の基礎付けとなりました。
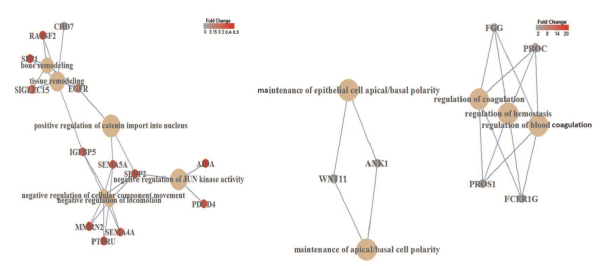
図:DSCR4遺伝子の過剰発現によって発現に差の生じた遺伝子の制御ネットワーク解析
左:DSCR4の過剰発現によって発現が抑制された遺伝子群は、細胞の移動、運動、改造過程の制御に関与する6種類の相互に結びついたパスウェイの増強を明らかにしました。右:発現が増加した遺伝子群は、頂端と基層部の細胞極性の維持における血液凝固と止血の制御に関与した3種類の相互に結びついたパスウェイを増強することを示しています。
4月1日付け新任教員の着任と研究室開設
2021年4月1日付けで教授が着任しました.

- 工樂 樹洋 教授
2021年4月1日付けで森 宙史助教が先端ゲノミクス推進センターの准教授として研究室を開設しました.
森 宙史:先端ゲノミクス推進センター / 森研究室・ゲノム多様性研究室

- 森 宙史 准教授
2021年4月1日付けで助教が着任しました.
















