Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
キンギョの様々な形態はどうやって生み出されたのか?
The Genetic Basis of Morphological Diversity in Domesticated Goldfish
Tetsuo Kon, Yoshihiro Omori, Kentaro Fukuta, Hironori Wada, Masakatsu Watanabe, Zelin Chen, Miki Iwasaki, Tappei Mishina, Shin-ichiro S. Matsuzaki, Daiki Yoshihara, Jumpei Arakawa, Koichi Kawakami, Atsushi Toyoda, Shawn M. Burgess, Hideki Noguchi, Takahisa Furukawa.
Current Biology 30, 1-15 (2020). DOI:10.1016/j.cub.2020.04.034
1. 背景
キンギョは1000年以上にわたって愛玩動物として飼育され、色、頭部の形、体の形、ヒレの形、目の形などが異なるさまざまな品種が生み出されてきた。現在、180以上の変異種、70以上の遺伝学的に樹立された系統が存在する。私たちは2019年にキンギョ(ワキン)の全ゲノム塩基配列を発表した。キンギョの祖先は4回の全ゲノム重複(WGD)を経て、最終段階で2n=50から生じた2n=100の異質4倍体ゲノムをもつ。異質4倍体ゲノムの生物では、サブゲノムが非対称的に進化し、それが多様な表現型を生み出すことが予想される。
2. 結果
キンギョゲノム上の転移因子(TE)を指標に、LとS、2セットのサブゲノムを同定した。次に、27のキンギョ系統の全ゲノム塩基配列の決定を行なった。これにより、キンギョが大きな3つのグループ(江戸、チャイナ、ランチュウ)に分かれることがわかった。さらに、GWASによる変異系統の解析を行った。その結果、「背びれなし」(ランチュウの特徴)ではSサブゲノム上のLrp6(Lrp6S)、「長い尾ひれ」ではSサブゲノム上のkcnk5b(kcnk5bS)、「出目」ではLサブゲノム上のLrp2a(Lrp2aL)、「アルビノ」ではLとS両方のoca2、「ハート型尾ひれ」ではS上のrpzクラスターが変異の原因遺伝子(候補)であることを明らかにした。
3. 今後の期待
WGDで生じたサブゲノム上の変異が、キンギョの多様な形態を生み出していることがわかった。キンギョのLとSのサブゲノムは、コモンカープ(コイ)のBとAのサブゲノムに対応させることができ、構造がよく保存されていた。LRP2はヒトではDonnai-Barrow症候群の原因遺伝子であり、OCA2はヒトでは眼皮膚白皮症の原因遺伝子である。キンギョの変異体は、ヒト疾患研究のモデルにもなる。
本研究は、大阪大学と国立遺伝学研究所・比較ゲノム解析研究室・発生遺伝学研究室・先端ゲノミクス推進センターとの共同研究として行われた。NIG-JOINTに支援された。

図:本研究で用いたキンギョ野生型(1)と変異型(2-28)。ゲノム解析により、変異型はチャイナグループ(2-11)、ランチュウグループ(12-17)、江戸グループ(18-28)に分けられた。
相同なDNA配列間でRad51リコンビナーゼによるDNA鎖を交換するしくみを解明
〜ヒトがん抑制の分子機構研究に弾み〜
Press release
Real-time tracking reveals catalytic roles for the two DNA binding sites of Rad51
Kentaro Ito, Yasuto Murayama, Yumiko Kurokawa, Shuji Kanamaru, Yuichi Kokabu, Takahisa Maki, Tsutomu Mikawa, Bilge Argunhan, Hideo Tsubouchi, Mitsunori Ikeguchi, Masayuki Takahashi & Hiroshi Iwasaki
Nature Communications (2020) 11, 2950 DOI:10.1038/s41467-020-16750-3
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの岩﨑博史教授、伊藤健太郎研究員、同大学 生命理工学院 生命理工学系のTAKAHASHI MASAYUKI特任教授、国立遺伝学研究所の村山泰斗准教授、横浜市立大学の池口満徳教授、理化学研究所の美川務専任研究員らの研究グループは、DNAの相同組換えの中心的な反応であるDNA鎖交換の反応機構を明らかにしました。
相同組換えは、DNA二重鎖切断(用語1)を正確に修復する生理機能であり、遺伝情報の維持や遺伝的多様性の創出にかかわる重要な生命現象です。その中心であるDNA鎖交換反応では、似た配列、すなわち、相同な配列を持つ2組のDNA間で鎖を交換します。この反応はRad51リコンビナーゼ(用語2)によって触媒されることが知られていますが、Rad51リコンビナーゼが相同配列を見つけてDNA鎖を交換するしくみは不明でした。
今回の研究では、DNA鎖交換反応をリアルタイムで観察し、Rad51リコンビナーゼがDNA鎖を交換する反応過程の詳細を明らかにしました。さらに、その反応の実際の分子構造をシミュレーションすることに世界で初めて成功しました。今回の成果により、相同組換えによるヒトがん抑制の分子機構研究にさらに弾みがつくことが期待されます。
この成果は、6月11日付けの『Nature Communications』に掲載されました。
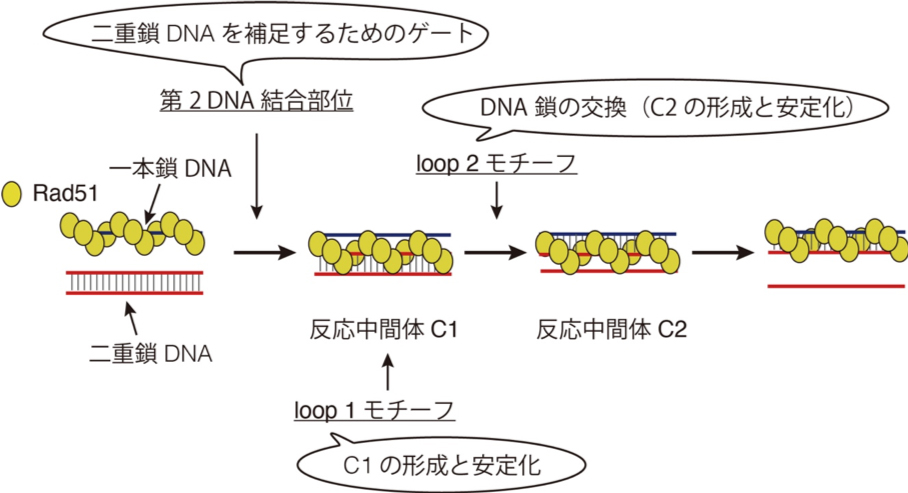
図: DNA鎖交換反応におけるRad51リコンビナーゼのDNA結合モチーフの役割
NIGバイオロジカルウェビナーを開催
NIGバイオロジカルウェビナーの開催
COVID-19の感染拡大防止の措置により移動や集会に様々な制約がかかり、特に
海外から研究者を招聘し最新の研究トピックを直接聞く機会が激減しています。
そこで、国内外の研究者のホットな遺伝メカニズム・ゲノム関係の研究の話題を、
タイムリーに伝える場として、NIGバイオロジカルウェビナーを企画しました。
オンラインセミナーとして、論文発表直近または直後のホットな話題を提供したいと
思います。特に海外留学中の研究者から研究成果を日本国内の研究者に届ける
ことで、若手研究者のプロモーションにも役立ててもらえるのではないかと期待しています。
視聴希望講者は事前登録制です。所外の方からの視聴を歓迎します。登録者にのみオンラインセミナーの接続情報を
通知します。前日までには、zoom会議室の接続情報を登録者にお送りします。
国立遺伝学研究所 副所長 仁木 宏典
第1回 NIGバイオロジカルウェビナー (テレビ会議セミナー)
開催日時: 2020年 8月11日(火)日本時間9:00から、1~1.5時間程度
演題: アーキアから探る染色体構造の構築原理と進化
講演者: 竹俣 直道
Postdoctoral Fellow
Stephen D. Bell Lab
Molecular and Cellular Biochemistry Department. Indiana University
http://www.indiana.edu/~sbelllab/
要旨:
細胞は自身よりも遥かに長大な染色体DNAをどのように折りたたんで収納しているのか — この問題は生物学における大きな謎の1つであり、多くの研究者が真核生物およびバクテリアを用いてその解明に長年取り組んできた。一方、第3の生物ドメインであり真核生物の起源となった原核生物でもあるアーキア(古細菌)では、染色体がどのような3次元構造をとるのかほとんど解明されていない。我々は、次世代シーケンサーを利用した染色体構造解析手法であるHi-Cを好熱性アーキアSulfolobusに用いることで、アーキア染色体の詳細な3次元構造を世界で初めて決定した。その結果、Sulfolobusの染色体はバクテリアよりもむしろ真核生物の染色体に近い高次構造をとること、そしてその高次構造形成に新規のSMCタンパク質「コーレシン」が関わることがわかった(Takemata et al., Cell 2019; Takemata & Bell, manuscript submitted)。本セミナーではこれらの結果をもとに、生命の3ドメイン間における染色体構築の共通原理と多様性について議論したい。
(日本語講演)
視聴登録: ウェビナー参加登録はこちら (所外の方の視聴を歓迎します。)
所外企画者(司会): 尾崎 省吾 准教授 / 九州大学大学院薬学研究院 臨床薬学部門 分子生物薬学
所内企画者: 仁木 宏典
切れたDNAをどう直す?
〜細胞が修復法を選択する仕組みを発見〜
RIF1 Controls Replication Initiation and Homologous Recombination Repair in a Radiation Dose-Dependent Manner
Yuichiro Saito, Junya Kobayashi, Masato T. Kanemaki, Kenshi Komatsu
Journal of Cell Science 2020 May 20. DOI:10.1242/jcs.240036
生命の遺伝情報を担うゲノムDNAはその化学的性質から内的、外的な要因により日常的に損傷を受けています。特に電離放射線はDNAを切断することでDNA二重鎖切断(DSB)を誘発し、その結果、細胞死やがん化を引き起こします。DSBはエラーの生じやすい『非相同末端結合』、または正確に修復可能な『相同組換え』により修復されることが知られており、二つの修復経路を適切に使い分けることがゲノムを維持するために重要だと考えられます。
これまで高線量の放射線を用いた研究結果から、ヒト細胞では非相同末端結合による修復が優位だと考えられてきました。しかし、高線量の放射線を用いた結果を一般化できるかはわかりません。そこで我々は低線量(弱)、高線量(強)の二種類の放射線を使い分け、ヒト細胞でのDSB修復活性を解析しました。その結果、低線量の放射線を照射した細胞では相同組換えがDSBを効率的に修復すること、放射線量が増加すると相同組換えの活性が弱まることを発見しました。この結果は、細胞がDNA損傷の『量』を感知し、適切な修復経路を使い分けていることを示唆すると考えられます。さらにDNA複製に関与するRIF1タンパク質が放射線量に依存して相同組換えの活性を弱めることを見出しました。これらの研究結果は、放射線治療においてがん細胞をより効率的に排除する手法の開発などに貢献すると期待されます。
本件研究は、斎藤(責任著者)が中心となり京都大学放射線生物研究センター小松研究室と国立遺伝学研究所鐘巻研究室にておこなわれました。
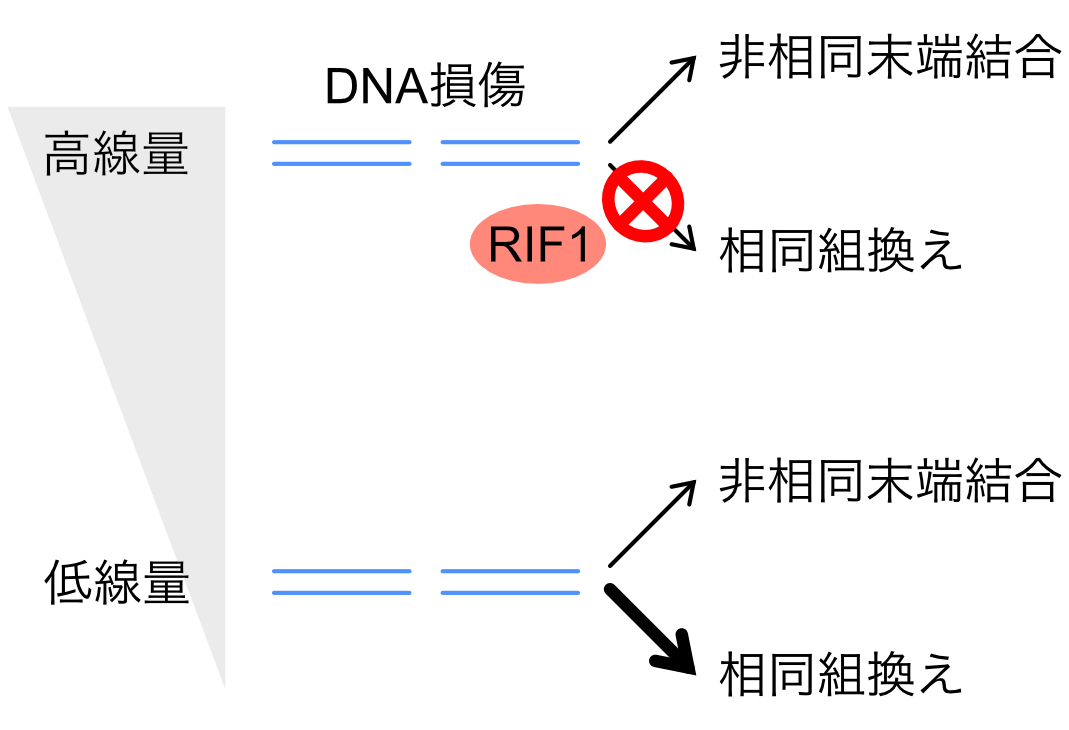
図:ゲノムに生じたDNA二重鎖切断は非相同末端結合または相同組換えにより修復されます。放射線量が増加するとRIF1タンパク質の働きにより、相同組換え修復が行われなくなることを見出しました。
- 第1著者の斎藤裕一朗博士研究員が同雑誌の「First person」で紹介されました。
国立遺伝学研究所とかずさDNA研究所が連携協定を締結

かずさ DNA 研究所は、1994 年に世界初の DNA 専門研究機関として発足し、世界の DNA 研究を先導するとともに、医療、農業、産業、教育の分野で幅広く社会に貢献しています。
弊所とはこれまでも共同研究を進め、最近では、イエネコ(アメリカンショートヘア種)やイチジク近縁種のイヌビワのゲノム解読や、ダイズ根圏に殺虫活性物質オカラミンを発見するなど成果を挙げていますが、これまでの学術交流を基に新たな共同研究へと発展します。
生態遺伝学研究室 石川助教が 日本進化学会研究奨励賞 を受賞

石川麻乃助教
生態遺伝学研究室 石川麻乃助教が日本進化学会 研究奨励賞を受賞しました。
この賞は進化学や関連する分野において,研究業績上大きな発展が期待される若手研究者に授与されます。
受 賞 名:2020年 日本進化学会 研究奨励賞
受賞テーマ:生活史進化の分子遺伝機構の解明
発表日:2020年6月5日
石川助教は翌6月6日には日本動物学会 奨励賞を受賞し、また今年4月には、令和2年度文部科学大臣表彰「若手科学者賞」も受賞しています。
日本動物学会 奨励賞受賞記事
文部科学大臣表彰「若手科学者賞」受賞記事
生態遺伝学研究室 石川助教が 日本動物学会 奨励賞 を受賞

石川麻乃助教
生態遺伝学研究室 石川麻乃助教が日本動物学会 奨励賞を受賞しました。
この賞は活発な研究活動を行い、将来の進歩、発展を強く期待される若手研究者に授与されるものです。
受 賞 名:2020年 日本動物学会 奨励賞
受賞テーマ:生活史の適応進化をもたらす遺伝基盤の解明
発表日:2020年6月6日
石川助教は 6月5日には、日本進化学会研究奨励賞を受賞し、また今年4月には、令和2年度文部科学大臣表彰「若手科学者賞」も受賞しています。
日本進化学会研究奨励賞受賞記事
文部科学大臣表彰「若手科学者賞」受賞記事
ドロボウは共生のはじまり!?
―盗葉緑体性渦鞭毛虫から探る葉緑体獲得の進化
Changes in the transcriptome, ploidy, and optimal light intensity of a cryptomonad upon integration into a kleptoplastic dinoflagellate
Ryo Onuma, Shunsuke Hirooka, Yu Kanesaki, Takayuki Fujiwara, Hirofumi Yoshikawa, Shin-ya Miyagishima
The ISME Journal (2020) DOI:10.1038/s41396-020-0693-4
Link to “Behind the Paper” the Nature Research Microbiology Community
植物や藻類の葉緑体は、もともと他の生物を捕食していた単細胞性の真核生物が、光合成生物を自身の細胞内に取り込み、統合したことによって誕生しました。このような葉緑体獲得は真核生物のさまざまな系統で独立に複数回起こったとされ、生態系に多様な藻類を生み出した進化の原動力であると考えられています。しかしながら、捕食-被食関係が永続的な共生関係に至った過程については多くのことが不明です。
盗葉緑体現象は、自前の葉緑体をもたない生物が他の藻類またはその葉緑体を自身の細胞内に取り込み、細胞内で一時的に維持する現象で、真の葉緑体を獲得する手前の進化段階であると考えられています。盗葉緑体性渦鞭毛虫Nusuttodinium aeruginosum(ヌスットディニウム アエルギノーサム)は、クリプト藻という単細胞藻類を取り込み、細胞内でその葉緑体を元のサイズの20倍以上に拡大することが知られています(図1A)。以前の観察結果から葉緑体の拡大にはクリプト藻の核が必要でことが示唆されましたが(Onuma & Horiguchi, 2015, Protist)、その詳細は明らかになっていませんでした。
そこで本研究では、N. aeruginosumと、それが取り込むクリプト藻を対象とし、クリプト藻核のトランスクリプトーム解析、様々な光条件での培養実験などを行い、盗葉緑体現象におけるクリプト藻核の役割を明らかにしました。その結果、渦鞭毛藻に取り込まれたクリプト藻核は(1)転写活性を維持しており、取り込まれる前よりも代謝・翻訳・DNA合成に関する遺伝子群の発現が上昇すること、(2)核分裂せずにDNA複製が持続し多倍体化すること(図1B)、(3)明暗の切り替えに応答した遺伝子発現変化がなくなること、(4)特に、光合成酸化ストレスを生じる強光条件下で宿主渦鞭毛藻の生存を支えていることが明らかになりました。
今回、盗葉緑体現象において見られた、取り込まれた藻類核の多倍体化と転写制御の喪失は、真の葉緑体をそれぞれ独立に確立した様々な生物群にも共通する現象です。つまり、これらの現象は、永続的な共生関係を確立する前から起こりうること、真の葉緑体をもつ生物群も太古の昔には盗葉緑体性生物であった可能性が示唆されます(図1C)。
本研究に至る過程をNature Research Microbiology CommunityのBehind the Paperで別途紹介しています。
本研究は、国立遺伝学研究所共生細胞進化研究室の大沼亮研究員(学術振興会特別研究員)、宮城島進也教授を中心として、国立遺伝学研究所、静岡大学、東京農業大学との共同研究チームによって行われました。
本研究は、科学研究補助金(17H01446、15H06834、17K15168、18J01089)、文科省私立大学戦略的研究基盤形成支援事業(S1311017)などの助成のもとに実施されました。
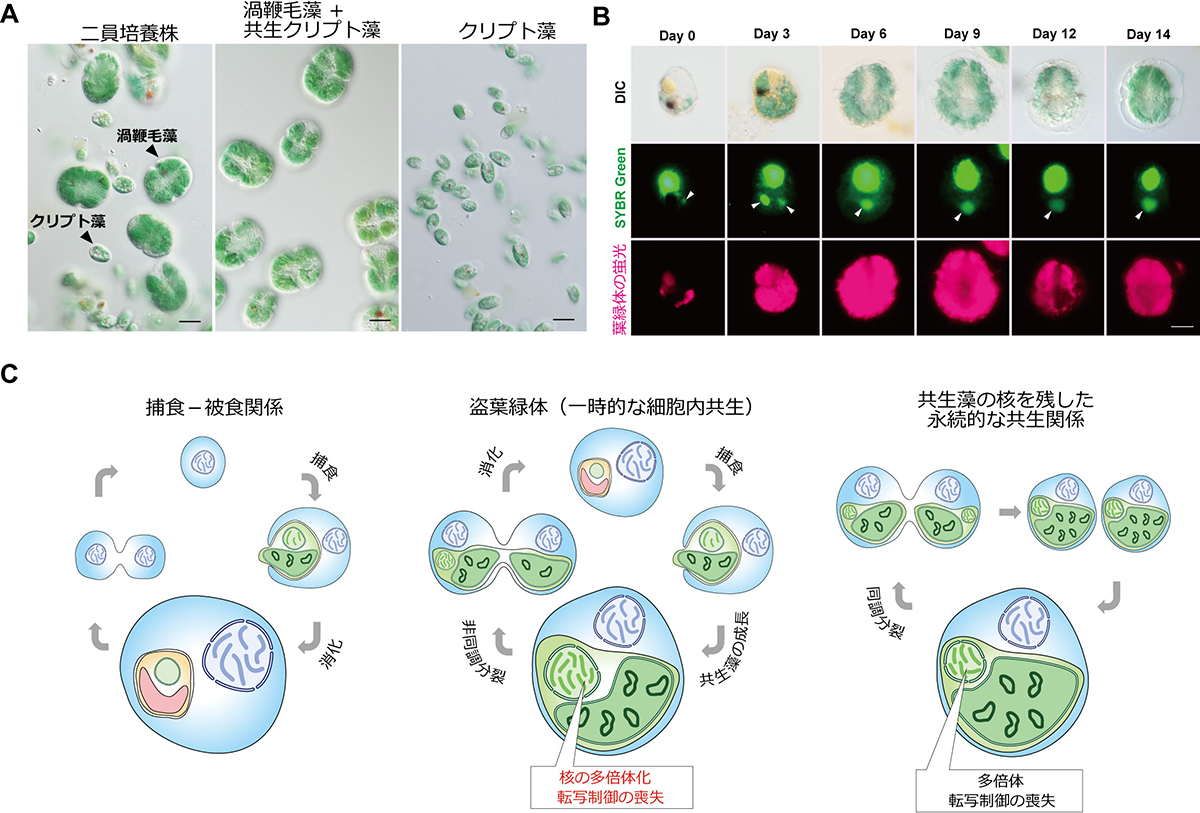
図:Nusuttodinium aeruginosumの盗葉緑体現象
(A) 渦鞭毛虫とクリプト藻の二員培養(左)、クリプト藻取り込んで維持している渦鞭毛藻(中央)、取り込まれる前のクリプト藻(右)の写真。スケールバーは10 µm。
(B) 渦鞭毛虫に取り込まれた後のクリプト藻核(矢尻;緑の蛍光)と葉緑体(赤の蛍光)の変化。渦鞭毛藻に取り込まれたクリプト藻核と葉緑体は徐々に拡大する。スケールバーは10 µm。
(C) 本研究の結果から示唆される、捕食-被食関係から永続的な共生関係への進化過程。捕食-被食関係では、捕食者は被食者をすぐに消化する(左)。葉緑体とその起源となった細胞の縮退核をもつ一部の藻類は、葉緑体と縮退核を自身の細胞分裂に同調させることで、永続的な共生関係を維持している。その縮退核は多倍体化しており、環境変動に応じた転写制御が無くなっていることが知られている(右)。N. aeruginosumに見られる盗葉緑体現象でも、取り込まれた藻類核の多倍体化と転写制御能の喪失がおこる(中央)。















