Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
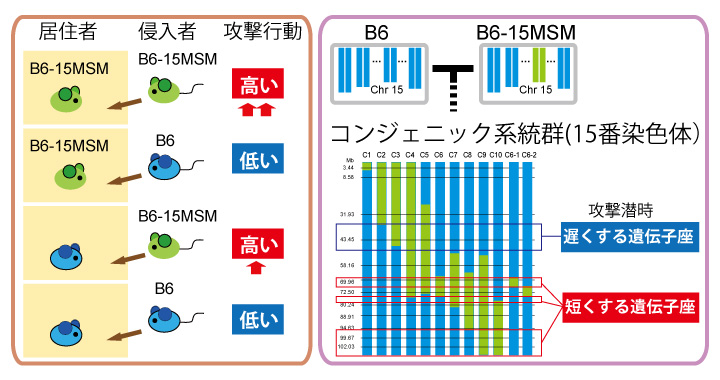
攻撃を挑発する遺伝子座
Mapping of Genetic Factors That Elicit Intermale Aggressive Behavior on Mouse Chromosome 15: Intruder Effects and the Complex Genetic Basis
Aki Takahashi, Hiroki Sugimoto, Shogo Kato, Toshihiko Shiroishi, Tsuyoshi Koide
PLOS ONE. September 21, 2015. DOI:10.1371/journal.pone.0137764
マウス開発研究室ではこれまで、野生由来マウス系統であるMSMのオスが過剰な攻撃性を示すことを明らかとし、その遺伝的基盤の一つとして15番染色体の関与を同定してきました(http://www.nig.ac.jp/nig/ja/2014/06/research-highlights_ja/20140613-2.html)。本研究では、この15番染色体上の攻撃性に関わる遺伝子座の特徴の解析を更に進め、15番染色体は特に相手の攻撃行動を誘発するような効果を持つことが明らかになりました。また、15番染色体の中にも攻撃行動に関わる遺伝子座が複数存在していることも明らかとなりました。
攻撃行動をはじめとした社会行動は、2個体の相互作用によって生まれるもので、相手があって初めて成り立つ行動です。雄マウスはなわばりを守る習性があり、なわばりに侵入してきたオスに対して居住雄が攻撃行動を示します。この攻撃行動に関わる遺伝子というのは、その個体自身の攻撃性を高めるものもあれば、他個体の攻撃行動を誘発するような要因も含まれてきます。私たちは15番染色体のコンソミックマウス系統(ほとんどすべての遺伝子は実験用マウスのC57BL/6J系統と同じなのですが、15番染色体のみMSM系統に由来するものを持っている系統。約してB6-15MSM)がC57BL/6J系統よりも高い縄張り性攻撃行動を示すことを明らかにしました。興味深いことに、B6-15MSM系統は居住者の時よりも、侵入者として用いられたときに、攻撃行動を高くすることが分かりました。つまり、侵入者として攻撃行動を誘発するような因子を持っていることが示唆されました。これが実際にどのような因子なのか(フェロモン、行動、超音波など)については、今回の解析では同定することができず、今後明らかにしていく課題です。
この15番染色体上の攻撃行動に関わる遺伝子座を同定するために、私たちは複数の組み換え系統(コンジェニック系統)を作成して、攻撃行動の解析をしました。統計数理額研究所の加藤助教との共同研究により回帰分析を行った結果、MSMの15番染色体上には攻撃潜時(攻撃行動を始めるまでの時間の長さ)に関わる遺伝子座が4つ存在することが明らかとなりました。そのうちの1つの遺伝子座については、4.1 Mbpの領域にまで狭められ、候補遺伝子は3つまで絞られました。
蓄積された突然変異が後世代に与える影響の解明に光
![]()
Germline mutation rates and the long-term phenotypic effects of mutation accumulation in wild-type laboratory mice and mutator mice
Arikuni Uchimura, Mayumi Higuchi, Yohei Minakuchi, Mizuki Ohno, Atsushi Toyoda, Asao Fujiyama, Ikuo Miura, Shigeharu Wakana, Jo Nishino, Takeshi Yagi Genome ResAugust 2015 25: 1125-1134; DOI: 10.1101/gr.186148.114大阪大学大学院生命機能研究科の内村有邦特任助教らの研究グループは、通常とは異なる形質を持つマウスが高頻度で誕生させることに成功し、世界で初めて、実験用マウスの世代あたりの変異率(突然変異の発生率)の測定に成功しました。また、ヒトとマウスの生殖系列では、よく似た特徴の変異が発生することも初めて明らかになりました。これは、通常の実験用マウスと遺伝子操作によりDNA複製時の変異率を高めたMutatorマウス※1 をそれぞれ20世代以上(9年間)に渡って継代を繰り返し、高い生殖系列の突然変異率が後世代の集団に与える影響について解析した結果です。
本成果は、人類集団で発生する変異の将来へのリスクを考える上で重要な発見だと考えられます。また、本研究では、水頭症や白内障、精神障害、筋ジストロフィー、アレルギー症状、腎障害、早期老化症、精子形成異常等、ヒト疾患にも関連する異常を示す個体も数多く見つかりました。さらには、「小鳥のように鳴くマウス」などの新奇の形質を示す変異体も誕生しました。本研究で作出された、多様なマウス変異体は今後のヒト疾患の治療方法の開発などに大きく役立つと考えられます。
本研究成果は、ゲノム科学専門誌「Genome Research」8月号に掲載されました(オンライン版については6月30日(火)に掲載されました)。
本研究は、新学術研究「ゲノム支援」の一部支援を受けて実施されており、国立遺伝学研究所の比較ゲノム解析研究室及び先端ゲノミクス推進センターがこの共同研究に参加しています。
用語解説
※1 Mutator(ミューテーター)マウス
遺伝子改変等により、自然発生する変異率を上昇させたマウス。生殖系列の変異の多くはDNA複製時のコピーミスが原因だと考えられている。そのため、本研究では、DNA複製で中心的な役割を担うDNAポリメラーゼδのDNA合成の正確性を低下させた遺伝子改変マウス(DNA複製時のコピーミス誘発マウス:ホモ接合型)を作製し、それをMutatorマウスとすることで継代実験を進めてきた。
細胞空間制御研究室 小田祥久准教授が平成27年度日本植物 学会賞奨励賞を受賞

新分野研究センター 細胞空間制御研究室の小田祥久准教授が平成27年度(第12回)日本植物学会賞奨励賞を受賞しました。
授賞式日時:平成27年 9月 7日(月)
授賞式場所:朱鷺メッセ:新潟コンベンションセンター(新潟県新潟市)
受賞名:平成27年度(第12回)日本植物学会賞奨励賞
受賞テーマ:細二次細胞壁パターンを創り出す空間シグナルの研究
平成27年度(第12回)日本植物学会賞受賞者について(日本植物学会賞HP)
減数分裂移行を制御するイネ蛋白質が結合するRNA配列
Rice MEL2, the RNA recognition motif (RRM) protein, binds in vitro to meiosis-expressed genes containing U-rich RNA consensus sequences in the 3′-UTR
Saori Miyazaki, Yutaka Sato, Tomoya Asano, Yoshiaki Nagamura, Ken-Ichi Nonomura
Plant Molecular Biology, Published online. 30 August, 2015. DOI:10.1007/s11103-015-0369-z
被子植物では、特定の季節に受粉・受精を行い、種子生産を完了させる必要があるため、生殖細胞の分化・発生のタイミングは厳密に制御されています。同一の葯内で、複数の花粉母細胞が同調的に減数分裂へと移行し、大量の花粉が同時に生産されるのもその一例です。私たちのグループは2011年に、イネの生殖細胞が減数分裂に移行するタイミング制御に関わるMEL2遺伝子の同定に世界に先駆けて成功しました。しかし、植物の減数分裂への移行タイミングを制御する機構はほとんどが不明のままです。
今回は、MEL2 蛋白質がもつRNA認識モチーフ(RRM)と優先的に結合する特徴的なRNAコンセンサス配列を試験管内で同定しました。同配列をイネゲノム配列と照合したところ、249個のイネ遺伝子が、3′-非翻訳領域(3′-UTR)内にコンセンサス配列と類似の配列を保存していました。また、葯での蓄積量がmel2突然変異体で変動するイネ蛋白質には、減数分裂での機能が示唆されるいくつかの蛋白質が含まれており、それらに対応するmRNA 3′-UTRの中に、MEL2結合コンセンサスと類似の配列を見出しました。これらの結果は、MEL2がmRNAの3′-非翻訳末端に結合し、減数分裂で重要な働きをする蛋白質の翻訳制御を介して減数分裂移行のタイミングを制御している可能性を示唆しています。
本研究は、国立研究開発法人農業生物資源研究所および金沢大学との共同研究の成果です。また、学術振興会 科研費(21678001、24770048、25252004)、二国間交流事業の支援を受けました。
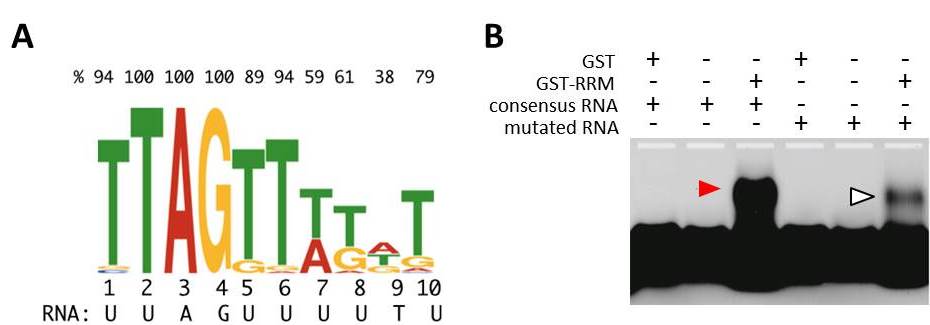
MEL2蛋白質はin vitroでウリジン(U)リッチなRNA配列に結合する.
(A) MEL2のRNA認識モチーフ(RRM)がin vitroで結合しやすい10塩基長のRNAコンセンサス配列. 上部の数値は、それぞれのポジションで優先的な塩基(T, A, G, あるいはC)の占めるパーセンテージ.
(B)ゲルシフトアッセイ. MEL2のRRMと、コンセンサス配列を含む一本鎖RNAを混合した時のみ、ラベルしたRNAバンド位置がシフトする(赤矢頭). コンセンサス配列に変異を入れると、シフト効率が激減する(白抜き矢頭).















