Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
国立遺伝学研究所 一般公開 2024:4月6日(土)開催-講演動画を配信中
ドワーフ・ネオン・レインボーフィッシュ(Melanotaenia praecox)のモデル生物化へ向けて:遺伝子工学のためのマイクロインジェクション法の確立
The dwarf neon rainbowfish Melanotaenia praecox, a smallspiny-rayed fish with potential as a new Acanthomorphamodel fish: II. Establishment of a microinjection procedurefor genetic engineering.
Kazuhide Miyamoto, Gembu Abe, Koichi Kawakami, Koji Tamura, Satoshi Ansai
Developmental Dynamics 2024 Feb 5 DOI:10.1002/dvdy.698
ドワーフ・ネオン・レインボーフィッシュは色鮮やかな淡水魚です。Melanotaenia praecoxは、Acanthopterygii (棘鰭上目)に属し、生物学的に興味深い特性を持つ小型のレインボーフィッシュです。私たちはM. praecoxが生態学、進化学、発生生物学などのさまざまな分野で新しいモデルとなる可能性があると期待しています。しかしながら、この種において分子レベル・遺伝子レベルのメカニズムを解析するために必要な方法論はほとんどありませんでした。本研究で、私たちは、M. praecoxでの遺伝子工学的手法、CRISPR/Cas9を用いた遺伝子ノックアウト法およびTol2トランスポゾンを用いたトランスジェネシス法、の開発に成功しました。M. praecoxでの遺伝子工学的方法論の確立により、この種におけるさまざまな生物学的現象の分子レベル・遺伝子レベルのメカニズムの研究が可能になります。
本研究は、東北大学の田村研究室と川上研究室の共同研究として行われました。
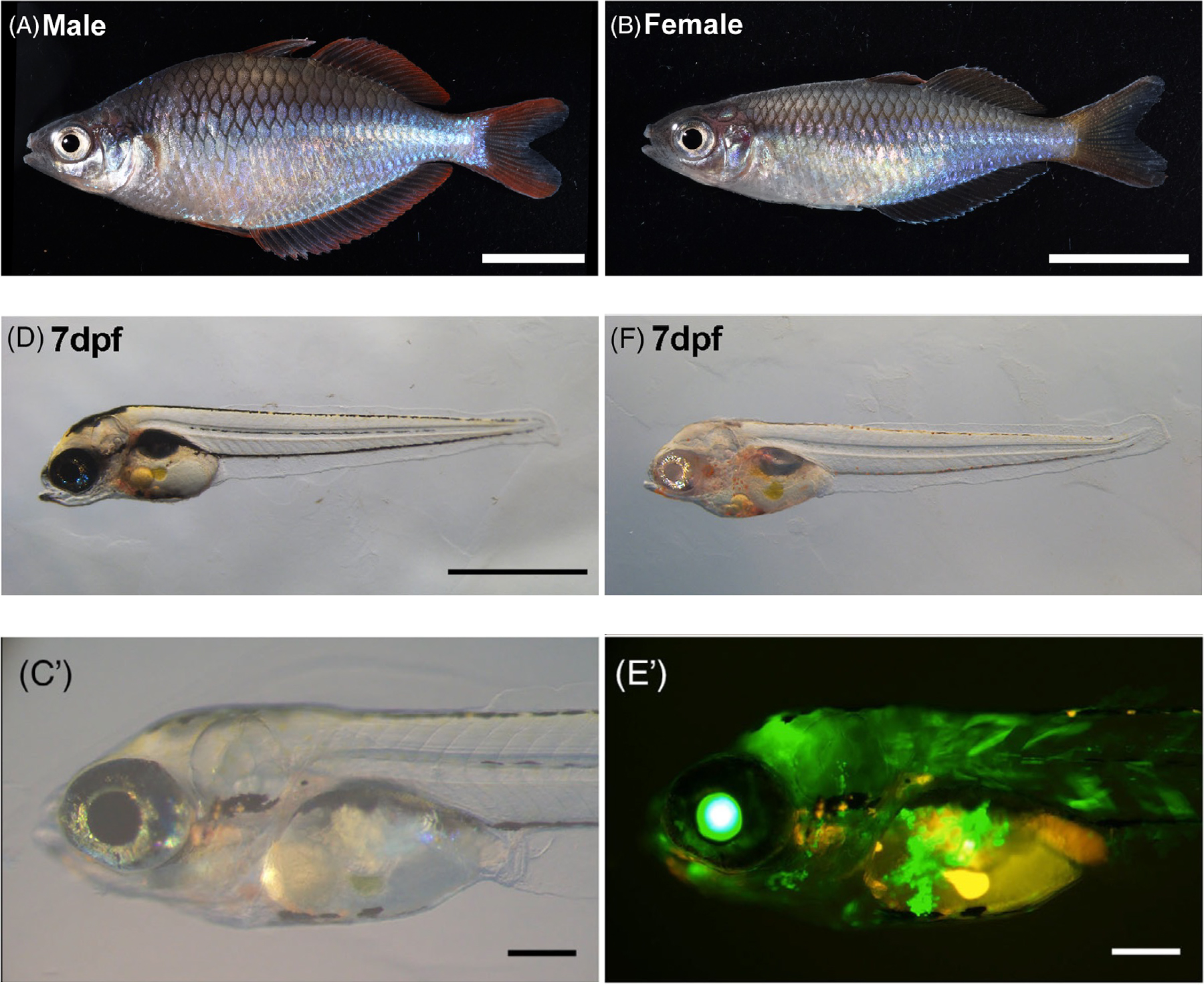
図:(A)(B)Melanotaenia praecoxのオスとメス。
(D)(F) CRISPR/Cas9を用いたチロシナーゼ遺伝子の破壊。
(C’)(E’) Tol2を用いたGFP遺伝子の導入。
変異型HRAS形質転換細胞ではクロマチンが凝縮している
前島研究室・ゲノムダイナミクス研究室
黒川研究室・ゲノム進化研究室
工樂研究室・分子生命史研究室
Chromatin organization and behavior in HRAS-transformed mouse fibroblasts
Aoi Otsuka*, Katsuhiko Minami*, Koichi Higashi, Akane Kawaguchi, Sachiko Tamura, Satoru Ide, Michael J. Hendzel, Ken Kurokawa, Kazuhiro Maeshima#
* These authors equally contributed to this work. #corresponding author
Chromosoma 2024 Feb 24 DOI:10.1007/s00412-024-00817-x
高等真核生物細胞のゲノムDNAはヒストンに巻き付きヌクレオソームを形成しています。近年、超解像イメージングやゲノムの3次元構造解析技術の1つであるHi-C法によって、ヌクレオソームは不規則に折りたたまれ、いくつもの凝縮したクロマチンドメインを形成していることが明らかにされてきました。ドメイン内部で局所的に液体のように振る舞うクロマチンの挙動は、転写やDNA修復といった細胞機能と深くかかわっていることが分かってきています。では、しばしばこうした機能が亢進しているがん細胞で、クロマチンはどのように振る舞っているのでしょうか?
今回、情報・システム研究機構 国立遺伝学研究所 ゲノムダイナミクス研究室の大塚碧 総研大生(SOKENDAI特別研究員)、南克彦 総研大生(元SOKENDAI特別研究員、学振特別研究員 DC2)、井手聖 助教、田村佐知子 テクニカルスタッフ、前島一博 教授のグループ、ゲノム進化研究室 東光一 助教、黒川顕 教授のグループ、分子生命史研究室 川口茜 助教は、カナダ・アルバータ大学のMichael J. Hendzel教授と共同で、がん遺伝子であるRASにより形質転換 (がん化)した細胞はそうでない細胞に比べて、よりクロマチンが凝縮していることを発見しました。
本研究では、腫瘍性変異型RASで形質転換されたマウス細胞 (CIRAS-3細胞) と非形質転換細胞 (10T1/2細胞)を用い、様々なスケールでクロマチンの振る舞いの違いを調べました。まず、共焦点顕微鏡を用いて細胞核の体積を調べ、CIRAS-3細胞で核が縮小していることを見出しました。また、超解像蛍光顕微鏡を駆使して生きた細胞でヌクレオソームの動きを観察したところ、CIRAS-3細胞ではクロマチンの動きがより抑制されていることがわかりました。この細胞ではヘテロクロマチンが増加しており、さらにクロマチンの空間的相互作用をマッピングするin situ Hi-C法から、「Bコンパートメント」と呼ばれるヘテロクロマチン領域同士の相互作用が増加していることがわかりました。
今回明らかになった、変異型RAS形質転換細胞における核の縮小とクロマチンの凝縮は、がん細胞が転移する際の細胞核の変形によるDNAダメージを軽減し、がん細胞の転移に有利に働いていると考えられます(図)。
本研究は、日本学術振興会(JSPS) 科研費(21H02453, 23K17398, 23K05798, 22H05606, 21H02535, 23KJ0998)、学術変革領域 A「ゲノムモダリティ」(20H05936)、科学技術振興機構(JST) JST 次世代研究者挑戦的研究プログラム(JPMJSP2104)、内藤記念科学振興財団、武田科学振興財団の支援を受けました。ゲノム解析については、先進ゲノム支援(22H04925(PAGS))の一環としておこなわれました。
雑誌「Chromosoma」は1939年創刊の歴史ある染色体学術誌で、遺伝研の図書館には創刊号から揃っています。
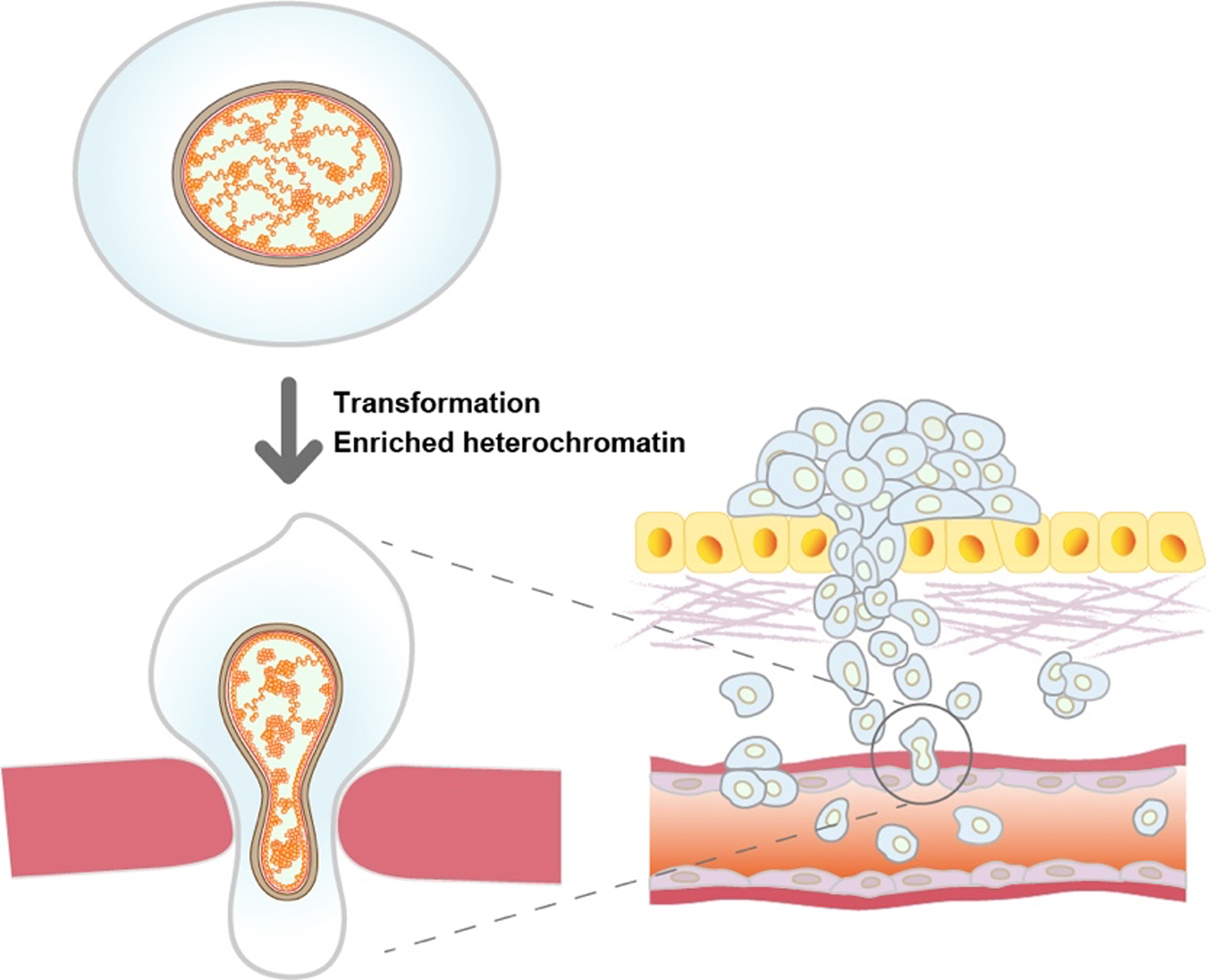
図:変異型HRAS形質転換細胞(左下)は、正常細胞(左上)に比べて凝縮したクロマチンを有している。凝縮したクロマチンは、細胞が転移する際の細胞核変形によるDNAダメージを軽減するのに役立つと考えられる。
休眠しやすさの違いが維持する遺伝的多様性
―異なる日長応答によるミジンコ2遺伝子型の共存―
プレスリリース
Different photoperiodic responses in diapause induction can promote the maintenance of genetic diversity via the storage effect in Daphnia pulex
Yurie Otake, Masato Yamamichi, Yuka Hirata, Haruka Odagiri and Takehito Yoshida
Proceedings of the Royal Society B: Biological Sciences (2024) 291, 20231860 DOI:10.1098/rspb.2023.1860
限られた資源をめぐって競争しているにもかかわらず、生物多様性がどのように維持されているのか、という問題は、生態学・進化生物学における重要な研究課題です。植物の種子やプランクトンの休眠卵といった休眠ステージは、変動環境で競争を緩和するストレージ効果という共存機構を促進することが知られています。これまでのストレージ効果についての研究では、休眠から覚めるタイミングの重要性が示されてきた一方で、休眠を始めるタイミングについてはあまり注目されてきませんでした。本研究では、ミジンコ(Daphnia pulex)の種内の遺伝的多様性に着眼し、休眠を始めるタイミングに種内で違いがあるかを調べ、それが遺伝子型の共存に寄与するか検証を行いました。本研究では、長野県阿南町の深見池から得られたミジンコの2つの遺伝子型を用いて、培養実験と数理モデルのアプローチからこの検証を試みました。実験の結果、日照時間の長さに反応して休眠を始めるタイミングに違いがあり、「昼が短くなるとすぐ休眠し始める遺伝子型」と、「昼が短くなってもなかなか休眠しない代わりに、単為生殖で数を増やす遺伝子型」が見られました。更に、数理モデルのシミュレーションにより、冬の訪れが早い年には前者が、遅い年には後者が有利になることでストレージ効果が促進され、休眠を始めるタイミングの違いが2つの遺伝子型の安定共存を可能にすることがわかりました。以上から、従来着眼されていた休眠から覚めるタイミングと同様に、休眠を始めるタイミングも生物多様性の維持に貢献する仕組みとして重要であることが示されました。
本研究は、日本学術振興会 特別研究員奨励費(特別研究員 大竹裕里恵、 課題番号:18J22937)、文部科学省科学研究費補助金 若手研究(研究代表者:山道真人、課題番号:19K16223)、基盤研究(B)(研究代表者:吉田丈人、課題番号:17H03730、21H02560)の研究助成を受けて実施されました。
本研究は、東京大学大学院総合文化研究科博士課程 大竹裕里恵(当時、現・京都大学生態学研究センター助教)、豪州クイーンズランド大学上級講師 山道真人(当時、現・国立遺伝学研究所 准教授)、東京大学大学院総合文化研究科 吉田丈人准教授(当時、現・東京大学大学院農学生命科学研究科 教授)、東京大学大学院総合文化研究科の修士課程学生2名の共著論文として、2024年2月14日にイギリスの国際学術誌英国王立協会紀要「Proceedings of the Royal Society B: Biological Sciences」に掲載されました。

図1: 実験①:共存条件下での単為生殖の速さの評価
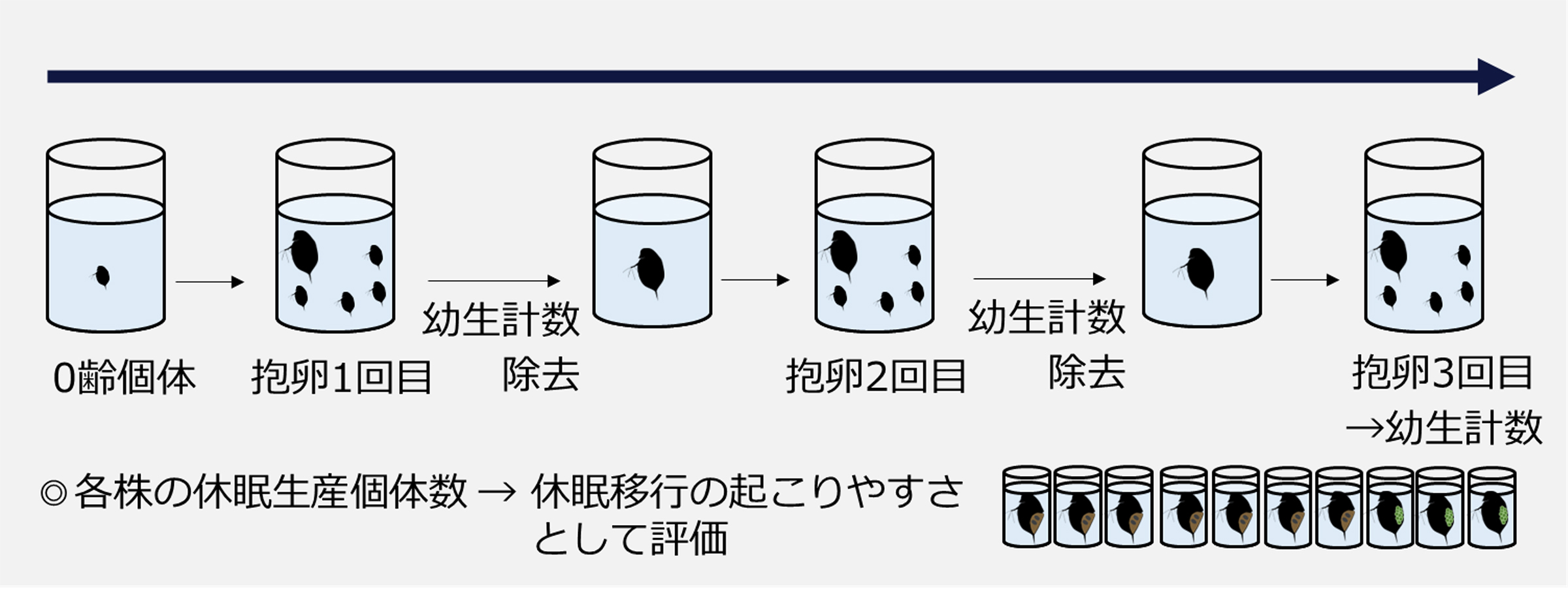
図2: 実験②:休眠しやすさの評価
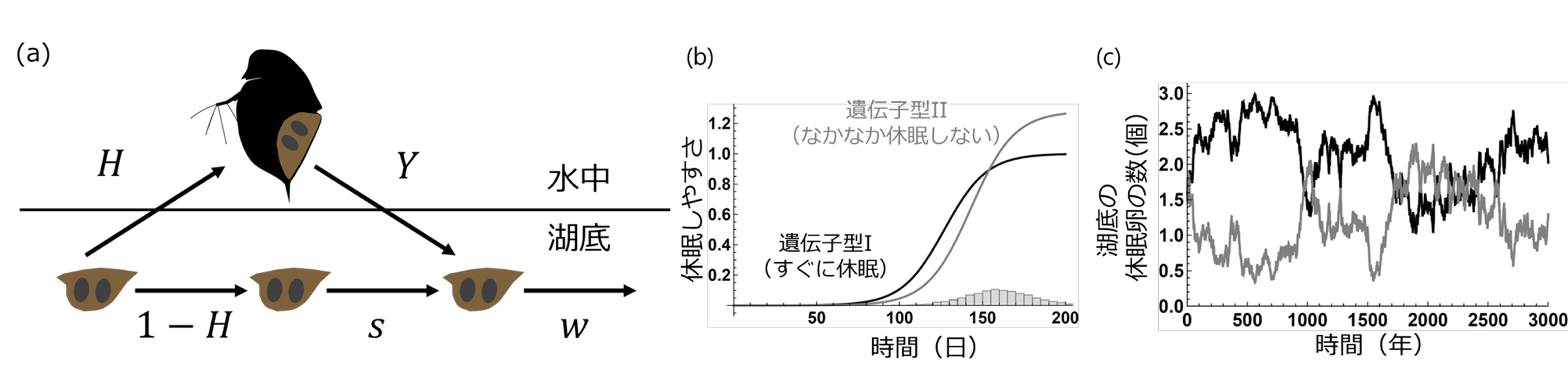
図3: ミジンコの休眠生活史と数理モデル
(a) ミジンコの休眠生活史:春先に確率 Hで孵化し、孵化した個体は秋から冬にかけて休眠卵Y個を産む。湖底の休眠卵は確率 sで夏を、確率wで冬を生きのびる。
(b) 2つの遺伝子型の休眠しやすさの違い:遺伝子型Iは秋から冬にかけてすぐに休眠するが、遺伝子型IIはなかなか休眠しない。右下のヒストグラムは、ミジンコの増殖に適した日数の年ごとの変動を示す。
(c) 湖底における休眠卵数の変動:遺伝子型Iが競争優位な年と、遺伝子型IIが競争優位な年が入れ替わりつつ共存する。
社会性が動物家畜化を生み出す
Association of tameness and sociability but no sign of domestication syndrome in mice selectively bred for active tameness
Bharathi Venkatachalam, Bhim B. Biswa, Hiromichi Nagayama, Tsuyoshi Koide*
*責任著者
Genes, Brain and Behavior (2024) 23, e12887 DOI:10.1111/gbb.12887
家畜動物は人類の生活に不可欠でとても重要な役割を果たしています。しかし、野生動物がどのような変化を受けて家畜化されていくのかまだ不明の点が多くあります。
情報・システム研究機構国立遺伝学研究所マウス開発研究室および総合研究大学院大学遺伝学コースの大学院生Bharathi Venkatachalam、Bhim B. Biswaと小出 剛准教授らは、マウスを用いて家畜化過程における形質変化の解明に取り組みました。
選択交配という方法により人になつく性質が高くなったマウス集団を用いてさまざまな行動を解析したところ、これらのマウスでは対照群と比較して同種個体間の社会的親和性が高くなっていることが分かりました。一方、社会性行動の中でも攻撃行動にはまったく違いがなく、他の行動にも違いはみられませんでした。これらの結果から、人になつく性質は社会的親和性が高くなることで生じると考えられました。
同種と他種を区別して社会性行動をすることは、動物が野生で生存していく上では生死に関わる重要なことです。一方で、家畜動物はその区別があいまいになって人になつく性質を示すことで繫栄してきた特殊な動物群であったと言えます。
実は、ヒトも社会性が高いという特徴がありますが、ペット動物を家族の一員のように扱ったりそれが死んだ際にはペットロスになったりします。私たちヒトもこのような家畜動物と共通した性質を持っているとも言えます。
本研究は、日本学術振興会(JSPS)科研費(19KK0177, 19H03270)、文部科学省、JST SPRING(JPMJSP2104)の支援を受けて行われました。
本研究成果は、2024 年 2 月 19 日付で、国際科学雑誌「Genes, Brain and Behavior」にオンライン掲載されました。
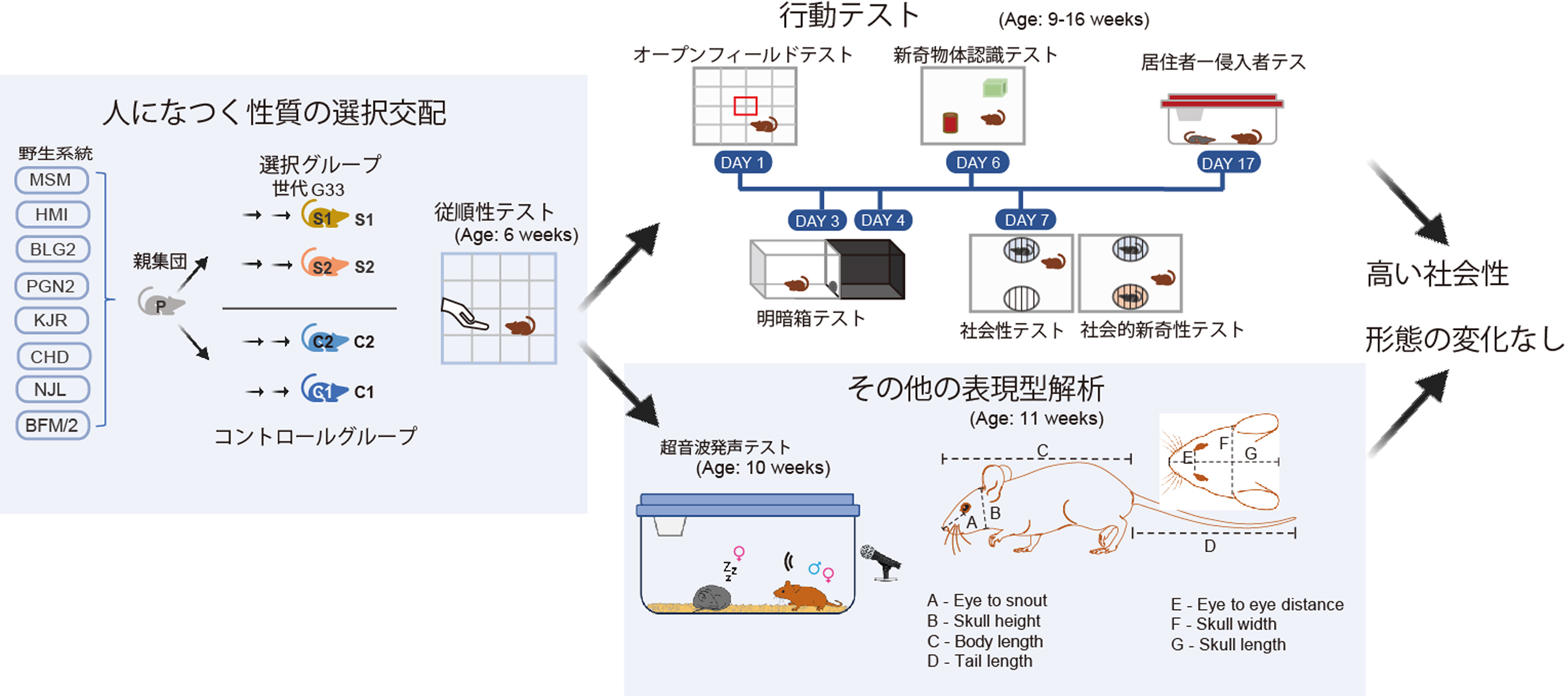
図:研究の概略と結果:人になつくマウスは高い社会性を示す一方で、家畜化症候群の兆候とされる形態変化は生じていない
- 研究室サイトはこちら
細胞内のパーソナルスペースの確保
Enucleation of the C. elegans embryo revealed dynein-dependent spacing between microtubule asters
Fujii, K., Kondo, T. & *Kimura
*責任著者
Life Sci. Alliance (2023) 7, e202302427 DOI:10.26508/lsa.202302427
近年の新型コロナウイルス感染症の流行に伴い、感染防止対策として有効な人との距離(2m程度)を「ソーシャル・ディスタンス」と表現するのを耳にする機会が増えました。人には心理学的に他人に入ってきて欲しくない「パーソナルスペース」があるとされていて、自然と他人と一定の距離(ソーシャル・ディスタンス)を保って離れようとします。京都の鴨川で、カップルが自然と間隔をあけて座っている様子はその心理の現れとされています。
本研究で、総合研究大学院大学・遺伝学専攻の藤井謙さんらのグループは、細胞内に存在する「中心体」と呼ばれる構造物が、あたかもパーソナルスペースを持っているかのように間隔をあけて配置することに着目し、そのしくみを明らかにしました。モデル生物の線虫の細胞から細胞核を取り除く新しい方法を開発し、そのような細胞の中で中心体がどんどん数を増していく様子を観察しました。中心体は細胞内で均等に配置しており、その均等な配置にはダイニンというモーター蛋白質が必要であることを明らかにしました。関連する遺伝子の阻害実験やコンピュータシミュレーションから、それぞれの中心体が細胞内のダイニンを奪い合うことによって、それぞれの「パーソナルスペース」を確保していることを明らかにしました。この研究は、細胞内で小さな構造物がどのように互いの距離を測っているのかを明らかにした研究として興味深いものです。

図:核を除いた線虫の胚細胞の顕微鏡像。白い点が中心体を表し、細胞内の複数の中心体がほぼ均等に配置している様子が見てとれる。(図は3次元の細胞を2次元に投影したもの。*は極体という中心体とは別の構造体。)
小型魚類遺伝研究室 技術補佐員募集
| 【仕事内容】 | ・ゼブラフィッシュの飼育補助(応相談) ・試薬調製や実験器具の洗浄などの実験補助(応相談) ・ジェノタイピングなどの分子生物学実験(応相談) |
| 【採用時期】 | 2024年4月 |
| 【雇用期間】 | 2025年3月末までの1年間 |
| 【応募資格】 | 魚類の研究に興味のある方。マイクロピペットを使った業務経験があると望ましい(応相談)。 |
| 【勤務地】 | 国立遺伝学研究所・小型魚類遺伝研究室 |
| 【給与・待遇】 | 遺伝研の規定に準じて決定 |
| 【勤務時間】 | 週3~5日(応相談):月〜金 9:00-16:00(昼休憩1時間、週30時間以内) |
| 【採用人数】 | 1~2名 |
| 【応募方法類】 | 封筒またはメール件名に「小型魚類遺伝研究室 技術補佐員応募」と明記の上、履歴書(写真添付・メールアドレス記載)、職務経歴書を下記宛先まで郵送またはメールにて送信下さい。書類選考通過者のみ面接を行い、採用を決定いたします。お送りいただきました履歴書等の応募書類は返却いたしませんのでご承知おき下さい。 |
| 【応募期間】 | 適任者が見つかり次第締め切ります。 |
| 【問合先・提出先】 | 〒411-8540 三島市谷田1111 国立遺伝学研究所 小型魚類遺伝研究室 Email: Tel:055-981-5849 担当:今井裕紀子 |
脊椎動物の運動神経軸索再生の際の標的特異性は、末梢神経叢でのグリア細胞との相互作用に依存する
Target-selective vertebrate motor axon regeneration depends on interaction with glial cells at a peripheral nerve plexus
Lauren J. Walker, Camilo Guevara, Koichi Kawakami, and Michael Granato
PLOS Biology (2023) 21, e3002223 DOI:10.1371/journal.pbio.3002223
末梢神経損傷からの機能回復における重要なステップの一つは、再生した軸索が損傷前の標的に正しく接続することである。四肢を支配する軸索にとって損傷前の標的特異性を再構築するのは特に難しい。なぜならそこでは末梢神経が集積し、異なる神経の軸索が入り混じる神経叢が存在するからである。本研究では、ゼブラフィッシュの胸ビレ(四肢動物の前肢に相当する)の基部にある神経叢において神経細胞が標的特異的な束に再分類される過程を、軸索をまばらにラベリングし、生細胞イメージングすることにより明らかにした。そこでは、3本の運動神経から再生した軸索が神経叢に合流し、入り混じったのちに分岐し、高い精度で元の筋肉領域に伸長し、機能を回復した。この再生プロセスでは、誤った方向に伸長した軸索は選択的に退縮したが、これは積極的な修正メカニズムが存在する可能性を示唆する。さらに、我々は神経叢にはシュワン細胞が軸索と共に豊富に存在することを見出した。再生中にそのシュワン細胞を取り除くと、顕著に軸索が誤方向に伸長する現象が生じた。本研究は、再生中の脊椎動物の運動神経の軸索が神経叢を伸長していく過程の初めてのリアルタイムイメージングに成功し、再生中に神経叢で軸索の再分類を促進するというシュワン細胞の新しい役割を明らかにした。
本研究は、米国ペンシルバニア大学のGranato研究室と川上研究室の共同研究として行われました。
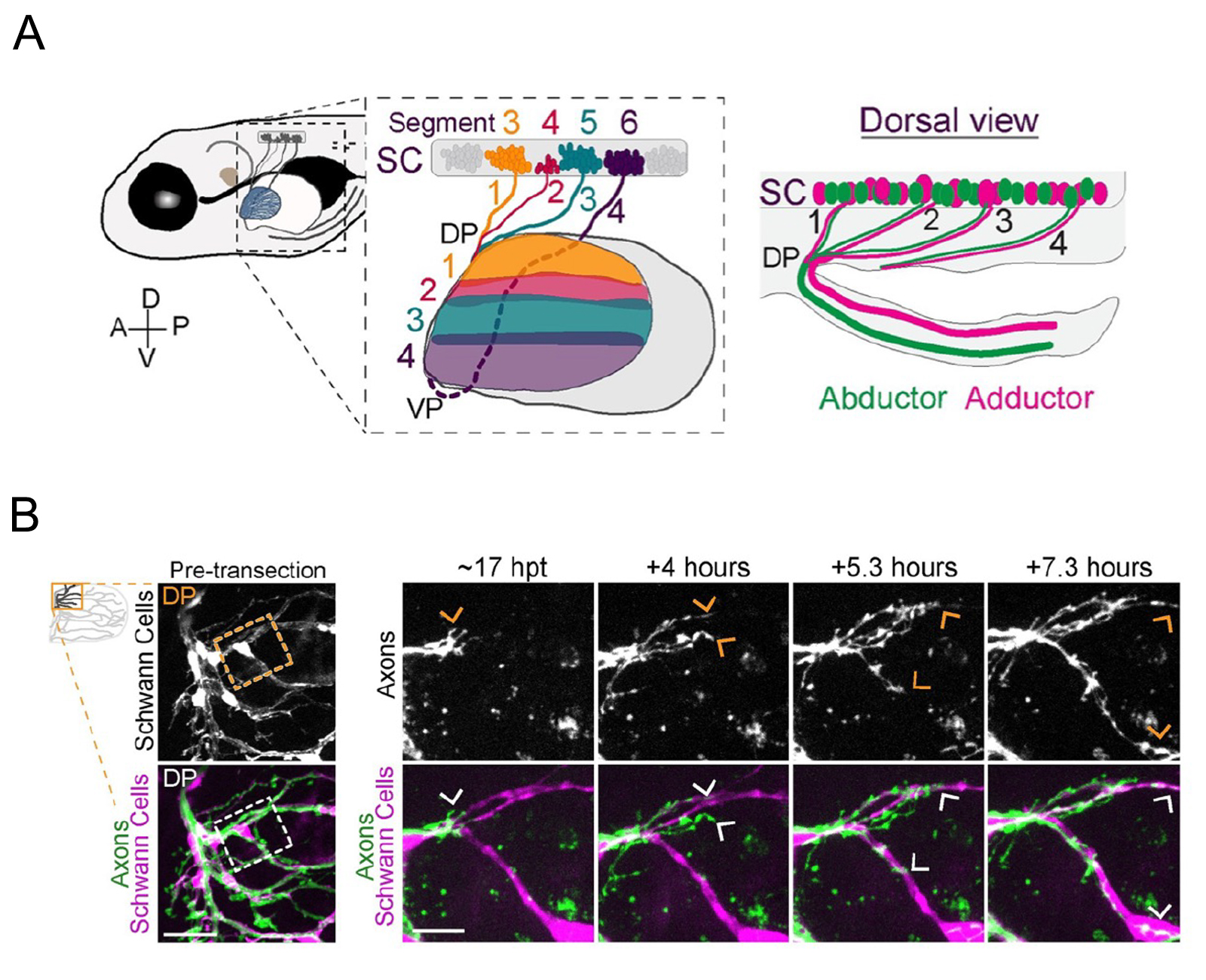
図:(A)ゼブラフィッシュの脊椎からの運動神経が神経叢で再分類され胸びれの筋肉に結合する様子。DP、VPは神経叢。Abductor:外転筋、Adductor:内転筋。
(B) 軸索(axon)がシュワン細胞に沿って伸長する様子のライブイメージング。シュワン細胞をラベルするために、トランスジェニックゼブラフィッシュを用いた。
分子細胞工学研究室総研大生・鳩山さんが第41回染色体ワークショップ・第22核ダイナミクス研究会で学生優秀ポスター発表賞を受賞
第41回染色体ワークショップ・第22核ダイナミクス研究会(2024年1月29-31日小田原)において、分子細胞工学研究室のD4鳩山雄基さんが学生優秀ポスター発表賞を受賞しました。
- 受賞発表タイトル: Advancement in degron-based technologies for dissecting pathways involved in chromosome function
















