Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
新型コロナウイルス感染症に関する遺伝研の対応について【2020年7月31日版】
夏季休業のお知らせ(8/14-17)
本研究所は、下記のとおり夏季一斉休業を実施します。
ご不便をおかけいたしますが、ご理解とご協力のほどお願いいたします。
令和2年8月14日(金)~17日(月)
細胞内の流れが卵の極性決定因子を押し流す
Cytoplasmic streaming drifts the polarity cue and enables posteriorization of the Caenorhabditis elegans zygote at the side opposite of sperm entry
Kenji Kimura and Akatsuki Kimura
Molecular Biology of the Cell (2020) 31: 1765–1773 DOI:10.1091/mbc.E20-01-0058
*FOURTH SPECIAL ISSUE on FORCES ON AND WITHIN CELLS
国立遺伝学研究所・細胞建築研究室では、木村健二助教(現・関西学院大学理工学部講師)が中心となって、細胞内の流れが受精卵の極性形成に寄与する仕組みを明らかにした。本成果は米国細胞生物学会が発行するMolecular Biology of the Cell誌に2020年5月28日(日本時間)に公開された。
生物の発生過程では、細胞極性(細胞内の成分の偏った分布)によって将来の体軸の向きが決定される。その研究モデルとして線虫C. elegansの受精卵が古くから用いられており、精子が持ち込む核と中心体の複合体(SPCC)の卵内における位置が体軸の一つである前後軸の向きを決めることが知られていた(図A:PP-type, SPCC側が後極側(posterior)になる)。しかし、前後軸ができるのは受精から約30分後であり、その間にどのようにSPCCの位置が決まるのか不明であった。今回、ライブイメージングによってSPCCの動きを詳細に追うことで、受精直後に生じる細胞内の流れがSPCCの位置をランダムに変えることが明らかになった(図B)。SPCCは時おり精子が入った側から逆サイドまで流され、その場合、精子が入った側が前極側となった(図A, C:DP-type)。このような動きは細胞内の流れ自体が確率的にふるまうことによる。本研究成果は、線虫の発生が型通りに進む前に、細胞内の流れの確率的な特性が体軸決定に重要なSPCC位置を決めることを初めて示した(図D)。
本研究は、JSPS科研費(JP26840072, JP19K06681, JP16H05119, JP16H00816, JP18H05529, JP18H02414)、NIG-JOINT (76A2019)の支援を受けました。
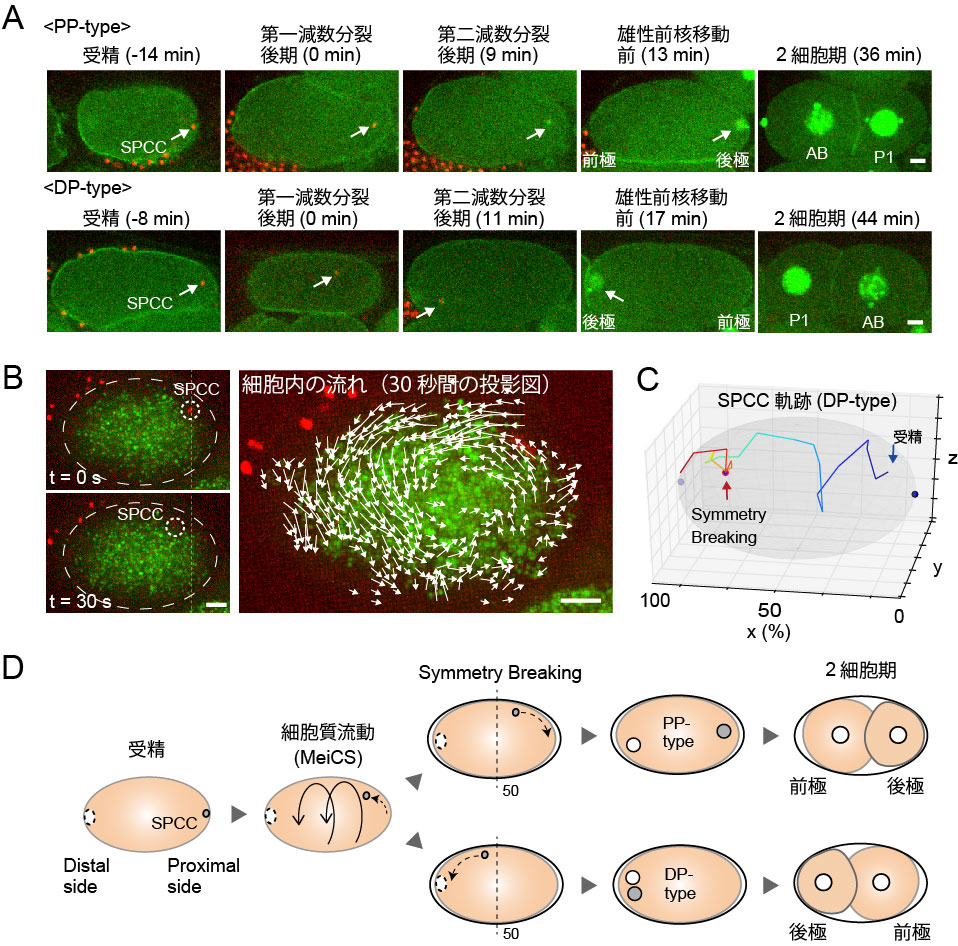
図:(A) 受精直後から第一分裂までの線虫受精卵。白矢印で精子由来の核と中心体の複合体(SPCC)の位置を示した。上段PP-type、下段DP-type (B) SPCCの移動(白丸)と細胞質の流れ(白矢印)は一致した。(C) DP-typeにおけるSPCC軌跡例 (D) 細胞質流動(MeiCS)はSPCCを押し流して前後軸の決定に影響する。
茎が伸長を開始する仕組みの発見
~アクセル因子とブレーキ因子の巧妙なバランスによる茎伸長制御~
Press release
Antagonistic regulation of the gibberellic acid response during stem growth in rice
Keisuke Nagai, Yoshinao Mori, Shin Ishikawa, Tomoyuki Furuta, Rico Gamuyao, Yoko Niimi, Tokunori Hobo, Moyuri Fukuda, Mikiko Kojima, Yumiko Takebayashi, Atsushi Fukushima, Yasuyo Himuro, Masatomo Kobayashi, Wataru Ackley, Hiroshi Hisano, Kazuhiro Sato, Aya Yoshida, Jianzhong Wu, Hitoshi Sakakibara, Yutaka Sato, Hiroyuki Tsuji, Takashi Akagi and Motoyuki Ashikari
Nature 15 July 2020 DOI:10.1038/s41586-020-2501-8
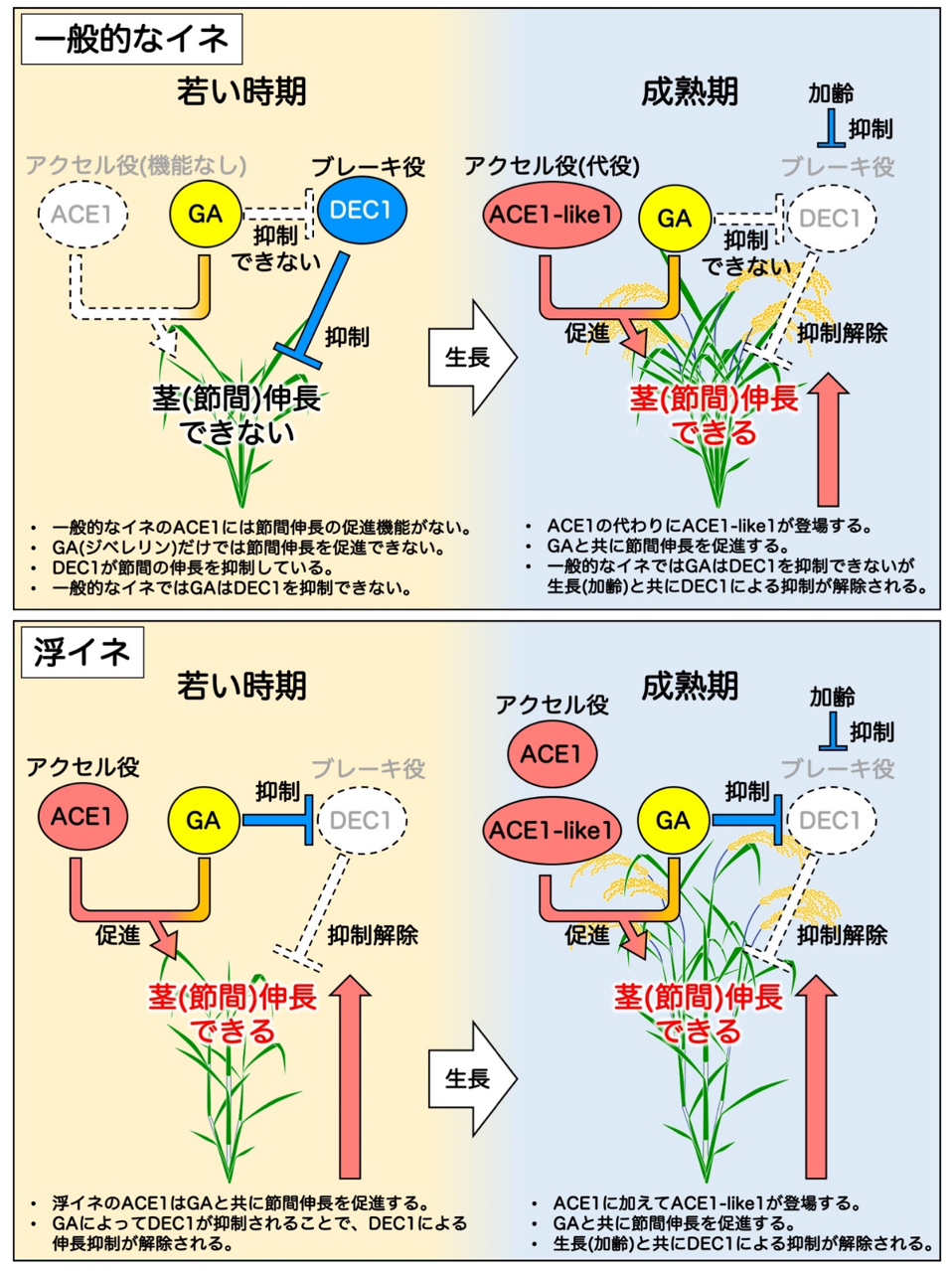
このたび、名古屋大学生物機能開発利用研究センター永井啓祐助教、芦苅基行教授らの共同研究チームは、これまで謎であった植物の茎が伸長を開始する仕組みを解明しました。約50年前に日本人の研究者らによって、茎伸長の開始を制御する因子の存在が提唱されていましたが、その実態は未解明のままでした。今回、研究チームはイネを使って、茎伸長におけるアクセル役であるACE1遺伝子とブレーキ役であるDEC1遺伝子の2つの因子を発見し、相反する機能を持つこれらの因子のバランスによって、茎が伸長を開始するタイミングが制御されていることを明らかにしました。また、このACE1遺伝子とDEC1遺伝子による茎伸長の制御機構はイネ科植物に共通したメカニズムであることも判明し、本研究成果はイネだけではなく、コムギやオオムギなどのイネ科作物の草丈を人為的に制御する技術への応用が期待されます。
本研究は、岡山大学、横浜市立大学、情報・システム研究機構国立遺伝学研究所、理化学研究所、農業・食品産業技術総合研究機構(以下、農研機構)との共同研究で行われたものです。
また本研究は、科学技術振興機構(JST)地球規模課題対応国際科学技術協力プログラム(SATREPS) (JPMJSA1706)、科学技術振興機構(JST)戦略的創造研究推進事業チーム型研究(CREST)(JPMJCR13B1)、理研-名古屋大科学技術ハブ、文部科学省新学術領域研究(17H06473)、文部科学省新学術領域研究(16H06466)、科研費 若手研究(B)(16K18565)、科研費 若手研究(19K15815)、新農業展開ゲノムプロジェクト(QTL5003)の支援によって遂行されました。
この研究成果は、2020年7月15日16時付(日本時間2020年7月16日0時)の英国科学雑誌「Nature」オンライン版に掲載されました。
遺伝研の貢献
本研究で用いられた浮イネおよび野生イネは、遺伝研およびナショナルバイオリソースプロジェクト・イネ(Oryzabase)より分譲されたものです。遺伝研は当該材料のゲノム情報提供と解析で貢献しました。
トゲウオの連続的な種分化
Genome-wide patterns of divergence and introgression after secondary contact between Pungitius sticklebacks.
Yamasaki, Y.Y., Kakioka, R., Takahashi, H., Toyoda, A., Nagano, A. J., Machida, Y., Møller, P.R., and Kitano, J.
Philosophical Transactions of the Royal Society B: Biological Sciences (2020) 375: 20190548 DOI:10.1098/rstb.2019.0548
生態遺伝学研究室の山﨑曜研究員と北野潤教授を中心とする研究グループは、日本に生息するトゲウオ科トミヨ属の種分化過程について解明し、現存する最古の科学雑誌(1665年より刊行)である英国王立協会哲学紀要(フィロソフィカル・トランザクションズ)Bにその成果を報告しました。
種の定義には様々なものがありますが、動物学で広く受け入れられている定義にマイアーの生物学的種概念があります。あるグループに属する個体同士は交配出来るが、別のグループとは交配できないような場合に別種と定義するものであり、この定義によると生殖隔離の進化が種分化と言えます。
しかし、生殖隔離と一口に言っても、全く雑種が生まれないくらいに生殖隔離が完全な状態もあれば、雑種子孫がある程度生まれるくらいに生殖隔離が不完全な状態もあります。ここ数十年間の野生生物の種分化研究では、種分化の初期段階、つまり2つのグループが分かれ始める初期段階に着目したものが大多数でした。そこで本研究では、種分化の全体像を理解するために、種分化が完成する間近の種分化後期の状態を解析するべくトゲウオ科トミヨ属の魚に着目しました。
北海道東部では、トミヨ淡水型(Pungitius sinensis)とトミヨ汽水型(Pungitius pungitius)の2種が共存している河川がいくつか存在します(図1)。これら2種は雑種オスが不妊になるなど生殖隔離がありますが、同所生息域では未だに低い頻度で交雑が起こっています。これら2種の過去の集団履歴、種間での遺伝的分化や遺伝子流動を解析するために、まずは淡水型トミヨを利用して全ゲノム参照配列を決定しました。ついで、これら2種の複数個体の全ゲノム配列を解読しました。
その結果、これら2種は約170万年前に地理的隔離を受けて分岐が生じ、約3.7万年前に再び二時的に接触して、現在は低頻度で遺伝子を交換していることが明らかになりました。これまでに研究室内外で実施された他のトゲウオの研究例と比較すると、今回研究対象とした同所トミヨ2種の遺伝的分化は、これまで報告された同所種間よりも進行したものであり、完成間近の種分化段階にあることが明らかになりました(図2)。今後は、様々なトゲウオの種群を比較することで種分化過程の全体像に迫っていきたいと考えています。
本成果は、国立遺伝学研究所比較ゲノム研究室、水産大学校、龍谷大学、美幌博物館、コペンハーゲン大学との共同研究として、科研費、先進ゲノム支援、遺伝研博士研究員制度などの支援を得て行われました。

図:トミヨ淡水型(Pungitius sinensis)とトミヨ汽水型(Pungitius pungitius)。黒線は10 mm。
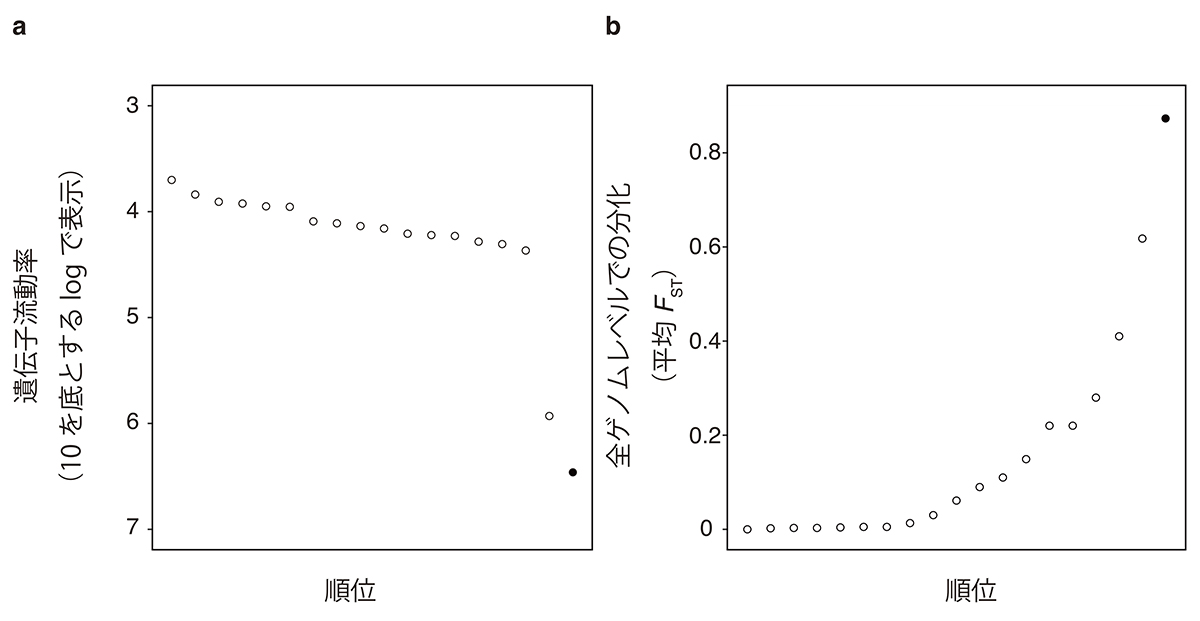
図:これまでに研究室内外で実施された他のトゲウオの同所種の研究例と比較。遺伝子流動率の高い順(a)、ゲノム分化の低い順番(b)に並べた。黒丸が今回研究対象とした同所トミヨ。
種の壁は絶対か?
Patterns of genomic divergence and introgression between Japanese stickleback species with overlapping breeding habitats.
Ravinet, M., Kume, M., Ishikawa, A., and Kitano, J.
Journal of Evolutionary Biology 2020 Jun 17. DOI:10.1111/jeb.13664
種分化は、ダーウィンの時代から現在まで続く「謎中の謎(mystery of mysteries)」です。種分化とは、一般的に「生殖隔離の進化」と定義されます。生殖隔離は、有るか無いかの二択ではなく、より正確に言うと「遺伝子流動率の低下」のことであり、連続的なものです。種の間に存在する生殖隔離とは、一体どの程度固定的なもので、どの程度流動的なものなのでしょうか?
生態遺伝学研究室とノッティンガム大と京都大学の共同研究チームは、日本に生息するトゲウオを利用してこの問いに挑み、その成果をヨーロッパ進化学会の刊行するJournal of Evolutionary Biologyに発表しました。
北海道の東部では、イトヨ(Gasterosteus aculeatus)とニホンイトヨ(G. nipponicus)という67万年くらい前に分岐したトゲウオ2種が生息しています。これら2種は、野外で見つかる雑種は少なく、ゲノム全体での配列の違いも大きいことが生態遺伝学研究室によって示されています。雑種が少ない一つの要因は、イトヨは川の上流、ニホンイトヨは川の下流で産卵するというように、産卵場所をうまく分けていることにあります。このたび、生態遺伝学研究室は、小河川の中で、ほぼ同じ場所でこの2種が生息している集団の全ゲノム解読を行い、遺伝子流動率などを解析しました。
その結果、この小河川では、2種間のゲノムレベルでの違いが明らかに低下しており交雑が進んでいることが分かりました。しかし、それでも別々の2種としてたしかに存在しており、種が均一化する現象、いわゆる逆行種分化(speciation reversal)は進行していませんでした。
トゲウオでは、生息地の人為的撹乱によって逆行種分化が生じた例がカナダで報告されており、今後は、どういった要因があれば生殖隔離が維持されて逆行種分化が生じないのか、どういった要因があれば逆行種分化によって種の壁が崩壊するのか、その要因に迫っていきます。
本研究は、科研費の支援を一部受けました。なお、筆頭著者のマーク・ラビネイ研究員は、生態遺伝学研究室の博士研究員として2年間ほど遺伝研で研究していました。
- 筆頭著者マーク・ラビネイ研究員、遺伝研在籍時のインタビュー記事はこちら

図:イトヨ(上)とニホンイトヨ(下)
2020年度 第4回 ABS講習会【ワシントン条約編】をウェビナー(Zoom)で開催
2020年度第2回「先進ゲノム支援」支援課題の公募のお知らせ
オスとメスの違いは、性染色体が生み出すのか、ホルモンが生み出すのか。
Differences in the contributions of sex linkage and androgen regulation to sex-biased gene expression in juvenile and adult sticklebacks.
Kitano J, Kakioka R, Ishikawa A, Toyoda A, Kusakabe M.
Journal of Evolutionary Biology 2020 Jun 13 DOI:10.1111/jeb.13662
動物のオスとメスの違いにおいて、性染色体の果たす役割が、発生・発達・成長段階で大きく変わるということを生態遺伝学研究室が解明し、ヨーロッパ進化学会の刊行するJournal of Evolutionary Biologyに発表しました。
動物のオスとメスは、見た目や行動など多くの点で違いがあり、性的二型と呼ばれます。例えばトゲウオ科のイトヨは、稚魚の時はオスとメスで見た目や行動に違いは見られませんが、成魚になるとオスは婚姻色を呈し縄張りを持ち求愛行動を示します(図1)。一方、メスはそのような色や行動を示しません(図1)。イトヨの性的二型は、チャールズ・ダーウィンが性淘汰(繁殖の成効率が個体間で違うことに着目した進化の理論)という概念を構築したり、ノーベル賞を受賞したニコ・ティンバーゲンが動物行動学(動物の行動を科学的に研究する学問でエソロジーとも呼ばれる)という学問分野を開拓したりするのに役立ってきました。
脊椎動物では、このような性的二型を生み出すメカニズムに、性連鎖(性染色体に原因遺伝子が座乗していること)と性ステロイド(アンドロジェンなど)による遺伝子発現制御があります。性染色体が性的二型を生み出すのか、ホルモンが性的二型を生み出すのかは、進化生物学における論争の種となってきました。
本研究チームは、脳のトランスクリプトーム(ゲノム中の全遺伝子の発現)の性差における性連鎖とアンドロジェン応答の役割を解析しました。その結果、稚魚に比して成魚では、性差を示す遺伝子の総数は増えますが、性差における性連鎖の相対的な貢献度は著しく低下しました。代わりに、アンドロジェン応答の役割が増加しました。これは、アンドロジェンの量がオスの成魚でのみ高まる知見と合致しています。この様子を模式図として示すと図2のようになります。
性染色体の役割が、発生・発達・成長段階で変化していくということは、あたり前のようだけど誰も着目しなかった部分であり、見逃されていた部分に着目しゲノム技術を用いて検証したという独自性の高い視点について高く評価して頂きました。
本研究は、生態遺伝学研究室が中心となり、比較ゲノム研究室と静岡大学との共同研究として行われました。日本学術振興会の科研費と遺伝研共同利用の支援を受けました。

図:成熟したオス(上)とメス(下)の頭部
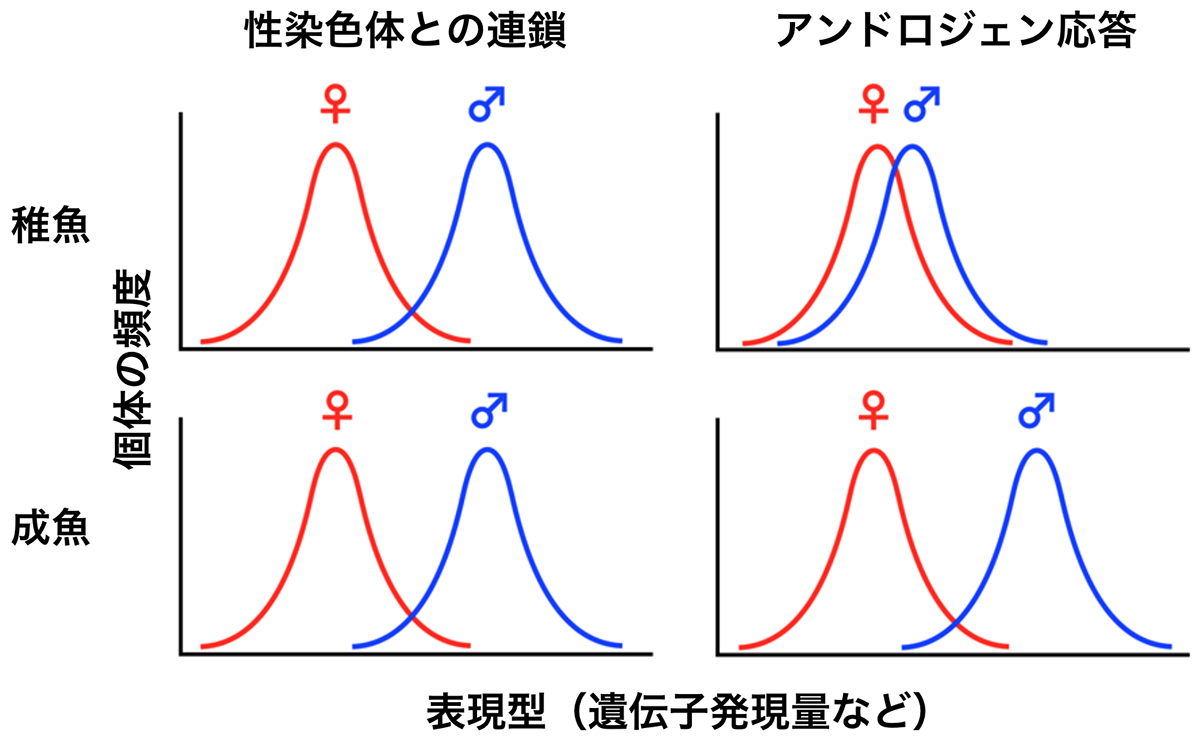
図:性染色体とアンドロジェンの役割の違いを示した模式図















