Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
右心室以外の心臓を構成する細胞へ分化する前駆細胞を発見
Sfrp5 identifies murine cardiac progenitors for all myocardial structures except for the right ventricle
Fujii Masayuki, Akane Sakaguchi, Ryo Kamata, Masataka Nagao, Shilvia M. Evans, Masao Yoshizumi, Akihiko Shimono, Yumiko Saga, and Hiroki Kokubo
Nature Communications. DOI:10.1038/NCOMMS1466
心臓は、発生過程において最も初期に形成される器官です。以前、心臓は発生初期に形成された心臓原基からすべての構造が形成されると考えられていましたが、最近、心臓原基の腹側領域にある細胞が、流出路から右心室にかけての領域を構成することが明らかとなりました。この細胞領域が二次心臓領域(Second heart field, SHF)、これまでの心臓原基は一次心臓領域(first heart field, FHF)と呼ばれています。二次心臓領域は心臓形成に寄与する心臓前駆細胞として認識されているのに対し、一次心臓領域はE7.5においてすでに心筋特異的分化マーカーを発現していることから、一次心臓領域に寄与する心臓前駆細胞は明らかにされていませんでした。また、刺激伝導系の一部を生み出す静脈洞についても、その前駆細胞については明らかになっていませんでした。
今回、Wntシグナルの負の制御因子であるSecreted frizzled-related protein (Sfrp)5 を発現する細胞の系譜解析を行なった結果、Sfrp5遺伝子を発現した細胞が、右心室以外の心筋と、静脈洞へと分化することから、右心室とそれ以外の心臓部分では、細胞系譜が異なること、またSfrp5発現細胞から刺激伝導系が生じる可能性が明らかになりました。今後Sfrp5遺伝子を発現する細胞の性質を詳しく解析することで、心房や心室を構成する心筋と、刺激伝導系を構成する特殊心筋の両心筋の誘導法が確立できることが期待されます。この研究は、以前発生工学研究室の助教であり現在は広島大学に所属する小久保博樹博士が、総研大の学生坂口あかねさんと推進した研究であり、遺伝研共同研究の成果となります。
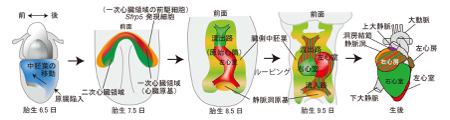
図 新たな心臓形成過程の模式図
胎生7.5日において、Sfrp5遺伝子が発現した細胞が左心室、心房の一部へと寄与する前駆細胞であること、また、Sfrp5遺伝子発現細胞の一部は、流出路と心房の一部へと寄与することを見出した。これまでの心臓形成のモデルを書きかえる重要な発見です。
「富澤純一先生を偲ぶ会」のご案内
去る2017年1月26日逝去されました国立遺伝学研究所長(第6代)富澤 純一 氏のお別れの会を、下記のとおり執り行いますので、謹んでお知らせいたします。
「富澤純一先生を偲ぶ会」
主催 「富澤純一先生を偲ぶ会」準備委員会
共催 国立遺伝学研究所、日本遺伝学会、日本分子生物学会
日時 平成29年4月22日(土) 午後2時から (午後1時 受付開始)
場所 三島市谷田1111 国立遺伝学研究所講堂
事前申込不要
問い合わせ 国立遺伝学研究所(荒木研究室)055-981-6756
アクセス http://www.nig.ac.jp/nig/ja/about-nig/access_ja
【富澤純一氏について】
富澤純一氏は、1947年に東京帝国大学を卒業後、国立予防衛生研究所化学部長、大阪大学教授、米国国立保健衛生研究所分子遺伝学部門部長を歴任した後、1989年に国立遺伝学研究所長に就任し、8年間に渡り、当研究所の発展に貢献されました。
研究面においては、細菌に感染するウイルス「T4ファージ」を用い遺伝的組換えがDNAの切断と再結合によって起こることの立証、プラスミド(環状2重鎖DNA)の試験管内での完全複製に初めて成功、DNAの複製開始がRNAによって制御されていることを示すなど、日本の分子生物学の草分けとして数々の業績を挙げられました。 これらの功績が認められ、日本学士院会員や全米科学アカデミー外国人会員に選出され、2000年には文化功労者に顕彰されました。日本分子生物学会の学会誌(英文学術誌)「Genes to Cells」では、初代編集長を1996年から2005年まで務めるとともに、若手研究者助成のための基金を寄付し、2011年から「富澤純一・桂子基金」として運用されています。
公募型共同研究・研究会「NIG-JOINT」採択結果について
中心体生物学 土屋さん、細胞建築 山本さん が「森島奨励賞」を受賞
総合研究大学院大学 遺伝学専攻が独自に行っている「森島奨励賞」の選考が、2016年度後期の学位申請者に対して行われ、
土屋裕樹さんと山本一徳さんが受賞しました。
・土屋裕樹(中心体生物学研究部門 北川研究室)
「The role of Cep295 in centrosome biogenesis of human cells」
・山本 一徳(細胞建築研究室 木村研究室)
「A study on inter-cellular forces for blastomere configurations in developing embryos」
授与式が2017年3月14日に行われ、桂専攻長から賞状と研究奨励金が贈られました。

森島奨励賞とは
総研大遺伝学専攻で優秀な研究成果を発表して学位を取得した学生に、その研究内容を称えるとともに今後のさらなる発展を促す目的で贈られます。遺伝学の先達
流行が作られるしくみ「同調現象」を、細胞の中で発見―細胞質流動の生成と逆転のメカニズム―
![]()
Endoplasmic Reticulum-Mediated Microtubule Alignment Governs Cytoplasmic Streaming
Kenji Kimura, Alexandre Mamane, Tohru Sasaki, Kohta Sato, Jun Takagi, Ritsuya Niwayama, Lars Hufnagel, Yuta Shimamoto, Jean-François Joanny, Seiichi Uchida, and Akatsuki Kimura
Nature Cell Biology (2017) DOI:10.1038/ncb3490
細胞内の流れ(細胞質流動)は、人間社会の流行のように気まぐれに逆転することがあります。情報・システム研究機構 国立遺伝学研究所の木村健二助教と木村暁教授らのグループは、この「流れ」の生成と逆転のメカニズムを、遺伝学と数理モデルを用いた解析により明らかにしました。この成果は3月14日(日本時間)に英国科学雑誌Nature Cell Biology に掲載されました。
人間社会の流行とは気まぐれなもので、いつのまにか多数派と少数派の逆転が起こります。流行の生成と逆転の原動力には、自らの意見や行動を周りの変化に合わせる「同調現象」が深く関わっています。興味深いことに、線虫の受精卵では細胞質流動の流れの向きが気まぐれに逆転します。細胞内の流れは微小管が作るレールの上を物質が運ばれることによって生じるので、レールが一方向にそろうとより大きな流れが生じます(図1)。
本研究では、細胞内に網目状に広がる小胞体が、微小管レールの方向性を同調させる「ネットワーク」の役割を担っていることを発見しました。さらに、微小管レールを人為的に長くすると流れの向きの逆転がほとんど起こらなくなることから、逆転の頻度が微小管レールの長さで決まることを突き止めました。すなわち、小胞体の動きが流れの同調効果を生み、微小管の長さが細胞質流動の逆転の頻度に影響するのです。
細胞質流動は動物胚の発生や植物の成長に重要な役割を果たしています。本研究は、細胞質流動の生成と逆転のメカニズムを明らかにしたことで、細胞質流動が関与する初期発生のしくみの解明につながると期待できます。また、同調やその逆転を細胞内で操作できることを明らかにしたことから、人間社会と自然界の両方で見られる同調現象のしくみを明らかにする良いモデルケースとなることも期待されます。
この研究は、国立遺伝学研究所の木村研究室と島本研究室、九州大学の内田研究室、仏キュリー研究所のJoanny研究室、EMBLのHufnagel博士との共同研究として行われました。本研究は文部科学省の科学研究費補助金、総研大若手教員海外派遣プログラム、日本学術振興会サマー・プログラムなどの助成を受けておこなわれました。
こちらで論文全文がご覧になれます。
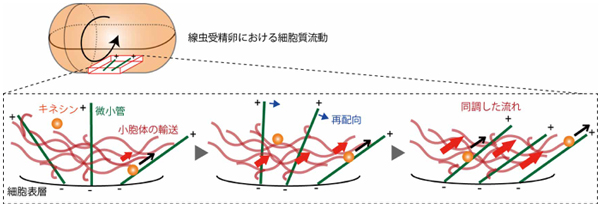
図1:細胞質流動を生むための小胞体を介した同調効果を示すモデル図
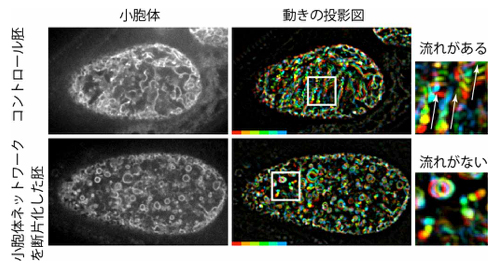
図2:線虫受精卵における小胞体とその動き
左列に線虫受精卵における小胞体の蛍光写真を示した(上段:正常胚、下段:小胞体の網目状構造を断片化した胚)。中列に連続写真の投影図を示した。動きを示すために各タイムポイントの蛍光像の色を変えて重ねて表示している。右列は白枠内の拡大図。流れの方向を矢印で示した。
トゲウオを用いて遺伝子発現の進化機構を解明
Different contributions of local- and distant-regulatory changes to transcriptome divergence between stickleback ecotypes.
Ishikawa, A., Kusakabe, M., Ravinet, M., Yoshida, K., Makino, T., Toyoda, A. Fujiyama, A., and Kitano, J.
Evolution. 71: 565-581(2017) DOI:10.1111/evo.13175
新しい環境へ適応進化するためには、遺伝子の発現量(RNA量)の変化が重要な役割を果たします。遺伝子発現量を変化させる突然変異には、大きく分けると、その遺伝子の近傍に突然変異が入るような近位変異と、遺伝子から離れた位置に突然変異が入るような遠位変異の二種類があります。近位と遠位のどちらが環境適応に重要なのかについては、古くから論争があり、進化生物学における大きな未解決問題の一つです。このたび生態遺伝学研究部門の石川麻乃助教と北野潤教授らのグループは、トゲウオ科魚類のイトヨを利用してこの問題に挑み、近位シス変異と遠位トランス変異のそれぞれの果たす役割に違いがあることを解明し、その成果を北米進化学会のEvolution誌に報告しました(http://onlinelibrary.wiley.com/doi/10.1111/evo.13175/full)。
イトヨでは、海に生息していた祖先型が河川に進出することで河川型が生まれました。我々は、まず海型と河川型間で脳内の多くの遺伝子の発現パターンが異なっていることを示したのちに、全ゲノムレベルでのeQTL解析(遺伝子発現量を制御する染色体上の位置を同定する手法)を実施しました。
その結果、環境適応には近位変異の方が重要である可能性を強く示唆する結果が得られました。逆に、遠位変異は適応進化の制約として働いていることが示唆されました。さらに、10%海水と100%海水の環境下ではeQTLが異なることなどを見出しました。
野外生物において、ここまで大規模にeQTLを実施したのは世界初であり、環境適応には近位変異の方が重要である可能性を強く示唆する成果であるとともに、複数の遺伝子を同時に変化させるホットスポットが環境依存的であることを示した成果は、環境変動への生き物の適応進化の起こりやすさについて考察する上で重要な知見を世に提示したものと思われます。類似の研究が他の分類群でも次々に実施されることが期待されます。
この成果は、東京大学大気海洋研究所、東北大学大学院生命科学研究科、国立遺伝学研究所比較ゲノム研究室との共同研究として実施されたものです。科研費 (JP23113007, JP23113001, JP221S0002, JP26870824)の支援を得て実施しました。
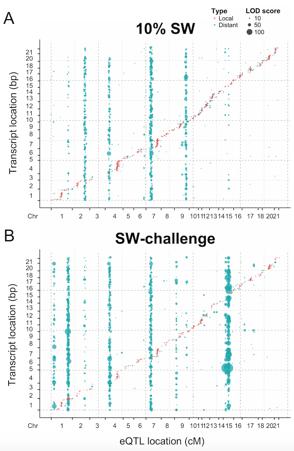
一つの点は有意なQTLを示す。横軸はマーカーの位置、縦軸は遺伝子の位置を表す。赤点は、遺伝子の発現量を制御する原因遺伝子座が近傍にあるものを、青点は、遺伝子の発現量を制御する原因遺伝子座が遠位にあるものを示す。縦に直線的に並んだ点は特定の遺伝子座が多くの遺伝子の転写発現を調節しているホットスポットを表している。上図は10%海水条件下、下図は100%海水条件下の結果を示す。ホットスポットのいくつかは明らかに環境依存的である。
【入札公告】電気・機械等設備保守業務
【入札公告】電気・機械等設備保守業務
遺伝研 一般公開 : 4月8日(土)開催 – 講演の動画を配信中
中心体生物学研究部門の北川教授が風戸賞を受賞


中心体生物学研究部門の北川大樹教授は、2017年3月4日風戸賞を受賞しました。
風戸賞は、電子顕微鏡並びに関連装置の研究・開発及び電子顕微鏡並びに関連装置を用いた研究(医学、生物学、物理学、化学、材料学、ナノテク、その他)において優れた業績を挙げた研究者に、公益財団法人 風戸研究奨励会が贈呈するものです。
受賞名:第十回(平成28 年度)風戸賞
受賞テーマ:「電子顕微鏡を用いた中心小体構造形成過程の解析」
総研大遺伝学専攻 見学会終了しました
小胞体内でタンパク質凝集を抑えるPIGNの新しい機能の発見
PIGN prevents protein aggregation in the endoplasmic reticulum independently of its function in the GPI synthesis
Shinji Ihara, Sohei Nakayama, Yoshiko Murakami, Emiko Suzuki, Masayo Asakawa, Taroh Kinoshita and Hitoshi Sawa
J Cell Sci 2017 130: 602-613; DOI:10.1242/jcs.196717
遺伝的変異や老化、様々なストレスによってタンパク質が正しい構造を獲得できないときに、不安定なタンパク質が凝集体を形成することが知られており、凝集体の形成は様々な神経変性疾患の発症に関わることが知られています。
私たちはC. elegansやヒト細胞を用いた解析から、小胞体に局在するPIGNタンパク質の異常によってタンパク質の凝集が引き起こされる事を見出しました。PIGNは糖脂質であるGPIアンカーの生合成に必要な酵素として知られていますが、我々は、PIGNがGPIアンカーの生合成に必要な酵素活性非依存的にタンパク質の凝集を抑える機能があること、すなわちPIGNがタンパク質の品質管理に関わること(非古典的機能と定義)を明らかにしました。またヒトではPIGN遺伝子の変異によってMultiple congenital anomalies-hypotonia-seizures syndrome1 (MCAHS1)と総称される知的障害・運動発達障害を示す遺伝子疾患を引き起こしますが、MCAHS1患者と同様の変異をCRISPR/Cas9 法によってC. elegansに導入したところ、タンパク質の凝集を引き起こすこともわかりました。この発見によって、タンパク質の凝集を抑える機構や遺伝子疾患の理解が更に進むものと期待できます。
本研究は、多細胞構築研究室にて伊原伸治助教が中心となり、鈴木えみ子准教授(遺伝子回路研究室)、大阪大学の木下タロウ教授、村上良子准教授の協力のもと行われました。
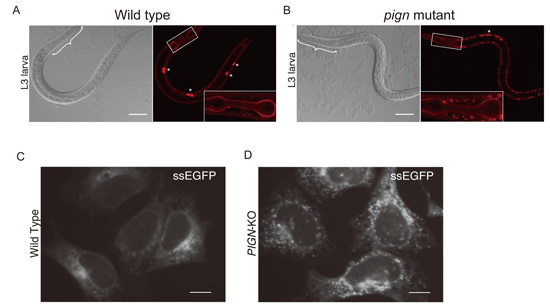
pign変異体で観察される凝集タンパク質
(A) 野生型線虫でのIV型コラーゲン(分泌タンパク質)の局在。(B) pign変異体で観察される凝集タンパク質。スケールバーは10um。凝集タンパク質は筋肉細胞内(白枠)にドット状に観察される。(CとD)分泌型EGFPを発現させた野生型HEK293細胞(C)とPIGN欠損HEK293細胞(D)。線虫のpign変異体と同様の凝集タンパク質が観察される。
3月1日付で3名の助教が着任
2017年3月1日付けで遺伝研に助教が3名着任しました.
- 吉場 聡子:中心体生物学研究部門・北川研究室
- 高橋 実鈴:植物遺伝研究室・佐藤研究室
- 川島 武士:生命ネットワーク研究室・有田研究室















