Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
「白」と「淡紅色」の花弁。サクラの新しい品種、遺伝研創立70周年を記念して命名
国立遺伝学研究所(遺伝研)の敷地内には、現在約220品種・500本の桜があります。これは、1950年頃に植物遺伝学者の竹中要(たけなか よう)博士が、遺伝学の研究と栽培品種の保存を目的に、桜を収集し植樹したことに由来します。

新しい品種は、2019年6月1日に創立70周年を迎えることを記念し、所内のメンバーによる投票を経て、「半兵衛白紅桜(はんべいしろべにざくら)」と命名されました。このサクラは、遺伝研で桜の研究が盛んに行われていた頃、いつの間にかこの地にて実生から発芽し、今日に至ります。空に向かってまっすぐ伸びる枝々に、「白い花弁」と「淡紅色の花弁」が咲き誇り、その特徴から、おそらくオオシマザクラとヤマザクラが自然交配して生じたものと思われます。
名前に付けた「半兵衛」とは、遺伝研の桜の収集と研究に多大なる貢献を果たした故・竹中要 博士の愛称です。また、所内投票では「『⽩紅』が花の様⼦が分かるので良い」「紅⽩とも重なり70周年を祝う意味で良い」という意⾒もみられたことから、「半兵衛白紅桜」と命名しました。
伸長から分裂への切り替えの仕組み
Division-site localization of RodZ is required for efficient Z ring formation in Escherichia coli
Yusuke Yoshii, Hironori Niki, Daisuke Shiomi
Molecular Microbiology 2019 DOI:10.1111/mmi.14217
細胞は伸長と分裂を繰り返しながら増殖するが、伸長と分裂はそれぞれ異なる仕組みで行われている。バクテリアでは、アクチン様タンパク質のMreBが伸長を制御し、チューブリン様タンパク質のFtsZが細胞分裂を行う。つまり、2種類の細胞骨格タンパク質の機能を交互に切り替えながら、バクテリアの細胞は分裂増殖している。伸長から分裂への転換時には、細胞分裂面でこの2つのタンパク質が直接作用し合い、伸長から分裂への切り替えが行われているらしい。しかし、細胞分裂面でこの2つのタンパク質の機能の切り替えを仲介する仕組みは謎であった。
立教大学の塩見グループではこれまでMreBと相互作用する因子RodZの解析を行ってきた。今回新たにRodZがFtsZに依存して分裂面に局在すること、その結果MreBを分裂面に呼び込むことを明らかにした。すなわち、RodZがMreBとFtsZの2つの細胞骨格タンパク質の分裂面での出会いを仲介していたのだ。実際、RodZが分裂面に来ないとFtsZによる分裂環(Zリング)形成が遅れてしまう。RodZはMreBを分裂面に呼び込むことで分裂環形成を促し、細胞伸長から分裂へのスムーズな切り替えを担っている。
本研究は遺伝研共同研究Aの支援を受け、立教大学の塩見大輔准教授と吉井佑介大学院生の研究チームと国立遺伝学研究所の微生物機能研究室で行われたものです。
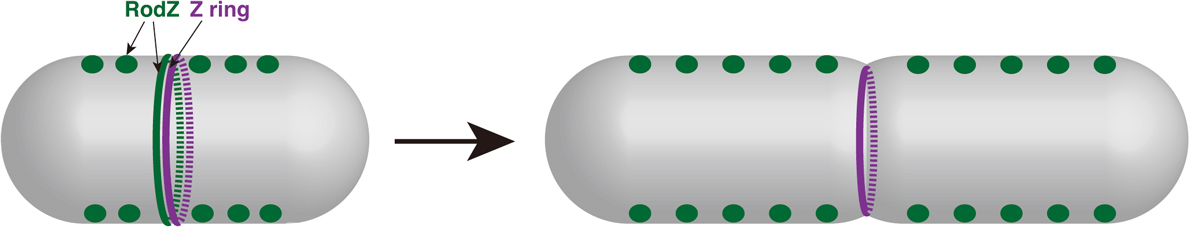
図:RodZの分裂面への局在が、効率的なZリング形成(=伸長から分裂への切り替え)を促進する
細胞内のダイナミックなクロマチン構造
Dynamic chromatin organization without the 30-nm fiber
Kazuhiro Maeshima, Satoru Ide and Michael Babokhov
Current Opinion in Cell Biology Volume 58, June 2019, Pages 95-104 DOI:10.1016/j.ceb.2019.02.003
真核生物のクロマチンはゲノムDNA、ヒストンや他のタンパク質からなる負に帯電した長いポリマーです。細胞内のクロマチンはどのような構造なのでしょうか? この10年多くの報告から、クロマチンは従来考えられてきたような、いわば結晶のような規則正しく折りたたまれた階層構造ではなく,ダイナミックで、不規則かつ流動的な構造であることがわかってきました。高等真核生物において、クロマチンは多数の塊(ドメイン)を作り、それを基本単位としてダイナミックに構造を変換しながら機能していると思われます。タンパク質のDNAへのアクセシビリティーを変化させることにより、クロマチンのダイナミックスは遺伝子の発現、 DNA複製、修復・組換えを含むさまざまなゲノム機能を支配しています。この総説論文ではゲノミックスとイメージングの最近の知見に基づき、生きた細胞におけるクロマチンの構造とダイナミクスとその生物学的役割を論じました。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST) (JPMJCR15G2)、日本学術振興会(JSPS) 科研費(16H04746)、武田科学振興財団の支援を受けました。
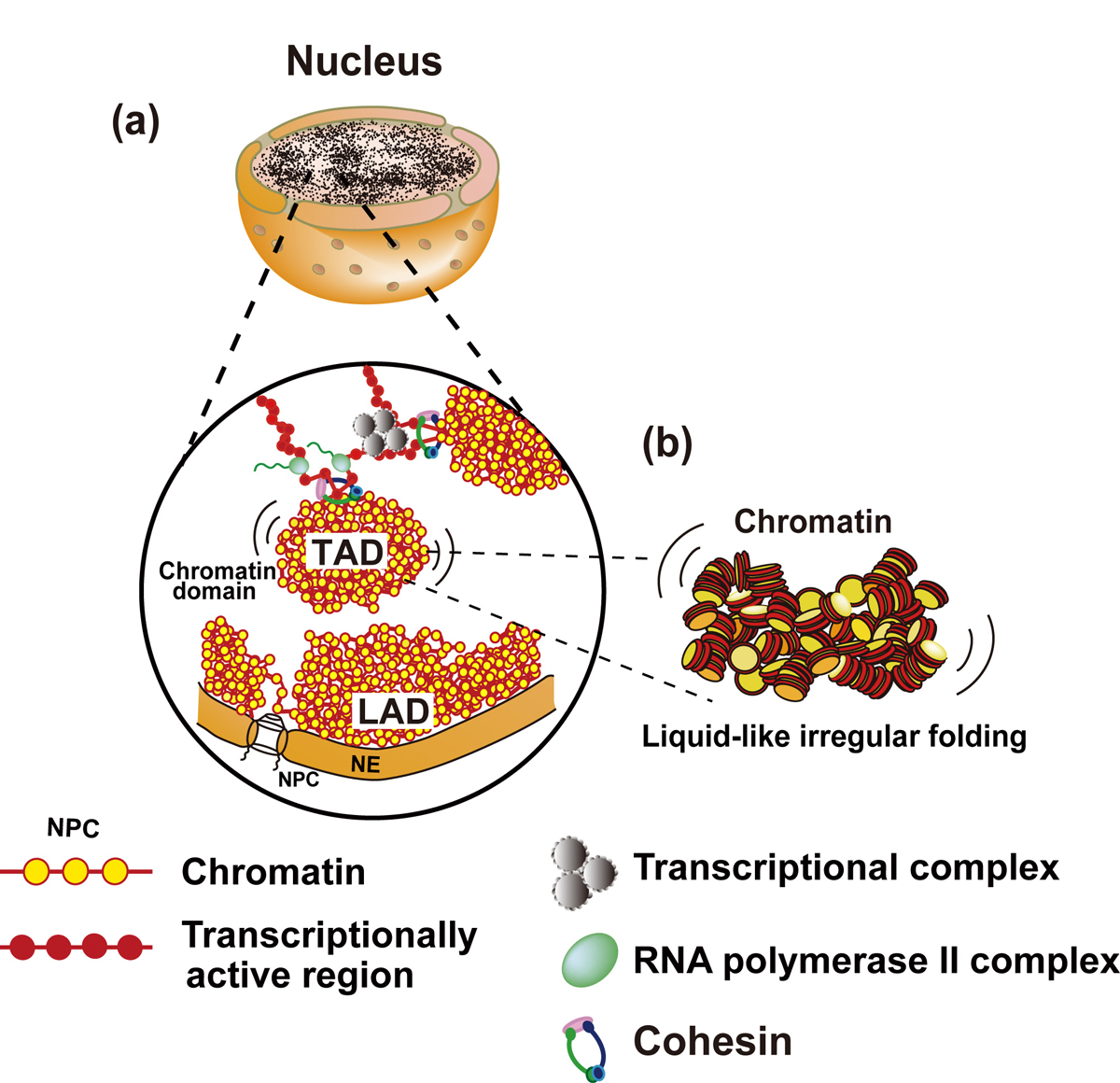
図:ヌクレオソーム線維(10-nm線維)がとても不規則な形で折り畳まれ、コンパクトなドメイン(TAD)を形成している。ドメインは大きく束ねるコヒーシンとヌクレオソーム同士の局所的な結合によって束ねられている。クロマチンのダイナミックスな構造は、規則性を持つ大きな構造に比べて、物理的な束縛が少なく、より動きやすい。ドメイン同士は転写装置によって緩く繋がれていると思われる。核膜NEに面した領域はLAD (lamina-associated domain)と呼ばれている。NPC, 核膜孔。
遺伝研での一時保育のご案内
遺伝研で提供する一時保育は3種類あります。
- 1. 遺伝研の一般公開、大学院入試、大学院説明会、遺伝研リトリートの時の一時保育
- 2. 遺伝研が勤務日なのに保育園や学童保育が休業する時の一時保育
- 3. 遺伝研研究会や遺伝研国際シンポジウムに参加する外部研究者に提供する一時保育
ご利用を検討される方は、下記ページをご覧ください。
https://sites.google.com/site/nigdanjo/4-day-care
この度、3.遺伝研研究会における一時保育が初めて開催されました。詳しくは下記の記事をご覧ください。
ゲノム進化研究室 東研究員が 第13回日本ゲノム微生物学会年会の若手賞を受賞

ゲノム進化研究室 東 光一 研究員が、3月6~8日に首都大学東京で開催された第13回日本ゲノム微生物学会年会にて、第13回日本ゲノム微生物学会若手賞を受賞しました。
▶ 受賞研究:微生物ゲノムと微生物群集構造の多様性に関する研究
▶ 受賞者一覧
東 研究員より受賞のコメントが届いておりますのでご紹介します。
| このたびは日本ゲノム微生物学会若手賞をいただき大変光栄に思います。これまでお世話になった、そして現在も共同研究などで楽しく議論させていただいている多くの先生方に厚く御礼申し上げます。大量のデータの中から面白い発見ができるよう、今後とも精進いたします。 |
▶ 学会HP:日本ゲノム微生物学会
▶ 研究室HP:ゲノム進化研究室
共生細胞進化研究室 大沼研究員が 日本藻類学会研究奨励賞、若手発表賞を同時受賞

共生細胞進化研究室 大沼 亮 研究員が、3月15~17日に京都大学で開催された日本藻類学会第43回大会にて、日本藻類学会研究奨励賞と、若手口頭発表賞を受賞しました。
第15回日本藻類学会研究奨励賞
▶ 課題名:渦鞭毛藻類Nusuttodinium属の盗葉緑体に関する研究
▶ 奨励賞受賞者一覧
若手発表賞(口頭、微細藻部門)
▶ 発表タイトル:渦鞭毛藻類Nusuttodiniumの盗葉緑体現象から紐解く細胞内共生の進化
大沼研究員より受賞のコメントが届いておりますのでご紹介します。
この度は、日本藻類学会研究奨励賞、若手発表賞をいただくことができ、大変光栄です。これらの賞を受賞できたのも、今までご指導、ご鞭撻をしてくださった方々のおかげだと思っています。皆様のご期待に沿える楽しい研究ができるよう、これからもますます精進していく所存です。
▶ 学会HP:http://sourui.org/index.html
▶ 研究室HP:共生細胞進化研究室
▶ インタビュー:ポスドクインタビュー
ゲノムダイナミクス研究室 佐々木さんが「森島奨励賞」を受賞

総合研究大学院大学 遺伝学専攻が独自に行っている「森島奨励賞」の選考が、2018年度後期の学位出願者に対して行われ、 ゲノムダイナミクス研究室 前島研究室に所属する佐々木飛鳥さんが受賞しました。
・佐々木飛鳥(ゲノムダイナミクス研究室 前島研究室)
「Analysis of telomeric chromatin using pyrrole-imidazole polyamide probe」
授与式が2019年3月12日に行われ、花岡専攻長から賞状と研究奨励金が贈られました。
森島奨励賞とは
総研大遺伝学専攻で優秀な研究成果を発表して学位を取得した学生に、その研究内容を称えるとともに今後のさらなる発展を促す目的で贈られます。遺伝学の先達
新スーパーコンピュータシステムの稼働開始のお知らせ
国立遺伝学研究所は、株式会社日立製作所の協力のもとスーパーコンピュタシステムをリニューアルし、本日( 3月 5日)から稼働を開始します。
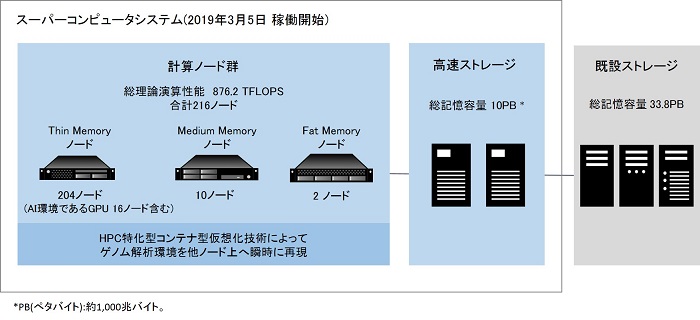
本システムは、高い演算性能や大規模なストレージ環境を有しており、世界中の研究者が塩基配列データを登録する国際塩基配列データベースをはじめ、ゲノム関連の各種データベースを構築するITインフラとしても活用されます。さらに、AIによる高度な解析環境や、高いセキュリティ環境なども提供することで、Society5.0 がめざすゲノム医療による研究に寄与し、一人ひとりの特性に合わせた病気の治療や予防を行う、個別化医療などの実現に貢献するものです。
遺伝子が転写される際のDNAの「動き」を生きた細胞の中で捉えた!
![]()
Single nucleosome imaging reveals loose genome chromatin networks via active RNA polymerase II
Ryosuke Nagashima, Kayo Hibino, S. S. Ashwin, Michael Babokhov, Shin Fujishiro, Ryosuke Imai, Tadasu Nozaki, Sachiko Tamura, Tomomi Tani, Hiroshi Kimura, Michael Shribak, Masato T.Kanemaki, Masaki Sasai, and Kazuhiro Maeshima
Journal of Cell Biology Published March 1, 2019 DOI:10.1083/jcb.201811090
JCBの注目論文として解説論文Spotlightが掲載されました
私たちの体は約40兆個の細胞からできています。そして、それぞれの細胞には全長約2メートルにも及ぶ生命の設計図ヒトゲノムDNAが収納されています。DNAの収納構造については、近年、多くのことが分かってきた一方で、生きた細胞でのDNAのふるまい(動き)についてはほとんど分かっていませんでした。
このたび、情報・システム研究機構 国立遺伝学研究所・永島崚甫総研大大学院生・日比野佳代助教・前島一博教授らのグループは、名古屋大学大学院工学研究科・S.S. Ashwin特任助教、笹井理生教授と共同で、光学顕微鏡の分解能を超える超解像蛍光顕微鏡を駆使することで、生きた細胞内のDNAの動きを観察することに成功しました(図1、動画1)。一般に、ゲノムDNAの遺伝情報が読み出される転写が起きる際、DNAを含む高次構造であるヌクレオソームは緩くなり、よりダイナミックに動くと考えられてきました。しかし本研究で調べたところ、転写を阻害するとDNAの動きが逆に活発化することが明らかになりました(図1C、動画2)。さらに、転写の際にDNA上で働くRNAポリメラーゼIIや他の転写因子が塊(ハブ)を作ってDNAの動きを抑える様子が示されました(図2)。この結果は、ハブを作ることでゲノムDNAは連結されてネットワーク化し、DNAの動きを抑え、効率的に転写を行う可能性を示唆するものです。
研究体制と支援
本研究成果は、国立遺伝学研究所・ゲノムダイナミクス研究室(永島崚甫総研大大学院生、日比野佳代助教、Michael Babokhov研究員、田村佐知子テクニカルスタッフ、野崎慎学振特別研究員、今井亮輔元総研大生、前島一博教授)、名古屋大学大学院工学研究科(S.S. Ashwin特任助教、藤城新大学院生、笹井理生教授)、東京工業大学(木村宏教授)、国立遺伝学研究所・分子細胞工学研究室(鐘巻将人教授)、ウッズホール海洋生物学研究所(Michael Shribakチームリーダー、谷知己チームリーダー)の共同研究成果です。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST) (JPMJCR15G2)、日本学術振興会(JSPS) 科研費(16H04746)、武田科学振興財団、RIKEN Pioneering Project、NIG-JOINT(2016-A2 (6))、 総研大2017年度学生派遣事業の支援を受けました。
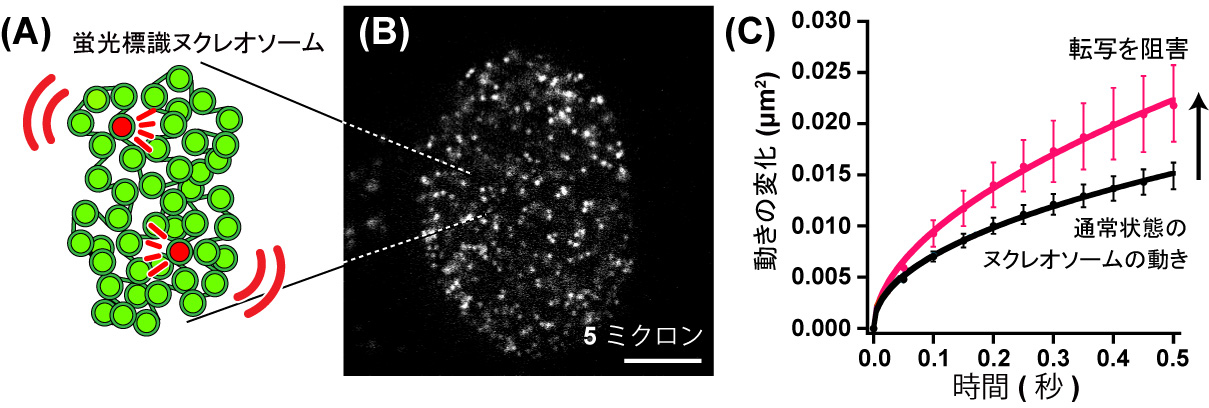
図1:(A)少数の蛍光標識されたヌクレオソーム(赤)。詳しくは、「研究の背景」を参照。それらに注目することで個々のヌクレオソームの動きを調べることができる。(B)超解像蛍光顕微鏡による核内のヌクレオソーム画像。1個1個のドットが1個1個のヌクレオソームを示している。(C)転写を阻害するとヌクレオソームの動きが上昇する(赤線)。黒線が通常状態のヌクレオソームの動き。ヌクレオソームの動きは「平均二乗変位」という量で表されている。
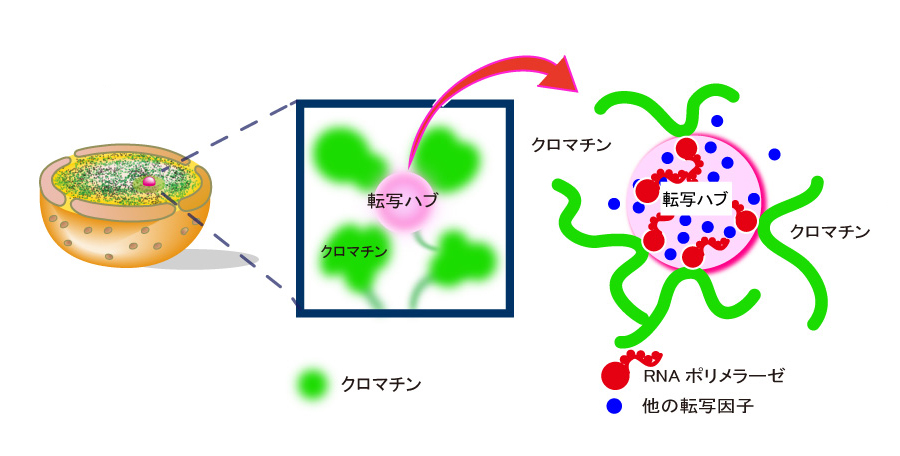
図2:細胞の核(左)の中で転写が起きる際、DNA上で働くRNAポリメラーゼII(赤)や他の転写因子(青)が塊(ハブ、ピンク色)を作ってクロマチンの動きを抑える(中央、右)。細胞核内のクロマチンは転写が起きる場所をハブとし、緩いネットワークを作っていると考えられる(右)。
動画1:超解像蛍光顕微鏡による核内のヌクレオソームの動きの動画。通常状態の細胞内のヌクレオソームの動き。1個1個のドットが1個1個のヌクレオソームを示している。1コマ50ミリ秒。
動画2:転写を阻害した際のヌクレオソームの動きの動画。通常の状態と比べて、ヌクレオソームの動きが活発化していることが分かる。1コマ50ミリ秒。















