Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
バクテリアにおける多コピーゲノムの複製制御と意義
Coordination of polyploid chromosome replication with cell size and growth in a cyanobacterium.
Ryudo Ohbayashi, Ai Nakamachi, Tetsuhiro Hatakeyama, Yu Kanesaki, Satoru Watanabe, Taku Chibazakura, Hirofumi Yoshikawa, and Shin-ya Miyagishima
mBio 10(2), e00510-19 DOI:10.1128/mBio.00510-19
ゲノムの倍数化は原核、真核生物問わず、全ての生物において共通して見られる現象です。大腸菌のようなモデル原核生物は1細胞あたり1コピーの環状染色体をもつ1倍体ですが、原核生物の複数の系統において1細胞あたり複数コピーの染色体をもつ倍数体生物の存在が知られています。また倍数性の原核生物の多くが、高温条件下など高ストレス環境に生息しています。倍数性生物において、染色体コピー数と細胞サイズに正の相関関係があることが知られていましたが、多コピー存在する染色体の複製がどの様に制御されているのか、複数コピーのゲノムを維持することによってもたらされるメリットは不明でした。
今回私たちは1細胞あたり複数コピーの染色体を保持するシアノバクテリア(光合成を行うバクテリア)の一種(Synechococcus elongatus; 1細胞当たり3-6コピー)を用いて細胞成長速度と染色体複製の関係を解析しました。その結果、複数存在する染色体のすべてが同時に複製されることは無く(図1)、成長速度に応じて一度に複製される染色体の数が変化することがわかりました。またDnaAという複製開始因子の活性調節によって複製される染色体数が制御されていることも明らかとなりました。さらに、DnaAを改変して人為的に細胞当たりの染色体コピー数を増加させるさせたところ、UVへの耐性が上昇することもわかりました。
以上のことから、複製する染色体のコピー数を細胞成長速度にあわせて変化させることで、細胞体積あたりの染色体数(遺伝子コピー数)を一定に保つことができること(図2)、複数コピーの染色体は、UV及び光合成酸化ストレスなどによりダメージを受けたゲノムコピーの修復のためのバックアップ情報として機能していることが示唆されます。
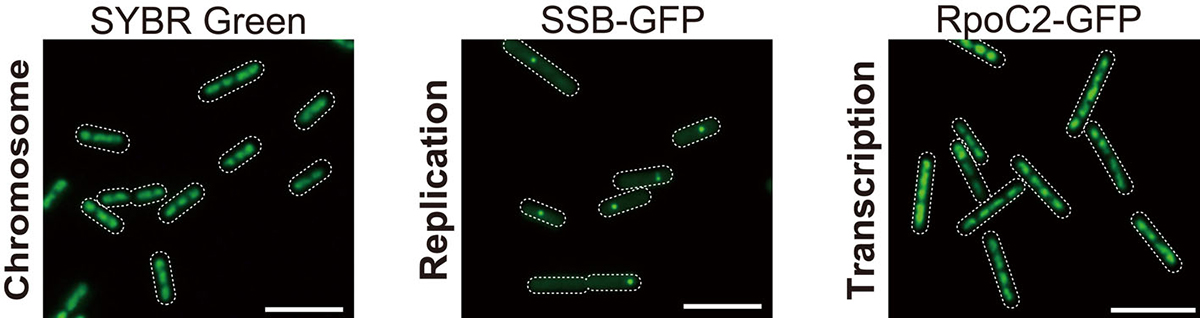
図1:シアノバクテリア(S. elongatus)の染色体(SYBR Green染色;1細胞あたり3-6コピーの染色体)とSSB-GFP(複製中の染色体)、RNAポリメラーゼ(転写中の染色体)の細胞内局在。遺伝子発現はすべての染色体コピーから行われるが、複製は1コピーずつ行われる
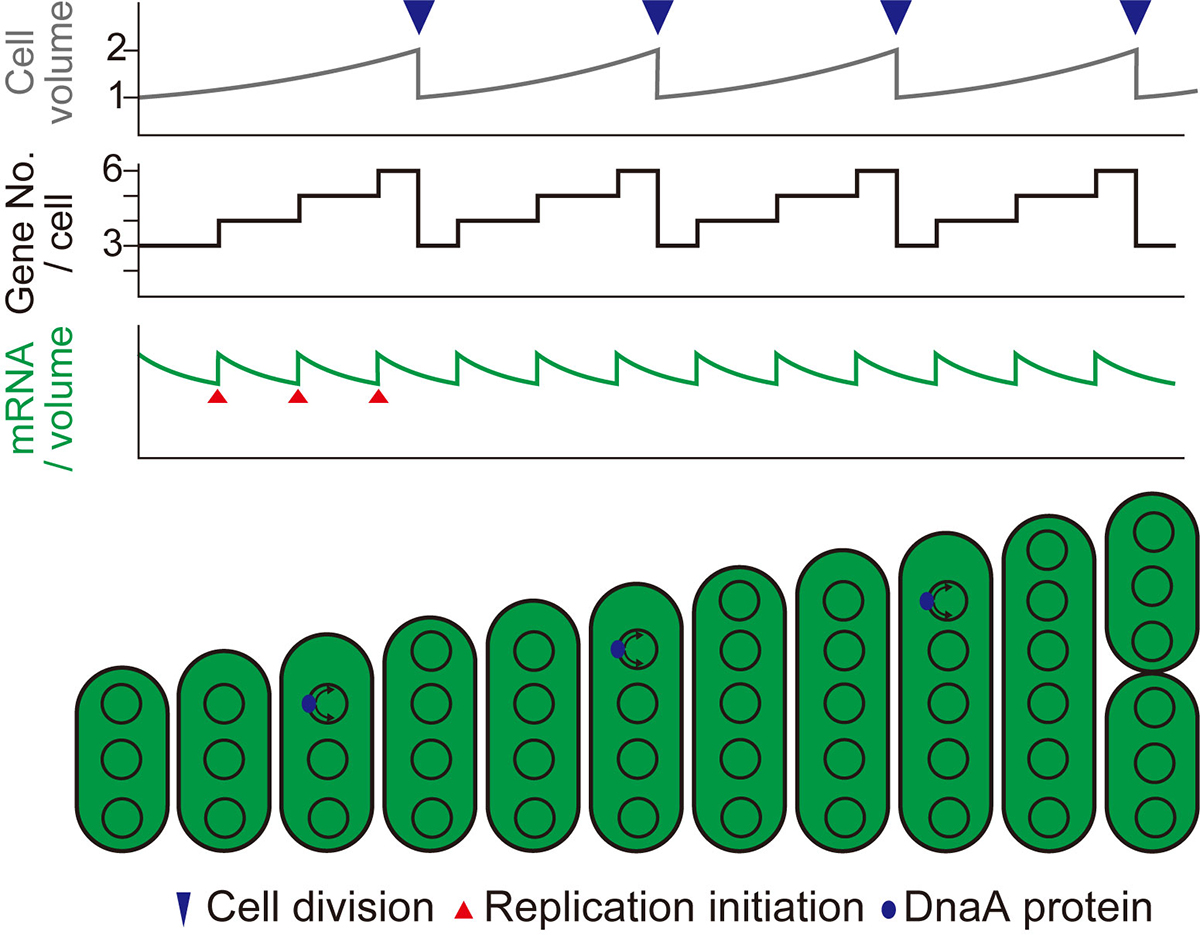
図2:細胞成長に伴う、1細胞あたりの遺伝子コピー数と細胞体積あたりのmRNAレベルの変化。細胞の成長速度に合わせて染色体コピー数が増加することにより、細胞体積当たりの遺伝子コピー数とmRNA量がほぼ一定に保たれる。
海から川や湖へ!魚の淡水進出を支えた鍵遺伝子の発見 ― DHAを自分で合成すれば、海から離れても生きられる ―
![]()
A key metabolic gene for recurrent freshwater colonization and radiation in fishes.
Asano Ishikawa, Naoki Kabeya, Koki Ikeya, Ryo Kakioka, Jennifer N. Cech, Naoki Osada, Miguel C. Leal, Jun Inoue, Manabu Kume, Atsushi Toyoda, Ayumi Tezuka, Atsushi J. Nagano, Yo Y. Yamasaki, Yuto Suzuki, Tomoyuki Kokita, Hiroshi Takahashi, Kay Lucek, David Marques, Yusuke Takehana, Kiyoshi Naruse, Seiichi Mori, Oscar Monroig, Nemiah Ladd, Carsten J. Schubert, Blake Matthews, Catherine L. Peichel, Ole Seehausen, Goro Yoshizaki, and Jun Kitano.
Science 31 May 2019: Vol. 364, Issue 6443, pp. 886-889 DOI:10.1126/science.aau5656
魚は、海から川や湖などの淡水域へ何度も進出しながら、さまざまな形や性質をもつ種に進化していきました。海と淡水域は、栄養分や浸透圧などに大きな違いがあるため、一部の魚は淡水域に何度も進出する一方で、全く淡水域に進出できない魚も多くいます。しかしながら、その違いは分かっていませんでした。
この度、情報・システム研究機構 国立遺伝学研究所の石川麻乃助教と北野潤教授らの国際共同研究チームは、進化生物学のモデル生物であるトゲウオを用いて、魚が海から淡水域へ進出する際に鍵となった遺伝子を発見しました。
鍵となった遺伝子は、必須脂肪酸「ドコサヘキサエン酸 (DHA)」を作るのに必要なFads2遺伝子でした。DHAは、本来、海の餌には多く含まれますが、淡水域の餌にはあまり含まれていません。本研究チームは、淡水域に進出したトゲウオでは、このDHAを作るのに必要なFads2遺伝子が増えているため、DHAの少ない淡水の餌でも生きられることを発見しました。Fads2遺伝子は、他の幅広い種類の魚でも、海水に生息する種に比べ、淡水域に進出した種で増えていたことから、魚の淡水域への進出の鍵となる役割を果たしてきたと考えられます。
本研究は、国立遺伝学研究所、東京海洋大学、アクアトト岐阜、フレッドハッチンソン癌研究所、北海道大学、スイス連邦水科学技術研究所、沖縄科学技術大学院大学、京都大学、龍谷大学、福井県立大学、水産大学校、ベルン大学、基礎生物学研究所、岐阜協立大学、スペイン水産養殖研究所からなる共同研究チームによっておこなわれました。
本研究は科研費(15H02418, 23113007, 16H06279, 26870824, 16K07469)、旭硝子財団助成金、住友財団助成金、学術振興会特別研究員奨励費(11J04816 ,16J06812)、スイス連邦水科学技術研究所内部資金、スイス連邦科学基金などの助成のもと実施されました。
この成果は2019年5月31日(米国東部標準時)に米国科学雑誌「Science」に掲載されました。
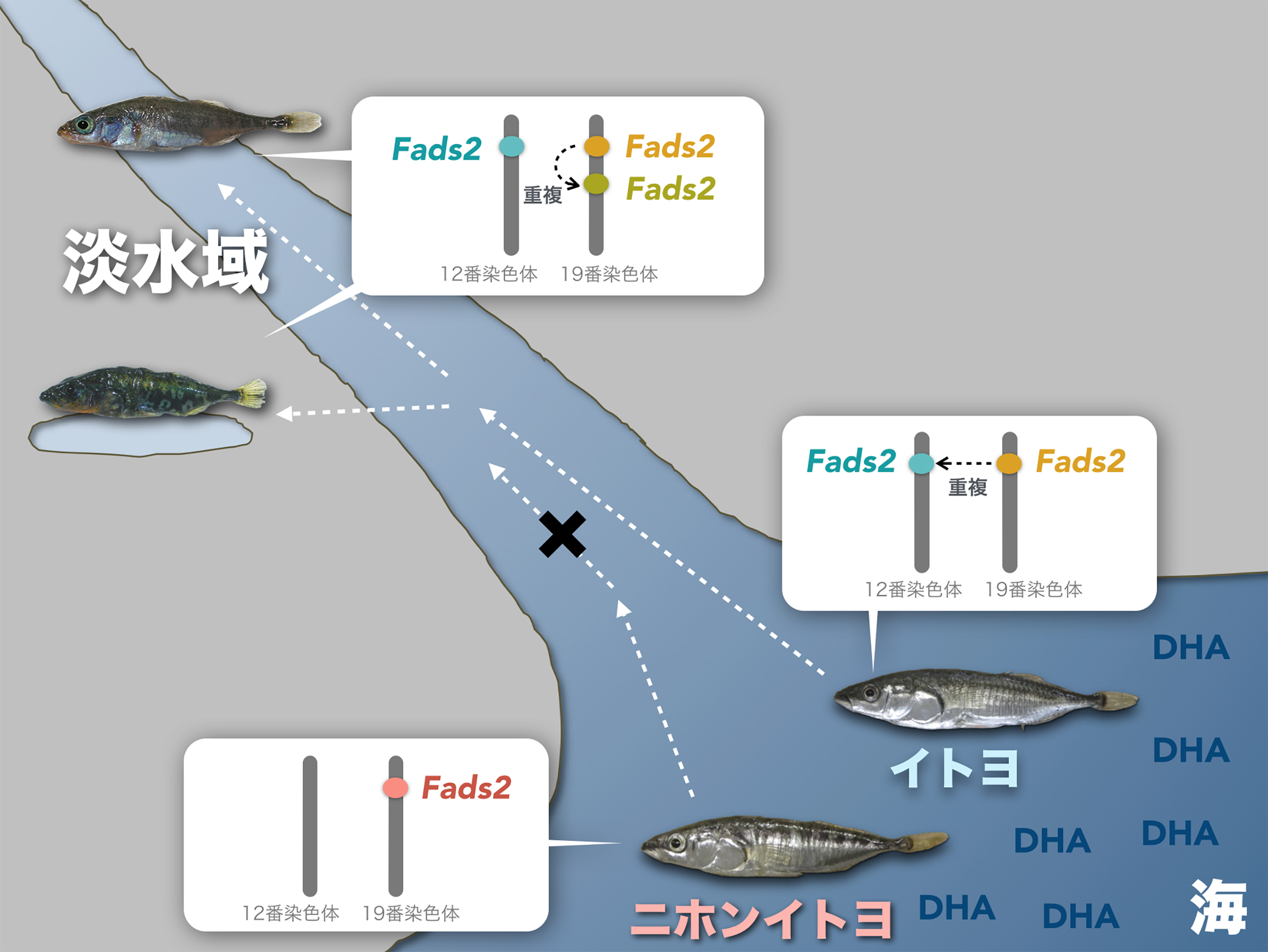
図:イトヨの淡水域への進出とDHA合成酵素Fads2遺伝子の増加
淡水域に進出できなかったニホンイトヨは19番染色体上にFads2遺伝子を1つしか持たないのに対し、淡水域に進出したイトヨは、19番染色体上と12番染色体上に2つのFads2遺伝子を持つ。淡水域に進出し、そこで一生を過ごすようになったイトヨでは、19番染色体上のFads2遺伝子がさらに増加している。
※EurekAlert!で本成果を紹介した記事を配信しています
染色体分配装置の硬さと柔らかさ
Mechanically distinct microtubule arrays determine the length and force response of the meiotic spindle
Jun Takagi, Ryota Sakamoto, Gen Shiratsuchi, Yusuke T. Maeda, Yuta Shimamoto
Developmental Cell, Vol 49, pp 267-278, 2019 DOI:10.1016/j.devcel.2019.03.014
国立遺伝学研究所の島本勇太准教授と九州大学理学部の前多裕介准教授らの研究チームは、物理と生化学を融合した新しい研究手法を使って、紡錘体と呼ばれる染色体分配装置が機械的な力を発生・享受しながら細胞内で安定して機能するしくみの一端を明らかにしました。この研究成果はDevelopmental Cell誌に掲載され、また同誌の紹介記事にハイライトされました。
私たちのからだを構成する細胞が分裂して自己を複製するためには、コピーされた遺伝情報を親細胞から娘細胞へ正確に受け渡す必要があります。この受け渡しは紡錘体と呼ばれる染色体の分配装置が細胞内で力を発生することによって行われていますが、紡錘体がどのようにして力を出したり感じたりしながら染色体を正確に分配しているかは分かっていませんでした。島本准教授らの研究チームは、ガラスを微細加工して作成した直径1ミクロン程の探針を使って紡錘体を直接触り、赤道面や極など、紡錘体の各部がそれぞれどのくらいの力を出し、また力を感じて変形することができるかを詳細に調べました(図1A)。その結果、紡錘体は不均質な機械的性質を持ち、特に赤道面と極の近傍は非常に硬く変形しづらいこと(図1B黄色の領域)、それに比べて赤道面と極の間の部分は柔らかく変形しやすいことが分かりました(図1B水色の領域)。紡錘体の赤道面や極を作っている構造は、染色体を引っ張るための足場となったり細胞の分裂軸を決めたりするのに重要な役割を担っています。一方で、紡錘体は自らのサイズを細胞に合った大きさで維持するために、赤道面と極の間の距離を適切に制御する必要があります。紡錘体が持つ機械的な不均質性は、赤道面と極の構造を堅牢に保ちながらも全体の長さを柔軟に調節するしくみを良く説明します。本研究は、紡錘体の物性が細胞分裂に必要な多くの機能を同時に実現するために最適化されていることを示唆するものであり、胚発生などで染色体の分配エラーが生じる仕組みを理解するための重要な発見であると考えられます。
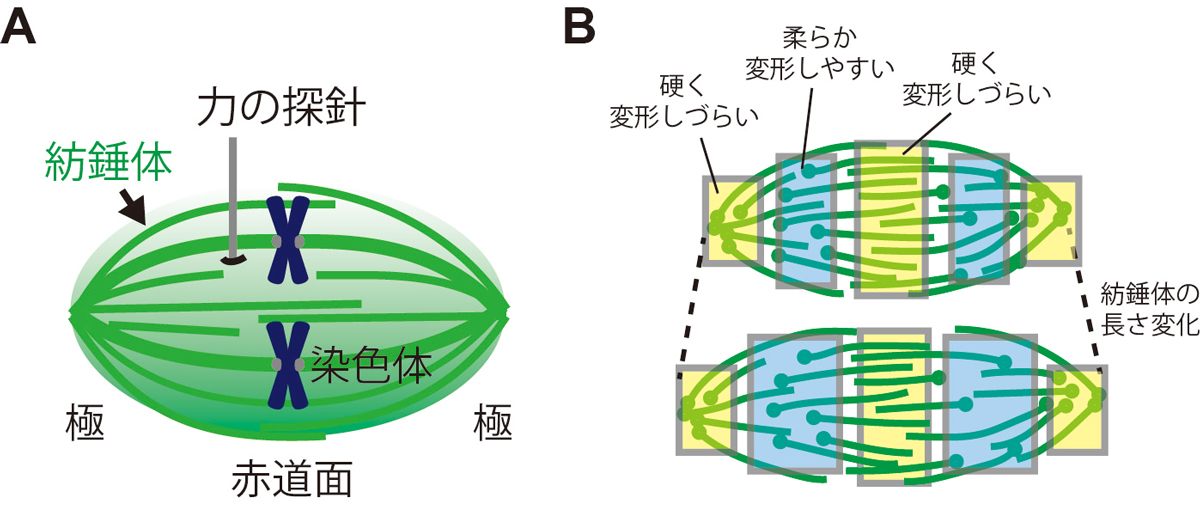
図:(A)ガラスを微細加工して作製した力の探針を使って、紡錘体の発生力と硬さを局所計測した。(B)紡錘体は不均質な機械特性を持ち(色付けされた領域)、極と赤道面の構造を硬く維持しながら全体の長さを柔軟に変化させられることが分かった(点線)。
発生工学研究室 島田さんが第52回発生生物学会 ベストポスター賞を受賞

相賀研究室 島田龍輝(総研大遺伝学専攻D5)さんが、先日大阪で開催された 第52回発生生物学会年会でベストポスター賞を受賞しました。
学会日時:平成31年5月15-17日
会場:大阪国際交流センター
受賞日:平成31年5月16日
演題:Exploring the murine germ cell masculinization mechanism
using scRNA-Seq datathe 52nd Annual Meeting of JSDB
島田さんより受賞のコメントが届いておりますのでご紹介します。
1細胞内での遺伝子発現を解析するsingle cell RNA-seq (scRNA-seq)という技術を使用し、
マウス生殖細胞の発生を理解することを目的とした研究でposter賞をいただきました。
研究室のサポートのおかげでscRNA-seqを取り入れ、解析できていることに感謝いたします。
また、遺伝研での発表手法に関する講義や議論のおかげで議論を深めることができました。
遺伝研所長 花岡文雄、瑞宝中綬章を受章

国立遺伝学研究所の花岡文雄所長が、令和元年度春の叙勲において瑞宝中綬章を受章することが決まりました。
▶ 所長挨拶ページへ
(略 歴)
昭和48年 東京大学大学院薬学系研究科 博士課程修了
昭和48年 東京大学薬学部 助手(生理化学教室)
昭和55年 東京大学薬学部 助教授(生理化学教室)
平成 元年 理化学研究所 主任研究員(放射線生物学研究室 → 花岡細胞生理学研究室)
平成 7年 大阪大学細胞生体工学センター 教授(細胞構造研究分野)
理化学研究所中央研究所 招聘主任研究員(兼務:平成18年3月まで)
平成14年 大阪大学大学院生命機能研究科教授(時空生物学講座)
平成19年 学習院大学理学部教授(化学科)
平成21年 学習院大学理学部教授(生命科学科)
平成28年 学習院大学定年退職
平成28年 筑波大学生命領域学際研究センター センター長
平成30年 筑波大学生存ダイナミクス研究センター センター長
国立遺伝学研究所 所長
遺伝子から続々解明される縄文人の起源~高精度縄文人ゲノム~
![]()
Late Jomon male and female genome sequences from the Funadomari site in Hokkaido, Japan
著者:神澤 秀明(国立科学博物館),Timothy A. Jinam(国立遺伝学研究所),河合洋介(東京大学),佐藤丈寛(金沢大学),細道一善(金沢大学),田嶋敦(金沢大学),安達登(山梨大学),松村博文(札幌医科大学),Kirill Kryukov(東海大学),斎藤成也(国立遺伝学研究所),篠田謙一(国立科学博物館)
雑誌:Anthropological Science
縄文人は、日本列島で16,000年前から3,000年前まで続いた縄文時代の狩猟採集民であり、縄文人の遺伝子はわたしたち日本人に引き継がれています。縄文人は東南アジアあるいは北東アジア起源と考えられてきました。しかしながら、縄文人の起源と成立の詳細については、今日まで明らかにされていませんでした。
国立科学博物館、情報・システム研究機構 国立遺伝学研究所、東京大学、金沢大学、山梨大学、札幌医科大学、東海大学の7研究機関からなる共同研究グループは、北海道礼文島の船泊遺跡から出土した約3,800年前の縄文人の全ゲノムを高精度で解読することで、縄文人の起源と成立の詳細を明らかにすることに挑みました。
本研究グループは、北海道礼文島の船泊遺跡から出土した縄文人のうち、最も保存状態がいいことがわかった男女2人の大臼歯からDNAを抽出し、全ゲノム分析を行いました。その分析の結果、全ゲノム配列を高精度で決定することに成功したのです。決定した高精度ゲノム配列を詳細に調べることで、HLAタイプ、疾患関連遺伝子の変異など、複数の形質を明らかにしました。これらの古代ゲノム情報から縄文人は狩猟、漁撈が生業活動の中心であったこと、小さな集団で生活していたことがわかりました。また、縄文人は、アメリカ先住民を含む東ユーラシア集団の中で最も古い時代に分岐したことがわかりました。その一方で、縄文人はウルチ、韓国人、台湾先住民、オーストロネシア系フィリピン人と遺伝的に近かったのです(図)。このことは東ユーラシアの地域集団の形成プロセスを知る重要な手掛かりになります。
今後、本研究で明らかになった高精度の縄文人ゲノムは、古代日本人DNA研究の基本となる参照配列になることに加えて、縄文人と弥生人の混血によって形成されたと考えられる現代日本人の成り立ちの詳細を理解するうえで重要な情報を提供することが期待されます。
本成果は日本人類学雑誌英文誌「Anthropological Science」に2019年5月下旬に掲載されます。
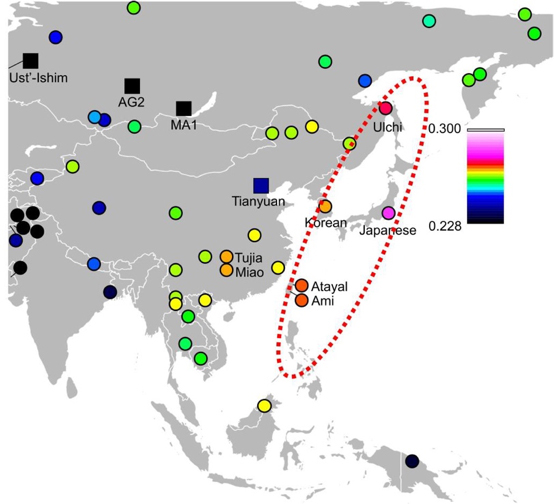
図:船泊縄文人と世界中の現代・古人との遺伝的親和性。縄文人と東アジア沿岸部周辺現代人の間に遺伝的親和性があることを示しています。
オーキシンデグロン(AID)法のためのCRISPR/Cas9を利用した新規タグ導入と分解阻害剤の開発
Generation of conditional auxin-inducible degron (AID) cells and tight control of degron-fused proteins using the degradation inhibitor auxinole
Aisha Yesbolatova, Toyoaki Natsume, Ken-ichiro Hayashi, Masato T. Kanemaki
Methods Available online 24 April 2019 DOI:10.1016/j.ymeth.2019.04.010
当研究室は植物ホルモンオーキシンによる分解経路を非植物細胞に移植することにより、オーキシンデグロン(auxin-inducible degron:AID)法を開発しました。ヒト細胞においては、植物由来のデグロン(mAID)を付加したタンパク質は、オーキシン添加に伴い、15-45分の半減期で分解されます。
私たちは以前CRISPR/Cas9を利用してHCT116細胞内の目的タンパク質C末端にタグを付加する方法を報告しました(Natsume et al. Cell Reports, 2016)。この度、総研大生Aisha Yesbolatovaを中心として、新たに目的タンパク質のN末端にタグを導入するベクターを開発し、HCT116およびDLD1細胞においてAID変異株を作成する方法の詳細なプロトコルを発表しました(図1)。
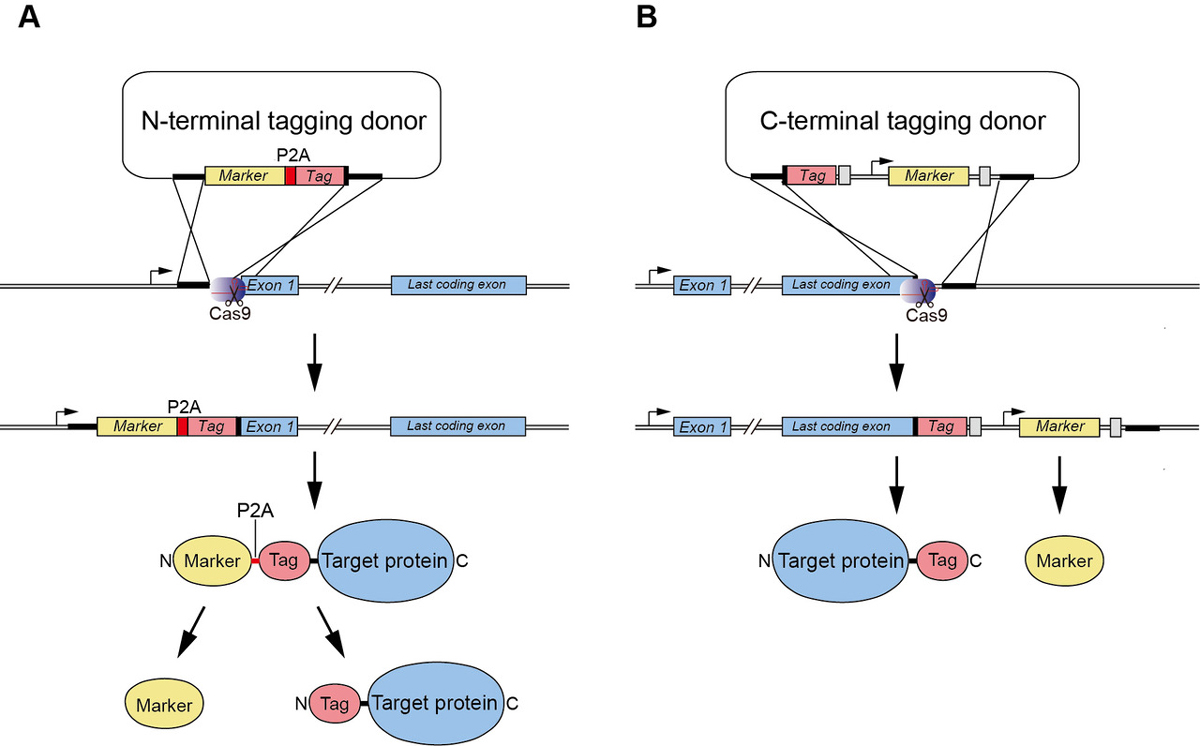
図1:(A)新たに開発したCRISPR/Cas9を利用したN末端コード領域へのタグ付加方法。(B)C末端コード領域へのタグ付加方法。
さらに、分解阻害剤オーキシノールを開発し、これによりオーキシン非添加時におきる弱い分解を抑制できることを示しました(図2)。また、標的タンパク質分解後の再発現時にオーキシノールを添加すること、より迅速に再発現が可能になることもわかりました。
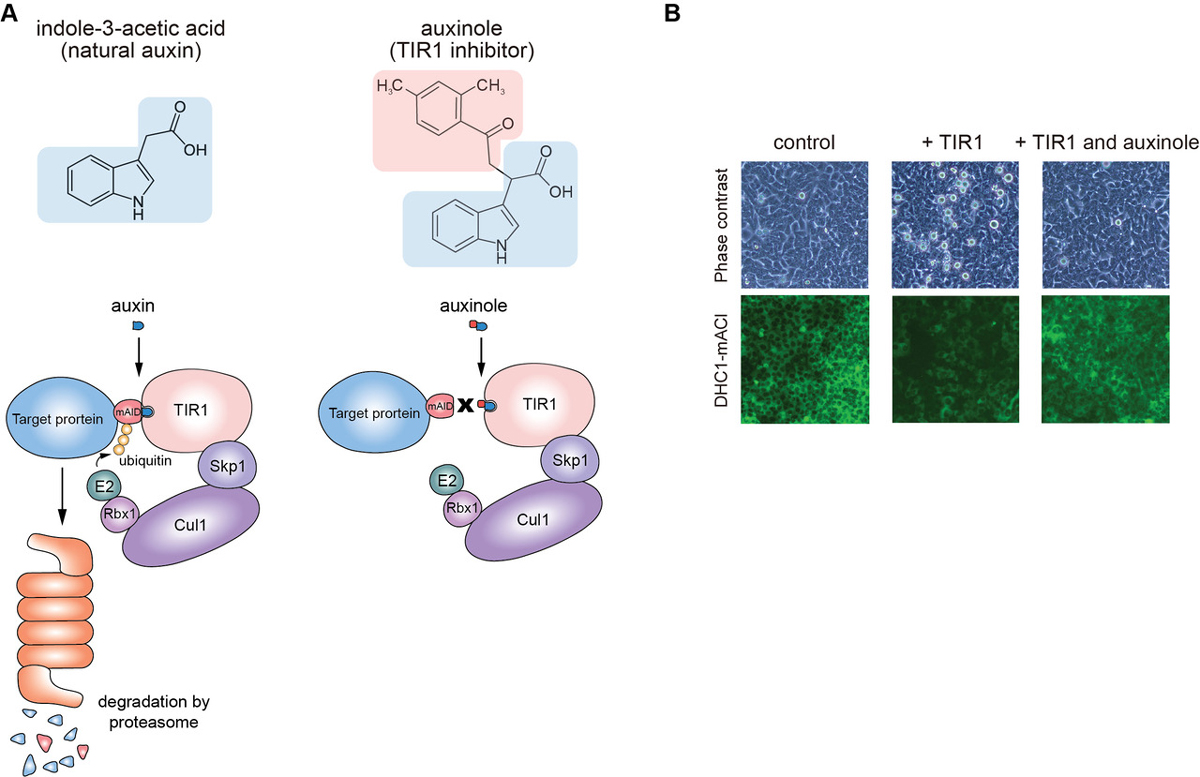
図2:(A)天然オーキシンIAAおよびオーキシノールの構造。これら化合物が働く作用機序を示す。(B)AIDタグを付加したダイニンサブユニットDHC1はTIR1の発現により、弱い分解を受けてしまう。この分解をオーキシノールは抑制することができる。
これら一連の技術改良は、ヒト細胞におけるAID法の利用促進とタンパク質機能解析研究に大いに役立つと期待されます。本論文に示したプラスミド材料は全てaddgeneおよびRIKEN BRCより入手可能です。
本研究は岡山理科大学・林謙一郎教授との共同研究としておこなわれました。本研究は科研費(17K15068, 18H02170 ,18H04719), JST A-STEP (AS2915150U), キヤノン財団、旭硝子財団、武田科学財団にサポートされました。
RinkaiHackathon2019 with DDBJingを開催:6月10-12日
DDBJの主催するDDBJingの一環として、 RinkaiHackathon2019 with DDBJingを開催します。本年は島根大学との共催で、開催場所は隠岐の島にある隠岐臨海実験所です。
今回のテーマは「機械学習を生物学的ビッグデータ(動物の模様、行動のビデオデータ、ゲノムなど)に適用したとき、何が見えるのか?」です。最近、しばしば話題になる機械学習の基礎を専門家に学び、3日間の実習でひろくデータサイエンスのエッセンスを実際に一緒に体験しましょう。これら解析実習を行うと同時に、実習期間中には、技術の進展によっては変わらない古典的な生物学の知識や思考体系とは何であるかを参加者で議論します。イベントを通じて、分野を超えた人的交流を進めるのも目的の一つです。臨海実験所に馴染みがない人、大規模データ解析には馴染みのない人、そういった人たちや所属研究室にそのようなノウハウがない人にほど、参加して欲しいと希望しています。とくに生命情報科学分野と動物学諸分野から、広く参加者を募集します。(使用言語:日本語)
締め切りが近いですが、下記ウェブサイトを参考に、興味のある方はRegistrationページから応募してください。
https://sites.google.com/view/rinkaihack/home/events/moredetailsrinkaihackathon2019?authuser=0
シンポジウム「遺伝学の最先端研究から見る生命誌2019」を開催:5月18日(土)
国立遺伝学研究所 創立70周年記念式典
国立遺伝学研究所は、創立70周年となる2019年6月1日(土)に記念式典と記念講演会を開催します。
開催日:
2019年6月1日(土)
開催場所:
三島市民文化会館(ゆうゆうホール)小ホール
参加者:
招待者、並びに関係者。なお記念講演会には近隣の高校生を招待
記念式典:11:00〜11:40
記念講演会:13:00〜15:30(開場12:15)
第1部 記念講演 大隅良典(東京工業大学栄誉教授)
講演タイトル 「半世紀の研究を振り返って -基礎科学の将来-」
第2部 パネルディスカッション「なぜ遺伝学を研究するのか」
パネラー 大隅良典(東工大栄誉教授)、桂勲(遺伝研前所長)、小林武彦(遺伝学会会長)
真骨魚類における発生シークエンスの進化的特徴の解明
Frequent nonrandom shifts in the temporal sequence of developmental landmark events during teleost evolutionary diversification
Fumihiro Ito, Tomotaka Matsumoto, Tatsumi Hirata
Evolution & Development 18 April 2019 DOI:10.1111/ede.12288
生物の発生は、時間経過に伴って起こる形態変化(発生イベント)の積み重ねとして記載される。この発生イベントの起こる順番(発生シークエンス)は同一種内でよく保存されていることから、発生シークエンスの変化は、形態進化や環境適応など、生物学的意義があると考えられる。
本研究では、様々な水中環境へ適応し、多様な形態を示す真骨魚類を解析対象とし、発生シークエンスの進化的特徴を明らかにした。解析には、胚発生過程が詳細に記載されている30種の真骨魚類で共通して観察され、かつ、幅広く体全体の発生をカバーすることのできる19種の発生イベントを用いた。2通りの最節約法を用いて祖先推定をし、系統比較解析を行った結果、共通の発生イベントからなるシークエンスは系統内で多様化しており、その進化過程において(1)発生イベントごとに変化の度合いが異なること、(2)隣接した順位のイベント間でより頻繁に入れ替わりが起こること、また(3)分岐年代に依存して変化が蓄積する傾向があることが示された。本研究の結果は、進化はどのような特徴を伴って進行するのかという問いの理解に繋がることが期待される。
本研究は、哺乳動物遺伝研究室博士課程に在籍していた伊藤史博博士、進化遺伝研究室の松本知高助教、脳機能研究室の平田たつみ教授の共同研究として、進化発生学の専門誌Evolution & Developmentに掲載されました。
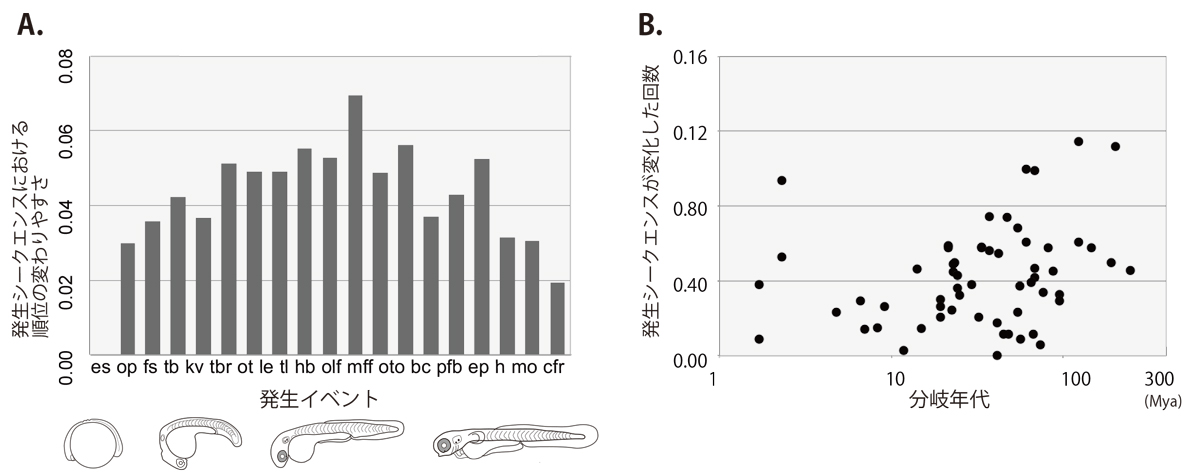
図:Event-pairing法による祖先推定に基づいた真骨魚類の進化過程におけるイベントごとの発生シークエンス変化量(A)と発生シークエンスの変化と分岐年代との関係(B)。
















