Archive
- Home
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
ゼブラフィッシュ胚/稚魚全個体移植による個体形成
Development and growth of organs in living whole embryo and larval grafts in zebrafish
Toshihiro Kawasaki, Akiteru Maeno, Toshihiko Shiroishi & Noriyoshi Sakai
Scientific REPORTS, 7: 16508 DOI:10.1038/s41598-017-16642-5
異なる年齢の動物2個体を並体融合 (parabiosis) した場合、血液性因子を介して別個体の器官再生等に影響を与え、老化個体の若返りや若い個体の老化が起こることが知られています。すなわち、動物では加齢に伴い個体全体が調和して発生・老化が進むと考えられます。しかしながら、これまでの並体融合法では初期胚と成体を融合させることは困難で、加齢の進んだ成体の血液性因子が器官形成を行っている胚に及ぼす影響は不明でした。
本研究で私たちは、免疫不全ゼブラフィッシュに胚/稚魚を個体まるごと皮下移植すると、宿主の血管が胚/稚魚へ浸潤し、循環系を共有して胚/稚魚が発生することを見つけました。これは並体融合とほぼ同等の体制を形成できたことを意味します。移植個体の器官形成を調べると、半数以上の個体で心臓、肝臓、精巣が欠損していることが認められました。宿主から生殖細胞を取り除くと移植胚の精巣欠損が起こらなくなったため、成体の特定の器官(細胞)に起因する血液性因子が初期胚の器官原器の発生に重篤な影響を与えることが明らかとなりました。今後、この移植法により脊椎動物の器官形成に影響を及ぼす新たな因子を明らかにできるものと期待されます。
本研究は国立遺伝学研究所小型魚類開発研究室と哺乳動物遺伝研究室の共同研究で行われました。
本研究は科学研究費補助金(JP23570260, JP25251034, JP25114003)の助成を受けました。
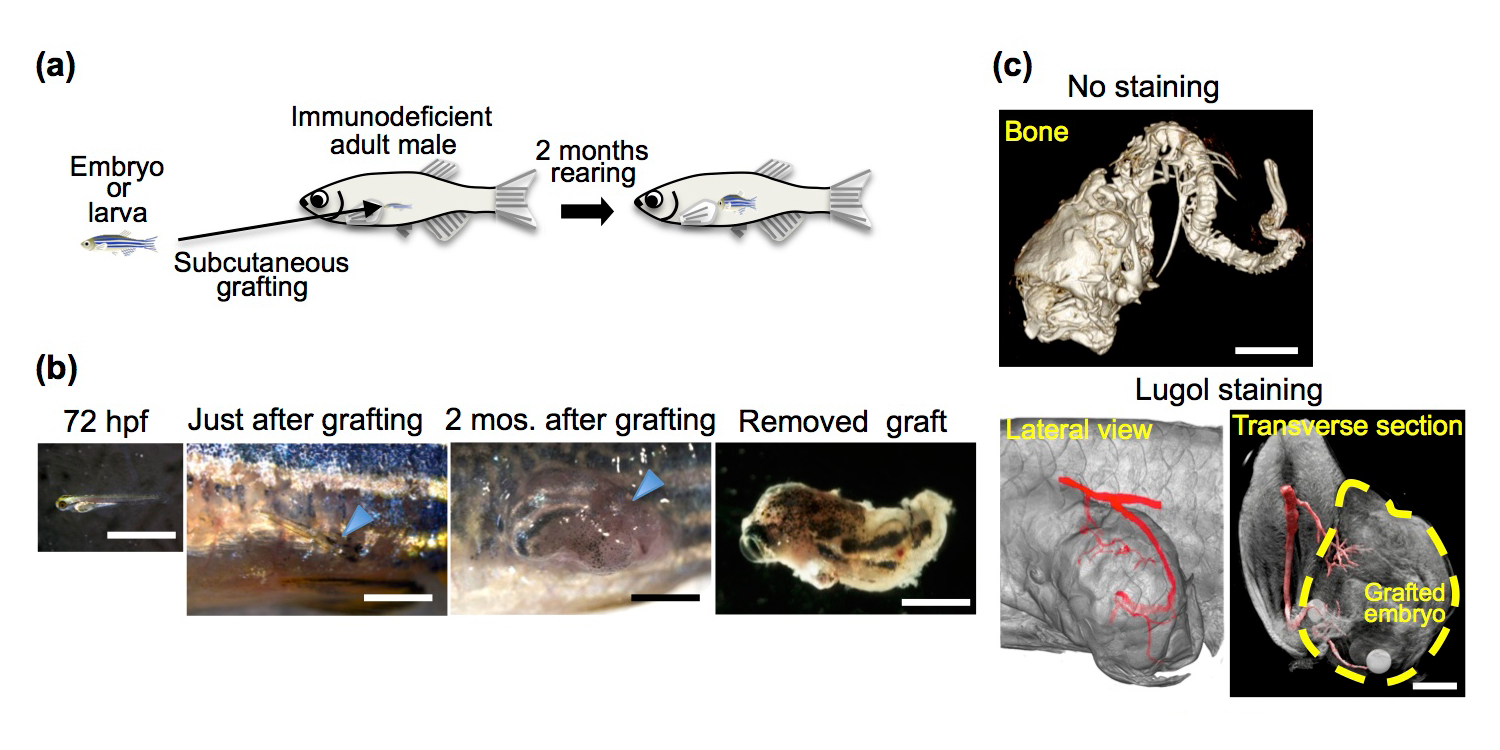
免疫不全ゼブラフィッシュに移植した72時間胚の発生。(a)全個体移植の概要。(b) 72時間胚と移植後の胚。(c) 移植後2ヶ月の胚のµ-CTイメージ。頭蓋骨と脊椎骨 (No staining)、血管系 (Lugol staining) が観察できる。
本成果の基盤のひとつとなったCTスキャンの記事をこちらでお読みいただけます
はじまりは卵の形だった~初期胚における細胞の配置パターンの決定機構~
![]()
An asymmetric attraction model for the diversity and robustness of cell arrangement in nematodes
Kazunori Yamamoto, Akatsuki Kimura
Development 2017 144: 4437-4449; DOI:10.1242/dev.154609
私たち多細胞生物は、たった一つの細胞(受精卵)が細胞分裂で数を増やすことによって形成されます。この個体形成の過程では、細胞同士の配置関係(細胞の配置パターン(1))が重要です。細胞の配置パターンは種によって多様で、一般にそれぞれ固有のパターンを持っていますが、細胞の配置パターンを決めるしくみはわかっていませんでした。
本研究では、特定の種の線虫(2)(C. elegans)の「卵の形」を変えると細胞の配置パターンが「他種の線虫のパターン」に変化することを発見しました。つまり、細胞の“容器”の役割を果たす卵の形が細胞の配置パターンに重要だったのです。また、卵の形の変化と細胞配置パターンの変化を再現する数理モデル(3)を世界で初めて構築しました。本研究で提唱する細胞の配置パターン決定のしくみは、ヒトをはじめとする様々な生物に共通すると考えられます。
本研究は、山本一徳博士(今春まで総合研究大学院大学(総研大)・大学院生/日本学術振興会特別研究員DC2、現・同特別研究員PD)によって、情報・システム研究機構 国立遺伝学研究所 細胞建築研究室の木村暁教授のもとでおこなわれました。山本博士は本研究の成果によって総研大遺伝学専攻の森島奨励賞を受賞しました。
本成果は、国際学術誌Developmentにおいて、定量的発生生物学に大きな影響を与えたダーシー・トムソン博士の著作「On Growth and Form」の刊行100周年を記念した特別号に掲載されます。
本研究は、科学研究費補助金(JP15H04372、JP15KT0083、JP16J09469)及び内藤記念科学奨励金、住友財団基礎科学研究助成、総合研究大学院大学学融合推進センター研究論文掲載費等助成の支援を受けておこなわれました。
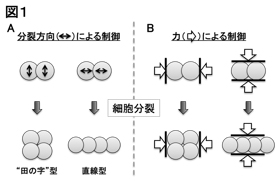
図1:細胞配置パターンの制御については、分裂方向の違い(A)によるものはよく研究されていたが、力による制御(B)についてはほとんどわかっていなかった。
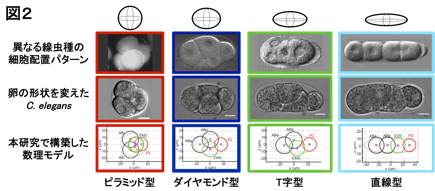
図2:本研究では、異なる線虫種の細胞配置パターン(A)を、ある種の線虫(C. elegans)の卵殻の形状を変えるだけで再現することに成功し(B)、さらに、このパターンの形状依存の変化を再現する数理モデルの構築にも成功した(C)。(A)でピラミッド型を示す種はEnoplus brevis (写真の出典は Schulze and Shierenberg, 2011)、T字型はCephalobus sp. (Goldstein, 2001)、直線型はBelonolaimus sp. (Goldstein, 2001)。
タンパク質レベルで発現調節を可能とするデグロン技術
Conditional Degrons for Controlling Protein Expression at the Protein Level
Toyoaki Natsume and Masato T. Kanemaki
Annual Review of Genetics, DOI:https://doi.org/10.1146/annurev-genet-120116-024656
タンパク質の発現を抑制した際に、その表現系を観察することにより、細胞内におけるタンパク質の機能を推察することは、様々な生物種において行われる遺伝学的解析です。この目的のために、siRNAやコンディショナル遺伝子ノックアウトによるタンパク質発現抑制が一般的に行われてきました。これらの方法は直接タンパク質を除去する訳ではないため、除去効果は間接的であり、除去にはタンパク質の半減期に依存した比較的長い時間を要します。そのため、時として除去による二次的影響が表現系として現れてくるといった問題がありました。
近年、タンパク質分解を誘導する「デグロン」配列を狙ったタンパク質に付加することにより、直接的にタンパク質発現を制御する技術が注目を集めています。デグロン技術によるタンパク質除去は直接的かつ迅速で、その効果を素早く観察することが可能です。私たちは、植物ホルモンオーキシンにより制御可能なデグロンを使い、オーキシンデグロン技術を開発しました。その他にも温度、低分子化合物、光、他のタンパク質の発現などにより制御可能なデグロン技術が開発されています。私たちは、これら新たな技術の開発の歴史と特性を総説としてまとめて発表しました。
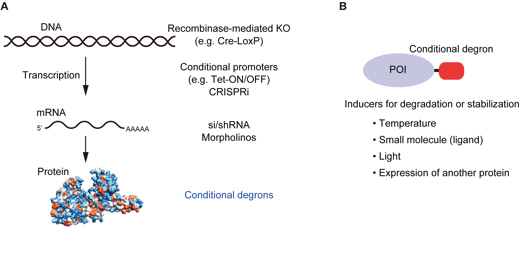
(A) タンパク質発現を制御するための技術。遺伝子レベルからタンパク質レベルまで様々な方法が有る。デグロン技術はタンパク質レベルで機能する。(B)デグロン技術には温度、低分子化合物、光、他のタンパク質発現により制御する方法が考案されている。
分裂期染色体の「脱」凝縮に関わる新たな機構
Release of condensin from mitotic chromosomes requires the Ran-GTP gradient in the reorganized nucleus.
Keita Aoki and Hironori Niki
Biology Open, November 15; 6(11):1614-1628, 2017 DOI:10.1242/bio.027193.
細胞周期の分裂期に高度に凝縮した染色体は、その後の間期で脱凝縮します。染色体の脱凝縮には、凝縮因子として有名なコンデンシンが染色体から解離する必要があると考えられていますが、その機構はまだよくわかっていません。
原核生物遺伝研究室では、ヒト細胞と同様に分裂期後に核膜再生と染色体脱凝縮が協調して起こるSchizosaccharomyces japonicus(分裂酵母の一種)を真核細胞のモデルとして、この問題に取り組みました。
本研究では、まず、脱凝縮の異常変異体として染色体が過凝縮する変異株をS. japonicusの温度感受性変異株ライブラリーから見つけることにしました。見つかった過凝縮する変異株は、pim1遺伝子に変異があることがわかりました。Small GTPase Ranのグアニンヌクレオチド交換因子であるPim1/RCC1の変異株では、染色体が異常に強く凝縮することが分裂酵母やハムスターを用いた研究から予てより知られていました(Nishimoto et al., 1978; Matsumoto and Beach 1991; Sazer and Nurse 1994)。
次に、S. japonicusの染色体過凝縮表現型の原因を明らかにするために、Pim1の細胞内局在を野生型と変異型とで比べました。そうしたところ、野生型Pim1は細胞周期を通じて主に核膜孔に局在していました。一方、変異型Pim1は、核膜孔に局在しましたが、この局在は核分裂後に娘細胞のうち片方の核から消失していました。そして、Pim1局在の消失した核でのみ染色体の過凝縮が起こることを我々は見つけました。
では、なぜPim1の核膜孔局在が不安定になると染色体の過凝縮が起こるのでしょうか?我々は、原因としてコンデンシンの影響を考えました。コンデンシンの染色体局在は野生型では分裂期後になくなりますが、pim1変異株では、過凝縮した染色体にコンデンシンが残留していました。また、pim1変異株の過凝縮染色体の頻度はコンデンシンの活性化リン酸化サイトの一つであるCDKサイトの活性化型変異により増加しました。これらの結果から、Ran経路に依存したコンデンシンの脱リン酸化もしくは不活性化が、効率的な染色体脱凝縮に関わると考えられました。
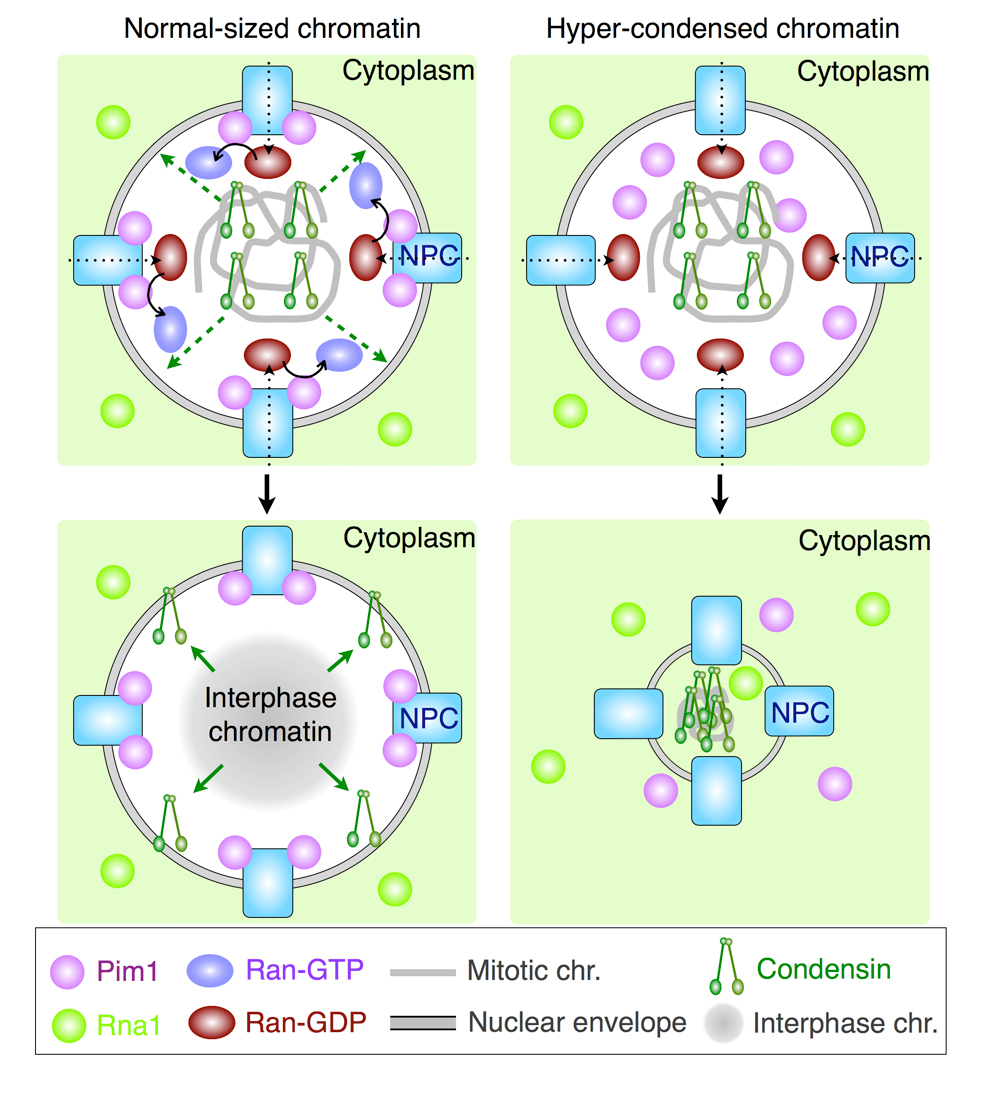
通常の核(左側)では、染色体上のコンデンシンは、分裂期後にRan-GTPに依存して染色体から離れる。そのため、脱凝縮したG1期核が形成される。一方、Pim1/RCC1に異常がある核(右側)では、Ran-GTPが少ないために分裂期後にコンデンシンが染色体から離れることができない。そのため、G1期に染色体が過凝縮する。
植物内の“水の通り道”を広げる遺伝子、発見
CORTICAL MICROTUBULE DISORDERING1 is required for secondary cell wall patterning in xylem vessels
Takema Sasaki, Hiroo Fukuda, Yoshihisa Oda
The Plant Cell, Published November 2017. DOI:https://doi.org/10.1105/tpc.17.00663
陸上の植物は地中の水分を根からくみ上げ全身に行き渡らせています。植物体内の水分は光合成などのあらゆる代謝に加え、体の体積を増やすための充填材として使われており、植物が葉を大きく広げ、高く生長していく上で必要不可欠なものです。この水分は植物体内で道管と呼ばれる中空の筒の中を通り、茎や葉の先端まで運ばれています。道管には壁孔と呼ばれる直径数ミクロンの微小な穴が開いており、道管内の水分は壁孔を通って道管から道管へ、さらには道管から葉や茎の細胞へと移動します(図左)。このように壁孔は植物の体のなかで水分の通り道となる重要な構造です。これまで、この壁孔の大きさが決まる仕組みはほとんどわかっていませんでした。
道管は、道管の元となる細胞が細胞の表面に厚く丈夫な細胞壁を沈着し、細胞内容物を消化することにより作られます。この道管の細胞壁の沈着が部分的に抑制されると壁孔が形成されます。植物細胞の表面には微小管と呼ばれる非常に細い繊維状の管が並列に規則正しく並んでおり、この微小管に沿って細胞壁が沈着します。これまでの研究により、道管の細胞では一部の微小管が分解されることにより細胞壁の沈着が抑制され、壁孔が作られることが分かってきました。しかしどのようにしてこの微小管の分解が制御され、壁孔の大きさが決まるのか未解明でした。
国立遺伝学研究所 小田祥久准教授らの研究チームは東京大学と共同で道管の細胞で働く遺伝子を網羅的に調べることにより、表層微小管の安定性を下げる新しいタンパク質を発見し、CORD1 (Cortical Microtubule Disordering1)と名付けました。このタンパク質は微小管に結合し、細胞表面での微小管の規則的な並びを乱し、分解されやすくすることにより、壁孔を作りやすくしていることがわかりました。CORD1を失った細胞では微小管が強固に並列に並び、分解されにくくなるために、壁孔が小さくなりました。一方、CORD1を過剰に発現させた細胞では微小管が散在し、分解されやすくなったために壁孔が大きくなりました。このように道管の細胞はCORD1の量によって微小管の壊れやすさを調節し、壁孔の大きさを決定していることがわかりました(図右)。CORD1の量を人為的に制御することができれば、植物内の水分の輸送効率を改変し、より早く育つ植物の作出が可能になるかもしれません。
微小管は道管細胞だけでなく、植物の体のほとんどの細胞で細胞壁の沈着を制御しています。微小管の並び方や分解されやすさは細胞壁の沈着の仕方に大きく影響し、その結果、細胞の形や役割にも影響します。これまでの研究では表層微小管を並行に並べる仕組みはよく研究されており、様々な遺伝子の働きが明らかとなってきました。しかし、今回発見したCORD1タンパク質のように微小管の配列を乱し分解されやすくするようなタンパク質の発見は世界で初めてです。この発見により、道管に加え、様々な植物細胞で細胞壁の沈着を制御する仕組みが見えてくると期待されます。
本研究は、東京大学大学院理学系研究科との共同研究として行われました。
本研究成果は、平成29年11月13日(米国東部標準時間)に米国科学雑誌The Plant Cellに掲載されました。
本研究は、文部科学省の科学研究費補助金 (16H01247, 15H01243, 15H05958)、日本学術振興会の科学研究費補助金16H06172, 16H06377)、科学技術振興機構(JST)の戦略的創造研究推進事業さきがけ (JPMJPR11B3)、三菱財団、内藤記念科学振興財団の助成を受けました。
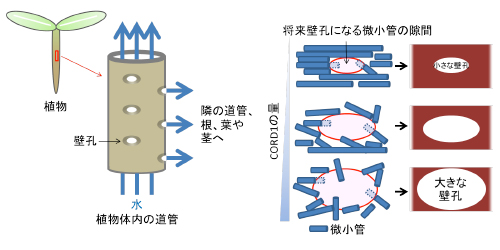
(左)植物の体内において水分は道管を通して全身に運ばれます。道管内の水分は道管から隣の道管へ、さらに道管から茎、葉、根の体細胞へと壁孔を通して運ばれます。(右)CORD1の量が多いと細胞壁の沈着を促進する微小管の並び方がバラバラになり、大きな壁孔が作られます。逆にCORD1の量が少ないと微小管はしっかりと平行に並び小さな壁孔が作られます。
【遺伝研でサバティカル】遺伝研では研究者交流促進プログラムの参加者を募集します
【遺伝研でサバティカル】遺伝研では研究者交流促進プログラムの参加者を募集します
リボソーム遺伝子の新たな機能 〜染色体の凝縮の場として〜
Multiple cis-acting rDNAs contribute to nucleoid separation and recruit the bacterial condensin, Smc-ScpAB
Koichi Yano, and Hironori Niki
Cell Reports, Vol. 21 Iss. 5, October 31, 2017 DOI:http://dx.doi.org/10.1016/j.celrep.2017.10.014
長いDNA分子は折れ畳まれ、染色体として細胞内に収納されている。この折り畳みの一端を担っているのがコンデンシン複合体である。コンデンシン複合体はバクテリアからヒトまで共通に保存された生物の基本的因子の一つである。バクテリアのコンデンシン複合体は、複製開始点付近の染色体領域に結合し、複製した染色体DNAを順次折り畳んで行く。こうして、2つの姉妹染色体へと分けられる。この時、バクテリアのコンデンシン複合体は複製開始点付近の、どの染色体領域を選んで結合しているのか?この点についてはこれまで不明であった。
今回、私たちは枯草菌を使い、複製の開始点付近に散在している複数のリボソーム遺伝子が、バクテリアコンデンシンの結合の場になっていることを見出した。私たちは、これまでにもバクテリアコンデンシンタンパク質が二本鎖DNAよりも一本鎖DNAに対して、より選択的に結合をすることを明らかにしている(Niki & Yano, 2016)。リボソーム遺伝子の転写は常に活発である。さらに、リボソーム遺伝子では転写されたRNAがDNAと結合したいわゆるR-ループを形成し、転写で生じた二本鎖の開裂を安定化させる。そのため、リボソーム遺伝子では他の遺伝子領域よりも一本鎖DNAが露出しやすい。このことが、一本鎖DNAに結合しやすいバクテリアコンデンシン複合体をリボソーム遺伝子に特異的に結合させている原因だと私たちは考えている。複数のリボソーム遺伝子が複製の開始点付近に散在しているのはリボソームRNAを増産するためだと、これまで考えられてきた。しかし、それだけではなく、このリボソーム遺伝子の配置はコンデンシン複合体によるDNA凝縮の場としても役立っていることが今回の研究から明らかになった。
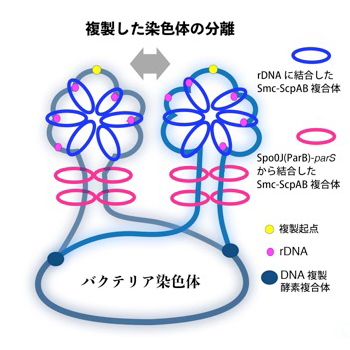
環状のバクテリア染色体は、1箇所の複製起点(黄色の丸)から複製を開始し、姉妹染色体を形成する。枯草菌のコンデンシンであるSmc-ScpAB複合体は、複製起点に散在するリボソーム遺伝子(rDNA、ピンクの丸)に結合し、リボソーム遺伝子以外の場所に結合したSmc-ScpAB複合体と共もに相互作用して、2つの姉妹染色体の分離を助ける。また、Smc-ScpAB複合体はSpo0J(ParB)-parSというDNAタンパク質複合体からも染色体に結合して、複製した染色体の左右のDNA鎖を対合させるように機能している。
チンパンジー親子トリオ(父親−母親−息子)の全ゲノム配列を高精度で解明
![]()
Direct estimation of de novo mutation rates in a chimpanzee parent-offspring trio by ultra-deep whole genome sequencing
Shoji Tatsumoto, Yasuhiro Go, Kentaro Fukuta, Hideki Noguchi, Takashi Hayakawa, Masaki Tomonaga, Hirohisa Hirai, Tetsuro Matsuzawa, Kiyokazu Agata, Asao Fujiyama
Scientific Reports 7, Article number: 13561 (2017) DOI:10.1038/s41598-017-13919-7
京都大学 高等研究院の松沢哲郎(まつざわ・てつろう)副院長・特別教授、自然科学研究機構 新分野創成センターの郷康広(ごう・やすひろ)特任准教授、情報・システム研究機構 国立遺伝学研究所の藤山秋佐夫(ふじやま・あさお)特任教授、学習院大学 理学部の阿形清和(あがた・きよかず)教授(元 京都大学 理学研究科)らの研究グループは、京都大学霊長類研究所のチンパンジー親子3個体(父:アキラ、母:アイ、息子:アユム)の全ゲノム配列(遺伝情報の配列)を高精度で決定(解明)し、父親・母親それぞれのゲノムが子どもに受け継がれる際に起きるゲノムの変化を明らかにしました。今回の研究では、霊長類研究所において長期にわたる比較認知科学研究(通称「アイ・プロジェクト」)の中心となっているチンパンジーを研究の対象としました。
チンパンジーは、進化的に私たちの最も近縁であり、99%のゲノム情報を私たちと共有している「進化の隣人」です。しかし、残りの1%のゲノムの違いに、「ヒトをヒトに」「チンパンジーをチンパンジーに」した原因があると考えられています。本研究では、そのチンパンジーを対象として、進化の駆動力である新規突然変異が、親から子どもへとゲノムが伝わる過程でどのように生じているか、その詳細を明らかにしました。
全ゲノム配列を高精度に明らかにするために、チンパンジーゲノム(約30億塩基対)の約150倍にあたる4500〜5700億塩基対(新聞朝刊の約7000〜8000年分の文字数に相当)の配列の決定を3個体すべてに対して行い、1世代における新規突然変異率の推定やそのパターンを解析しました。本研究で得られたデータ量は、これまでのヒトを含めた個人ゲノム研究として前例のない大規模データになります。それらの大規模データの解析を行った結果、チンパンジーの生殖細胞系列では、1世代に生じる新規一塩基突然変異は1億塩基対あたり平均1.48個生じていました。この値はヒトで報告されている値(0.96~1.2)より高い結果でした。また父親(精子)由来が75%でした。さらに、高精度な配列を得たことにより、1世代で生じるゲノム構造変化(新規遺伝子交換や新規コピー数変異)の動態も高精度に明らかにすることができました。これらのゲノム構造変化は、ヒトゲノム研究においても、その詳細がいまだ充分に明らかにされていないため、今回の研究で開発した方法や得られた結果は、ヒトゲノムの構造変化を含めたよりダイナミックなゲノム変化を解析するための方法論も提示することができました。
本研究成果は英国時間11月1日午前10時(日本時間11月1日午後7時)に、英科学誌「Scientific Reports」オンライン版に掲載されました。
遺伝研の貢献
京都大学霊長類研究所から解析用試料の提供を受けて、遺伝研先端ゲノミクス推進センターにおいて大規模ゲノムシーケンシングによる塩基配列決定とその後の配列アセンブリング、個体間の配列比較などのゲノム情報解析をおこないました。
研究支援
本研究は、以下の研究事業、研究課題、研究助成による支援を受けて実施されました。
日本学術振興会「グローバルCOEプログラム」「研究拠点形成事業:先端拠点形成型」「博士課程教育リーディングプログラム」、科学研究費補助金「新学術領域研究:ゲノム支援」「新学術領域研究:ゲノム相関」「新学術領域研究:個性創発脳」「特別推進研究」「基盤研究(S)」「基盤研究(A)」「基盤研究(B)」「若手研究(A)」「若手研究(B)」「挑戦的萌芽研究」「特別研究員奨励費」、国立遺伝学研究所共同研究、京都大学霊長類研究所共同利用・共同研究、稲盛財団















