Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
大量遺伝情報研究室の藤澤貴智研究員らがLODチャレンジ Japan 2019の基盤技術部門優秀賞を受賞

大量遺伝情報研究室 藤澤貴智 特任研究員は、DBCLS 山本泰智 特任准教授らと連名で、データの利活用を目的としたアイデア・アプリケーションを競い合うLinked Open Dataチャレンジ 2019において基盤技術部門優秀賞を受賞しました。受賞作品となった JSON2LD Mapper は、Webアプリケーション等で広く使われているJSON形式からLODを構成するデータ形式の一つであるJSON-LD形式へ変換するツールです。
LOD (Linked Open Data)は、世界中のだれもが意味情報を付与したデータを公開することで、インターネット上を一つの知識ベースとして扱うことを可能にすることのできる仕組みです。LODチャレンジは、そのデータ公開や技術開発に関するコンテストであり、受賞した作品は、2017年に受賞したデータ公開を促進するためのアイデアを実現したものです。
▶ Linked Open Data チャレンジ Japan 2019 受賞作品発表
LODチャレンジ2019は、さまざまな分野でデータ作りやデータの活用にチャレンジされている方々による活動の発表の場を提供するために、新たなデータづくり、データ公開、データ共有の仕掛けやオープンデータ活用のアイディア、アプリケーションなどを「作品」として募集し表彰するものです。
▶ 大量遺伝情報研究室
単細胞生物の藻食―毒まんじゅうは光合成生物への進化の素―
Responses of unicellular predators to cope with the phototoxicity of photosynthetic prey
Akihiro Uzuka*, Yusuke Kobayashi*, Ryo Onuma*, Shunsuke Hirooka, Yu Kanesaki, Hirofumi Yoshikawa, Takayuki Fujiwara, and Shin-ya Miyagishima
(*Co-first authors)
Nature Communications 10, 5606 (2019) DOI:10.1038/s41467-019-13568-6
Link to “Behind the paper” in Nature Ecology and Evolution.
真核生物による葉緑体つまり光合成能の獲得は、真核細胞内へのシアノバクテリア(光合成を行うバクテリア)の一次共生(紅藻、緑藻、植物の共通祖先)の他、それによって生じた真核藻類の二次共生により(褐藻、渦鞭毛藻、ミドリムシなどのそれぞれの祖先)様々な系統で独立に何度も起きたことが知られています。また、細胞内に取り込んだ単細胞藻類を数週間から数ヶ月間、葉緑体のように利用した後に消化する単細胞生物(盗葉緑体性生物)、長期にわたって任意共生させる単細胞生物が多くの系統で見つかっており、葉緑体の成立は、単細胞真核細胞による単細胞藻類の捕食、一時的保持、恒久的保持という順の進化の結果だと考えられています。
光合成装置は有害な活性酸素種を生じるため、藻類および植物は光合成酸化ストレスへの様々な対処機構を発達させていること、対処しきれない場合は死んでしまうことが知られています。同様に単細胞藻類を共生させるまたは捕食する真核生物も、単細胞生物の場合、細胞内に取り込んだ藻類細胞に光が届くので活性酸素種が生じ、光合成酸化ストレスに曝されると予想されますが、単細胞の捕食性生物にとって藻類えさが毒まんじゅうであるのかについての研究例はこれまでありませんでした。
そこで、日当たりの良い湿原から単離した系統の大幅に異なる3種の藻食アメーバを用いた解析を行いました。その結果、以下のことが3種のアメーバに共通して起こることが明らかとなりました、(1)藻食アメーバは餌の光合成性と光特異的に強い酸化ストレスに曝される。光合成酸化ストレスが上昇する強光下で光合成生物を補食すると死ぬこともある。(2)昼間にはアメーバの酸化ストレス対応遺伝子群の発現が上昇し、一方でアクトミオシン等ファゴサイトーシス関連遺伝子群の発現が抑制される。(3)アメーバは昼間には餌の取り込みを抑制する一方で、それでもなお取り込んでしまう餌の消化速度を速める。つまり、細胞内の光合成性えさの数を減少させることで活性酸素種の発生を抑えていると予想される。これに似た現象として、光合成酸化ストレスが高まる環境下で、細胞内の共生藻類を消化または吐き出すことが、ミドリゾウリムシ、サンゴなどで知られている。(4)アメーバは、これまで藻類・植物でのみ見つかっていたクロロフィル(光合成色素;光合成装置から遊離した状態で光を受けると活性酸素種を生じる)の分解・無毒化遺伝子を、それぞれ独立に、光合成生物からの遺伝子水平転移により獲得している。これらの遺伝子は、光または酸化ストレスにより発現誘導される。
これらの結果、光合成生物を細胞内に共生させ、さらには葉緑体として利用するための機構は、捕食・被食の段階から漸進的に準備されてきたことが示唆されます。これまで、葉緑体タンパク質をコードする核ゲノムの遺伝子群の多くは、恒久的な細胞内共生の確立後、共生体ゲノムから宿主核ゲノムに移行することで獲得されたと考えられてきました。しかしながら、今回の研究の結果、それらの少なくとも一部は、共生が成立するよりも遙か前の、捕食・被食段階から(例えば光合成性えさゲノムから捕食者の核ゲノムへの)水平転移によって順次獲得されてきた可能性も示唆されます。
本研究に至った経緯等は別途Nature Ecology and Evolution誌の “Behind the paper” で紹介しています。
本研究は、国立遺伝学研究所の宇塚明洋(元総研大大学院生)、小林優介(現茨城大学)、大沼亮(学術振興会特別研究員)を中心として、静岡大学、東京農業大学との共同研究チームによっておこなわれました。
本研究は、科学研究補助金(16K14791, 17H01446, 17J08575)、文科省私立大学戦略的研究基盤形成支援事業(S1311017)などの助成のもとに実施されました。

図:小田貫湿原(静岡県富士宮市、2013年4月23日)から単離した藻食アメーバ。それぞれ真核生物の異なるスーパーグループに属するが(2種はアメーボゾア、1種はエクスカバータ)、光合成性えさの生じる酸化ストレスに対して同様の対処機構をそれぞれ独立に進化させていることがわかった。赤は細胞内に取り込まれたシアノバクテリア(光合成をするバクテリア)のクロロフィル(光合成色素)蛍光。
【開催中止】遺伝研国際シンポジウム「Molecular Mechanism of Chromosome Replication」
2020年3月4-5日に開催予定の遺伝研国際シンポジウムは、新型コロナウィルスの感染拡大防止の観点から開催の中止を決定いたしました。
既にお申し込みをいただきました皆様におかれましては大変申し訳ありませんが、何卒ご理解をいただきたく宜しくお願い申し上げます。
遺伝研国際シンポジウム中止のお知らせ:http://kanemaki-lab.sakura.ne.jp/symposium/
大脳皮質ニューロンが適切な場所で移動を停止するしくみ
Semaphorin 6A–Plexin A2/A4 interactions with radial glia regulate migration termination of superficial layer cortical neurons.
Yumiko Hatanaka, Takahiro Kawasaki, Takaya Abe, Go Shioi, Takao Kohno, Mitsuharu Hattori, Akira Sakakibara, Yasuo Kawaguchi & Tatsumi Hirata
iScience 21, pp 359-374, 2019 DOI:10.1016/j.isci.2019.10.034
中枢神経系では、多くのニューロンが脳室に面した場所で生まれたのち、最終目的地まで移動します。大脳皮質においても脳室帯で生まれたニューロンは、ラジアルグリア細胞の突起をガイドとして、脳表面に向かって移動することが知られています。機能的な脳構造を作るためには、これら移動ニューロンが適切な位置で停止することが必要ですが、そのメカニズムについてはよくわかっていませんでした。私たちはセマフォリン(Sema)ファミリーの受容体として知られるプレキシン(Plxn)A2とA4のダブルノックアウト(dKO)マウスを解析する過程で、大脳皮質の最表層を占めるニューロンが適切な位置を超え、第1層に侵入するということを見出しました。野生型マウスではPlxnA2/A4はこれら移動ニューロンの先導突起上に発現しており、PlxnA2を使ったレスキュー実験により、これら分子の発現が移動停止に必要であることを確認しました。一方PlxnA2/A4のリガンドであるSema6A分子はラジアルグリア細胞に発現しており、ラジアルグリア細胞のSema6A遺伝子をノックアウトするとニューロンは第1層へと侵入しました。これまでの研究から、PlxnA2/A4とSema6Aの相互作用は反発活性を引き起こすことが知られています。以上の結果から、最表層のニューロンはラジアルグリアの突起をガイドとして移動したのち、ニューロン上のPlxnA2/A4と突起上のSema6Aが相互作用することにより突起を離れ、そこで移動を終了するという新しい分子メカニズムが考えられました。
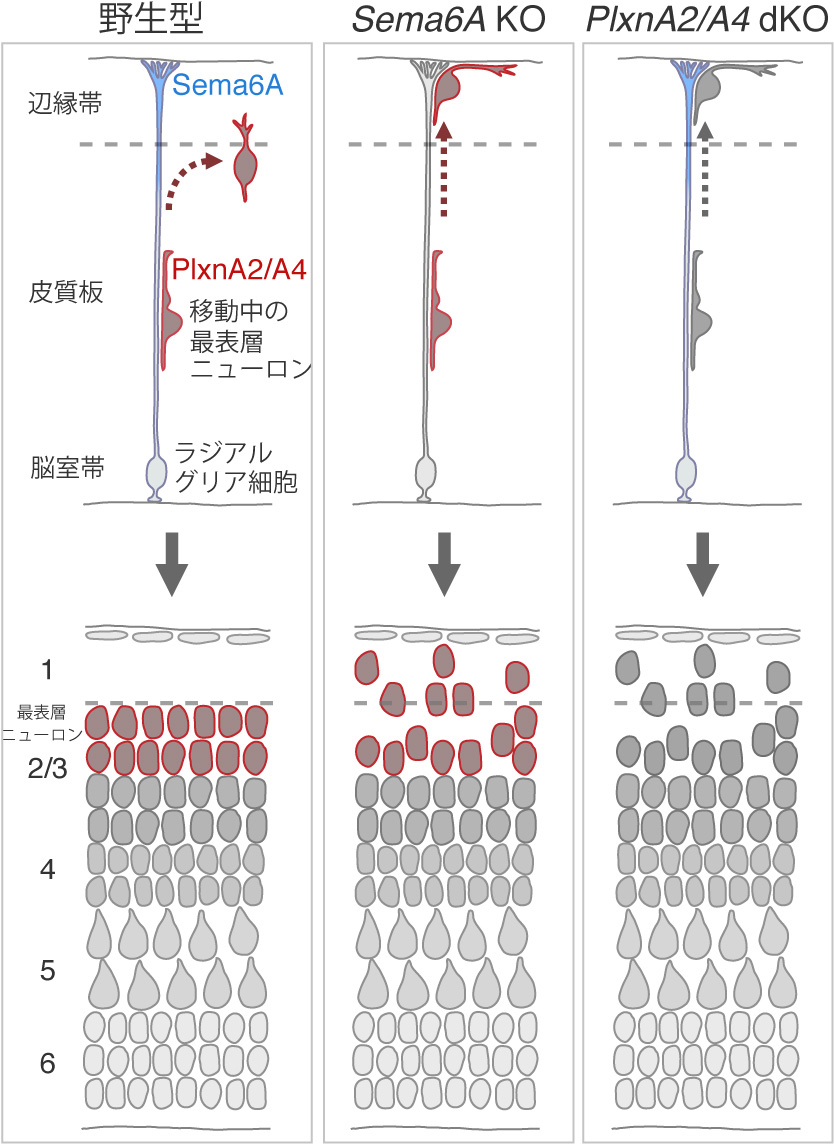
図:大脳皮質のニューロンはラジアルグリア細胞の突起をガイドとして表層方向へ移動します。最表層ニューロンの停止過程では、ニューロンに発現しているPlxnA2/A4とラジアルグリア細胞上のSema6Aの相互作用により、辺縁帯(将来の第1層)の直下で移動を停止すると考えらます。どちらかの遺伝子が欠損するとこれらニューロンは第1層に侵入し、大脳皮質ニューロンの配置が乱れます。
本研究は畠中由美子(大阪大学生命機能研究科助教)と川崎能彦(遺伝学研究所助教)が中心となって行ったものであり大阪大学生命機能研究科、国立遺伝学研究所、理化学研究所、名古屋市立大学、中部大学、生理学研究所の共同研究として行われました。
NIG-JOINT Collaboration Research Grants 2013-A, 2017-A
植物のユニークな細胞分裂の仕組みを解明 ~農作物増産に期待~
Press release
A novel katanin-tethering machinery accelerates cytokinesis
Takema Sasaki, Motosuke Tsutsumi, Kohei Otomo, Takashi Murata, Noriyoshi Yagi, Masayoshi Nakamura, Tomomi Nemoto, Mitsuyasu Hasebe, Yoshihisa Oda
Current Biology 29, 1-11 DOI:10.1016/j.cub.2019.09.049
細胞分裂はあらゆる生物の成長の根幹となる生命現象です。植物の細胞分裂は根や茎の先端で繰り返され、植物の成長は細胞分裂の効率に大きく依存します。植物細胞は細胞板で細胞質を仕切ることにより分裂します。この仕組みは細胞がくびれることにより分裂する動物細胞と異なっています。植物細胞が細胞板を形成して細胞分裂をする仕組みには未解明の部分が数多く残されています。
情報・システム研究機構 国立遺伝学研究所の小田祥久教授らの研究グループは、植物細胞が細胞板を効率よく作り出す仕組みを世界で初めて明らかにしました。本研究グループは、細胞板を作り出す装置に含まれるタンパク質「CORD4」を見出し、CORD4が細胞板の成分を運ぶレールである微小管(1)を効率よく配置することにより、細胞板をより短時間で作り出していることを突き止めました。
本研究により、植物のユニークな細胞分裂の仕組みの一端が明らかになりました。この成果は植物の細胞分裂の仕組みとその仕組みの進化の過程の解明に繋がる貴重な手がかりです。この仕組みを利用することで、農作物の生育を早める新しい技術に繋がる可能性も期待されます。
本研究は、北海道大学電子科学研究所ニコンイメージングセンター、自然科学研究機構基礎生物学研究所、名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM)との共同研究として行われました。
また、本研究は、文部科学省の科学研究費補助金(JP19H05372, JP19H05677, JP19H05670)、日本学術振興会の科学研究費補助金(JP18H02469, JP18K14737, JP18KK0195, JP15H05953, JP16H06280, JP16H06378)、物質・デバイス領域共同研究拠点:人・環境と物質をつなぐイノベーション創出ダイナミック・アライアンスにおける共同研究「COREラボ」(20186001,20166001)、国立遺伝学研究所 NIG-JOINT(89A2019)、ヒューマン・フロンティア・サイエンス・プログラムの助成を受けました。なお、所属は論文受理時のものです。
本研究成果は、米国科学雑誌「Current Biology」に2019年11月14日午前11時(米国東部時間)に掲載されました。
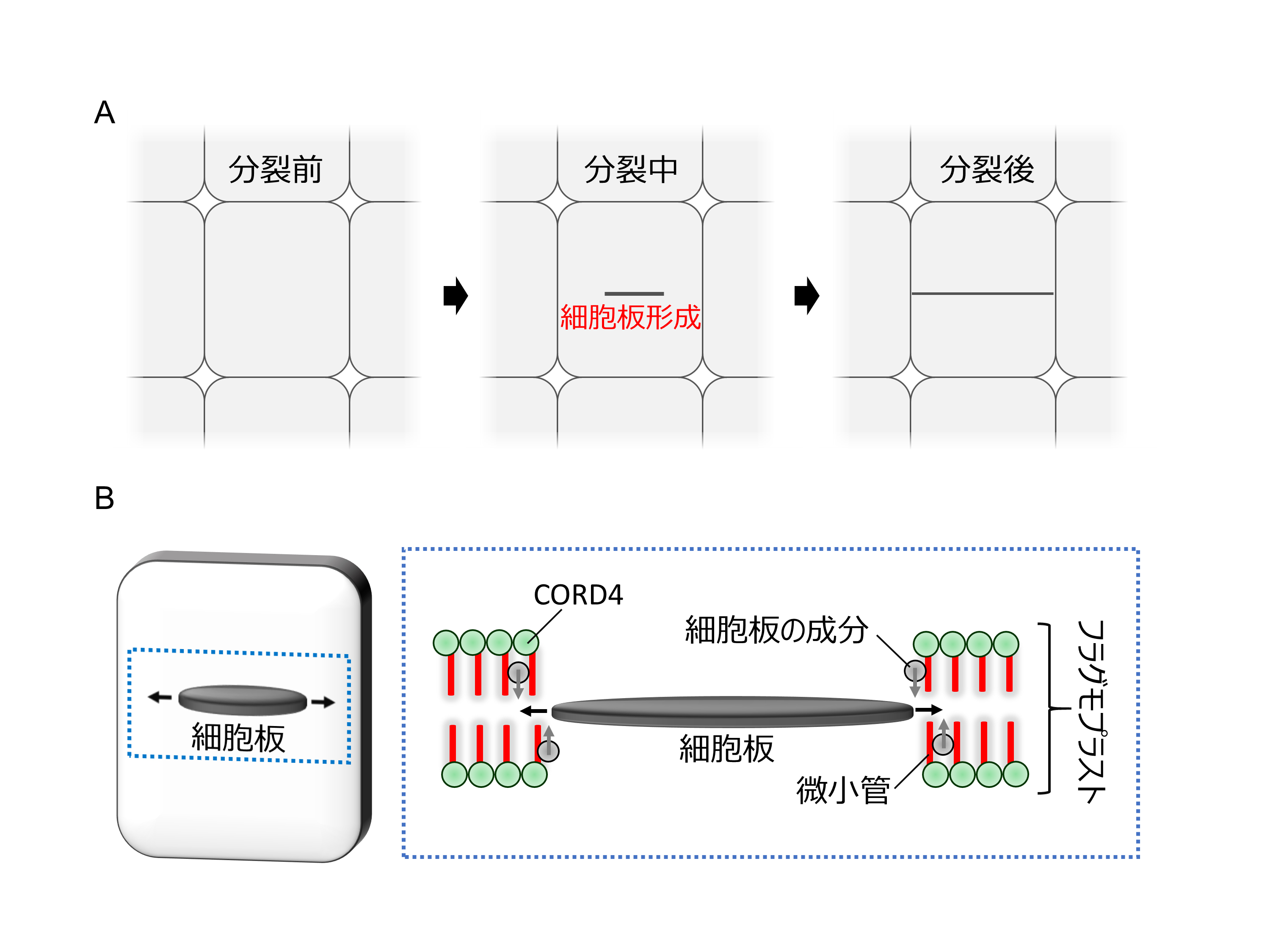
図: 植物細胞の分裂の様子
A, 植物細胞は細胞板により細胞質を仕切ることで分裂する。
B, 細胞板はフラグモプラスト(2)と呼ばれる装置により作られる。フラグモプラストでは短い微小管が細胞壁の成分を含む小胞を輸送する足場としてはたらいている。CORD4は、フラグモプラストの微小管を細胞板に垂直に並べる。輸送された小胞が細胞板と融合することにより細胞板が拡大していく。
マイクロフォーカスX線CT装置による海産無脊椎動物の解析方法
Microfocus X-ray CT (microCT) Imaging of Actinia equina (Cnidaria), Harmothoe sp. (Annelida), and Xenoturbella japonica (Xenacoelomorpha).
Maeno A, Kohtsuka H, Takatani K, Nakano H.
Journal of Visualized Experiments 150 e59161 1-9 DOI:10.3791/59161
これまで生物を扱う研究者は、不透明な生物内部の器官を調べる際に、組織標本の作成など破壊的な観察方法に頼らざるをえませんでした。一方で、非破壊的なマイクロフォーカスX線CT装置(microCT)を用いる観察方法は、技術進歩によりとても有効な観察手法となってきました。しかしながら、この観察手法は、生物学分野では医療および産業分野においてほど一般的とはいえません。この理由はサンプル採取、固定、染色、撮影、およびデータ解析までの各ステップをカバーするわかりやすいマニュアルが少ないことと、生物学で対象とするような後生動物に多様性があるからです。特に、海産無脊椎動物は、多様なサイズや形態、生理機能を持つため、サンプル調整法やハードウェア設定などの手法をサンプルに応じて最適化することが重要です。
国立遺伝学研究所 前野哲輝技術専門職員、東京大学 幸塚久典技術専門職員、筑波大学 中野裕昭准教授らの共同研究グループは、この課題の解決に取り組みました。その取り組みの成果として、系統発生的に異なる3つの海産無脊椎動物(ウメボシイソギンチャク(刺胞動物)、ウロコムシ(環形動物)、およびニッポンチンウズムシ(珍無腸動物))を使用して、microCTによる解析手法を紹介した論文を、ビデオジャーナル「JoVE(Journal of Visualized Experiments)」にて公開しました。今後、本手法により、様々な海産無脊椎動物の構造が明らかになることが期待されます。
microCTを研究に活用したい方へ
国立遺伝学研究所では、microCTを使用する環境にない研究者を対象に、研究目的に合わせた撮影計画とmicroCTによるデータ取得、プレゼンテーション用の画像や動画作成までをサポートする画像解析支援を行なっています。対象となる生物材料は、海産無脊椎動物だけでなく、魚類、哺乳類、昆虫、植物など広い範囲をカバーしています(装置の仕様による制限はあります)。ご興味のある方は、毎年、10月頃に募集の始まる公募型共同研究(NIG-JOINT)をご確認の上、担当者までお問い合わせください。
技術専門職員 前野哲輝(amaeno@nig.ac.jp)
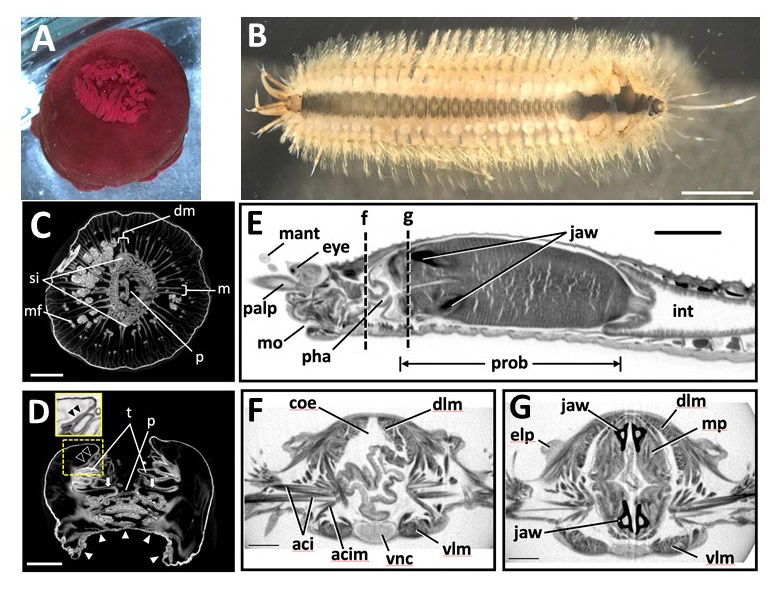
図:この研究で使用した海洋無脊椎動物 (A,B)
(A)麻酔下のウメボシイソギンチャク(刺胞動物花虫綱)。(B)麻酔下のウロコムシ (環形動物門多毛綱)。この段階で、ほとんどのウロコ(背鱗)が失われている。残っているのは後方(写真右側)の4枚のみである。 Scale bars = 3 mm.
CTスキャンによる断面画像 (C-G)
ウメボシイソギンチャクの横断面(C) と縦断面(D) Scale bars in C, D = 3 mm.
ウロコムシ前端部分の矢状断面 (E) とE図点線fとgの横断面(F, G)
Scale bars: E = 1 mm; F, G = 0.3 mm.
動画: CTスキャンデータから作成したウロコムシ全身のボリュームレンダリングおよび横断面動画。6秒から16秒:ボリュームレンダリング画像。上段は左から見た図、下段は正面から見た図。17秒から1分42秒:横断面動画。上段の矢状面画像上の動く緑色のラインは横断面の位置を示す。17秒から53秒の左下は、標本前端部分を拡大撮影したデータの横断面。1分7秒から1分14秒の右上は、画像解析ソフトImarisを用いて作成した主要臓器の3Dモデル。
協力:鹿児島大学 田中正敦氏
関連リンク
生物の複雑な構造を3次元で解き明かす
本技術は以下の研究成果の基盤のひとつになっています。
・日本近海で初の珍渦虫の新種を発見 ―動物の起源や進化過程を探る糸口に―
・ヒト先天異常「全前脳胞症」の発症にかかわる制御配列を発見
・魚の浮き袋という進化上の発明のカギは、「腹側」から「背側」への遺伝子スイッチの切り替えだった
・単子葉植物の茎に特徴的な形態形成を制御するメカニズム
・歯の本数は、複数のエンハンサーによるShh遺伝子の発現調節によって決まる
・ゼブラフィッシュ胚/稚魚全個体移植による個体形成
・遺伝子スイッチの「移設」が手に水かきを作る
・カブトムシの角(ツノ)にオスとメスとの違いが現れる時期の特定に成功(基礎生物学研究所)
・ヒト4番染色体長腕部分重複症の原因解明:Hand2遺伝子量効果による四肢・心臓の形態異常
神経細胞の誕生日タグづけ法を開発して新規嗅覚回路を発見
A Novel Birthdate-Labeling Method Reveals Segregated Parallel Projections of Mitral and External Tufted Cells in the Main Olfactory System
Tatsumi Hirata, Go Shioi, Takaya Abe, Hiroshi Kiyonari, Shigeki Kato, Kazuto Kobayashi, Kensaku Mori and Takahiko Kawasaki
eNeuro 31, ENEURO.0234-19.2019, 2019 DOI:10.1523/ENEURO.0234-19.2019
鼻で受容された匂いの情報は、脳の嗅球へと伝えられ、ここで二次元的に整理された匂い地図として表現されます。この情報は、その後ランダムに拡散的に入り混じりながら次の中枢へと伝えられてゆくと考えられてきました。我々は、神経細胞の発生タイミングの違いを利用してloxP遺伝子組換えを誘導するトランスジェニックマウス系統(誕生日タグづけ法)を開発し、嗅球から中枢への神経結合パターンを解析しました。その結果、嗅球の神経細胞のうち早生まれの僧帽細胞と遅生まれの房飾細胞は、同じ匂い情報の入力を受けながらも、異なる標的に出力する並列回路を作ることがわかりました。
並列処理は感覚情報処理の基本です。例えば視覚系は、眼で受け取られた視覚風景の中から「色」「線の傾き」「動き」といった異なる特徴を抽出して並列処理することで、エッジの効いた属性情報へと転換し、我々が「物をどう見るべきか」を一義的に決めています。本研究結果は、嗅覚並列回路も、同じように、同一セットの匂い情報の中から、何らかの特徴を抽出し、強調して、出力へとつなげていることを意味しています。嗅覚の鈍い私たち人間には嗅覚の属性情報を想像することは難しいですが、「誕生日タグづけ法」は、今後嗅覚の並列情報処理の機能的意味を知る上でも有効であると期待されます。
本研究は、日本学術振興会と文科省による科学研究費(16H04659、17H05776; 17H05587) および、ROIS未来投資型プロジェクト研究支援を受けて実施されました。
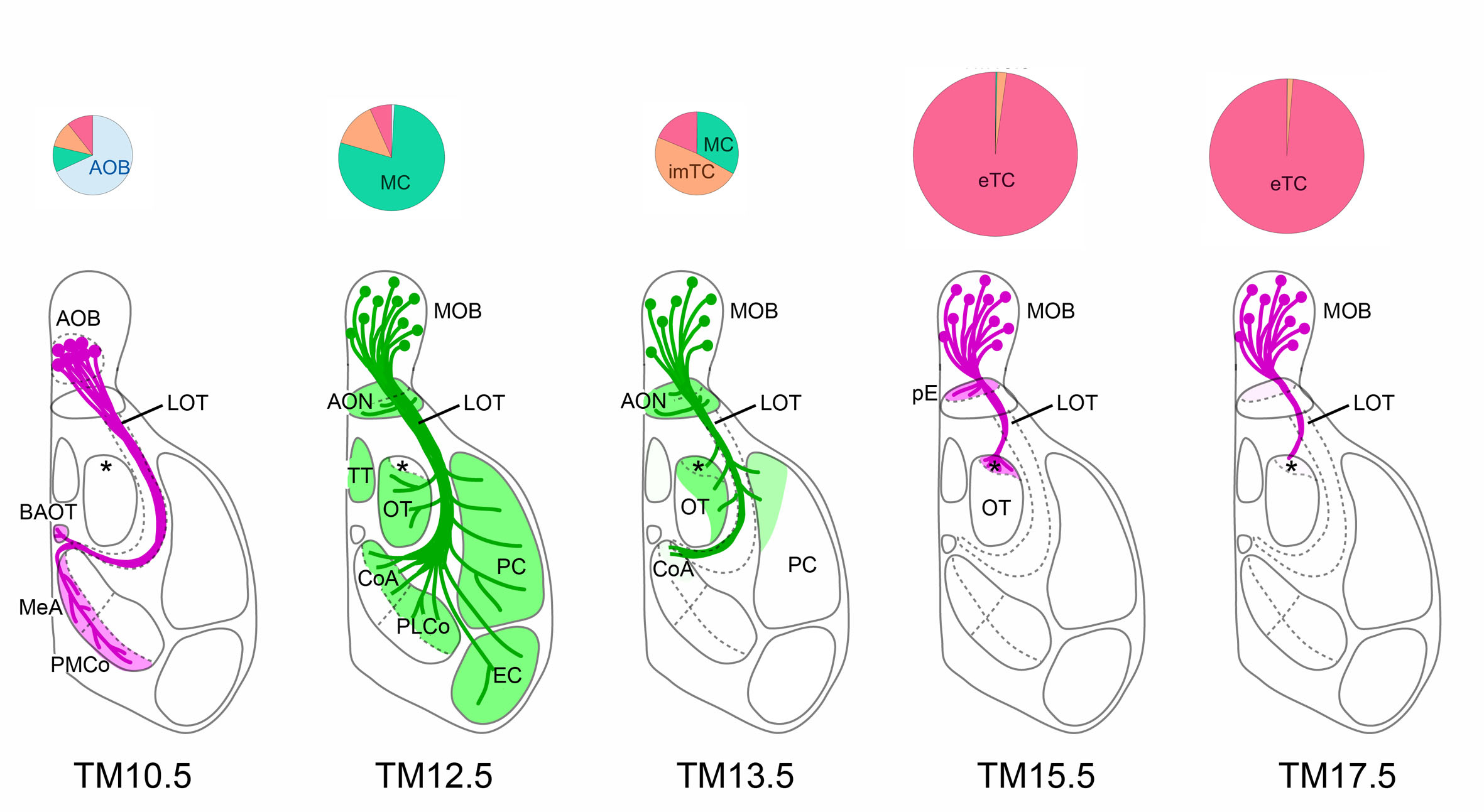
図:誕生日タグづけ法による嗅球投射神経細胞の分類と軸索投射のパターン
タグづけ時期 (TM10.5~17.5) の違いにより、副嗅球(AOB)、僧帽細胞(MC)、房飾細胞(TC)を分類でき(円グラフ)、それらが異なる標的に軸索を投射することが明らかとなった(下模式図)。
- 本技術は“誕生日タグづけ マウスの脳画像データベース”「NeuroGT」の基盤になっています。
ヒト先天異常「全前脳胞症」の発症にかかわる制御配列を発見
Press release
SHH signaling mediated by a prechordal and brain enhancer controls forebrain organization
Tomoko Sagai, Takanori Amano, Akiteru Maeno, Rieko Ajima, Toshihiko Shiroishi
PNAS first published November 4, 2019 DOI:10.1073/pnas.1901732116
わたしたちの脳は、DNA配列に書き込まれた設計図をもとに作られます。その設計図は、どの遺伝子が「どのような細胞で働き」、「どれくらいのタンパク質を生産するか」を正確に指示しています。もし、設計図が壊れて、胎児期の脳を形成する重要な時期に、遺伝子の「制御」にエラーが起これば、重篤な先天異常につながります。
情報・システム研究機構 国立遺伝学研究所の嵯峨井知子博士研究員、城石俊彦名誉教授(現理化学研究所(理研)バイオリソース研究センター(BRC)センター長)、理研BRCの天野孝紀チームリーダーらの共同研究グループは、脳の形成に重要な「遺伝子の働きを制御する」仕組みを発見しました。脳の形成には、SHH(ソニックヘッジホック)遺伝子が重要であることが知られていましたが、本研究ではこの遺伝子の遺伝子発現を調節する「制御DNA配列(エンハンサー(1))」をマウスのゲノムから見出しました。ヒトを含む他の脊椎動物ゲノム中にもこの配列に類似の配列が存在していました。そして、この配列の機能不全は、ヒトの先天異常である全前脳胞症(holoprosencephaly)の発症原因となり得ることがわかりました。
本研究成果は、米国科学雑誌「米国科学アカデミー紀要(PNAS)」に2019年11月4日午後3時(米国東部標準時間)に掲載されました。
本研究は、文部科学省のJSPS科研費 JP24247002ならびにJP15H02412の助成を受けたものです。
組織構造解析では、国立遺伝学研究所のX線マイクロCT技術が研究成果の基盤の一つになっています。
国立遺伝学研究所 3D Imaging Roomウェブサイト
生物の複雑な構造を3次元で解き明かす
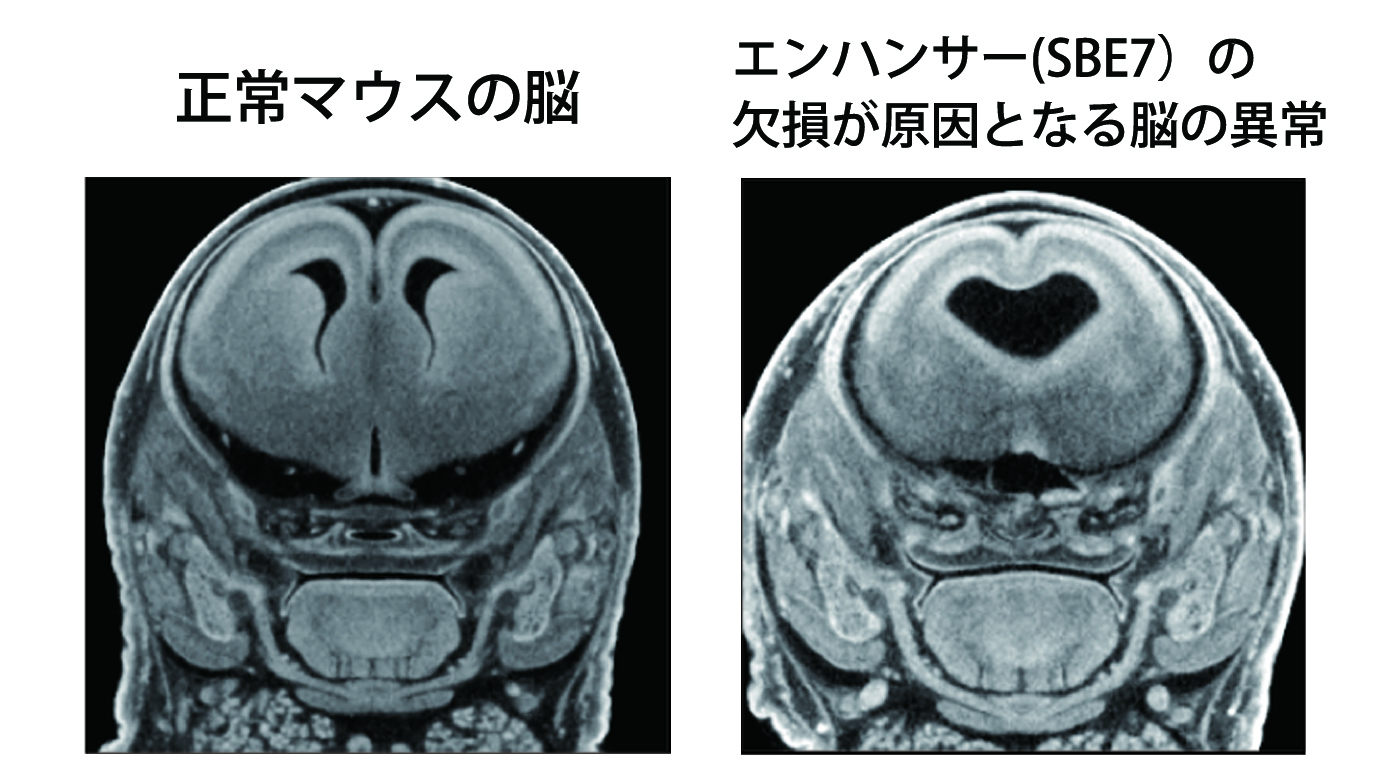
図: X線CT解析で撮影された正常マウスの脳(左)と異常をきたした脳(右)。
異常をきたした脳(右)は、エンハンサー(SBE7)の欠損によって大脳不分離となった。
卵子の前駆体形成に必須なRNA制御因子の発見
ELAVL2-directed RNA regulatory network drives the formation of quiescent primordial follicles
Yuzuru Kato, Tokuko Iwamori, Yoichirou Ninomiya, Takashi Kohda, Jyunko Miyashita, Mikiko Sato, and Yumiko Saga
EMBO reports e48251, 2019 DOI:10.15252/embr.201948251
ヒトを含む哺乳動物の卵子は原始卵胞と呼ばれる最も未成熟な卵胞の発達により産生されます。原始卵胞は出生前後の卵巣で形成され、その未成熟性を維持しつつ逐次的に卵子に成長することで、長期に渡る女性の生殖可能期間を支えています。この分子機構の破綻は早発閉経など女性不妊とも密接に関わることから、医学的にも重要な研究課題の一つです。
国立遺伝学研究所の加藤譲助教らのグループは九州大学、山梨大学との共同研究により、原始卵胞の形成に必須な2つのRNA結合タンパク質を同定しました。グループはまず、原始卵胞の形成に関わる遺伝子の探索からRNA結合タンパク質ELAVL2をコードする遺伝子Elavl2を同定しました。卵巣においてELAVL2は卵母細胞特異的に発現します。遺伝子ノックアウトによりElavl2遺伝子を破壊したところ、卵母細胞が原始卵胞形成直前に死滅することが明らかとなりました。続いて、ELAVL2に結合するメッセンジャーRNAを解析したところ、ELAVL2がP-bodyと呼ばれるRNAとタンパク質複合体から成る細胞質顆粒因子のメッセンジャーRNAと結合することを見出しました。さらに、ELAVL2の標的RNAの一つであり、P-body形成に必須のRNAヘリカーゼであるDDX6をノックアウトしたところ、P-body様の顆粒および原始卵胞の形成が著しく阻害されることを見出しました。すなわち、ELAVL2に始まる一連のRNA制御機構が原始卵胞の形成に重要であることが示されました。これらの知見は原始卵胞形成の分子機構の理解と生殖医療の発展に貢献することが期待されます。
本研究は以下の支援を受けて行われました。 日本学術振興会[(No.17K07422加藤譲)、(No.26251025相賀裕美子) 文部科学省新学術領域[(No.26114512, 16H01259, 19H05246加藤譲)、(No.26114506岩森督子)]
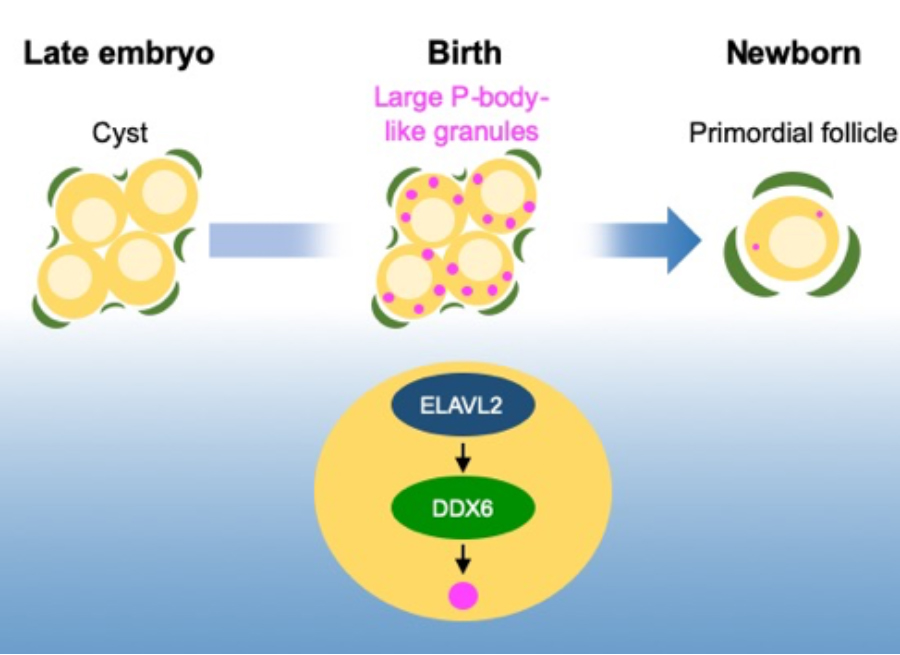
図:マウスにおいて原始卵胞(Primordial follicle)は出生直後に形成される。原始卵胞の形成に先立ち卵母細胞(黄色)の細胞質にはP-body様の細胞質顆粒が形成される。RNA結合タンパク質ELAVL2とDDX6はこの顆粒の形成および原始卵胞の形成に必須である。
トゲウオ特集号が米国誌より刊行

特別寄稿「国立遺伝学研究所の70年」が生物の科学「遺伝」2019年11月号に掲載されました

前島教授が米国JCB誌の People & Ideas 欄で紹介されました
ゲノムダイナミクス研究室 前島一博教授が米国Journal of Cell Biology誌 (Rockefeller University Press) のインタビューを受け、People & Ideas欄で詳しく紹介されました。
JCB People & Ideas欄は、個々の科学者が今までどのような道を辿ってきたかを伝えるためのインタビュー記事です。読者に科学的な側面だけでなく、科学者個人にも光を当てることを目的としており、科学者達のユニークな体験や興味・考えをハイライトしています。
不具合を解決:セミナー情報が正しく表示されないエラーについて
いつもご利用いただきありがとうございます。
一部のブラウザのバージョンにおいてセミナー情報が正しく表示されない不具合が発生していましたが解決しました。
引き続きセミナー情報をご利用いただけます。
生きたヒト細胞のDNAの流動的な動きを捉えた
Press release
Organization of fast and slow chromatin revealed by single-nucleosome dynamics
S. S. Ashwin, Tadasu Nozaki, Kazuhiro Maeshima, and Masaki Sasai
PNAS first published September 16, 2019 DOI:10.1073/pnas.1907342116
名古屋大学大学院工学研究科の S.S. Ashwin 特任助教、笹井 理生 教授のグループは、国立遺伝学研究所の 野崎 慎 日本学術振興会特別研究員 (現ハーバード大研究員)、前島 一博 教授のグループとの共同研究により、ヒト細胞核の中でゲノムDNAが多様で流動的な動きを示すことを明らかにしました。共同研究グループは超解像蛍光顕微鏡を駆使して、生きた細胞内のゲノムDNAを観測し、その動きを統計的に分析しました。その結果、ゲノムDNAの中で速く動く部分と遅く動く部分があり、それぞれ特徴的な塊を形成して、細胞の状態に応じてその比率が大きく変わることを発見しました。遅い部分は、細胞核膜周辺のラミンや核の中のコヒーシンと呼ばれるタンパク質などによって、ゲノムDNAの動きが束縛されて産み出されていると思われます。本研究によって、DNAは生きた細胞の中で大きく揺らいでいて、その動きと細胞の性質に密接な関連があることが明らかになりました。この成果は、DNAの変化に伴って生じる細胞の異常や関連する疾患の理解につながることが期待されます。
本研究は、科学技術振興機構・戦略的創造研究推進事業(CREST) (JPMJCR15G2)、科研費新学術領域研究「クロマチン潜在能」(JP19H05258、JP19H05273) 科研費新学術領域研究「先進ゲノム支援」(JP16H0627)、科研費基盤研究B(JP19H01860、JP16H04746)、武田科学振興財団、RIKEN Pioneering Project、遺伝研共同研究(2016-A2(6))の支援を受けました。
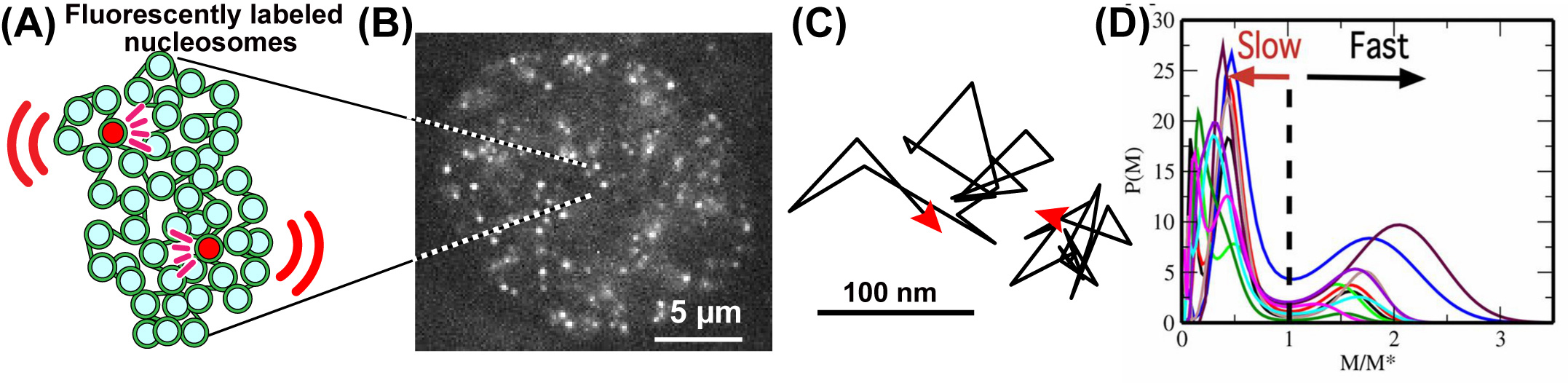
図: A)少数のヌクレオソーム(DNAがヒストンと呼ばれるタンパク質に巻かれたもの)を蛍光標識する(赤)ことにより、ヌクレオソーム1個1個の動きを調べることができる。(B)超解像蛍光顕微鏡による核内のヌクレオソーム画像。1個1個のドットが1個1個のヌクレオソームを示している。Nozaki et al. (2017) より転載。(C) 個々のヌクレオソームの動きを1コマ50ミリ秒で追跡した軌跡。(D) 観測された個々のヌクレオソームの動きの大きさを平均二乗変位で測ると、ヌクレオソームの個数分布はふた山にわかれ、速いヌクレオソーム(クロマチン)と遅いヌクレオソーム(クロマチン)があることがわかる。図は10個の細胞についての観測結果を重ねて描いたもの。
動画: 超解像蛍光顕微鏡による細胞核内 ヌクレオソーム 動き 動画。1 個 1 個のドットが 1 個 1 個 ヌクレオソームを示している。 1 コマ 50 ミリ秒。Nozaki et al. (2017) より転載。
MCM8–9経路の相同組換えを制御する新規因子HROB
Control of homologous recombination by the HROB–MCM8–MCM9 pathway
Nicole Hustedt, Yuichiro Saito, Michal Zimmermann, Alejandro Álvarez-Quilón, Dheva Setiaputra, Salomé Adam, Andrea McEwan, Jing Yi Yuan, Michele Olivieri, Yichao Zhao, Masato T. Kanemaki, Andrea Jurisicova, and Daniel Durocher
Genes & Development online advanced publication DOI:10.1101/gad.329508.119
人を含む多くの生物は、両親からそれぞれ1つずつ受け継ぐことで、合計2コピーのゲノムを遺伝情報として持っています。相同組換えはこの2コピーのうち、一方を鋳型として、もう一方を上書きする反応です。相同組換えは配偶子(精子と卵子)形成時の減数分裂に関与するだけでなく、DNA複製中のDNAや放射線で損傷したDNAを修復することに寄与しており、これにより細胞死や発癌などが抑制されます。
相同組換えは主に二つのステップで構成されます。つまり、(1)長いゲノムの中から目的の情報がある部位を探索し、(2)その領域の情報をコピーすることで元の情報を鋳型の情報に上書きします。多くの研究から、情報を探索する反応については詳細がわかってきていますが、コピーする反応の詳細はよくわかっていませんでした。これまでに我々はこのコピー反応に重要な機能を持つMCM8-9の機能を解析してきましたが、今回カナダトロント大学のDaniel Durocher教授ら研究グループと共同でMCM8-9をコピーすべき部位に連れてくる新たな因子HROBを発見しました。MCM8-9と同様に、HROBを欠損した細胞はDNA複製時に機能するDNA修復に異常を持ち、HROBノックアウトマウスも不妊になることから、HROBがMCM8–9とともに正常に機能することがゲノム維持と減数分裂に重要であることが明らかとなりました。HROBとMCM8-9が関与する相同組換えメカニズムの理解が進むことで、癌治療や不妊治療などの応用につながる可能性が期待されます。
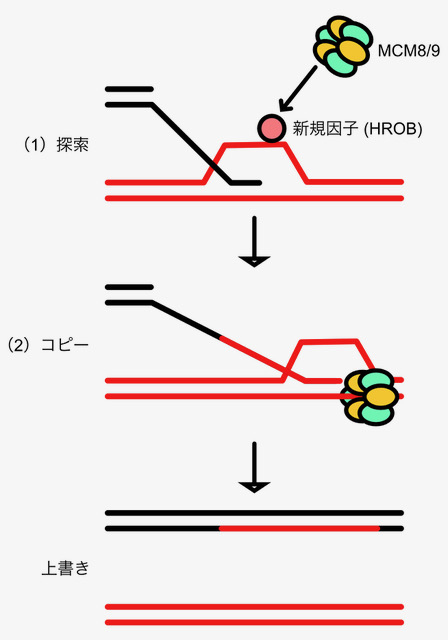
図:相同組換えは(1)目的の情報を探索し、(2)情報をコピーすることで元の情報を鋳型の情報に上書きします。この反応に必須であるMCM8–9を必要な部位に集める新しい因子としてHROBタンパク質を同定しました。
「大学共同利用機関シンポジウム2019」を10月20日(日)に開催
「寺deサイエンス」を開催:10月11日(金)
日 時: 10月11日(金)19:00~20:30(受付:18:30~)
場 所: 君澤山 蓮馨寺(三島市広小路町1-39)
内 容:『新聞・テレビ・ラジオから学ぶサイエンス』
第1部:科学記事をどう読むか
話し手:川内十郎氏(静岡新聞社文化生活部長・論説委員)
聞き手:五條堀 孝 (遺伝学普及会 共同代表理事、
サウジアラビア科学技術大学特別栄誉教授)
第2部:NHKスペシャル制作者が語る、驚きカガク舞台裏
話し手:結城仁夫氏 (NHK科学番組チーフ・ディレクター)
聞き手:小林 武彦 (遺伝学普及会 共同代表理事、東京大学教授)
対 象: サイエンスに関心のある一般の方
定 員: 70名(申込多数の場合は、遺伝学普及会維持会員優先の上、他抽選)
参加費: 1000円
申し込み: 公益財団法人遺伝学普及会 事務局まで
①氏名 ②性別 ③住所 ④電話番号 を明記の上、メール・はがき・FAXでお申込みください。電子申請も可能です。
【問い合わせ・申し込み】
〒411-8540 三島市谷田1111
公益財団法人遺伝学普及会 事務局
TEL:055-981-6857、 FAX:055-981-6877
Email:genetics@nig.ac.jp
魚で見つかったレム睡眠とノンレム睡眠
Neural signatures of sleep in zebrafish.
Louis C Leung, Gordon X Wang, Romain Madelaine, Gemini Skariah, Koichi Kawakami, Karl Deisseroth, Alexander E Urban, and Philippe Mourrain
Nature 571(7764) 198-204 (2019) DOI:10.1038/s41586-019-1336-7
徐波睡眠(ノンレム睡眠)と急速眼球運動睡眠(レム睡眠)は、哺乳類、鳥類、爬虫類で見つかっているが、このようなニューロンのシグネチャーが羊膜類以外の脊椎動物でも見られるかどうかは不明であった。今回我々は、ゼブラフィッシュにおける非侵襲性の蛍光睡眠ポリグラフィー検査(fPSG)を開発し、脳全体の不偏的な活動 記録と、眼球運動、筋肉運動および心拍の評価と組み合わせることで、ゼブラフィッシュには少なくとも2つの大きな睡眠シグネチャーがあることを示した。我々はこれらのシグネチャーを徐バースト型睡眠 (SBS)および伝搬波型睡眠(PWS)と命名した。これらは、それぞれ徐波睡眠(ノンレム睡眠)とレム睡眠に共通する性質を有している。さらに、哺乳類の睡眠に関連するメラニン凝集ホルモンシグナル伝達が、ゼブラフィッシュにおいてもPWSシグネチャーと全体的な睡眠量を調節していることを見いだした。これらの観察結果は、哺乳類と魚類で共通する睡眠の神経シグネチャーは、4億5000万年以上前の脊椎動物の脳で生じたであろうことを示唆している。
本研究は、国立遺伝学研究所と米国スタンフォード大の共同研究として行われました。
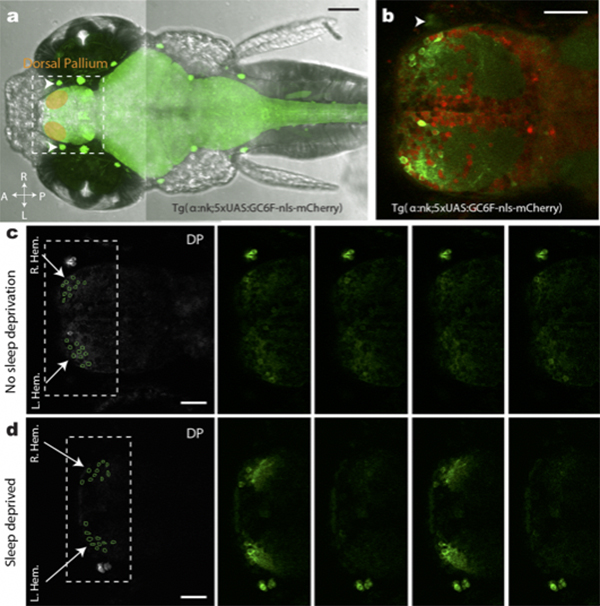
図:(a,b)カルシウムイメージングに用いたトランスジェニックゼブラフィッシュ(c)睡眠非遮断フィッシュ(d)睡眠遮断フィッシュに見られる徐バースト型睡眠
▶この研究の基盤となった研究はこちらです。
















