Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
インドネシアの古代湖はメダカの進化のゆりかご ~スラウェシ島の湖で3種のメダカが同所的に種分化したことを証明~
Press release
Evidence for sympatric speciation in a Wallacean ancient lake
Nobu Sutra, Junko Kusumi, Javier Montenegro, Hirozumi Kobayashi, Shingo Fujimoto, Kawilarang W. A. Masengi, Atsushi J. Nagano, Atsushi Toyoda, Masatoshi Matsunami, Ryosuke Kimura, Kazunori Yamahira
Evolution 13 August 2019 DOI:10.1111/evo.13821
琉球大学の山平寿智教授、松波雅俊助教、木村亮介准教授、九州大学の楠見淳子准教授、龍谷大学の永野惇准教授、および国立遺伝学研究所の豊田敦特任教授らの共同研究チームによる研究成果が、進化学の国際学術雑誌「Evolution」誌に掲載されます。※本日オンライン版に掲載されました。
<発表のポイント>
◆インドネシアのスラウェシ島の古代湖に生息する3種のメダカが、1つの湖の中で同所的に3種に分化したことを明らかにしました。
◆種の誕生=種分化は、通常集団が別々の場所に隔離されることが引き金となります。隔離を伴わない“同所的種分化”の実証例はこれまでに数例しか知られていませんでした。種分化の仕組みの一端を明らかにしたことは、地球上の生物多様性の成り立ちを知る上で重要な研究成果です。
◆メダカは日本が誇る生物学のモデル生物です。今後は、同所的種分化の原因遺伝子の特定など、モデル生物としての利点を活かした種分化研究の展開が期待されます。
国立遺伝学研究所の貢献
国立遺伝学研究所 比較ゲノム解析研究室は、先進ゲノム支援の一環として、インドネシアの
スラウェシ島ボソ湖に生息する3種のメダカの多型情報を得るために必要な参照配列(セレベ
ンシスメダカのゲノム)を主にPacBio Sequelのロングリードを用いて構築しました。

図: インドネシアのスラウェシ島の古代湖と古代湖に生息する3種のメダカ
[遺伝研70周年記念] 第二部パネルディスカッションをまとめたPDFを公開

6月1日に開催された遺伝研70周年記念講演会では、第二部にてパネルディスカッションがおこなわれました。
パネルディスカッションでは、小林武彦日本遺伝学会長、桂勲遺伝研前所長、大隅良典東工大栄誉教授の3名がパネラーとして登壇し、
「遺伝学について」、「3人の出会い」、「高校生の質問」などが話題となりました。
これらの内容をPDFにまとめ、以下のリンクから公開しました。
▶ PDFリンク
川上教授・鈴木准教授が「遺伝学講座・みしま」で講演
遺伝学講座・みしま
最新の研究についてわかりやすくお話しします。この機会に生命の不思議、遺伝について学んでみませんか。
内容:
発生遺伝学研究室 川上浩一教授
「モデル生物ゼブラフィッシュで生命の謎を解く」
遺伝子回路研究室 鈴木えみ子准教授
「ミクロの世界の遺伝学~電子顕微鏡で解き明かす生命の不思議~」
対象:
三島市民及び近隣住民(先着350人)
日時:
令和元年9月29日(日)
18時00分から20時00分(開場17時30分)
場所:
三島市民文化会館小ホール(一番町20番5号)
申込:
要申込
三島市政策企画課までお申込みください。
申込時に、①代表者名②人数③連絡先 をお伝えください。
申込締切は令和元年9月24日(火)です。
FAX:055-973-5722
E-mail: seisaku@city.mishima.shizuoka.jp
ゼブラフィッシュ研究からわかった「てんかん発作」の新しい仕組み ―てんかん発作へのグリア細胞ネットワークの関与―
Press release
Glia-neuron interactions underlie state transitions to generalized seizures
Carmen Diaz-Verdugo, Sverre Myren-Svelstad, Ecem Aydin, Evelien van Hoeymissen, Celine Deneubourg, Silke Vanderhaeghe, Julie Vancraeynest, Robbrecht Pelgrims, Mehmet LLyas Cosacak, Akira Muto, Caghan Kizil, Koichi Kawakami6, Nathalie Jurisch-Yaksi & Emre Yaksi
Nature Communications 10, Article number: 3830 (2019) DOI:10.1038/s41467-019-11739-z
重篤なてんかん発作が発生すると脳神経細胞のはたらきとつながりが大きく変化します。この変化を通して、脳神経細胞のネットワークはバランスのとれた安静状態から、きわめて活動的、同期的になります。しかしながら、この変化の根底にあるしくみはわかっていませんでした。
情報・システム研究機構 国立遺伝学研究所の川上浩一教授らとノルウェー科学技術大学カヴリ統合神経科学研究所ほかの共同研究グループは、モデル生物のゼブラフィッシュにおいて、てんかん発作を人為的に発生させて、脳全体の神経細胞とグリア細胞の活動をカルシウムイメージングによって調べました。その結果、てんかん発作直前に、神経細胞に先んじてグリア細胞のネットワークが大きく活動することを見出しました。
これまでのてんかん治療薬は、神経細胞やその活動をターゲットにしたものが主流でしたが、この研究成果によってグリア細胞やその活動をターゲットにしたてんかん治療薬の開発が期待できます。
本研究成果は、英国科学雑誌「Nature Communications」に2019年8月23日午前10時(英国夏時間)に掲載されました。
- 脳に写される視覚世界をカルシウムセンサーGCaMPでリアルタイム可視化
以下の実験技術が本研究成果の基盤の一つになっています。
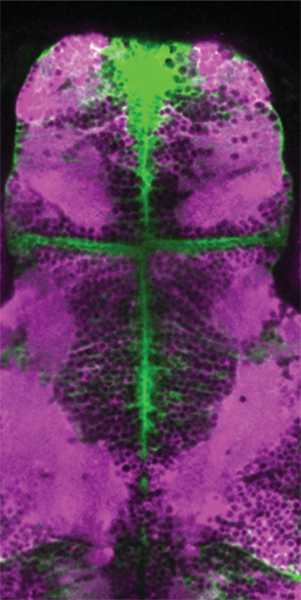
図: ゼブラフィッシュ脳のグリア細胞の活動のカルシウムイメージング
ゼブラフィッシュの稚魚で人為的にてんかんを発生させたときのグリア細胞の活動の様子をカルシウムイメージングで記録した。紫色の部分がグリア細胞ネットワークを示す。
微生物ゲノムの遺伝子アノテーションおよびDDBJ登録支援ツール DFAST
DFAST: a flexible prokaryotic genome annotation pipeline for faster genome publication
Yasuhiro Tanizawa, Takatomo Fujisawa, Yasukazu Nakamura
Bioinformatics 34(6) 1037-9, 2018 DOI:10.1093/bioinformatics/btx713
新型シークエンサーの利用が広がる微生物のゲノム研究においては大量のゲノムデータを高速に処理することが求められつつあります。また一方で、新規解読された塩基配列は公共塩基配列データベースに登録することが学術雑誌への論文掲載の必須条件となっており、煩雑な登録手続きは研究者の大きな負担ともなっています。DDBJ Fast Annotation and Submission Tool (DFAST) は微生物ゲノムアノテーションおよびDDBJへの塩基配列登録支援を目的に開発された解析パイプラインです。画面上の操作のみでDDBJへの塩基配列登録に必要なファイルを生成することができるウェブ版と、コマンドラインで動作し大量データ処理や解析ワークフローの自由なカスタマイズを特長とするスタンドアローン版が開発されており、https://dfast.ddbj.nig.ac.jp で利用可能となっています。典型的なゲノムサイズのバクテリアであれば5分でアノテーションを行うことができ、偽遺伝子の検出やセレノシステイン等のアミノ酸翻訳時の例外検出などの独自の機能も持っています。
実験研究者とバイオインフォマティシャンのどちらにとっても使いやすいツールを目指した本ツールにより、微生物研究におけるゲノムデータの利用を一層促進することが期待されます。
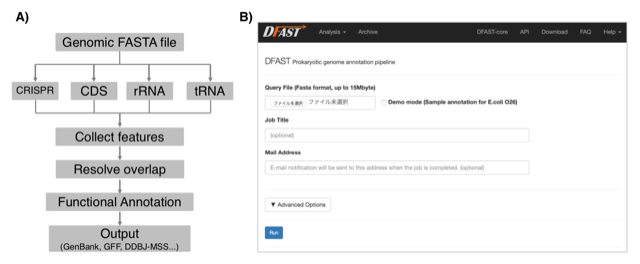
図:A) DFASTのアノテーションワークフロー。B) ウェブ版DFASTのジョブ投入フォーム
先進ゲノム支援「情報解析講習会」を10月9-11日に開催(申込〆切9月10日)
イネの花粉形成を司る葯タペート細胞でオートファジーの可視化に成功
Monitoring autophagy in rice tapetal cells during pollen maturation.
Shigeru Hanamata, Jumpei Sawada, Bunki Toh, Seijiro Ono, Kazunori Ogawa, Togo Fukunaga, Ken-Ichi Nonomura, Takamitsu Kurusu, Kazuyuki Kuchitsu.
Plant Biotechnology 36 (2): 99-105 (2019) DOI:10.5511/plantbiotechnology.19.0417a
オートファジーは、真核生物に広く存在するタンパク質や脂質など生体分子の大規模な分解系です。最近では、我々の主食である穀物イネの正常な花粉・種子の形成にも必須の役割を果たすことがわかっています。本論文では、イネの花粉への栄養・材料の供給組織である葯タペート細胞における、時空間的なオートファジー動態の定量解析手法を開発しました。
タペート細胞においてオートファジーの誘導過程を可視化するために、タペート細胞で特異的に発現する遺伝子のプロモーターを用いて、オートファゴソーム(用語解説)の形成に必要なATG8とGFPの融合タンパク質をイネで誘導し、解析を行いました。タペート細胞の細胞質特異的にオートファゴソーム様の構造体が観察されるとともに(図1A)、葯の発達ステージ毎の3次元画像解析から、特定のステージからタペート細胞全体にオートファジーが誘導されることが明らかになりました(図1B)。
今後は、多様なイネの葯発達に異常を示す変異体群に本技術を適用することで、穀物イネの葯発達のしくみや、その過程におけるオートファジーの重要性を明らかにできると期待されます。さらに、地球環境変動などの要因により、イネの品質や収量の低下が懸念される中で、それを防ぐ新たな技術開発への貢献も期待されます。
本研究は、東京理科大学、公立諏訪東京理科大学、国立遺伝学研究所の共同研究成果であり、NIG-JOINT (84A2018)の支援を受けました。
用語解説
オートファゴソーム:オートファジーを担う、細胞内の二重膜に包まれた球状の構造体
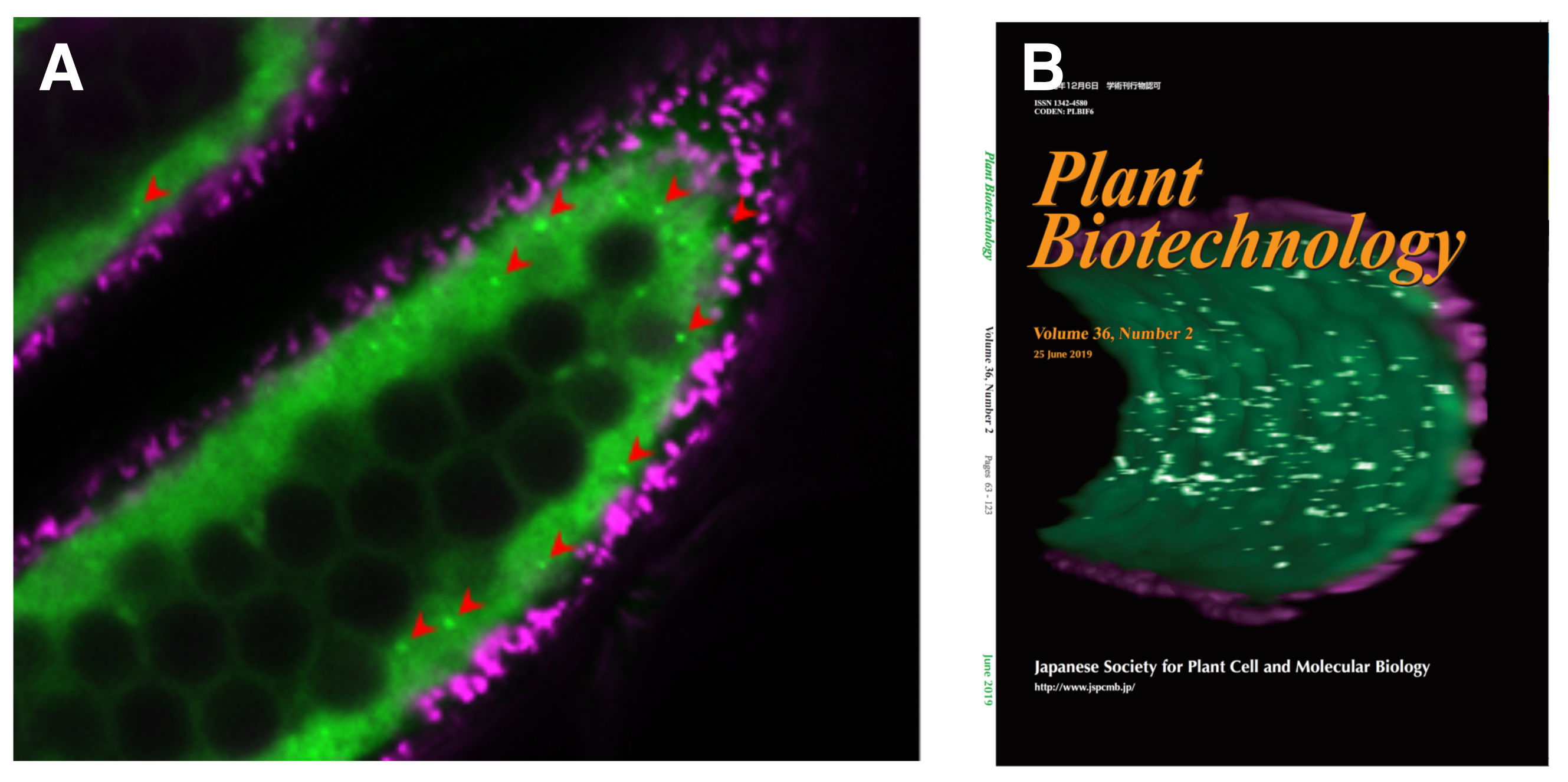
図:イネの葯におけるオートゴソーム/細胞内オートファジー関連構造体の可視化
(A) GFP-ATG8を発現するイネの葯の縦断切片の、レーザー共焦点蛍光顕微鏡による可視化解析。中央の黒い多数の球状の構造物は、将来花粉になる小胞子。GFP-ATG8はタペート組織全体に分布し(緑)、しばしばオートファゴソーム様のドット(赤い矢頭)として検出される。タペートを取り囲むマジェンタのシグナルは、葯壁細胞のクロロフィルの自家蛍光。(B) オートファジーが進行中の葯の3D再構築画像。 「図は掲載誌より転載」
神経回路構築研究室 中沢研究員が「時実利彦記念神経科学優秀博士研究賞」を受賞

神経回路構築研究室の中沢さんが、2019年7月に開催されたNEURO2019(第42回日本神経科学大会・第62回日本神経化学会大会合同大会)において「時実利彦記念神経科学優秀博士研究賞」を受賞しました。
この賞は、神経科学・脳科学分野における大学院学生による優秀な研究への助成により、同分野の若手研究者を顕彰し、日本における同分野の研究の更なる発展を促進することを目的として、在学中もしくは、博士号取得2年以内の研究者に贈られるものです。
▶ 学会HP:日本神経科学学会 「時実利彦記念神経科学優秀博士研究賞」受賞者一覧
▶ 受賞テーマ:新生仔マウス大脳皮質の長期in vivoイメージングによる神経回路再編の動的機構の解明
中沢さんは総合研究大学院大学で2018年9月に学位を取得しており、その際 総合研究大学院大学の「SOKENDAI 賞」、
遺伝学専攻の「森島奨励賞」も受賞しています。
マウスが黒毛になるしくみ、四半世紀を経て解明 ―江戸時代の愛玩用ねずみから受け継がれた遺伝子―
Press release
Nested retrotransposition in the East Asian mouse genome causes the classical nonagouti mutation
Akira Tanave, Yuji Imai, Tsuyoshi Koide
Communications Biology 2 August 2019 10.1038/s42003-019-0539-7
マウス遺伝学の「ABC」をご存知でしょうか?aは黒色の毛色になる変異、bは茶色の毛色になる変異、cは白色の毛色(アルビノ)になる変異です。(図1)このABCは、マウス遺伝学の黎明期にアルファベットの一文字で有名な変異が順番に表記されたことに由来し、これらの変異を「古典的変異」と呼びます。黒色の毛色になるaはノンアグーチとよばれ、その原因は1994年の論文で報告されました。その論文によると、Agouti遺伝子内にVL30というレトロウイルス様配列が挿入されたことで毛色が野生色の茶色から黒色に変化したとされ、今までの四半世紀の間、広く信じられてきました。
情報・システム研究機構 国立遺伝学研究所の田邉彰研究員と小出剛准教授らの研究グループは、VL30の挿入が原因ではなく、この配列の中にさらに入れ子状に挿入された別のタイプのレトロウイルス様配列(β4)が、黒色の毛色の真の原因であることをつきとめました。(図2)また、この黒毛変異は日本産愛玩用マウスを起源としていることを発見しました。(図3)この黒毛変異は現在の標準的な実験用マウス系統の多くに共通してみられることも分かりました。
本研究成果は、マウス実験で古くから利用されている黒毛変異の理解を深めるとともに、レトロウイルス様配列の挿入に起因する遺伝子変異のしくみおよびゲノム進化の理解に貢献すると期待されます。
本研究成果は、英国科学雑誌「Communications Biology」に2019年8月2日午前10時(英国夏時間)に掲載されました。
本研究の一部は、科研費(基盤研究B)「新規野生由来ヘテロジニアスマウス集団を用いた不安障害モデルの確立」、科研費(基盤研究B)「動物のヒトへのなつき行動における遺伝子・神経回路および行動学的基盤の解明」の支援を受けておこなわれました。

図1: 代表的な実験用系統C57BL/6 (B6)と野生系統MSM
(左)B6系統は黒毛のノンアグーチ変異(a)を有することで知られている。他にも多数の実験用系統がノンアグーチ変異を持つ。
(右)日本産の野生系統MSM。アグーチ(A)の遺伝子型で野生色(茶色)を示す。
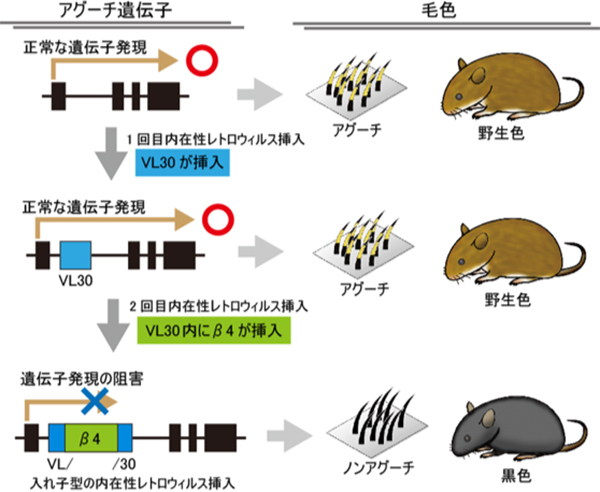
図2: アグーチ遺伝子へのレトロウイルス様配列挿入が引き起こす黒色の毛色
古典的変異であるノンアグーチは、2段階のレトロウイルス様配列の挿入により生じた。アグーチ遺伝子のイントロン内にレトロウイルス様配列のVL30が挿入されたが、アグーチの毛色に変化は生じない。次にVL30内にレトロウイルス様配列β4が挿入されたことで、アグーチ遺伝子の発現が遮断され、黒色の毛色が生じた。ゲノム編集によりβ4配列のみを削除したβ4-delマウスと、β4を含むVL30全体を削除したVL30-delマウスは、ともに茶色のアグーチ表現型を示したことにより、β4が黒色に毛色を変化させる主要な役割を果たしていることがわかる。
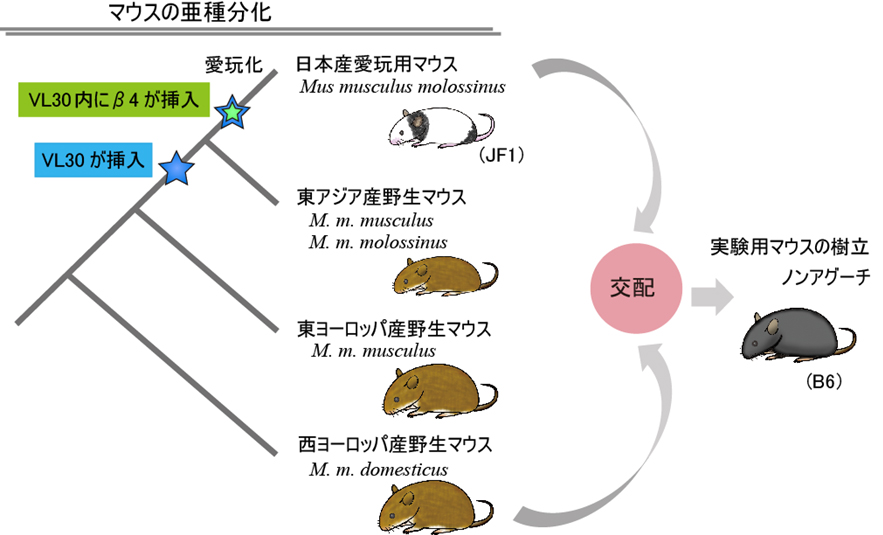
図3: 古典的変異ノンアグーチ(黒毛)と日本産愛玩用マウスとの関連
VL30配列は、東アジア産野生マウスにおいてアグーチ遺伝子に挿入された。その後、日本産愛玩用マウスがつくられるまでの過程でVL30内にβ4の挿入が生じて、黒毛となった。日本産愛玩用マウスと標準的な実験用マウスの間で同じ黒毛変異が共有されていることから、ノンアグーチ変異は日本産愛玩用マウスから広まったものであることが分かった。実験用マウスB6と日本産愛玩用マウスJF1は、ともにβ4の挿入を持ち黒毛になる。
▶ Nature Research Ecology & Evolution Communityの”BEHIND THE PAPER”に小出准教授による紹介記事が掲載されました。
Reexamining the a of Mouse Genetics A to Z
▶本成果に関する小出准教授の”Comment”が同学術誌に掲載されました。
A role for the rare endogenous retrovirus β4 in development of
Japanese fancy mice(PDF)
藻類のオイル生産を制御する因子を同定-有用脂質生産の自在制御に向け大きな一歩-
Press release
LIPID REMODELING REGULATOR 1 (LRL1) is differently involved in the phosphorus-depletion response from PSR1 in Chlamydomonas reinhardtii
Nur Akmalia Hidayati, Yui Yamada-Oshima, Iwai Masako, Takashi Yamano, Masataka Kajikawa, Nozomu Sakurai, Kunihiro Suda, Kanami Sesoko, Koichi Hori, Takeshi Obayashi, Mie Shimojima, Hideya Fukuzawa, Hiroyuki Ohta
The Plant Journal 27 July 2019 DOI:10.1111/tpj.14473
東京工業大学 生命理工学院のNur Akmalia Hidayati(ヌル アクマリア ヒダヤティ)博士後期課程3年、堀孝一助教、太田啓之教授、下嶋美恵准教授、岩井雅子特任助教と京都大学 福澤秀哉教授、東北大学 大学院情報科学研究科 大林武准教授、かずさDNA研究所 櫻井望チーム長(現所属・国立遺伝学研究所)らの研究グループは、バイオ燃料をはじめとする有用脂質生産に活用が期待される藻類の一種「クラミドモナス」(用語1)で、リンや窒素の栄養欠乏時に起こるオイルの蓄積を制御する因子の同定に成功しました。またこの制御因子は、特に栄養欠乏時の細胞内にオイルが大量に蓄積する時期に機能する主要な制御因子であることも突き止めました。
今回、種々の藻類で広く見られる栄養欠乏時のオイルの大量蓄積を制御する制御因子を見出したことで、明らかになった脂質蓄積の制御の機構や制御因子自体を、藻類で生産する有用脂質の種類や生産の時期を自在にコントロールするための仕組みづくりに活用することが期待されます。
藻類はリンや窒素などの栄養欠乏時に細胞内にオイルを多量に蓄積することが広く知られています。この仕組みの解明が藻類で様々な有用脂質を自在に生産するための大きな手掛かりになると考えられていました。
研究成果は7月27日発行の英国科学雑誌「プラント ジャーナル(The Plant Journal)」に掲載されました。
本研究は、科学研究費基盤研究A、科学技術振興機構 産学共創プラットフォーム共同研究推進プログラム(OPERA) 「ゲノム編集による革新的な有用細胞・生物作成技術の創出」研究領域(研究総括:山本卓(広島大学教授))における研究の一環として行われました。
本成果におけるメタボローム解析の基盤となった解析ツールやデータベースは下記のサイトから入手できます。
KOMICS (The Kazusa Metabolomics Portal)
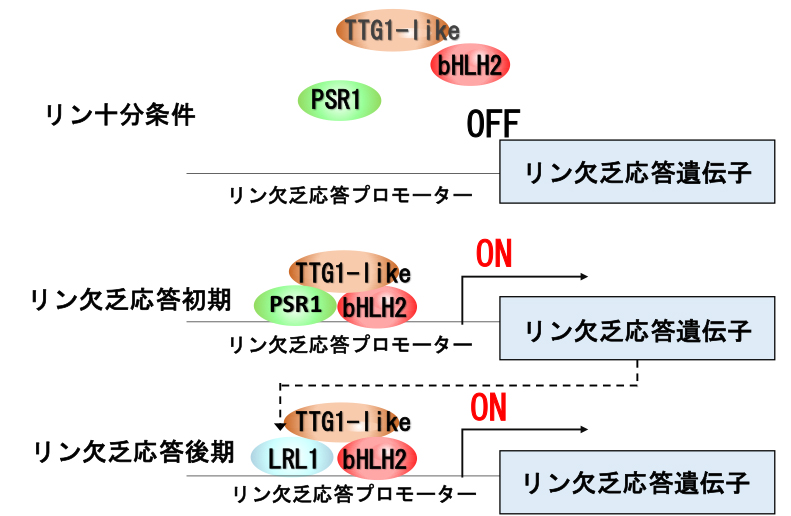
図: リン欠乏時におけるLRL1の機能のモデル
LRL1は、他の転写因子bHLH2や、制御因子の連結に関わる因子TTG1と共同してリン欠乏応答遺伝子の発現誘導に直接働いていることが明らかになった。
夏季休業のお知らせ(8/15,16)
本研究所は、下記のとおり夏季一斉休業を実施します。
ご不便をおかけいたしますが、ご理解とご協力のほどお願いいたします。
令和元年8月15日(木)、16日(金)
危険な光合成に依存しながら安全に増殖する細胞
Day/Night Separation of Oxygenic Energy Metabolism and Nuclear DNA Replication in the Unicellular Red Alga Cyanidioschyzon merolae.
Shin-ya Miyagishima, Atsuko Era, Tomohisa Hasunuma, Mami Matsuda, Shunsuke Hirooka, Nobuko Sumiya, Akihiko Kondo, Takayuki Fujiwara
mBio 10(4), e00833-19, 2019 DOI:10.1128/mBio.00833-19
光合成は約30億年前にシアノバクテリアにおいて誕生し、その後シアノバクテリアが真核細胞内に共生して葉緑体となることで真核細胞に導入され種々の藻類と植物が進化しました。さらに単細胞の真核藻類が様々な系統の真核細胞内に共生することで光合成は真核生物の複数の系統に広がりました。
光合成は地球上の生命の生育を支える一方で、高濃度の活性酸素種を生じDNA、タンパク質、脂質などを損傷します。陸上植物においては、細胞増殖は茎頂および根端等の光合成を行わない分裂組織に限定され、「危険な光合成」と「DNAを安全に複製すべき細胞増殖と次世代個体の創出」は場所(組織)によって分業されています。一方で、陸上植物よりも先に地球上に出現し、陸上植物の祖先でもある単細胞藻類では、同一細胞が光合成を行い分裂増殖しますが、光合成の危険性にどの様に対処しながら増殖しているかは不明でした。
国立遺伝学研究所の宮城島教授・恵良元研究員らと神戸大学の蓮沼教授・近藤教授らの共同研究グループは、単細胞紅藻を用いた解析を行い以下のことを明らかにしました。(1)葉緑体の光合成とミトコンドリアの呼吸(光合成ほどでは無いがこちらも活性酸素種を生じる)活性が朝方最大となり夕方に向けて低下する、(2)光合成・呼吸に比べるとエネルギー変換効率が低い解糖・発酵系が夕方から夜に活性化される、(3)核のDNA複製と細胞分裂は夜間におこる、(4)夜間の細胞に光を当てて光合成を行わせるとDNAの損傷頻度が高くなる。
以上の結果、活性酸素種を生じる光合成と、葉緑体と同様にバクテリアの細胞内共生によって誕生したミトコンドリアにおける呼吸活性が低下する夕方から夜間にDNA複製を行うことで「安全な」細胞増殖が行われていることが明らかとなりました。同様の結果は葉緑体成立後間もなく紅藻と分岐した緑藻でも見られました。
つまり宿主であると真核細胞と共生体である葉緑体・ミトコンドリアの時間分業により、お互いの対立が回避されることで光合成真核細胞が成立したと考えられます。 本研究は、科研費(基盤A、17H01446)とJST・未来社会創造事業などの支援を受けて行われました。
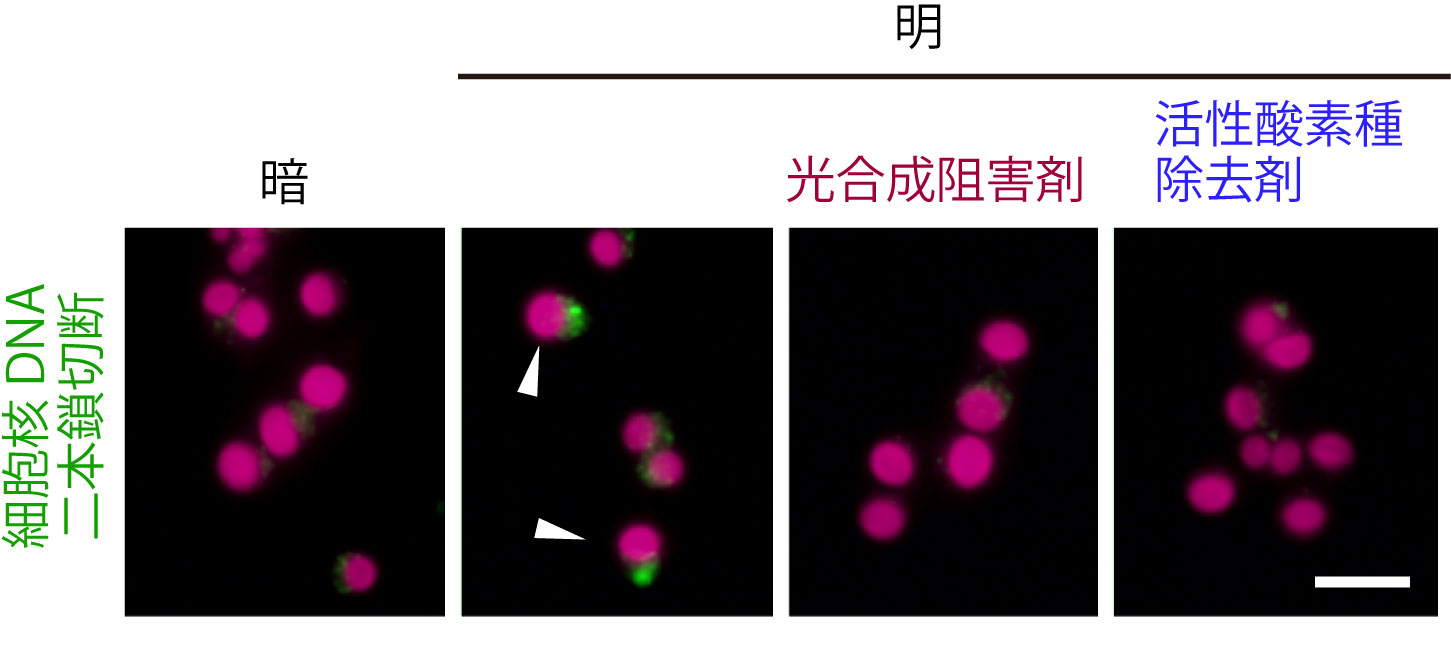
図1:単細胞紅藻Cyanidioschyzon merolaeを明暗周期培養し、夜の初期の細胞(暗)に光を当てて光合成を行わせた(明)場合と、さらにDCMU(光合成阻害剤)またはTEMPOL(活性酸素種除去剤を)加えた上で光を当てた場合。赤は葉緑体の蛍光、緑はMRE11タンパク質(DNA二本鎖切断)を示す。夜間の細胞が光合成を行うと酸化ストレスにより核DNAが高頻度に損傷する(矢尻)。
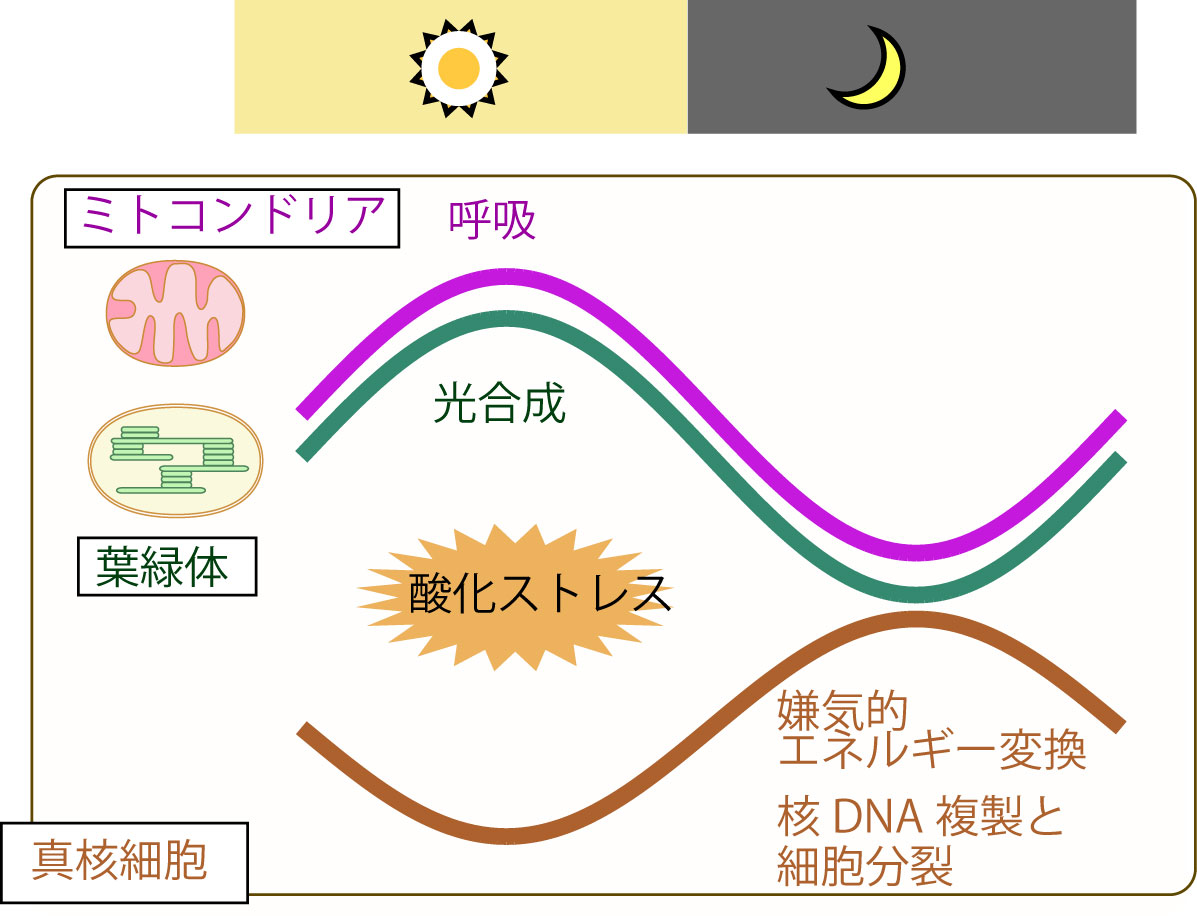
図2:真核細胞(宿主)と葉緑体(共生体・光合成)・ミトコンドリアの呼吸(共生体・呼吸)の時間分業による真核藻類細胞の安全な分裂増殖
創立70周年 特設ページを開設しました
創立70周年 特設ページを開設しました
大脳皮質の神経細胞が秩序正しく配置するしくみ
Press release
Memo1 Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development
Naoki Nakagawa, Charlotte Plestant, Keiko Yabuno-Nakagawa, Jingjun Li, Janice Lee, Chu-Wei Huang, Amelia Lee, Oleh Krupa, Aditi Adhikari, Suriya Thompson, Tamille Rhynes, Victoria Arevalo, Jason L. Stein, Zoltán Molnár, Ali Badache, E. S. Anton
Neuron Published:July 02, 2019 DOI:10.1016/j.neuron.2019.05.049
哺乳類の大脳皮質では、神経細胞の層構造が高度な情報処理に重要です。この層構造の形作りには、胎児期において、神経細胞の生みの親である神経幹細胞が重要な役割を果たします。神経幹細胞が伸ばす放射状突起が「ガイド役」として、神経細胞の移動に使われるのです。放射状突起は、それぞれの神経幹細胞から一本ずつ出ていて、互いに交わらず、脳表面に向かって等間隔に伸びています。この放射状突起が層構造づくりの「足場」の役割を果たすのです(図)。しかしながら、この「足場」がつくられるしくみはよくわかっていませんでした。
情報・システム研究機構 国立遺伝学研究所の中川直樹助教らと米国ノースカロライナ大学Eva S. Anton博士らの共同研究グループは、マウスを用いた研究で、層構造の「足場」作りに関与する遺伝子を明らかにし、層構造が作られるしくみの一端を明らかにしました。 細胞骨格の制御因子のMemo1遺伝子をマウスでノックアウトすると、神経幹細胞が伸ばす突起が過剰に枝分かれしたり、間隔にばらつきが生じたりして、「足場」が不完全になったのです。このため、神経細胞の動きが乱れて、結果として神経細胞の移動が異常になり、神経細胞の層構造に乱れが生じました。
神経幹細胞が規則的に配列し、神経細胞層づくりの足場となるためには、Memo1遺伝子が重要だったのです。
本研究は、科研費(19K16281)、早石修記念海外留学助成、米国国立衛生研究所研究費、North Carolina大学IDDRC研究費の支援を受けて実施されました。
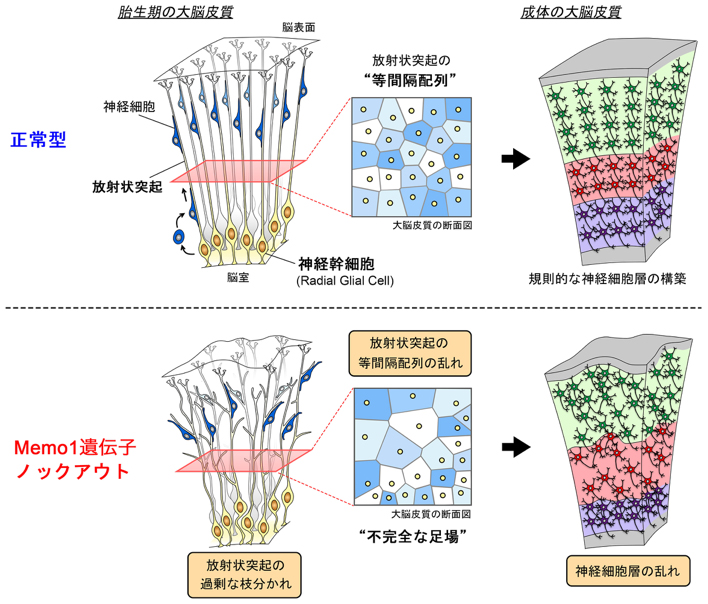
図:神経幹細胞の放射状突起にみられる等間隔配列と神経細胞層の構築
(上)胎児期の大脳皮質では、神経幹細胞は脳室を覆うシートのように局在し、それぞれ一本の放射状突起を脳表面まで伸ばしている。各神経幹細胞の放射状突起は互いに交わらず、等間隔を維持している(タイリング)。神経細胞は、等間隔に並んだ放射状突起の「足場」に沿って移動することで、規則的な層構造を構築する。
(下)今回の研究で明らかとなった、Memo1遺伝子の働きを示した模式図。Memo1の機能が無いことで、放射状突起の過剰な枝分かれと間隔のばらつきが生じ、神経細胞層の乱れにつながると考えられる。
「夏休み子ども遺伝学講座」を開催
顕微鏡で植物プランクトンを観察しよう
対象:
三島市内の小学生4年生から6年生 30名
(申込者多数の場合は抽選)
日時:
令和元年7月30日(火)
午前9時30分~午前12時00分(予定)
場所:
国立遺伝学研究所(三島市谷田1111)本館3FA316
持ち物:
筆記用具
講師:
宮城島進也 教授(国立遺伝学研究所)
申込:
三島市政策企画課まで電話か電子メールでお申込みください。
申込時に ①氏名 ②学年 ③住所 ④電話番号 をお伝えください。
申込み締切は令和元年7月16日(火)です。
E-mail: seisaku@city.mishima.shizuoka.jp
新分野創造センターのテニュアトラック教員がテニュア獲得
2019年7月1日付けで新分野創造センターの准教授がテニュアを獲得しました。
遺伝研の新分野創造センター(Center for Frontier Research)は,「あたらしい人材」と「あたらしい分野」を同時に育成するためのインキュベーションセンターです。遺伝研の卓越した研究環境や様々なサポートを活用して若手の優れた研究者がテニュアトラック独立准教授として研究室を運営し、遺伝学とその周辺領域に新しい分野を開拓する研究を行っています。テニュアを獲得した教員は遺伝研に新しい研究部門を創り、自らが創成に貢献している新分野を牽引していきます。

- 島本 勇太 准教授
キンギョの全ゲノム解読により脊椎動物の進化の謎に迫る ―新型次世代DNAシーケンサーを使って全ゲノム重複と進化の謎解明に道筋―
Press release
De Novo assembly of the goldfish (Carassius auratus) genome and the evolution of genes after whole genome duplication
Zelin Chen*, Yoshihiro Omori*, Sergey Koren, Takuya Shirokiya, Takuo Kuroda, Atsushi Miyamoto, Hironori Wada, Asao Fujiyama, Atsushi Toyoda, Suiyuan Zhang, Tyra G. Wolfsberg, Koichi Kawakami, Adam M. Phillippy, NISC Comparative Sequencing Program, James C. Mullikin, and Shawn M. Burgess *(equally contribution)
Science Advances 26 Jun 2019:Vol. 5, no. 6, eaav0547 DOI:10.1126/sciadv.aav0547
大阪大学蛋白質研究所の大森義裕招へい教授(当時准教授。現 長浜バイオ大学教授)らの研究グループは、国立遺伝学研究所・川上浩一教授、藤山秋佐夫特任教授、愛知県水産試験場内水面漁業研究所弥富指導所、および米国国立衛生研究所(NIH)Shawn Bargess上席研究員らと共同でキンギョの全ゲノム配列を世界で初めて解読し、キンギョの祖先種(フナの仲間)のゲノムが約1400万年前に倍加したことや(全ゲノム重複)、倍加した遺伝子群の一部が進化の過程で淘汰されたり、新たな発現パターンを獲得したりする様子を明らかにしました。今回の研究では、新型のロングリード次世代DNAシーケンサーを使ったことと、通常の交配から得たキンギョではなく、ゲノム構造がシンプルな雌性発生キンギョを用いたことがブレイクスルーに繋がりました。キンギョは約千年前にフナから選別・育種され、現在、デメキンやランチュウ、リュウキンなど数十種類の多様な品種が飼育されています。キンギョは、その形態的な多様性から、私たち、人間を含む脊椎動物の体の形を決めるメカニズムの解明に役立つと考えられていますが、全ゲノムが解読されていないため遺伝子レベルでの研究が困難でした。今回のゲノム解読により、体の形を決めるメカニズムや全ゲノム重複と進化の研究を進めるための新たな扉が開かれました。また、キンギョの品種にはヒトの病気と似た症状をもつものがあり、キンギョがヒトの病気の原因解明や診断・治療法の確立に役立つ可能性も期待されることから、アメリカなど海外でもそのゲノム情報の研究に注目が集まっています。
この成果は2019年6月26日(米国東部標準時夏時間)に米国科学雑誌「Science Advances」に掲載されました。
国立遺伝学研究所の貢献
国立遺伝学研究所は、NIHのゲノム解析チームと国内のキンギョ研究者らを結びつける役割を果たし、また、第Ⅲ世代シーケンサでのゲノム解読に適した高分子高品質なキンギョ体細胞DNAの抽出精製と組織摘出実験を実施しました。
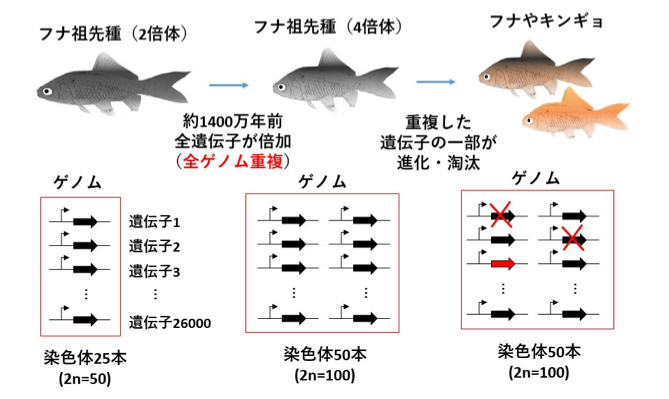
図: キンギョとフナの祖先種での全ゲノム重複と進化 キンギョやフナの祖先種では、約1400万年前に全遺伝子が倍加する現象(全ゲノム重複)が起こり、遺伝子が一般の魚類の2倍となった。その後、倍加した遺伝子の一部は進化・淘汰されている。その変遷の様子が今回のゲノム解読により明らかとなった。
ガーナ大学との国際交流協定締結
ガーナ大学よりEbenezer Oduro Owusu 先生(ガーナ大学Vice-Chancellor) ほか3名の研究者をお招きしました。この協定により、教育研究分野での協働はもちろん、学生の交流などもさらに強化されることが期待されます。
 |
 |
| ガーナ大学Ebenezer Oduro Owusu先生と花岡遺伝研所長 | 調印後の和やかな雰囲気 |
動画「全地球史アトラス」最終章の公開-研究成果に基づき生命の誕生と進化のストーリーを再現した全映像の完成-
Press release
東京工業大学地球生命研究所の主任研究者 丸山茂徳 特任教授(所属:理学院)および情報・システム研究機構 国立遺伝学研究所の黒川顕 教授らの研究グループは、文部科学省科学研究費補助金・新学術領域研究「冥王代生命学の創成」(課題番号2605)において、これまで未解明の問題であった「地球と生命の起源」を解明する研究に取り組んできました。 2014年度から始まった本研究によって、丸山 特任教授らは、生命誕生の場および生命の起源、進化に関するこれまでの定説を覆す新たな仮説を提案してきました。この新仮説をわかりやすく専門外の方々に紹介することを目的として、「冥王代生命学の創成」研究チームは、有限会社ライブの上坂浩光氏とともに、動画「全地球史アトラス」を制作し、順次公開してきました。今回は、これまでに公開されたシリーズ(1~9章)に続く新シリーズとして、10、11、12章を公開します。動画「全地球史アトラス」は12章で完結となり、本公開によって、全シリーズをご覧いただくことが可能になります。
最新の研究成果と、新たな仮説が物語る地球と生命の歴史を、地球の誕生、生命の誕生、そして人類の誕生から地球に未来までの進化を含めてご覧いただけます。
本作品は、文部科学省科学研究費補助金・新学術領域研究「冥王代生命学の創成」(課題番号2605)の支援の下におこなった研究の成果を映像にしたものです。
全地球史アトラス
第1章:地球誕生
第2章:プレートテクトニクス
第3章:原始生命誕生
第4章:生命進化の第1ステージ
第5章:生命進化の第2ステージ
第6章:生命進化の第3ステージ
第7章:生命大進化の夜明け前
第8章:カンブリア紀の生命大進化
第9章:古生代
第10章:中生代から人類の誕生まで
第11章:人類代〜人類誕生と文明の構築
第12章:地球の未来
- 動画「全地球史アトラス」はこちらでご覧いただけます
図:動画「全地球史アトラス」トップページ(2019年5月24日現在)

















