Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
DNAは、生きた細胞の中で不規則な塊を作っていた!-遺伝子情報や細胞関連疾患の理解につながる成果-
![]()
Dynamic organization of chromatin domains revealed by super-resolution live-cell imaging
Tadasu Nozaki, Ryosuke Imai, Mai Tanbo, Ryosuke Nagashima, Sachiko Tamura, Tomomi Tani, Yasumasa Joti, Masaru Tomita, Kayo Hibino, Masato T. Kanemaki, Kerstin S. Wendt, Yasushi Okada, Takeharu Nagai, and Kazuhiro Maeshima
Molecular Cell Published: July 13, 2017 DOI:10.1016/j.molcel.2017.06.018
DNAは規則正しくらせん状に折り畳まれて細胞の核の中に収められていると、長い間考えられてきました。ところが近年、この規則正しい構造は存在せず、不規則に核のなかに収納されていることがわかってきました。しかしながら、実際の収納の様子を「生きた細胞」で捉えた決定的な証拠はありませんでした。
このたび情報・システム研究機構 国立遺伝学研究所・野崎慎研究員・前島一博教授らと大阪大学・永井健治教授、理化学研究所・岡田康志チームリーダーの共同グループは、光学顕微鏡の分解能を超える超解像蛍光顕微鏡を構築することで、生きた細胞内におけるDNAの収納の様子を観察することに世界で初めて成功しました。その結果、DNAは不規則に折りたたまれ、「クロマチンドメイン」とよばれる小さな塊を形作っていることがわかりました(図1)。このクロマチンドメインは細胞増殖、細胞分裂を通じて維持されていることから、遺伝情報の検索・読み出し・維持に重要な染色体ブロック(機能単位)として働くことが示唆されます。
本研究の結果によって、遺伝情報がどのように検索され、読み出されるのかについての理解がさらに進むとともに、DNAの折りたたみの変化で起きるさまざまな細胞の異常や関連疾患の理解につながることが期待されます。
本研究成果は、平成29年7月13日12時(米国東部時間)に米国科学雑誌 Molecular Cell に掲載されました。
本研究は、大阪大学産業科学研究所・永井健治教授、理化学研究所生命システム研究センター・岡田康志チームリーダー、米国MBL・谷知己チームリーダー、JASR・城地保昌チームリーダー、国立遺伝学研究所・鐘巻将人教授、オランダエラスムスMC・Kerstin S. Wendtチームリーダー、慶應義塾大学・冨田勝教授、国立遺伝学研究所・野崎慎学振特別研究員、前島一博教授グループとの共同研究としておこなわれました。
本研究は文部科学省科学研究費補助金・新学術領域研究「少数性生物学」(領域代表:大阪大学 永井健治教授)、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST) 「統合1細胞解析のための革新的技術基盤」(研究総括:東京大学大学院 菅野純夫教授)(研究課題名「超解像3次元ライブイメージングによるゲノムDNAの構造、エピゲノム状態、転写因子動態の経時的計測と操作」(JPMJCR15G2)、研究代表者:岡田 康志)、および科学研究費補助金(16H04746)の支援を受けました。
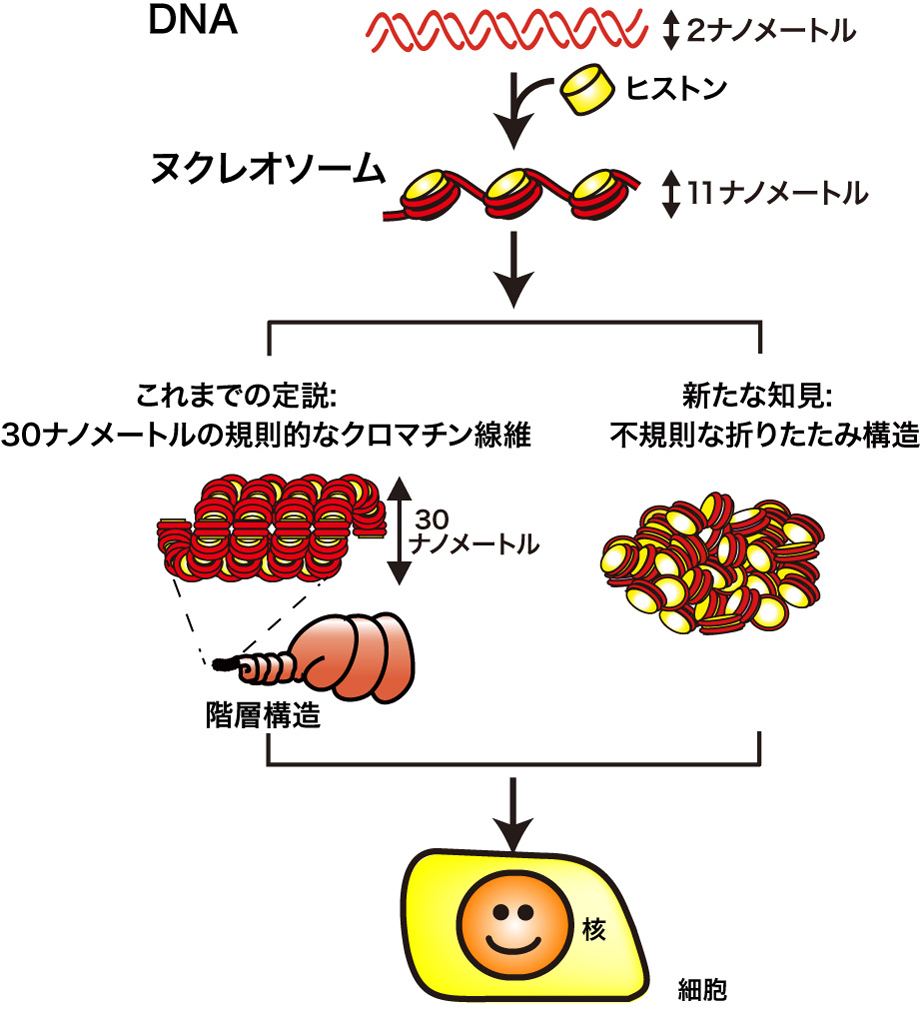
図1 DNAの細胞内収納に関するこれまでの定説(中段左)と新しい説(中段右)。
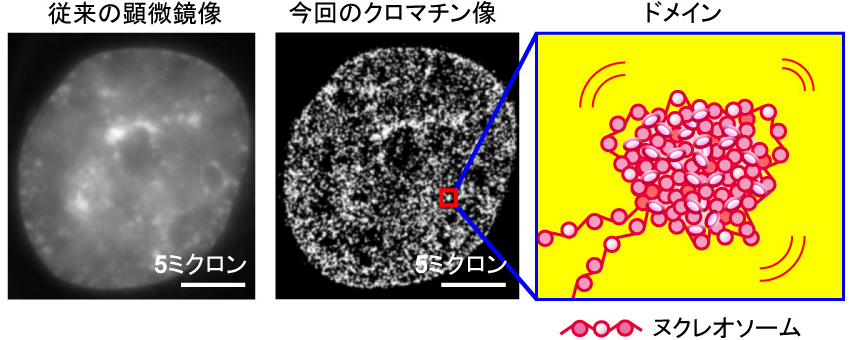
図2 左は従来の生細胞の顕微鏡像(DNAを染色している)。中央は今回の研究で得られた超解像のクロマチン像。より細部の構造がはっきりと分かり、つぶつぶのクロマチンの塊(クロマチンドメイン)が観察された。(右)ヌクレオソーム(研究の背景参照)が塊を作ってドメインを形成すると考えられる。
DNAの違いから、芽生え段階でカンキツの様々な果実特性を高精度に予測 -カンキツ品種改良へのゲノミックセレクションの有効性を確認-
![]()
Potential of genomics-assisted breeding for fruit quality traits
Mai F. Minamikawa, Keisuke Nonaka, Eli Kaminuma, Hiromi Kajiya-Kanegae, Akio Onogi, Shingo Goto, Terutaka Yoshioka, Atsushi Imai, Hiroko Hamada, Takeshi Hayashi, Satomi Matsumoto, Yuichi Katayose, Atsushi Toyoda, Asao Fujiyama, Yasukazu Nakamura, Tokurou Shimizu, Hiroyoshi Iwata
Scientific Reports 7, Article number: 4721 (2017) DOI:10.1038/s41598-017-05100-x
近年、果樹の品種改良では、DNAの違いから特性を予測し個体を選抜する「DNAマーカー選抜」の利用が進んでいます。しかし、DNAマーカー選抜の利用は少数の遺伝子が関わる特性に限られており、果実重など重要な特性の多くを占める、多数の遺伝子が少しずつ関わる特性には利用できませんでした。
農研機構、東京大学および情報・システム研究機構 国立遺伝学研究所は共同で、大量のDNAマーカー情報から特性を予測する新技術「ゲノミックセレクション」により、芽生え段階で果実重、果実の硬さ、果皮の色、果皮のむきやすさ、果肉の色、じょうのう膜3)のやわらかさといった果実の特性を高い精度で予測することに成功しました。
その結果、ゲノミックセレクションを利用すれば、従来のDNAマーカー選抜法の利用が困難であった、多数の遺伝子が関わる特性についても、芽生え段階で選抜できることが明らかになりました。
ゲノミックセレクションの活用により、消費者などの新たなニーズ(たとえば特徴的な香りを持つカンキツなど)に応える、カンキツの品種改良の加速化・効率化が期待されます。
遺伝研の貢献:
国立遺伝学研究所先端ゲノミクス推進センターならびに比較ゲノム解析研究室は、柑橘全ゲノムシーケンスを実施しました。また、同研究所大量遺伝情報研究室は、シーケンスデータをもとにSNPアレイの設計をおこなうことで本研究に貢献しました。
掲載雑誌:
本研究成果は国際科学雑誌「Scientific Reports」(7月5日付け:日本時間7月5日18時)に掲載されました。
助成金等の情報:
本研究は農林水産省委託プロジェクト「ゲノム情報を活用した農産物の次世代生産基盤技術の開発」プロジェクト「多数の遺伝子が関与する形質を改良する新しい育種技術の開発」(NGB)、情報・システム研究機構 新領域融合プロジェクト「生命システム」サブテーマ1 超大量ゲノム情報、運営費交付金の支援を受けました。
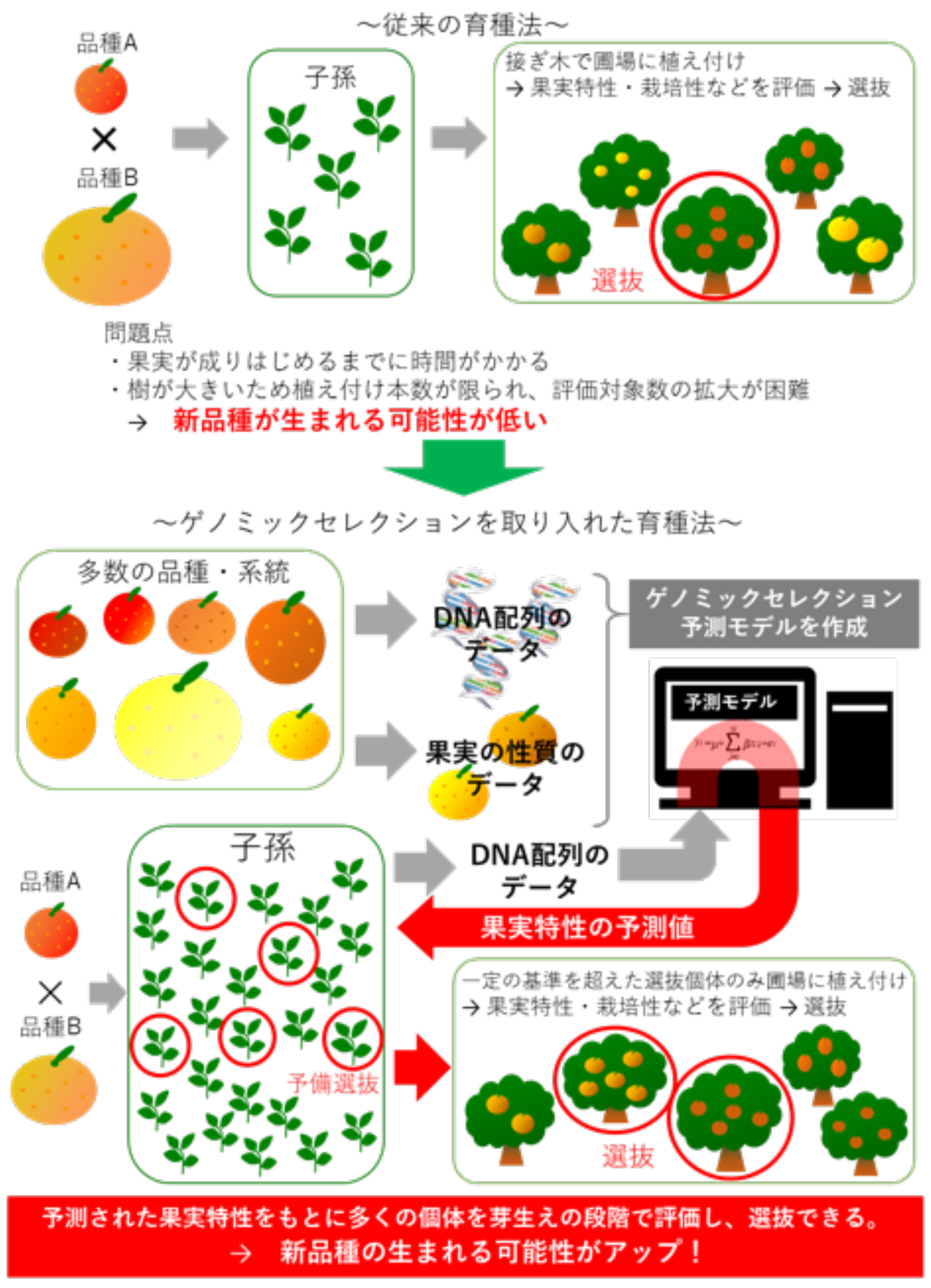
従来の育種法とゲノミックセレクションを取り入れた育種法の比較
家畜動物はなぜ人になつくのか~人に近づくマウスをつくり遺伝のしくみを解明~
![]()
Selective breeding and selection mapping using a novel wild-derived heterogeneous stock of mice revealed two closely-linked loci for tameness
Yuki Matsumoto, Tatsuhiko Goto, Jo Nishino, Hirofumi Nakaoka, Akira Tanave, Toshiyuki Takano-Shimizu, Richard F Mott, Tsuyoshi Koide
Scientific Reports 7, Article number: 4607 (2017) DOI:10.1038/s41598-017-04869-1
家畜動物の多くは、自ら人に近づく(能動的従順性)性質をもつことがわかっていますが、この性質がどのような遺伝的しくみによってもたらされるのか不明でした。このたび、情報・システム研究機構 国立遺伝学研究所の松本悠貴(総研大遺伝学専攻大学院生)と小出剛准教授らのグループは、動物が人に近づく行動に関わるゲノム領域を明らかにしました。
本研究では、野生マウス同士を交配させて生まれたマウスの中から人の手を恐れず近寄ってくるマウスを選び、それらをさらに交配させるという選択交配実験を繰り返すことによって、自ら人に近づくマウス集団を作り出すことに成功しました。次に、これらマウスから、人に近づく行動を生み出すゲノム領域を調べたところ、11番染色体上の二つのゲノム領域が重要であることを発見しました。さらに、これら二つのゲノム領域がイヌの家畜化にも影響している可能性を比較ゲノム解析から見出しました。
本成果は動物の家畜化に関わる遺伝の仕組みを明らかにした画期的なものです。これまで家畜化に成功していない多くの動物種に家畜化の道をひらく可能性が期待できます。
本研究は、ロンドン大学のRichard F. Mott博士との共同研究の成果です。
この成果は平成29年7月4日午前10時(英国時間)に英国オンライン・ジャーナル Scientific Reports に掲載されました。
本研究は、科研費(15H01298, 15H05724, 16H01491, 15H04289(代表:小出剛);24658240(代表:後藤達彦)、特別研究員奨励費(代表:松本悠貴)、情報・システム研究機構新領域融合プロジェクトの支援を受けました。
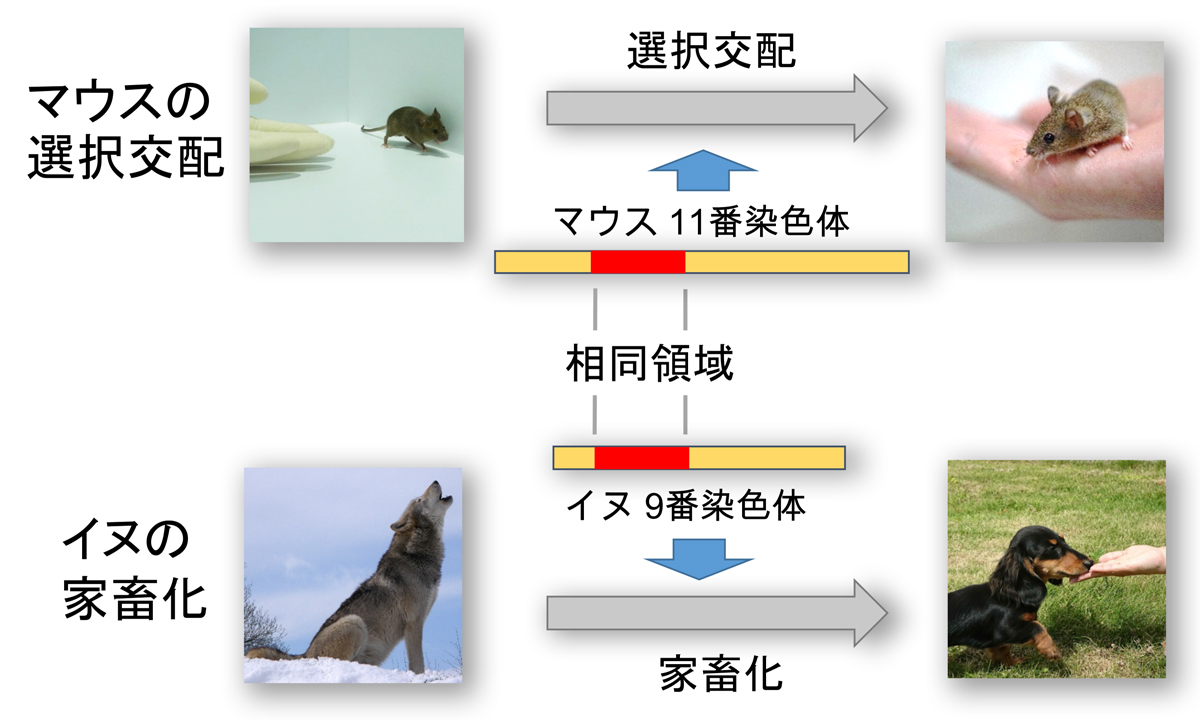
選択交配により自ら人に近づくマウスを作成して解析したところ、11番染色体上のゲノム領域が人に近づく行動に重要だった。また、この領域は犬の家畜化に関するゲノム領域と相同だった。
新分野創造センターにあたらしい研究室ができました
2017年7月1日付けで新分野創造センターに村山泰斗准教授が着任しました.

- 村山泰斗 准教授
新分野創造センター(Center for Frontier Research)は,「あたらしい人材」と「あたらしい分野」を同時に育成するためのインキュベーションセンターです. 若手の優れた研究者が研究室主催者(テニュアトラック准教授)として研究室を運営し, 遺伝研の卓越した研究環境や様々なサポートを活用して遺伝学とその周辺領域に新しい分野を開拓する研究を行っています.
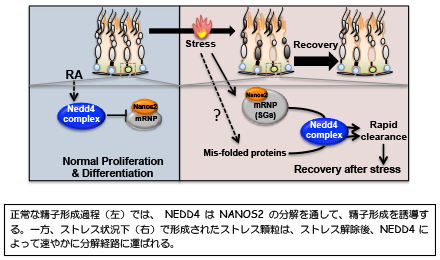
E3リガーゼNEDD4によるNANOS2の分解が精子形成の開始に必須である
NEDD4 controls spermatogonial stem cell homeostasis and stress response by regulating messenger ribonucleoprotein complexes
Zhi Zhou, Hiroshi Kawabe, Atsushi Suzuki, Kaori Shinmyozu & Yumiko Saga
NATURE COMMUNICATIONS. 8, Article number: 15662 (2017) DOI:10.1038/ncomms15662
精子形成は、精子幹細胞が自分自身を維持しつつ,分化細胞を生み出だす非常に高度に制御されたシステムである。我々は以前、精子幹細胞で雄特異的RNA結合タンパク質NANOS2がmRNA-タンパク質複合体として機能し未分化性の維持に寄与していることを報告した(Dev Cell, 2015)。一方、精子幹細胞から分化細胞を生み出すには、このNANOS2を幹細胞から消失させる必要がある。我々は、このメカニズムとして、NEDD4による蛋白質の分解機構が関与することを明らかにした。NEDD4はHECTドメインを持つE3-ユビキチンリガーゼであり、比較的ブロードに発現している。精子形成の誘導にはRAシグナルが関与するが、RAによりNedd4の活性化因子であるNDFIP2が誘導され、その結果としてNEDD4が活性化するようである。NEDD4を精子幹細胞でKOすると、NANOS2が分解されずに維持され、結果として、精子形成が抑制されることが分かった。また、NEDD4はNANOS2のみならず、他のmRNPタンパク質の分解にも関与し、特にストレス顆粒のクリアランスに必須な因子であることが分かった。精巣は高温状態にさらされると直ちにストレス顆粒を作成し、細胞を一時的に不活性化状態に維持する。正常な温度に戻ると、このストレス顆粒は速やかに分解され、細胞は定常状態に移行するが、この時NEDD4がないと、ストレス顆粒がクリアランスされないことが分かった。また我々は、この過程でNANOS2がユビキチン化されることを見出している。したがって、NEDD4を介したmRNPのターンオーバーは精子形成の恒常性を維持する重要なメカニズムである。この研究は、遺伝研ポスドクとして、来日し、その後3年間ポスドクとして活躍したZhou Zhiが中心になって行った。またNEDD4-KOマウスの分与および解析はMax-Plank Insitituteの川辺浩志博士との共同研究である。
壊れた「DNAのファスナー」を修理するには?~細胞がDNAをコピーする際のバックアップシステムを発見~
![]()
Acute inactivation of the replicative helicase in human cells triggers MCM8–9-dependent DNA synthesis
Toyoaki Natsume, Kohei Nishimura, Sheroy Minocherhomji, Rahul Bhowmick, Ian D. Hickson, Masato T. Kanemaki
Genes & Development DOI:10.1101/gad.297663.117
情報・システム研究機構 国立遺伝学研究所の夏目豊彰助教と鐘巻将人教授らのグループは、コペンハーゲン大学のIan D. Hickson らのグループと共同で、DNA をコピーする際の失敗に対処する新たなしくみを発見しました。この成果は米国科学雑誌Genes & Developmentオンライン版に掲載されました。
1つの細胞が2つに増える際、DNAは正確に2倍にコピーされ(DNA複製)、2つの細胞に均等に分配されます。DNAをコピーするには二本鎖DNAを開く必要があり、この過程は服のファスナーを開ける動きに似ています(図1A)。ファスナーを開けるためには「スライダー」を引くことが必要ですが、細胞内でこの「スライダー」の役割をしているタンパク質がMCM2-7複製ヘリカーゼです。しかし、DNAはとても長いので(ヒトで約2m)、すべての二本鎖DNAを開くのは大変です。時として複製ヘリカーゼが外れてしまう事があり、これが一旦外れてしまうと、二度と元に戻すことはできません。このままでは遺伝情報は複製されないままになり、子孫の細胞から失われてしまいます。
本研究では複製ヘリカーゼを、独自に開発したオーキシンデグロン技術を駆使して人為的に壊して外した際に、細胞がどのように対処するのか観察しました(オーキシンデグロン技術に関してはこちらでご覧になれます)。その結果、MCM2-7複製ヘリカーゼによく似たMCM8-9ヘリカーゼがDNA複製の再開に働く新たなバックアップシステムを発見しました(図1B)。
抗がん剤にはDNAに傷をつけることでMCM2-7複製ヘリカーゼの脱落を促進して作用するものがあります。MCM8-9ヘリカーゼの阻害薬はバックアップを断つため、従来の抗がん剤作用を増強する新薬になるかもしれません(図2)。
この研究は、情報・システム研究機構 国立遺伝学研究所の鐘巻研究室(夏目豊彰、西村浩平、鐘巻将人)とコペンハーゲン大学のIan D. Hickson研究室(Sheroy Minocherhomji, Rahul Bhowmick, Ian D. Hickson)との共同研究として行われました。
本研究は、文部科学省の科学研究費補助金(25891026, 15K18482, 17K15068, 25131722, 16K15095)、科学技術研究機構(JST)の戦略的創造研究推進事業(さきがけ)(JPMJPR13A5)、持田記念医学薬学振興財団、SGH財団、住友財団の助成を受けて行われました。
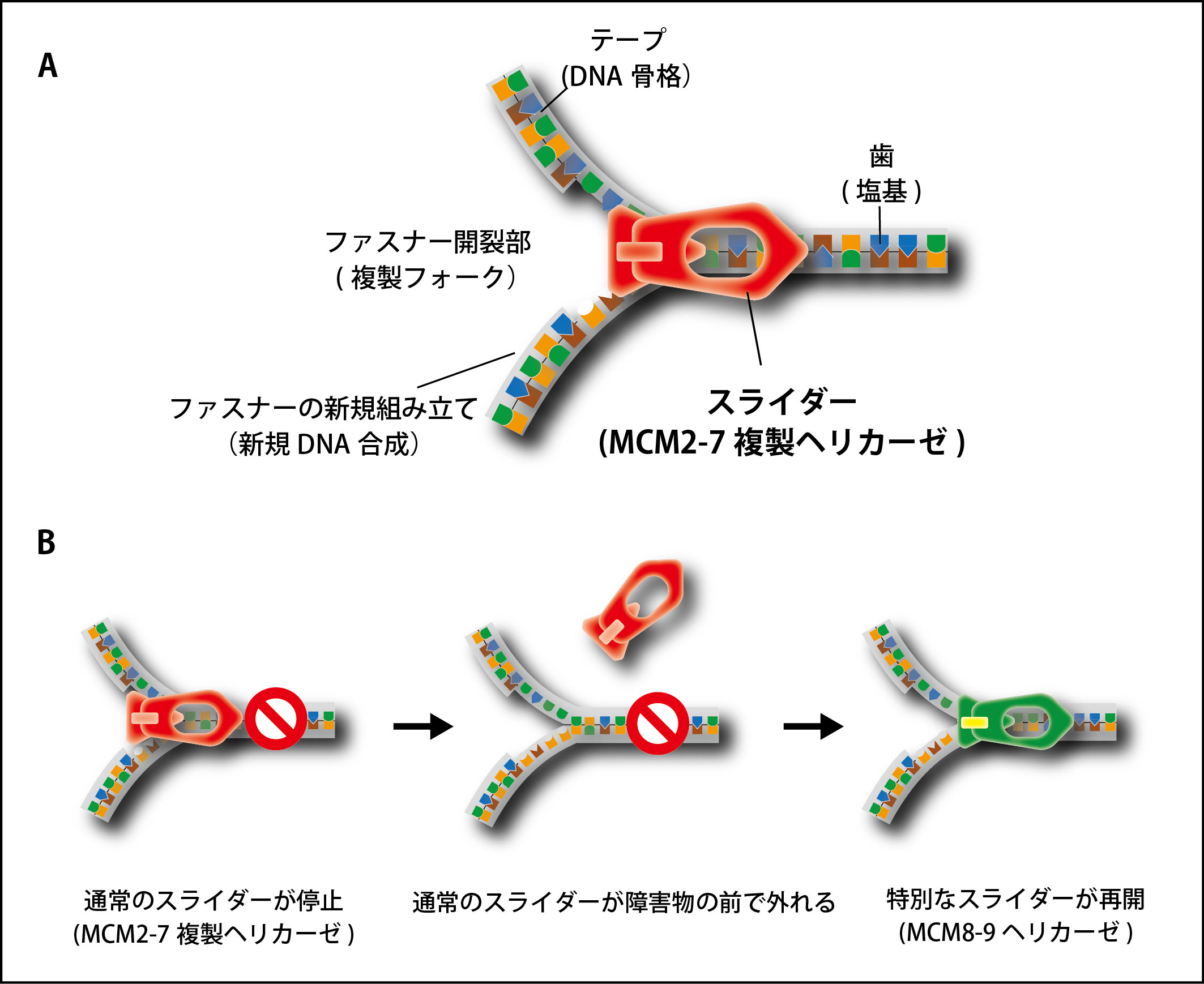
図1 DNA 複製の過程はファスナーを開ける動作に似ている
(A) DNA 複製をする際、二本鎖DNAを開く必要がある。スライダーが移動してファスナーを開くように、MCM2-7 複製ヘリカーゼが二本鎖DNAを開く。
(B) MCM2-7 複製ヘリカーゼ(スライダー)がその進行中に障害物に遭遇し、DNA のファスナーから外れる事がある。複製を続けるために、細胞はバックアップスライダーであるMCM8-9 ヘリカーゼを呼び込み、DNA の複製の停止に対処する。
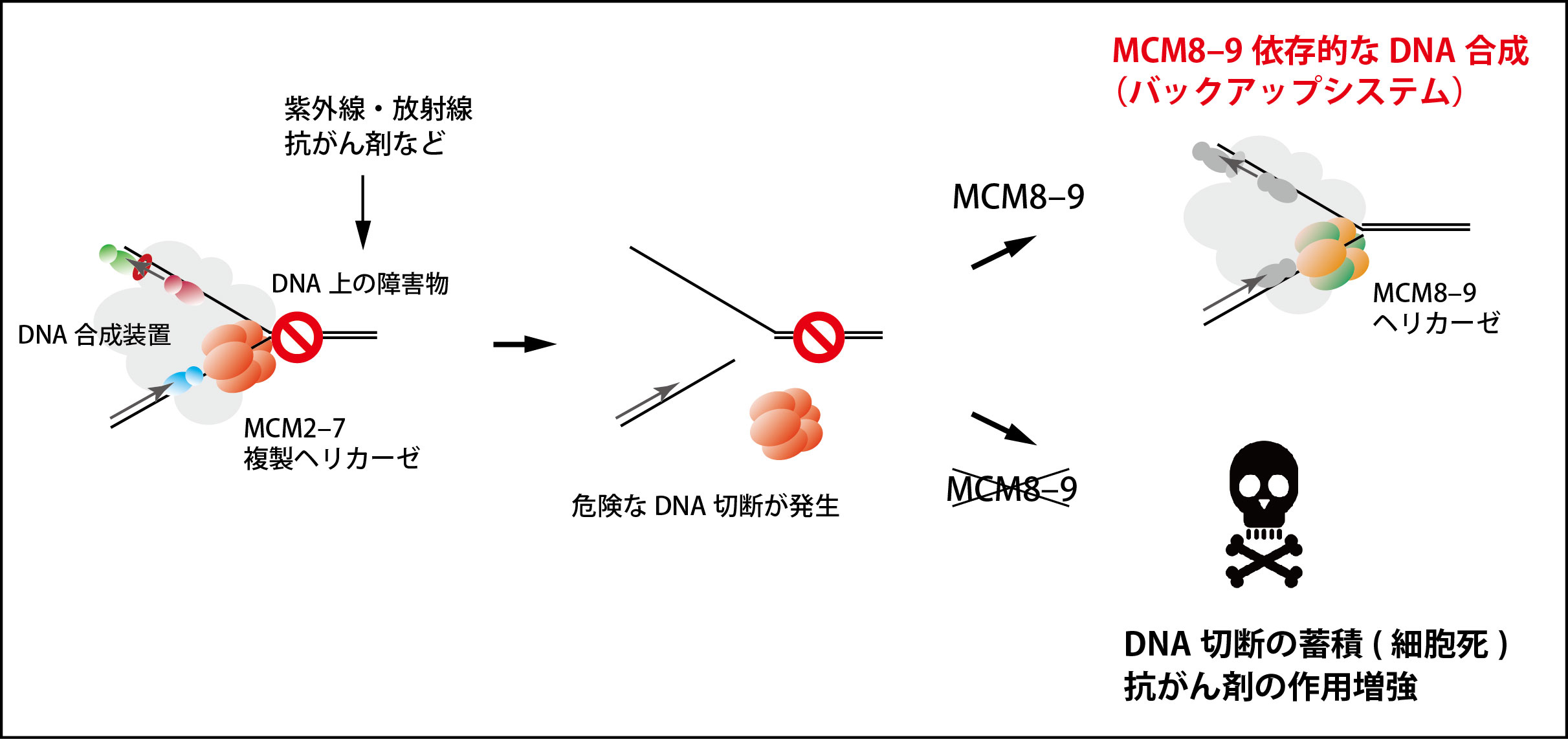
図2 MCM8-9ヘリカーゼに依存したDNA複製のバックアップシステム
DNA上の障害物によってMCM2-7複製ヘリカーゼが外れ、危険なDNA切断が生じてDNA複製が停止する。今回、MCM8-9ヘリカーゼがMCM2-7に代わってDNA合成を続けることを発見した(右上)。一方、MCM8-9が働かない場合、細胞は死に至る(右下)。
DNA複製のライセンシング(許可)反応の分子観察
Flexible DNA Path in the MCM Double Hexamer Loaded on DNA
Kohji Hizume, Hiroaki Kominami, Kei Kobayashi, Hirofumi Yamada, and Hiroyuki Araki
Biochemistry. Publication Date (Web): May 1, 2017 DOI:10.1021/acs.biochem.6b00922
DNA複製反応が起こる細胞周期S期に先立ち、その前のG1期までに、複製が開始する染色体領域には“複製反応をこの領域から開始する許可反応(ライセンシング)”が起こります。ライセンシング反応は、複製反応に使用されるDNAヘリカーゼの主要な構成因子であるMCM複合体がDNA上に配位される反応であることが知られています。
今回、微生物遺伝研究部門の荒木弘之教授・日詰光治助教らのグループは、試験管内でこのライセンシング反応を再現し、その結果得られたMCMとDNAとからなる複合体を原子間力顕微鏡(AFM)により観察しました。従来は、リング状のMCM複合体が二つ向かい合わせに結合した構造の中央をDNAがまっすぐに通過していると考えられていたのに対し、実際に得られたAFM観察像では、DNAが側面から漏出していたり、DNAのループ状構造が形成されていたりするなど、自由なDNAの通過パターンが存在するようすが検出されました。また、京都大学工学部の山田啓文教授のグループと共同研究を行い、高分解能周波数変調(FM)AFMによる観察も行い、二つのMCM複合体とDNAとの高解像度観察にも成功しました。これらの観察結果から、これまで考えられていたモデルとは異なるメカニズムで、DNA複製のライセンシングが行われている可能性が示唆されました。
DNA複製反応は、多くのタンパク質因子がDNAに作用し、互いに構造変化をしながら進行していく動的な反応です。このような反応を理解するうえで、本研究のような分子観察を応用してDNA‐タンパク質の配位を解明していくことは、反応の分子機構を明らかにするうえで非常に重要なアプローチです。
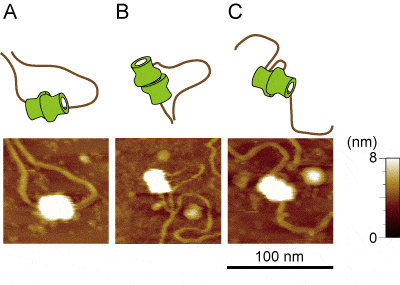
DNA上に配位した二つのMCM複合体のFM-AFM観察像。これまで考えられてきたように、二つのMCM複合体をまっすぐ通過するようにDNAが結合しているもの(A)に加えて、MCM複合体の側面からDNAが出てくるもの(B)や、DNAがループを形成しているもの(C)が観察された。
「先進ゲノム支援」による支援課題の公募を開始
「先進ゲノム支援」による支援課題の公募を開始
単子葉植物の茎に特徴的な形態形成を制御するメカニズム
KNOTTED1 Cofactors, BLH12 and BLH14, Regulate Internode Patterning and Vein Anastomosis in Maize
Katsutoshi Tsuda, Maria-Jazmin Abraham-Juarez, Akiteru Maeno, Zhaobin Dong, Dale Aromdee, Robert Meeley, Toshihiko Shiroishi, Ken-ichi Nonomura and Sarah Hake.
The Plant Cell. published online April 5, 2017 DOI:10.1105/tpc.16.00967
単子葉植物の茎は、維管束がリング状に並んだ双子葉植物と異なり、茎全体に散らばった散在型維管束を持ちます。また、タケにみられるように明確な節と節間の繰り返し構造からなる茎も単子葉類の特徴です。これらは理科の教科書などに出てくる良く知られた性質であり、脆弱な茎は農作物の倒伏による収量のロスをまねくため育種上重要なターゲットとされてきたのにも関わらず、その発生過程を制御する分子メカニズムはほとんど不明でした。わたしたちは、トウモロコシのBELL1-like Homeobox (BLH)転写因子がこれらの単子葉類に特徴的な茎の形態形成に重要な役割を果たしていることを明らかにしました。まず、植物の地上部全体の源である茎頂分裂組織(メリステム)の維持に不可欠なKnotted1-like Homeobox (KNOX)転写因子のコファクターとしてBLH12 およびBLH14を同定しました。blh12/14 二重変異体では、腋芽や花序のメリステムが正常に維持されないのに加え、茎が短くなる矮性を示し、その内部の維管束数は大きく減少していました。タンパク質の発現パターンの解析やマイクロCTによる茎の内部構造の詳細な観察により、BLH12/14が(1)節間基部にある介在分裂組織に蓄積し分裂活性を維持することで節間細胞の持続的な供給および十分な茎の成長を可能にしていること、(2)未熟な茎の内部で維管束同士の早期融合を抑制することで、多数の独立した維管束の形成を可能にしていることが示唆されました。本研究は国立遺伝学研究所・実験圃場の津田勝利助教とカリフォルニア大学バークレー校Sarah Hake教授を中心としたグループの共同研究の成果であり、科研費若手(B)(JP16K18637) の支援を受けて行われました。また、哺乳動物遺伝研究室の前野哲輝技術員によるマイクロCT観察がこれまで観察が困難であった維管束ネットワークの可視化において大きく貢献しました。
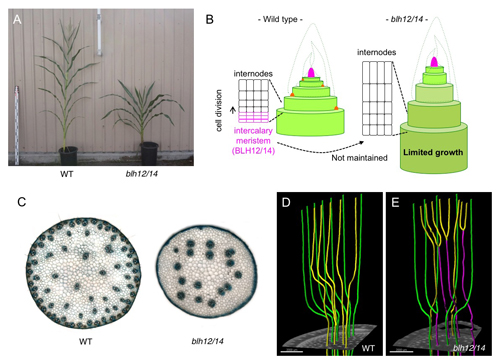
- (A) 野生型トウモロコシ(左)とblh12/14二重変異体(右)。
- (B) BLH12/14は介在分裂組織(Intercalary Meristems)の維持に不可欠な役割を果たす。blh12/14二重変異体では介在分裂組織が維持されず、茎の成長が制限されるため矮性となる。
- (C) 野生型およびblh12/14の茎の断面写真。blh12/14では維管束数が大幅に減少する。
- (D) マイクロCTデータから抽出した野生型トウモロコシの茎の維管束ネットワーク。互いに交わることなく独立した維管束を形成する。
- (E) blh12/14 二重変異体の茎の維管束ネットワーク。維管束同士の融合(マジェンタ)が頻繁に見られる。
見たらつい食べたくなるのは本能だった~視覚情報を摂食行動に結びつける神経回路の発見~
![]()
Activation of the hypothalamic feeding centre upon visual prey detection
Akira Muto, Pradeep Lal, Deepak Ailani, Gembu Abe, Mari Itoh, Koichi Kawakami
Nature Communications 8, Article number: 15029 (2017) DOI:10.1038/ncomms15029
情報・システム研究機構国立遺伝学研究所の武藤彩助教、川上浩一教授らの研究チームは、モデル生物のゼブラフィッシュをもちいて、獲物を視覚的に認識したときに摂食行動を引き起こす脳の仕組みについて明らかにしました。
食べものを見ただけで反射的に食べたくなるということは誰しもあることです。すなわち、摂食行動は、個体の栄養状態だけでなく、身近に食料が存在するかどうかによって引き起こされるのですが、その摂食行動が過去の摂食経験から学んだ結果なのか、生まれたときから備わっているものなのかはわかっていませんでした。
本研究では、モデル生物であるゼブラフィッシュの稚魚を用いた実験から、摂食経験が全くない稚魚であっても、餌により視覚が刺激されたときに、脳の「獲物検出器」と呼ぶべき神経細胞集団を介して、視床下部の摂食中枢が活動することを、カルシウムイメージングの手法を用いて示しました。
本研究により、餌を見たときに、その情報を食欲へ変換する神経回路が生まれながらに脳内に存在し、その神経回路の活動によって摂食行動が引き起こされることが明らかになりました。
本研究成果は、平成29年4月20日10時(英国時間)に英国オンライン・ジャーナル Nature Communications に掲載されました。
本研究は科学研究費(課題番号 JP25290009、 JP25650120、JP15H02370、JP16H01651)、および、ナショナルバイオリソースプロジェクト(NBRP)、国立研究開発法人日本医療研究開発機構(AMED)、総合研究大学院大学学融合推進センター(CPIS)の支援を受けました。

獲物となるゾウリムシを見つけたゼブラフィッシュ稚魚の行動と視床下部下葉の神経活動
カルシウム蛍光指示タンパク質GCaMPを視床下部下葉に発現させた稚魚を用いて、捕獲行動の様子を蛍光カメラで経時的に記録した。ゾウリムシが目の前に来たときに視床下部の神経が興奮し始める様子がわかる。
カルシウムイメージングの詳細はこちらでご覧になれます
DNAは細胞のバネとしても働いている
「DNAの新たな役割」を提唱
![]()
Nucleosome−nucleosome interactions via histone tails and linker DNA regulate nuclear rigidity
Yuta Shimamoto, Sachiko Tamura, Hiroshi Masumoto, and Kazuhiro Maeshima
Molecular Biology of the Cell April 20, 2017 DOI:10.1091/mbc.E16-11-0783
情報・システム研究機構国立遺伝学研究所の島本勇太准教授と前島一博教授らのグループは、細胞の核の「強さ」が産み出される仕組みを、物理の先端技術と生化学の研究手法をもちいて明らかにしました。この成果は、米国細胞生物学会誌であるMolecular Biology of the Cell誌に重要論文であることを示す「ハイライト」として掲載されました。
私たちの体を形成する細胞の核のなかには生命の設計図であるDNAが収められています。細胞および核は押されたり引っ張られたりして、絶えず物理的な力にさらされています。この力によりDNAが切れたりすると、細胞にさまざまな問題が生じます(図1)。これまで、細胞の核はその硬い殻の構造によって内部のDNAを守っていると考えられてきました。
本研究では、直径が髪の毛の百分の一ほど( 〜1ミクロン)の細いガラス針を使ってヒト細胞の核を直接触り(図2A)、力を掛けたときの核のゆがみを観察することで、核の「強さ」を計測しました(図2B)。その結果、核は力に対抗するための「硬さ」と「弾性」を合わせ持っていることがわかりました。さらに、この弾性力は、これまで考えられてきた核の殻の構造だけでなく、収納されたDNA自体によっても生み出されていることがわかりました(図3)。これまで遺伝情報のメモリデバイスとみなされてきたDNAが、核の弾性を支えるバネの役割を演じているのです。
力が加わることによって核に生じるゆがみとそれに伴うDNAの損傷は、細胞に「死」や「がん化」など、様々な異常をもたらすと考えられています。今回の発見は、このような細胞の異常が起こるしくみの解明につながることが期待されます。
本研究は、情報・システム研究機構国立遺伝学研究所・島本勇太准教授、田村佐知子テクニカルスタッフ、前島一博教授と、長崎大学・増本博司講師との共同研究です。本研究の遂行にあたり、国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域(研究開発総括:名古屋大学大学院 曽我部正博特任教授)(課題名「細胞核のマイクロメカニクスと機械受容メカニズムの解明」、研究代表者:島本勇太)、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST) 「統合1細胞解析のための革新的技術基盤」(研究総括:東京大学大学院 菅野純夫教授)(研究課題名「超解像3次元ライブイメージングによるゲノムDNAの構造、エピゲノム状態、転写因子動態の経時的計測と操作」(JPMJCR15G2)、研究代表者:岡田 康志)、JSTテニュアトラック普及・定着事業、および科研費(15K14515、16H04746)の支援を受けました。
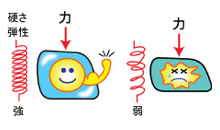
図1 細胞には絶えず力がかかっており、バネ弾性がないとつぶれてしまい(右)、細胞の機能が損なわれて異常が起きてしまう。
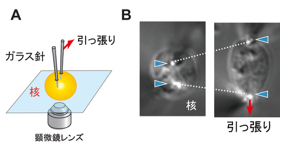
図2 (A) 核に2本の細いガラス針を刺し、引っ張る。(B) 核の変形とガラス針のたわみを顕微鏡で同時に観察して弾性を測定できる。
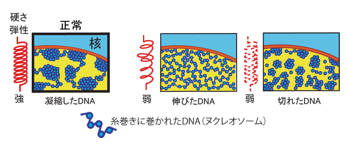
図3 DNAが凝縮し塊を作ることによって、バネ弾性が産み出される(左)。DNAが引き延ばされたり(中央)、切れたりすると(右)、バネが弱くなる。核の中ではDNAは糸巻きであるヒストンたんぱく質に巻かれて、ヌクレオソームと呼ばれる構造をつくっている。
遺伝情報分析研究室の飯塚朋代さんが総研大未来科学者賞を受賞

総研大は平成26年度から、科学者として活躍している修了生の研究を顕彰することを目的とした「総研大科学者賞」と、科学者を志す在学生の研究の奨励を目的とした「総研大未来科学者賞」を新設しました。
遺伝情報分析研究室 池尾研究室所属の飯塚朋代さん(総研大遺伝学専攻D3)がそのうちの「総研大未来科学者賞」を受賞しました。
研究テーマ
比較ゲノム解析による平行進化機構の解明 ~担子菌類を例として~
遺伝研 国際シンポジウム「ゲノムでわかる生命・環境・進化」を開催
4月1日付で教員3名が遺伝研に着任しました
2017年4月1日付で教員3名が遺伝研に着任しました.
| 教授 |
准教授 |
|
|
|
助教 |
|
右心室以外の心臓を構成する細胞へ分化する前駆細胞を発見
Sfrp5 identifies murine cardiac progenitors for all myocardial structures except for the right ventricle
Fujii Masayuki, Akane Sakaguchi, Ryo Kamata, Masataka Nagao, Shilvia M. Evans, Masao Yoshizumi, Akihiko Shimono, Yumiko Saga, and Hiroki Kokubo
Nature Communications. DOI:10.1038/NCOMMS1466
心臓は、発生過程において最も初期に形成される器官です。以前、心臓は発生初期に形成された心臓原基からすべての構造が形成されると考えられていましたが、最近、心臓原基の腹側領域にある細胞が、流出路から右心室にかけての領域を構成することが明らかとなりました。この細胞領域が二次心臓領域(Second heart field, SHF)、これまでの心臓原基は一次心臓領域(first heart field, FHF)と呼ばれています。二次心臓領域は心臓形成に寄与する心臓前駆細胞として認識されているのに対し、一次心臓領域はE7.5においてすでに心筋特異的分化マーカーを発現していることから、一次心臓領域に寄与する心臓前駆細胞は明らかにされていませんでした。また、刺激伝導系の一部を生み出す静脈洞についても、その前駆細胞については明らかになっていませんでした。
今回、Wntシグナルの負の制御因子であるSecreted frizzled-related protein (Sfrp)5 を発現する細胞の系譜解析を行なった結果、Sfrp5遺伝子を発現した細胞が、右心室以外の心筋と、静脈洞へと分化することから、右心室とそれ以外の心臓部分では、細胞系譜が異なること、またSfrp5発現細胞から刺激伝導系が生じる可能性が明らかになりました。今後Sfrp5遺伝子を発現する細胞の性質を詳しく解析することで、心房や心室を構成する心筋と、刺激伝導系を構成する特殊心筋の両心筋の誘導法が確立できることが期待されます。この研究は、以前発生工学研究室の助教であり現在は広島大学に所属する小久保博樹博士が、総研大の学生坂口あかねさんと推進した研究であり、遺伝研共同研究の成果となります。
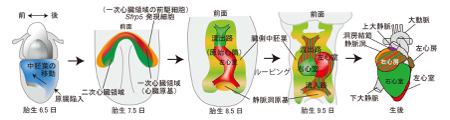
図 新たな心臓形成過程の模式図
胎生7.5日において、Sfrp5遺伝子が発現した細胞が左心室、心房の一部へと寄与する前駆細胞であること、また、Sfrp5遺伝子発現細胞の一部は、流出路と心房の一部へと寄与することを見出した。これまでの心臓形成のモデルを書きかえる重要な発見です。
「富澤純一先生を偲ぶ会」のご案内
去る2017年1月26日逝去されました国立遺伝学研究所長(第6代)富澤 純一 氏のお別れの会を、下記のとおり執り行いますので、謹んでお知らせいたします。
「富澤純一先生を偲ぶ会」
主催 「富澤純一先生を偲ぶ会」準備委員会
共催 国立遺伝学研究所、日本遺伝学会、日本分子生物学会
日時 平成29年4月22日(土) 午後2時から (午後1時 受付開始)
場所 三島市谷田1111 国立遺伝学研究所講堂
事前申込不要
問い合わせ 国立遺伝学研究所(荒木研究室)055-981-6756
アクセス https://www.nig.ac.jp/nig/ja/about-nig/access_ja
【富澤純一氏について】
富澤純一氏は、1947年に東京帝国大学を卒業後、国立予防衛生研究所化学部長、大阪大学教授、米国国立保健衛生研究所分子遺伝学部門部長を歴任した後、1989年に国立遺伝学研究所長に就任し、8年間に渡り、当研究所の発展に貢献されました。
研究面においては、細菌に感染するウイルス「T4ファージ」を用い遺伝的組換えがDNAの切断と再結合によって起こることの立証、プラスミド(環状2重鎖DNA)の試験管内での完全複製に初めて成功、DNAの複製開始がRNAによって制御されていることを示すなど、日本の分子生物学の草分けとして数々の業績を挙げられました。 これらの功績が認められ、日本学士院会員や全米科学アカデミー外国人会員に選出され、2000年には文化功労者に顕彰されました。日本分子生物学会の学会誌(英文学術誌)「Genes to Cells」では、初代編集長を1996年から2005年まで務めるとともに、若手研究者助成のための基金を寄付し、2011年から「富澤純一・桂子基金」として運用されています。
公募型共同研究・研究会「NIG-JOINT」採択結果について
中心体生物学 土屋さん、細胞建築 山本さん が「森島奨励賞」を受賞
総合研究大学院大学 遺伝学専攻が独自に行っている「森島奨励賞」の選考が、2016年度後期の学位申請者に対して行われ、
土屋裕樹さんと山本一徳さんが受賞しました。
・土屋裕樹(中心体生物学研究部門 北川研究室)
「The role of Cep295 in centrosome biogenesis of human cells」
・山本 一徳(細胞建築研究室 木村研究室)
「A study on inter-cellular forces for blastomere configurations in developing embryos」
授与式が2017年3月14日に行われ、桂専攻長から賞状と研究奨励金が贈られました。

森島奨励賞とは
総研大遺伝学専攻で優秀な研究成果を発表して学位を取得した学生に、その研究内容を称えるとともに今後のさらなる発展を促す目的で贈られます。遺伝学の先達
流行が作られるしくみ「同調現象」を、細胞の中で発見―細胞質流動の生成と逆転のメカニズム―
![]()
Endoplasmic Reticulum-Mediated Microtubule Alignment Governs Cytoplasmic Streaming
Kenji Kimura, Alexandre Mamane, Tohru Sasaki, Kohta Sato, Jun Takagi, Ritsuya Niwayama, Lars Hufnagel, Yuta Shimamoto, Jean-François Joanny, Seiichi Uchida, and Akatsuki Kimura
Nature Cell Biology (2017) DOI:10.1038/ncb3490
細胞内の流れ(細胞質流動)は、人間社会の流行のように気まぐれに逆転することがあります。情報・システム研究機構 国立遺伝学研究所の木村健二助教と木村暁教授らのグループは、この「流れ」の生成と逆転のメカニズムを、遺伝学と数理モデルを用いた解析により明らかにしました。この成果は3月14日(日本時間)に英国科学雑誌Nature Cell Biology に掲載されました。
人間社会の流行とは気まぐれなもので、いつのまにか多数派と少数派の逆転が起こります。流行の生成と逆転の原動力には、自らの意見や行動を周りの変化に合わせる「同調現象」が深く関わっています。興味深いことに、線虫の受精卵では細胞質流動の流れの向きが気まぐれに逆転します。細胞内の流れは微小管が作るレールの上を物質が運ばれることによって生じるので、レールが一方向にそろうとより大きな流れが生じます(図1)。
本研究では、細胞内に網目状に広がる小胞体が、微小管レールの方向性を同調させる「ネットワーク」の役割を担っていることを発見しました。さらに、微小管レールを人為的に長くすると流れの向きの逆転がほとんど起こらなくなることから、逆転の頻度が微小管レールの長さで決まることを突き止めました。すなわち、小胞体の動きが流れの同調効果を生み、微小管の長さが細胞質流動の逆転の頻度に影響するのです。
細胞質流動は動物胚の発生や植物の成長に重要な役割を果たしています。本研究は、細胞質流動の生成と逆転のメカニズムを明らかにしたことで、細胞質流動が関与する初期発生のしくみの解明につながると期待できます。また、同調やその逆転を細胞内で操作できることを明らかにしたことから、人間社会と自然界の両方で見られる同調現象のしくみを明らかにする良いモデルケースとなることも期待されます。
この研究は、国立遺伝学研究所の木村研究室と島本研究室、九州大学の内田研究室、仏キュリー研究所のJoanny研究室、EMBLのHufnagel博士との共同研究として行われました。本研究は文部科学省の科学研究費補助金、総研大若手教員海外派遣プログラム、日本学術振興会サマー・プログラムなどの助成を受けておこなわれました。
こちらで論文全文がご覧になれます。
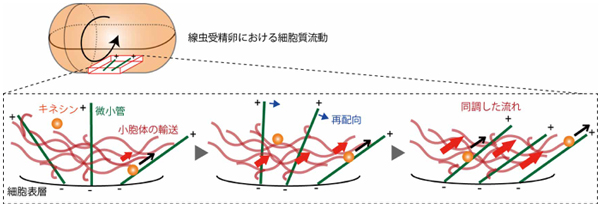
図1:細胞質流動を生むための小胞体を介した同調効果を示すモデル図
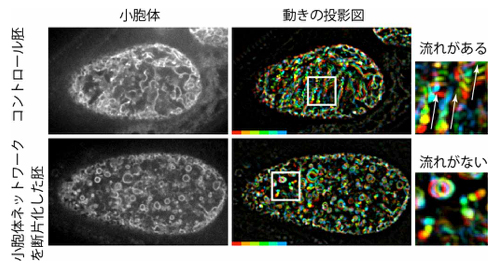
図2:線虫受精卵における小胞体とその動き
左列に線虫受精卵における小胞体の蛍光写真を示した(上段:正常胚、下段:小胞体の網目状構造を断片化した胚)。中列に連続写真の投影図を示した。動きを示すために各タイムポイントの蛍光像の色を変えて重ねて表示している。右列は白枠内の拡大図。流れの方向を矢印で示した。

















