Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
遺伝子回路研究室 宮崎研究員が 日本味と匂学会第51回大会の優秀発表賞を受賞

遺伝子回路研究室の宮崎隆明研究員は、9月25~27に開催された「日本味と匂学会第51回大会」に於いてポスター発表を行い、「味覚部門」優秀発表賞を受賞しました。
受賞ポスタータイトル:
「Gustatory second-order neurons that have direct synaptic connections to the feeding/reward systems (キイロショウジョウバエにおいて味覚二次神経は摂食/報酬系に直接シナプス接続する)」歯の本数は、複数のエンハンサーによるShh遺伝子の発現調節によって決まる
SHH signaling directed by two oral epithelium-specific enhancers controls tooth and oral development
Tomoko Sagai, Takanori Amano, Akiteru Maeno, Hiroshi Kiyonari, Hyejin Seo, Sung-Won Cho and Toshihiko Shiroishi
Scientific Reports, 7, Article number: 13004 (2017) DOI:10.1038/s41598-017-12532-y
動物の種によって臼歯や切歯の数や並び方はさまざまです。このような形態の多様性を生み出す遺伝学的なメカニズムは、まだ明らかになっていませんでした。国立遺伝学研究所の嵯峨井知子博士研究員、天野孝紀助教、城石俊彦教授らのグループは、複数の遺伝子発現制御配列(エンハンサー)が協調的に機能して歯の形成を制御するメカニズムを発見しました。この研究成果は、韓国のヨンセ大学Sung-Won Cho博士、理研ライフサイエンス技術基盤研究センターの清成寛ユニットリーダーらのグループとの共同研究として、英国科学誌Scientific Reportsのオンライン版(10月11日)に掲載されました。
歯や舌など口腔内における器官形成に重要な遺伝子であるShhは、その発現がどのように制御され、形態にどのように寄与しているのか、ほとんど分かっていませんでした。本研究では、歯と舌の味蕾におけるShhの発現を制御する2つのエンハンサーに着目して、これらを遺伝子工学的に破壊したマウス(ノックアウトマウス)を作製しました。どちらか1つのエンハンサー配列を破壊しても、歯や舌などの口腔器官の形成に顕著な異常は見られず、2つのエンハンサーを同時に破壊した場合に、はじめて臼歯が過剰に形成されるという異常な表現型が見られました。
このエンハンサー同時破壊マウスでは、発生中の歯においてShh遺伝子の発現量が著しく低下するものの、発現量がゼロにならないことがわかりました。この結果から、本研究で破壊した2つのエンハンサー以外にもShh発現に寄与する制御配列の存在が推定され、3つ以上のエンハンサーによって発現量が段階的に制御されていることが示唆されました。すなわち、複数のエンハンサーがShhの発現を一定量以上に保つことによって、マウスの歯の本数が正確にコントロールされていることが明らかになりました。本研究は、文部科学省の科学研究費補助金(科研費番号24247002)の助成によっておこなわれました。
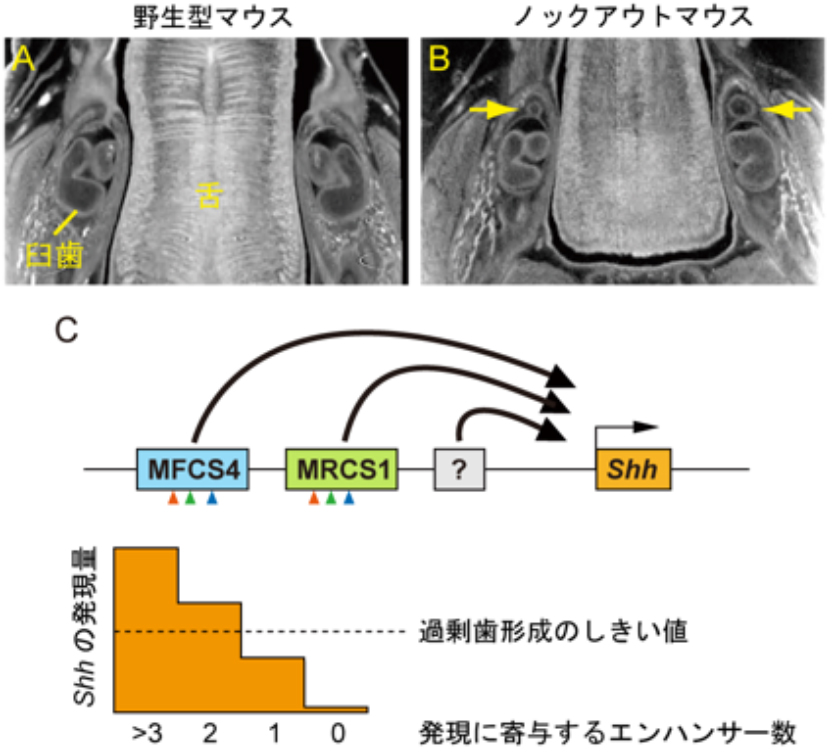
Shhエンハンサーの同時ノックアウトマウスにおける過剰臼歯の形成。野生型マウス(A)とエンハンサー同時ノックアウトマウス(B)の胎仔の下顎のX線CT画像。エンハンサーが破壊された場合には、第一臼歯の前に過剰な歯が形成される。歯の形態形成におけるShhエンハンサーの作用モデル(C)。二つのエンハンサー(MFCS4とMRCS1)は、進化的に保存された三つのモチーフを持ち(C、矢頭)、両者の機能が重複していることをよく説明する。Shhの発現量は、未同定のエンハンサーを含む複数のエンハンサーによって加算的に制御され、Shh発現が一定量のしきい値を下回ることにより過剰歯が形成されると考えられる。二つのエンハンサーは、制御する発現領域が少し異なることから、部分的に機能分化しつつも協調して歯の形態形成に寄与していると考えられる。
※本研究成果にはマイクロCTスキャンの技術が貢献しています
陸上植物の祖先の特徴をもつ苔類ゼニゴケの全ゲノム構造を解明
![]()
Insights into land plant evolution garnered from the Marchantia polymorpha genome
John L. Bowman, Takayuki Kohchi, Katsuyuki T. Yamato, et al.
Cell Volume 171, Issue 2, p287–304.e15, 5 October 2017 DOI:/10.1016/j.cell.2017.09.
京都大学の河内孝之 教授らの研究グループは、豪・モナシュ大学(ジョン L. ボウマン教授)、近畿大学(大和勝幸教授)、神戸大学(石崎公庸准教授)、情報・システム研究機構 国立遺伝学研究所(中村保一教授)、基礎生物学研究所(上田貴志教授)、東北大学(経塚淳子教授)をはじめとする国内外39の大学・研究機関と共同で、ゼニゴケの全ゲノム構造を解明しました。
イネやアブラナなどの被子植物からコケ植物まで、全ての陸上植物は藻類から進化し、約5億年前に水中から陸上へと進出しました。コケ植物の一種である苔類は、陸上進出後の最も早い時期に他の種から分かれて独自に進化した植物の系統の1つであり、陸上植物の祖先の特徴を保っています。このことから、苔類を用いた研究により、全ての陸上植物に共通する重要な分子メカニズムとその進化を解明することが可能になると期待されます。ゼニゴケは苔類の代表的な種の1つであり、15世紀以来、個体発生・生理・遺伝の様式について詳細な観察が行われてきました。近年、ゲノム編集技術 をはじめとする様々な遺伝子機能解析の手法が確立され、分子メカニズムの研究が容易な植物として改めて注目されるようになりました。
今回の研究でゼニゴケの全ゲノムの塩基配列が判明し、構造が明らかになりました。その結果、ゼニゴケは他の植物種に比べて、植物の発生過程・生理機能の制御に関わる遺伝子の重複 が非常に少ないこと、ゼニゴケが陸上植物の基本的な分子メカニズムの祖先型を持つことなどがわかりました。本研究により、ゼニゴケは、植物の基本的な分子メカニズムを研究するための新たな「モデル植物」として確立され、今後の研究により新しい育種技術などへの応用につながることが期待されます。
本研究成果は10月5日、Cellオンライン版に掲載されます。
遺伝研の貢献
大量遺伝情報研究室はコミュニティアノテーションシステムとゲノムデータベースを構築し運用することにより、ゲノムのアノテーションの質の向上に寄与しました。また、先端ゲノミクス推進センターおよび比較ゲノム解析研究室は完全長 cDNA 配列解析を実施することにより、ゲノムアノテーションの基盤情報提供と質の向上に貢献しました。
研究支援
本研究は科学研究費補助金 新学術領域研究「植物発生ロジックの多元的開拓」、新学術領域研究「先進ゲノム支援」、基盤研究(B)「陸上植物における光環境依存的な成長相転換機構の普遍性と多様性」等の支援を受けました。

※著者所属:京都大学、近畿大学、神戸大学、国立遺伝学研究所、奈良先端科学技術大学院大学、東京大学、名古屋大学、岡山大学、基礎生物学研究所、東北大学、東京農業大学、かずさDNA研究所、理化学研究所、首都大学東京、熊本大学、埼玉大学、豪・モナシュ大学、米・エネルギー省Joint Genome Institute、オーストリア・グレゴールメンデル研究所、独・オスナブルック大学、墨・INBIOTECA、英・ケンブリッジ大学、墨・CINVESTAV-IPN、英・オックスフォード大学、新・The New Zealand Institute for Plant & Food Research、スウェーデン・ウプサラ大学、オーストリア・ウィーンバイオテクノロジーセンター、仏・モンペリエ大学、スイス・チューリッヒ大学、米・ケンタッキー大学、国立台湾大学、米・コールドスプリングハーバー研究所、西・Centro Nacional de Biotecnologia-CSIC、米・アリゾナ大学、米・ミネソタ大学、独・マックスプランク研究所、独・ウルム大学
- ゼニゴケのゲノムデータベースをこちらでご利用いただけます
染色体生化学研究室 村山准教授が 遺伝学会奨励賞を受賞

2017年7月1日着任の新分野創造センター 染色体生化学研究室 村山泰斗准教授は、9月14日、日本遺伝学会第89回大会(岡山開催)に於いて日本遺伝学会奨励賞を受賞しました。
日本遺伝学会奨励賞は、遺伝学の特定の分野ですぐれた研究を活発に行い将来の成果が期待される会員に授与されます。
受賞名:日本遺伝学会奨励賞
受賞テーマ:「コヒーシンによる姉妹染色体接着の制御機構に関する研究」
「Molecular regulation of sister chromatid cohesion by the cohesin ring complex」2018年度国立遺伝学研究所 共同研究・研究会「NIG-JOINT」の募集を開始しました(締切:2017年12月18日(月))
遺伝研 公開講演会2017 – 講演の動画を配信中
藻類の酸性環境への適応戦略 -強酸性環境に生息する藻類のゲノム情報を解読-
![]()
Acidophilic green algal genome provides insights into adaptation to an acidic environment
Shunsuke Hirooka, Yuu Hirose, Yu Kanesaki, Sumio Higuchi, Takayuki Fujiwara, Ryo Onuma, Atsuko Era, Ryudo Ohbayashi, Akihiro Uzuka, Hisayoshi Nozaki, Hirofumi Yoshikawa, Shin-ya Miyagishima
PNAS September 11, 2017 DOI:10.1073/pnas.1707072114
藻類は世界中の様々な環境に生息しています。多くの生物は生きることが難しいpH 2という胃酸並の酸性環境に生息する藻類も多く存在します。過酷な酸性環境にこれらの藻類はどのようにして適応したのでしょうか?
情報・システム機構国立遺伝学研究所の廣岡俊亮研究員、宮城島進也教授らと豊橋技術科学大学・広瀬侑助教、東京農業大学・兼崎友研究員、吉川博文教授、野尻湖水草復元研究会・樋口澄男氏、東京大学・野崎久義准教授らの共同グループは好酸性緑藻Chlamydomonas eustigmaのゲノムを解読し、好酸性緑藻のゲノムの特徴を見出すことにより、世界で初めて藻類の酸性環境への適応機構を明らかにしました。
本成果により、藻類の適応進化の理解が進むとともに、多くの生物の増殖を抑制する酸性環境で生育できる有用藻類の創出が期待されます。これによって、藻類の野外大量培養で問題となる他生物混入の解決が期待されます。
本研究成果は、米国科学誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版(Early Edition)に2017年9月第3週に掲載されます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「藻類・水圏微生物の機能解明と制御によるバイオエネルギー創成のための基盤技術の創出」(研究総括:早稲田大学・松永是教授)における研究課題「高バイオマス生産に向けた高温・酸性耐性藻類の創出」(研究代表者:宮城島進也)、文部科学省私立大学戦略的研究基盤形成支援事業(S1311017)、および文部科学省の科学研究費補助金(25251039)の支援を受けておこなわれました。
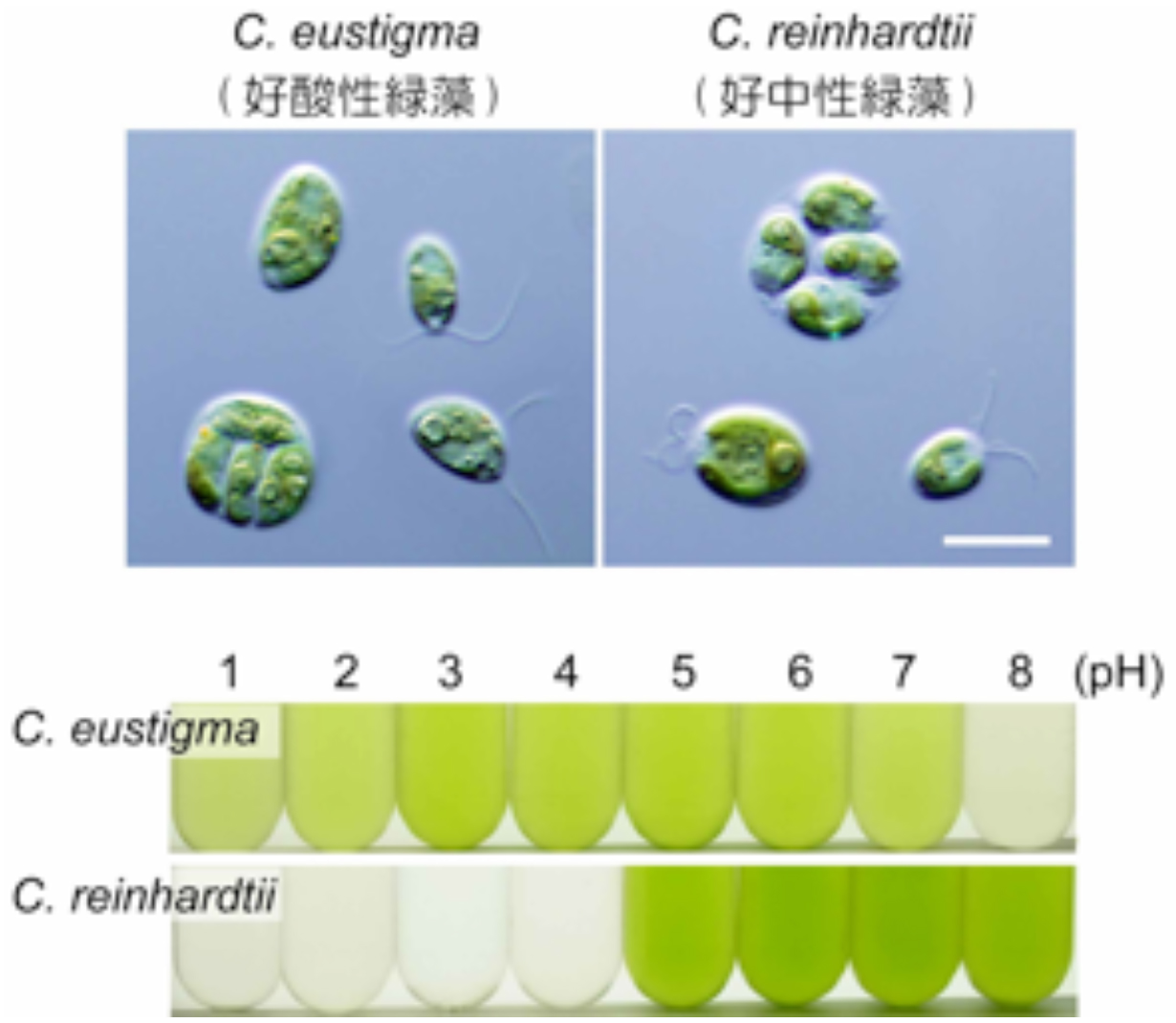
好酸性緑藻であるC. eustigmaは近縁の好中性緑藻Chlamydomonas reinhardtiiよりも酸性の環境で生育できる。画像中のスケールバーは10μm。
微生物遺伝 Harsh Nagpalさんが「森島奨励賞」を受賞
総合研究大学院大学 遺伝学専攻が独自に行っている「森島奨励賞」の選考が、2017年度前期の学位申請者に対して行われ、微生物遺伝研究部門 荒木研究室に所属し、特別研究派遣学生として大阪大学大学院生命機能研究科 深川研究室へ派遣されているHarsh Nagpalさんが受賞しました。授与式が2017年9月8日に行われ、桂専攻長から賞状と研究奨励金が贈られました。


遺伝子発現解析の基準となるデータを快適に検索できるウェブツール「RefEx」を開発
![]()
RefEx(Reference Expression dataset)
URL:http://refex.dbcls.jp
RefEx, a reference gene expression dataset as a web tool for the functional analysis of genes
Ono H, Ogasawara O, Okubo K, Bono H
Scientific Data, 4:170105 DOI:10.1038/sdata.2017.105
現在、生命科学分野においては誰でも利用可能なデータが公共データベースとして多数存在しているものの、実際にそれらを自らの研究に利用しようとしたときに、どれを使ったらよいか分からないといった問題があります。とくに遺伝子発現データは、DNAマイクロアレイの発明によってゲノム規模の測定が可能となってから、さまざまな研究グループによって異なる測定手法を用いて産生されたデータが指数関数的に蓄積していました。大量の遺伝子発現データの中から、まずどれを選び、調べればよいのかの指針になりうる代表的な遺伝子発現量データセットあるいはリファレンス(参照)データが必要とされている状況でした。
このたび、情報・システム研究機構 データサイエンス共同利用基盤施設 ライフサイエンス統合データベースセンター(DBCLS)の小野 浩雅 特任助教、坊農 秀雅 特任准教授、情報・システム研究機構 国立遺伝学研究所の小笠原 理 特任准教授、大久保 公策 教授の研究グループは、 遺伝子発現解析の基準となる各遺伝子の遺伝子発現量を簡単に検索、閲覧できるウェブツール「RefEx」(http://refex.dbcls.jp)を開発しました。複数の遺伝子発現計測手法によって得られた哺乳類の正常組織、細胞等における遺伝子発現データを収集し並列に表現することによって、各組織における遺伝子発現状況を計測手法間の差異とともに直感的に比較できることが特長です。RefExを用いることで、生命現象の解明や医薬品の開発等につながる研究成果の解釈などが容易になり、生命科学研究の進展に大いに寄与することが期待されます。
本研究は、国立遺伝学研究所が有する遺伝研スーパーコンピュータシステムを利用しました。
本成果は8月30日(英国時間)に英国オンライン・ジャーナル Scientific Data に掲載されました。
発表論文の日本語レビュー (First Author’s by DBCLS)
FANTOM5データを誰でも活用できる形に (Nature Japan著者インタビュー, フリーアクセス)

図 遺伝子発現解析の基準となるデータを快適に検索可能なウェブツール「RefEx」
生細胞クロマチンの「密度」イメージングに成功!
Density imaging of heterochromatin in live cells using orientation-independent-DIC microscopy
Ryosuke Imai, Tadasu Nozaki, Tomomi Tani, Kazunari Kaizu, Kayo Hibino, Satoru Ide, Sachiko Tamura, Koichi Takahashi, Michael Shribak, and Kazuhiro Maeshima
Molecular Biology of the Cell, 2017 DOI:10.1091/mbc.E17-06-0359
国立遺伝学研究所・総研大大学院生 今井亮輔(学振特別研究員)、野崎慎 学振特別研究員、前島一博教授らは、米国ウッズホール海洋生物学研究所(MBL)・Michael Shribakチームリーダー、谷知己チームリーダー、理化学研究所生命システム研究センター・高橋恒一チームリーダーらと共同で、ヘテロクロマチンなどの細胞内構造の密度を生きた細胞のなかで観察することに成功しました。この成果は、米国細胞生物学会Molecular Biology of the Cell誌にオンライン出版されました。同誌Quantitative Cell Biology特集号(11月号)に重要論文であることを示す「ハイライト」として掲載されます。
真核生物の細胞核の中には「ヘテロクロマチン」と呼ばれる転写不活性で凝集したクロマチンが存在しています。細胞核内のDNAを特異的染色によって調べると、このヘテロクロマチン領域は周囲の脱凝集領域(ユークロマチン)の5.5倍から7.5倍もDNAが濃縮されていることがわかります。これまで、ヘテロクロマチンはこのような高度な凝集によって転写因子等のアクセスを阻害し、転写不活化していると考えられてきました。しかしながら今回、MBLのShribakによって開発された、観察対象の屈折率および質量濃度を定量的にマッピングする微分干渉顕微鏡Orientation Independent DIC (OI-DIC)を用いて、生細胞核内の各クロマチン領域の絶対密度定量を行ったところ、ヘテロクロマチンの密度(208 mg/mL) はユークロマチン(136 mg/mL)のわずか1.53倍であることが明らかになりました(図)。
定量解析の結果、各クロマチン領域における最大の構成成分はDNA(ヌクレオソーム)ではなく、タンパク質やRNAといったヌクレオソーム以外の成分(~120 mg/mL)であることが分かりました。更に遺伝研スパコンを用いたモンテカルロシミュレーションの結果から、このヌクレオソーム以外の構成成分がヘテロクロマチンの穏やかなアクセス阻害(moderate access barrier)を産み出していることが示唆されました。
これらの成果により、生きた細胞のクロマチン環境を理解するためには、従来クロマチンの主な構成成分と思われていたヌクレオソームだけでなく、それ以外の成分にも着目する必要性が明らかになりました。また今回定量した密度値は今後の細胞内クロマチン環境の細胞生物学的・生物物理学的研究にとって重要な基礎データとなります。
本研究の遂行に当たり、平成27年度総研大海外学生派遣事業、遺伝研・共同研究(2016-A2)、文部科学省科研費(16H04746, 17J10896)、JST CREST (No. JPMJCR15G2)、NIHグラント(R01-GM101701) の支援を受けました。
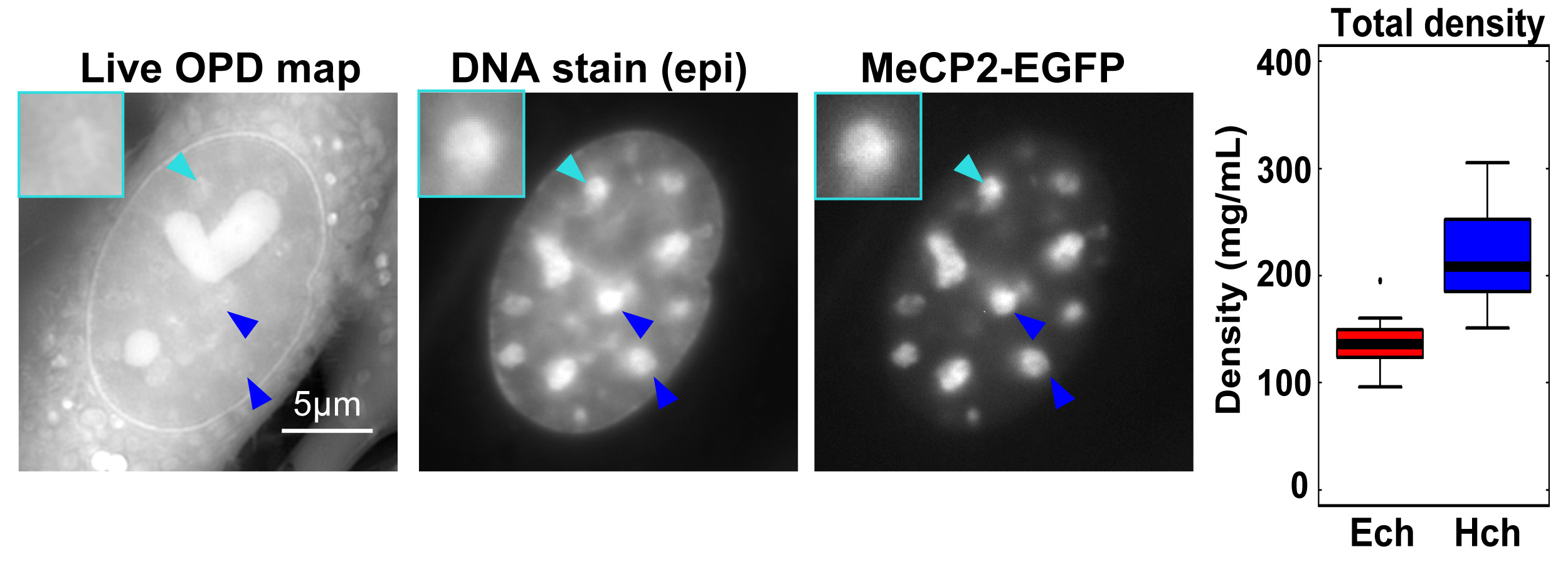
(左) 同一のマウス生細胞におけるOI-DIC光路長差マップ (光が透過する局所領域の屈折率差をマッピングした像)、DNA染色像およびヘテロクロマチンマーカーMeCP2-EGFP蛍光像。矢尻で示される蛍光の強い領域がヘテロクロマチン。光路長差マップでは、これらの領域は周囲のユークロマチンより同等か、わずかにだけ明るい。OI-DIC光路長差マップの核内の強いシグナルは、核小体に由来するもの。(右) 既知の質量濃度と屈折率を持つ溶液の検量線に基づいて定量したヘテロクロマチン (Hch, 208 mg/mL) およびユークロマチン (Ech, 136 mg/mL) の質量濃度(密度)。各クロマチン領域の密度比は1.53であった。
セルロース合成の”足場”増やす遺伝子を発見
![]()
A novel plasma membrane-anchored protein regulates xylem cell-wall deposition through microtubule-dependent lateral inhibition of Rho GTPase domains
Yuki Sugiyama, Mayumi Wakazaki, Kiminori Toyooka, Hiroo Fukuda, Yoshihisa Oda
Current Biology DOI:10.1016/j.cub.2017.06.059
セルロースは、紙・綿だけでなく近年注目されているセルロースナノファイバーなどの成分にもなる重要な生物資源です。セルロースは植物細胞の「細胞壁」に含まれる主要な物質ですが、その合成を制御する仕組みはよく分かっていません。
情報・システム研究機構国立遺伝学研究所の小田祥久准教授らの研究グループは植物の細胞壁合成を制御する新しい遺伝子IQD13を発見しました。IQD13遺伝子が作り出すタンパク質はセルロース合成の足場となる微小管(1)を安定化させるとともに、細胞壁合成を阻害するタンパク質の分布を制限することで、細胞壁の面積を増やす働きがあることがわかりました(図)。
IQD13遺伝子の働きを人為的に操作することにより、細胞壁の合成を制御して、セルロース生産に利用しやすい植物の作出に繋がることが期待されます。
本研究は、東京大学大学院理学系研究科、理化学研究所 環境資源科学研究センターとの共同研究としておこなわれました。
本研究成果は、平成29年8月10日(米国東部標準時間)に米国科学雑誌Current Biology に掲載されました。
本研究は、文部科学省の科学研究費補助金 (16H01247, 15H01243, 15H05958)、日本学術振興会の科学研究費補助金16H06172, 16H06377)、科学技術振興機構(JST)の戦略的創造研究推進事業さきがけ (JPMJPR11B3)、三菱財団の助成を受けました。
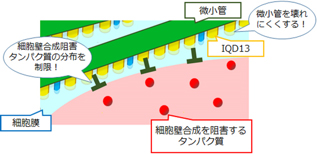
図 IQD13は、微小管を壊れにくくすると同時に、細胞壁合成を阻害するタンパク質の分布を制限していると考えられる
脳機能研究部門 平田教授と、多細胞構築研究室 澤教授が 平成28年度特別研究員等審査会専門委員(書面担当)として表彰されました

日本学術振興会では、学術研究の将来を担う研究者の養成・確保を目的とした特別研究員事業を行っており、その選考に際しては、適正・公平な審査のため、審査終了後、書面審査結果の検証を行っています。その検証結果に基づき第一段の書面審査において有意義な審査意見を付した専門委員が表彰されることとなっていますが、平成28年度は書面審査を行った約1,500名の専門委員等のうち、表彰対象の任期2年目にあたる約600名の中から158名が選考され、本研究所の平田教授と澤教授が対象となりました。
表彰式は8月8日(火)に行われ、桂勲研究所長より表彰状が授与されました。
社会的順位がうつ様行動や脳内の遺伝子発現に影響する
![]()
Hierarchy in the home cage affects behaviour and gene expression in group-housed C57BL/6 male mice
Yasuyuki Horii, Tatsuhiro Nagasawa, Hiroyuki Sakakibara, Aki Takahashi, Akira Tanave, Yuki Matsumoto, Hiromichi Nagayama, Kazuto Yoshimi, Michiko T. Yasuda, Kayoko Shimoi, Tsuyoshi Koide
Scientific Reports Article number: 6991 (2017) DOI:10.1038/s41598-017-07233-5
うつ病の発症の多くで生活環境によるストレスが関わっていると考えられており、その中でも「社会的ストレス」は対応の難しいものの一つです。したがって、社会的ストレスが脳に与える影響を明らかにすることは、うつ病を軽減するための治療法の確立に役立つと期待されています。
本研究では、社会的ストレスがあると報告されていた実験動物のマウスを用いることで、うつ様行動を誘発する社会的ストレスの詳細を調べました。その結果、社会的順位(1)が「低い」とよりうつ様行動(2)を示すことが判明しました。さらに、社会的順位の脳内の遺伝子発現への影響を調べた結果、セロトニン受容体などの遺伝子の発現に影響することが明らかになりました。また、このうつ様行動と遺伝子発現の変化は抗うつ薬(3)の投与によって緩和されました。
本研究成果によって、社会的順位によるストレスが脳に与える影響を明らかにすることができました。うつ病の改善に向けた方法論の確立につながることが期待できます。
行動や性格には遺伝と環境の両方が重要な役割をはたしていますが、今回の研究では遺伝によらない環境の影響について遺伝研の行動遺伝学をテーマにしているチームと静岡県立大のチームが明らかにしました。
本研究成果は、平成29年8月1日10時(英国時間)に英国オンライン・ジャーナル Scientific Reports に掲載されました。
本研究は、情報・システム研究機構 国立遺伝学研究所の堀井康行および小出剛准教授らと静岡県立大学の大学院生長澤達弘および下位香代子教授らとの共同研究として実施されました。
本研究は科学研究費補助金、特に新学術領域「マイクロ精神病態」(15H01298)、科学研究費補助金(15H05724, 16H01491 and 15H04289)、遺伝研共同研究(2013-B7)の支援を受けました。
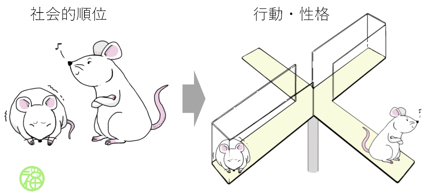
図:本研究では、ケージ内で形成される社会的順位がマウス個体の行動・性格や脳内の遺伝子発現に影響を及ぼすことを明らかにしました。
夏季休業のお知らせ(8/14,15)
本研究所は、下記のとおり夏季一斉休業を実施します。
ご不便をおかけいたしますが、ご理解とご協力のほどお願いいたします。
平成29年8月14日(月)、15日(火)
「第三回ショウジョウバエ多様性研究会(9/30〜10/2)」を開催
左右の神経の混線を防ぐ“正中線の関所”を守る仕組み
![]()
Spinal RacGAP α-chimaerin is required to establish the midline barrier for proper corticospinal axon guidance
Shota Katori, Yukiko Noguchi-Katori, Shigeyoshi Itohara, Takuji Iwasato
Journal of Neuroscience 26 July 2017, 3123-16; DOI:10.1523/JNEUROSCI.3123-16.2017
遺伝研のある三島からすぐ東の箱根には江戸時代、関所が設けられ入り鉄砲出女などの不適切な旅人が通過することを防ぐために厳しい取り調べがおこなわれていました。同様に、発達期の脳や脊髄の中にも関所があり、越えてもよい神経と越えてはいけない神経の選別がおこなわれています。こうした関所での神経の選別の仕組みは比較的よく研究されてきました。一方、もし、箱根の関所自体が壊れてしまったら、不適切な旅人も審査を受けずに自由に行き来できるようになってしまいますので、関所が正常に機能するためには関所を護衛することも大切です。神経でも同様ですが、これまで神経の関所が守られる仕組みは知られていませんでした。
情報・システム研究機構国立遺伝学研究所の香取将太研究員、岩里琢治教授らの研究チームは、脊髄の真ん中(正中線)にある関所に着目し、マウスを用いた実験で神経の関所を守る仕組みを世界で初めてあきらかにしました。
胎児や子供の脳・脊髄では、正中線にある関所において、正中線を通過して左右交差する神経を適切に選別し、左右の神経の混線を防いでいます。本研究では遺伝子ノックアウトの技術を駆使して、脊髄の正中線の関所を守る仕組みにαキメリンと呼ばれるたんぱく質が重要な役割を持ち、αキメリンは周辺細胞が正中線に侵入して関所を壊すのを防いでいることをあきらかにしました(図)
神経の「関所を守る仕組み」が存在することは新しい発見であり、本成果により、発達期に神経が選択的につながる仕組みの理解を進展させることが期待されます。
本研究成果は、平成29年7月26日(米国東部時間)に北米神経科学学会誌 Journal of Neuroscience に掲載されました。
本研究は、国立遺伝学研究所形質遺伝研究部門の香取将太研究員が中心となり、国立遺伝学研究所形質遺伝研究部門 岩里琢治研究室、理化学研究所脳科学総合研究センター行動遺伝学技術開発チームとの共同研究でおこなわれました。
本研究は、科学研究費補助金(15K14889, 13J04498, 16K14559, 15H04263, 15H01454, 22115009)、新学術領域「スクラップ&ビルドによる脳機能の動的制御」(16H06459)、新潟大学脳科学研究所共同利用・共同研究(2016-2610)の支援によりおこなわれました。
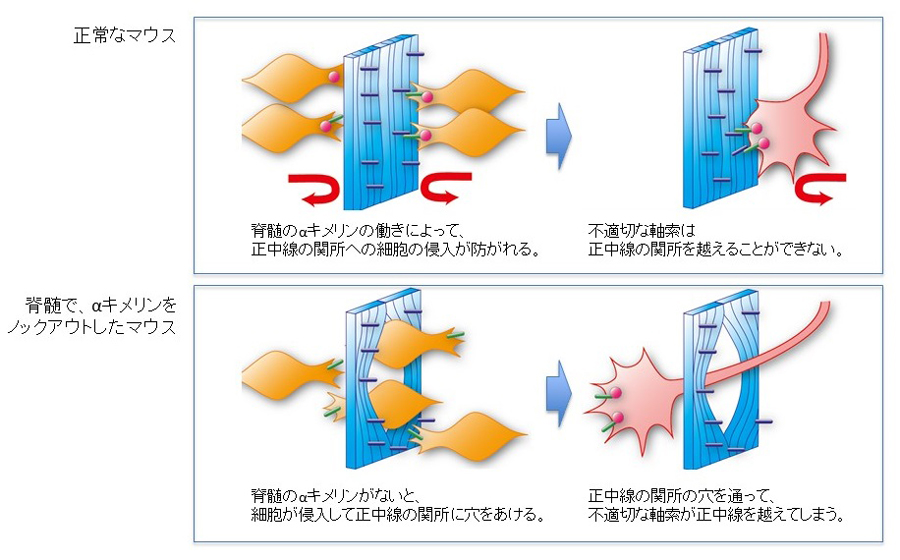
図 脊髄のαキメリンは、神経の関所を守ることによって、不適切な軸索が通過することを防いでいる。
ヒト内在性レトロウイルス由来転写調節エレメントの網羅的同定
Systematic Identification and Characterization of Regulatory Elements Derived from Human Endogenous Retroviruses.
Jumpei Ito, Ryota Sugimoto, Hirofumi Nakaoka, Shiro Yamada, Tetsuaki Kimura, Takahide Hayano, and Ituro Inoue.
PLoS Genetics. Jul 12;13(7):e1006883. 2017. DOI:10.1371/journal.pgen.1006883
トランスポゾンの一種であるヒト内在性レトロウイルス(HERV)は、自身の配列中に転写調節エレメントを有しており、挿入部位近傍の遺伝子発現に様々な影響を与える。本研究では公的データベースに蓄積したChIP-Seqデータを再解析することで、HERV由来転写調節エレメント(HERV-RE)を網羅的に同定した。合計794,972箇所のHERV-REが同定された。クラスター解析により、HERVが転写因子の結合パターンによりいくつかのグループに分類されることが明らかとなった。すなわち、多能性幹細胞系(POU5F1, SOX2, NANOG)、内胚葉系(FOXA1/2, FATA4/6, SOX17)、造血幹細胞系(GATA1/2, SPI1, TAL1)の転写因子、およびCTCFが結合するHERVグループが同定された。HERV-REは先天性免疫システムに関わる遺伝子周囲に有意に多く存在しており、これら遺伝子の調節に関わっていることが示唆された。また我々は、同定されたHERV-REを搭載したデータベースdbHERV-REs (http://herv-tfbs.com/)をWEB上に公開した。本研究は遺伝子転写調節におけるHERV-REの役割を解明するための基盤を提供するものである。
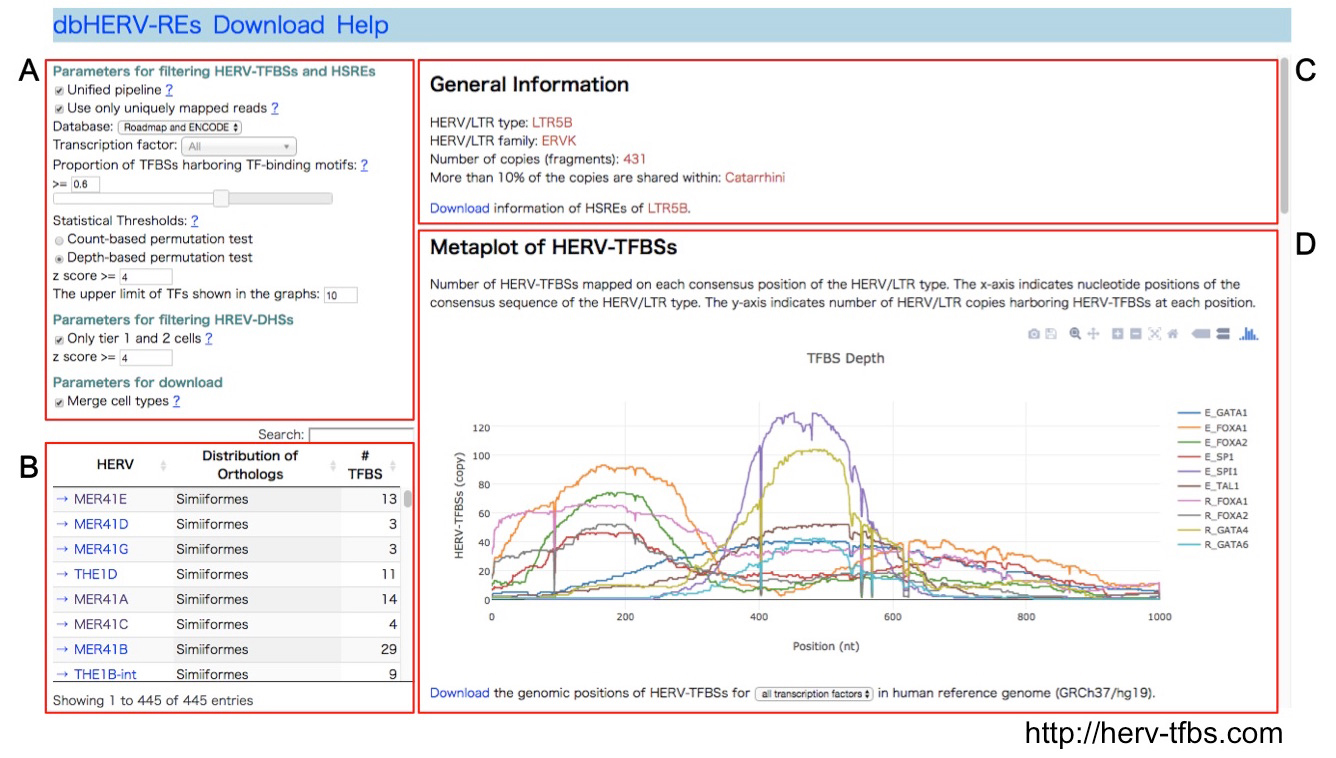
dbHERV-REs (http://herv-tfbs.com/)。各種パラメータおよび転写因子の種類等を選択し(A)、HERVの種類を選択すると(B)、HERVの基礎情報(系統学的分類、コピー数、挿入年代)(C)、およびHERV-REのHERV配列上およびヒトゲノム上における位置情報を表示する(D)。
「夏休み子ども遺伝学講座」を開催
お米が実るようすを観察しよう!
お米が実るようすを観察しよう!と題して「夏休み子ども遺伝学講座」を開催いたします。
毎日食べているお米を一緒に観察してみましょう。
対象:
三島市内の小学校3年生~6年生 30名
申込者多数の場合は抽選となります。
日時:
平成29年8月23日(水)
午前9時00分~午前12時00分(予定)
場所:
国立遺伝学研究所(三島市谷田1111)
申込:
三島市政策企画課まで電話か電子メールでお申込みください。
申込時に ①氏名 ②学年 ③住所 ④電話番号 をお伝えください。
申込み締切は平成29年8月10日(木)です。
E-mail: seisaku@city.mishima.shizuoka.jp
















