Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
植物細胞遺伝研究室Harsha Somashekar さんが「森島奨励賞」を受賞

総合研究大学院大学 遺伝学コースが独自に行っている「森島奨励賞」の選考が、2023年度前期の学位出願者に対して行われ、植物細胞遺伝研究室 野々村研究室に所属するHarsha Somashekarさんが受賞しました。
・Harsha Somashekar(植物細胞遺伝研究室 野々村研究室)
「GLUCAN SYNTHASE-LIKE5 promotes anther callose deposition to maintain timely initiation and progression of meiosis in rice (Oryza sativa L.)」
授与式が2023年9月12日に行われ、花岡所長から賞状と研究奨励金が贈られました。
▶ 森島奨励賞とは
総研大遺伝学専攻で優秀な研究成果を発表して学位を取得した学生に、その研究内容を称えるとともに今後のさらなる発展を促す目的で贈られます。
▶ 遺伝学の先達
2023年度 PAGS・DDBJ合同 初級者情報解析講習会 申込締切:10月2日(月)
会場: ハイブリッド開催(Onsite & Online Hybrid) Zoom使用 現地会場:国立遺伝学研究所(DDBJ)静岡県三島市谷田1111
想定スキルレベル: 情報解析初級者(UNIX初心者)
募集人員: 現地会場: 20 名程度、オンライン参加:100名程度 ・応募者多数の場合は、先進ゲノム支援における支援依頼者及び申請者を優先します。さらに多数の場合は抽選等で参加者を決定いたします。 ・各自のPCを持参ください(Windows、Macいずれも可) ・講習内容をご自身のPCで行うには遺伝研スパコンのログインユーザアカウントが必要となります。お持ちでない方で現地参加の方、およびオンライン参加でご希望の方は当選確定後直ちに取得していただく必要があります。なお、オンライン参加の方は、遺伝研スパコンのアカウント取得は必須ではありません。 ・抽選に外れた方およびオンラインでの参加希望者にはweb配信でご参加頂けます(講習内容についてのオンライン参加者からの質問には、参加者のマシン環境依存の問題もあるため、回答困難な場合もあることをご承知おきください)。
参加費用: 無料(旅費は参加者でご負担ください。)
申込締切: 2023年10月2日(月)
※ 申込方法・講習スケジュール等、詳細につきましては以下のURLをご覧ください。 https://www.genome-sci.jp/bioinformatic#1
第31回木原記念財団学術賞講演会のご案内(8/30・オンライン)
第31回木原記念財団学術賞を本研究所の宮城島進也教授(共生細胞進化研究室)が受賞しました。木原記念財団より記念講演会がオンラインで開催されます。お申し込みによりどなたでもご聴講いただけます。
日時: 2023年8月30日(水) 14:00-16:15
14:20~15:20 第31回受賞者 国立遺伝学研究所 宮城島進也博士
「微細藻類の研究系ー細胞内共生による生命進化の研究と社会実装ー」
15:20~16:05 祝賀講演 国立遺伝学研究所 所長 花岡文雄博士
「国立遺伝学研究所の歩み」
会場: オンライン開催(ZOOM)
申し込み: 木原記念財団ウェブサイトよりお申し込み頂けます。
参加無料・定員500名
DNA複製開始に必須なタンパク質の発見
In silico protein interaction screening uncovers DONSON’s role in replication initiation
Yang Lim, Lukas Tamayo-Orrego, Ernst Schmid, Zygimante Tarnauskaite, Olga V. Kochenova, Rhian Gruar, Sachiko Muramatsu, Luke Lynch, Aitana Verdu Schlie, Paula L. Carroll, Gheorghe Chistol, Martin A. M. Reijns, Masato T. Kanemaki, Andrew P. Jackson, and Johannes C. Walter
Science 2023 Aug 17 DOI:10.1126/science.adi3448
細胞が増殖するには、遺伝情報をコードする染色体DNAを複製する必要があります。これまで、真核生物のDNA複製研究は出芽酵母をモデルとして解析が進んでいました。出芽酵母においては、複製開始反応に必要なタンパク質は全て同定されており、それらを使って再構成複製実験も行われています。この反応において、CDC45, MCM2-7, GINSから構成されるCMG複製ヘリカーゼを組み立てることが重要な制御ポイントになっており、遺伝研の荒木弘之名誉教授が発見したSld2がGINS, Polε, Dpb11と前ローディング複合体(pre-LC)を作り、GINSをMCM2-7に呼び込むことを明らかにしています。
一方、脊椎動物においてもCMG複製ヘリカーゼ形成が重要であるにも関わらず、その形成反応の全容が明らかになっていません。本論文では、小頭症を引き起こす原因遺伝子がコードするDONSONが、GINS, Polε, TOPBP1 (Dpb11のホモログ)とpre-LCを作り、CMG複製ヘリカーゼを構成するのに寄与していることを見出しました。本研究ではAlfafold2 multimerを駆使したAIによるタンパク質結合予測を駆使し、カエル卵抽出液、ヒト培養細胞、マウス個体を用いてDONSONの機能を解析しました。
坂本(村松)佐知子技官と鐘巻将人教授がAID2法を利用して、DONSONを分解除去できるヒト細胞を作成しました。本研究は、英エジンバラ大学のAndrew Jackson教授と米ハーバード大学Johannes Walter教授との国際共同研究としておこなわれました。
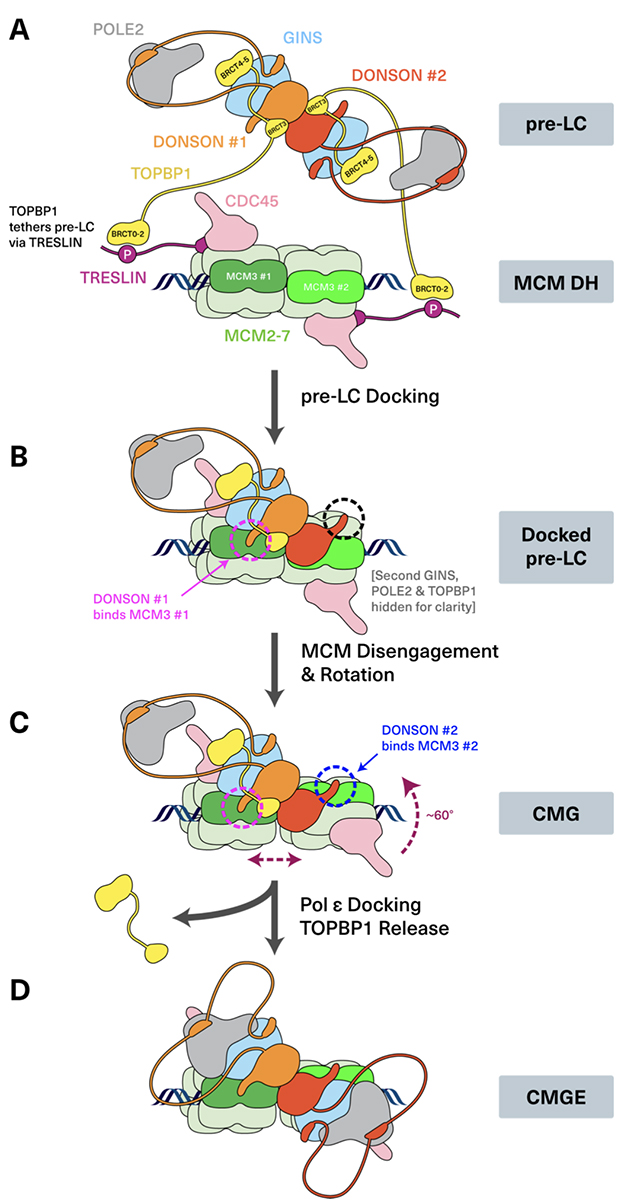
図:複製開始反応におけるCMGヘリカーゼを構成に至るまでのモデル図。
ゴルジ体の動きが神経回路発達 の原動力だった
-「ゴルジ体極性シフト」が赤ちゃんの脳で神経回路を形作るー
プレスリリース
Golgi polarity shift instructs dendritic refinement in the neonatal cortex by mediating NMDA receptor signaling
Naoki Nakagawa, Takuji Iwasato
Cell Reports 2023 Jul 28 DOI:10.1016/j.celrep.2023.112843
私たちの脳の神経回路は、胎児期にゲノム情報によって大まかに作られた後、出生後に様々な刺激を受ける中で再編されて完成します。例えば、マウスのヒゲ感覚を司る大脳皮質の神経回路では、神経細胞は新生仔期に入力を受けることにより、1本のヒゲからの刺激を伝達する軸索群の方向にのみ樹状突起を伸ばし、特徴的な非対称パターンを形成します。しかしながら、神経細胞の中でどのような仕組みが働くことで、樹状突起の非対称パターンが決められるのかはわかっていませんでした。
今回、情報・システム研究機構 国立遺伝学研究所の中川直樹助教らは、マウスの新生仔期に、神経活動によって神経細胞の中でゴルジ体の分布に水平方向の偏りが生まれ(「ゴルジ体極性シフト」)、その極性が樹状突起の非対称パターンを決めていることを発見しました。
細胞内小器官であるゴルジ体は、胎児期など個体発生の早期に細胞内で極性を形成し、その極性が細胞分化や細胞移動等において重要な役割を担うことが知られていました。一方で、生後発達期に神経回路が再編される時に、神経活動によってゴルジ体の極性が変化することや、その極性の変化が神経回路再編に関与することはわかっていませんでした。
本研究成果は、生後発達期の神経活動に依存する神経回路発達の研究に細胞極性の概念を新たに導入する画期的なものです。
この研究は学術変革領域研究(A)「脳の若返りによる生涯可塑性誘導 -iPlasticity- 臨界期機構の解明と操作」(JP21H05702、JP23H04242)および「神経回路センサスに基づく適応機能の構築と遷移バイオメカニズム」(JP22H05518)、新学術領域研究「スクラップ&ビルドによる脳機能の動的制御」(JP16H06459)、科研費(JP19K16281、JP21K15199、JP20H03346、JP21K18245)、上原記念生命科学財団助成金、武田科学振興財団助成金の支援を受けておこなわれました。
本研究成果は、国際科学雑誌「Cell Reports」に2023年7月29日(日本時間)に掲載されました。
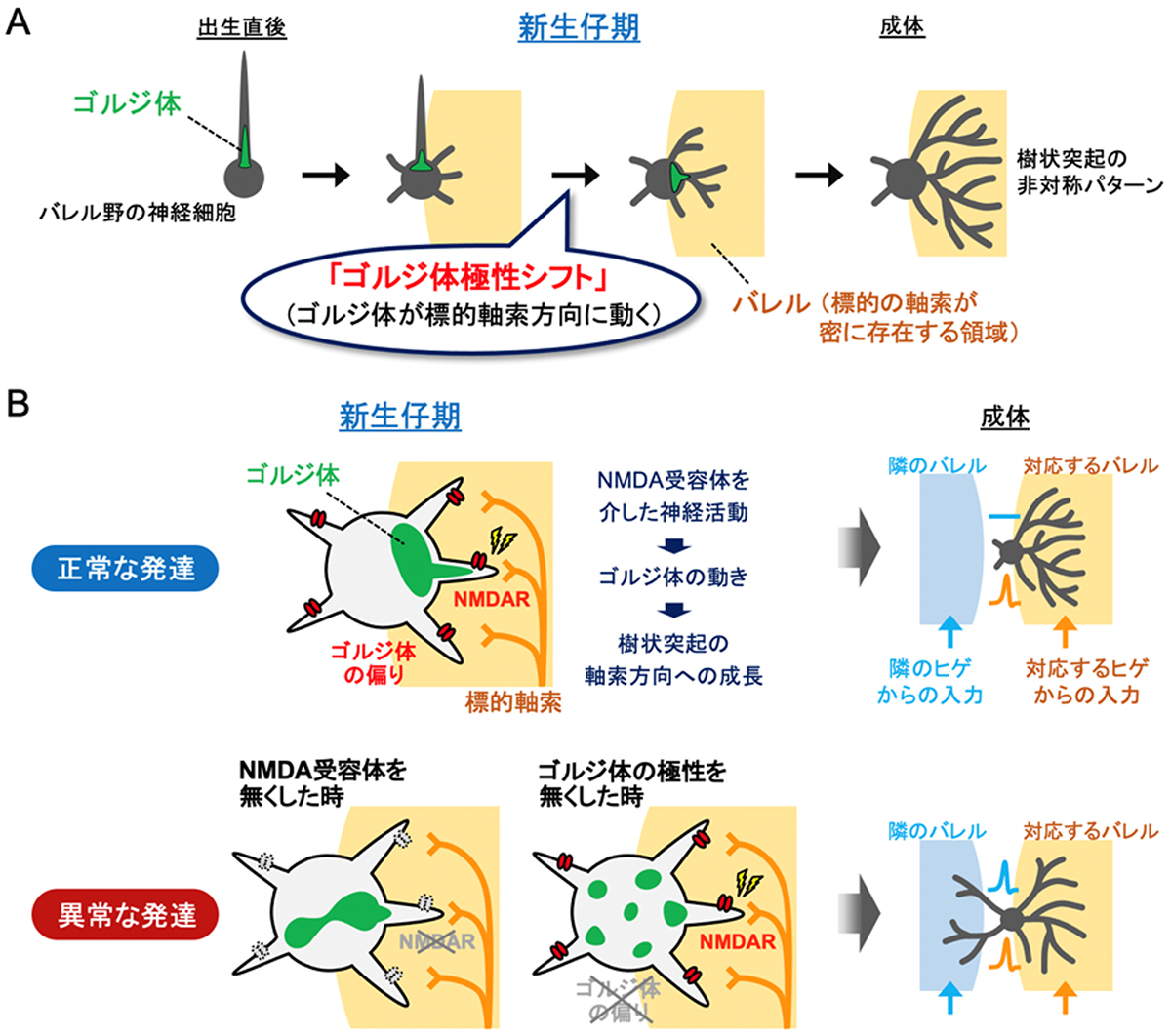
図: ゴルジ体の「極性シフト」が樹状突起の適切なパターンを形成する
(A)成体マウスでは、ヒゲ感覚を司る大脳皮質バレル野の神経細胞(灰色)は、1本のヒゲからの入力を伝える軸索の集まり(バレル)(黄色で示した領域)の方向にだけ非対称的に樹状突起を伸ばしている。この特徴的な樹状突起パターンによって、マウスは個々のヒゲからの入力を区別することができる。今回、神経細胞のゴルジ体(緑色)は出生直後には脳表面方向(図の上方向)に分布しているが、新生仔期にバレルの方向に動くことでゴルジ体分布に水平方向の極性が生まれること、および、そのゴルジ体の極性シフトが樹状突起パターンを決めていることを発見した。
(B)(上)正常な発達過程では、新生仔期に、NMDA受容体(NMDAR)が標的軸索からの入力を受けることにより、ゴルジ体が入力を受けた方向に動く。樹状突起はゴルジ体が局在している方向にのみ選択的に成長する。この仕組みによって、神経細胞は、対応する1本のヒゲのみに選択的に反応するようになる(右側、成体の図)。(下)一方、新生仔期にNMDA受容体を無くしたり、ゴルジ体の極性を壊す操作を行うと、樹状突起は標的軸索以外の方向にも間違って伸びるようになる。その結果、神経細胞は、対応するヒゲだけでなく隣のヒゲにも反応するようになり、ヒゲの区別ができなくなる。
(図はNakagawa and Iwasato, Cell Rep. (2023) July 28 より一部改変して掲載)
ネコの多発性嚢胞腎における新しい遺伝子多型を発見
プレスリリース
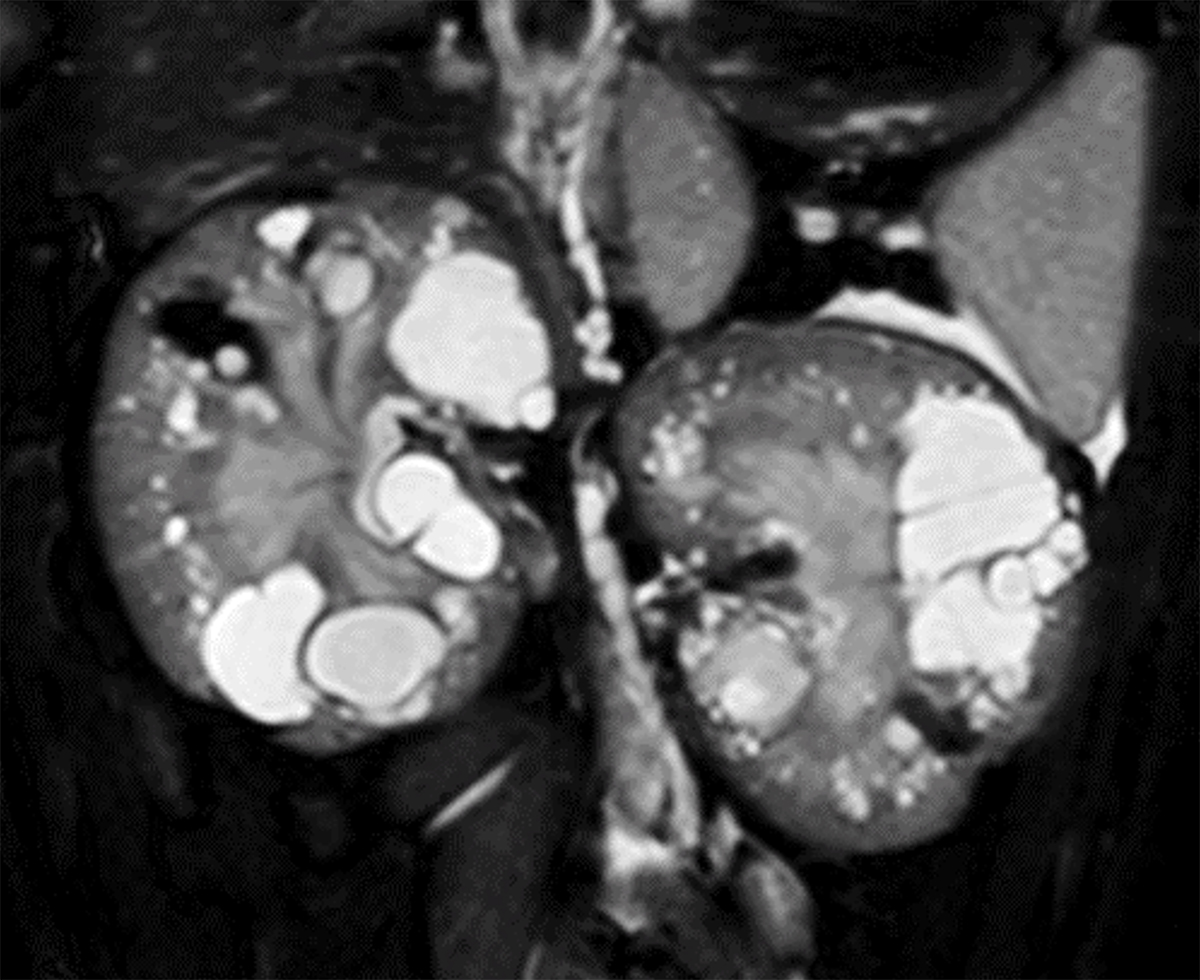
Large-scale epidemiological study on feline autosomal dominant polycystic kidney disease and identification of novel PKD1 gene variants
Fumitaka Shitamori, Ayaka Nonogaki, Tomoki Motegi, Yuki Matsumoto, Mika Sakamoto, Yasuhiro Tanizawa, Yasukazu Nakamura, Tomohiro Yonezawa, Yasuyuki Momoi, Shingo Maeda*(*責任著者)
Journal of Feline Medicine and Surgery 2023 July 25 DOI:10.1177/1098612X231185393
多発性嚢胞腎はネコで最も多い遺伝性腎疾患とされていますが、日本での発生率はよくわかっていませんでした。本研究では比較的大規模なネコの疫学調査を実施することで国内での発生率や好発品種をはじめて推定しました。
ネコの多発性嚢胞腎はPKD1遺伝子のエクソン29にナンセンス多型(chrE3:g.42858112C>A)が生じることで発症することが知られており、この一つの多型がネコの多発性嚢胞腎の多くの症例で検出されます。しかし多発性嚢胞腎を発症したネコの一部ではPKD1遺伝子エクソン29のナンセンス多型(chrE3:g.42858112C>A)が認められない症例も報告されており、その他の多型の存在が推測されていました。
本研究では、多発性嚢胞腎のネコでのみ見つかった新規の多型として、PKD1遺伝子エクソン15に4種類の多型(chrE3:g.42848361A>C、chrE3:g.42848725delC、chrE3:g.42849470G>C、chrE3:g.42850283C>T)を同定しました。今回の知見は、ネコの多発性嚢胞腎の新規遺伝子診断の開発および遺伝子検査に基づいた適切な交配による予防法の確立につながることが期待されます。
本研究は、科研費(課題番号:JP19H00968および23H00357)およびアニコムキャピタル研究助成(EVOLVE)の支援により実施されました。
本研究成果は国際科学雑誌「Journal of Feline Medicine and Surgery」に日本時間7月25日午後6時に掲載されました。

図: ネコの多発性嚢胞腎でみられるPKD1遺伝子エクソン29ナンセンス多型
多発性嚢胞腎を発症したネコの多くでPKD1遺伝子のエクソン29に”TGC”がストップコドンである”TGA”に置換するナンセンス変異(chrE3:g.42858112C>A)を認める。
ALSにおける運動障害の一因か。運動ニューロンのはたらき、過剰なTDP-43によって低下。
Dysregulated TDP-43 proteostasis perturbs excitability of spinal motor neurons during brainstem-mediated fictive locomotion in zebrafish
Kazuhide Asakawa, Hiroshi Handa, Koichi Kawakami
Development, Growth & Differentiation 2023 July 15 DOI:10.1111/dgd.12879
身体を動かすことができなくなってしまう難病、筋萎縮性側索硬化症(きんいしゅくせいそくさくこうかしょう、Amyotrophic lateral sclerosis、以下、ALSと略す)では、筋肉を収縮させる神経細胞「運動ニューロン」の機能が失われることが知られています。ALSの運動ニューロンには、TDP-43(ティーディーピー 43)とよばれるタンパク質を含んだ凝集体が蓄積する、という特徴があります。TDP-43の凝集は、90%以上のALSにおいて認められますが、多くの場合TDP-43を産生する遺伝子(TARDBP遺伝子)に、変異がありません。この為、遺伝子変異によらずに生じるTDP-43の毒性のメカニズムを理解することが、重要な研究課題となっています。
浅川和秀特命准教授らは、カルシウムイメージングという技術を用いて、擬似運動中の熱帯魚ゼブラフィッシュの正常な運動ニューロンと、TDP-43を過剰に発現している運動ニューロンの神経活動を同時に計測して比較しました。その結果、TDP-43のタンパク質量が過剰になると、運動ニューロンの活動(神経興奮性)が低下することを発見しました(図)。
本研究によって、TDP-43のタンパク質量が変動することで運動ニューロンの機能が低下し、そのことがALSにおける運動障害の一因である可能性が示唆されました。
本研究の成果は、Development, Growth & Differentiation誌に2023年7月15日に掲載されました。本研究は、情報・システム研究機構 国立遺伝学研究所(浅川和秀特命准教授、川上浩一教授)と、東京医科大学(半田宏特任教授)による共同研究グループによって実施されました。
本研究は、「生命の彩」ALS研究助成基金、加藤記念難病研究助成基金、第一三共生命科学研究振興財団、武田科学振興財団、科研費(JP16K07045、JP19K06933、JP22H02958、 JP23H04266、JP21H02463)、AMED-PRIME(JP23gm6410011h0003)、ナショナルバイオリソースプロジェクト(NBRP)の支援を受けて実施されました。
浅川和秀特命准教授は、ALSの克服に必要な重要問題を解決するための研究費のご寄附を、個人や企業の皆様方から広く募っています(ご寄付は、こちらから)。
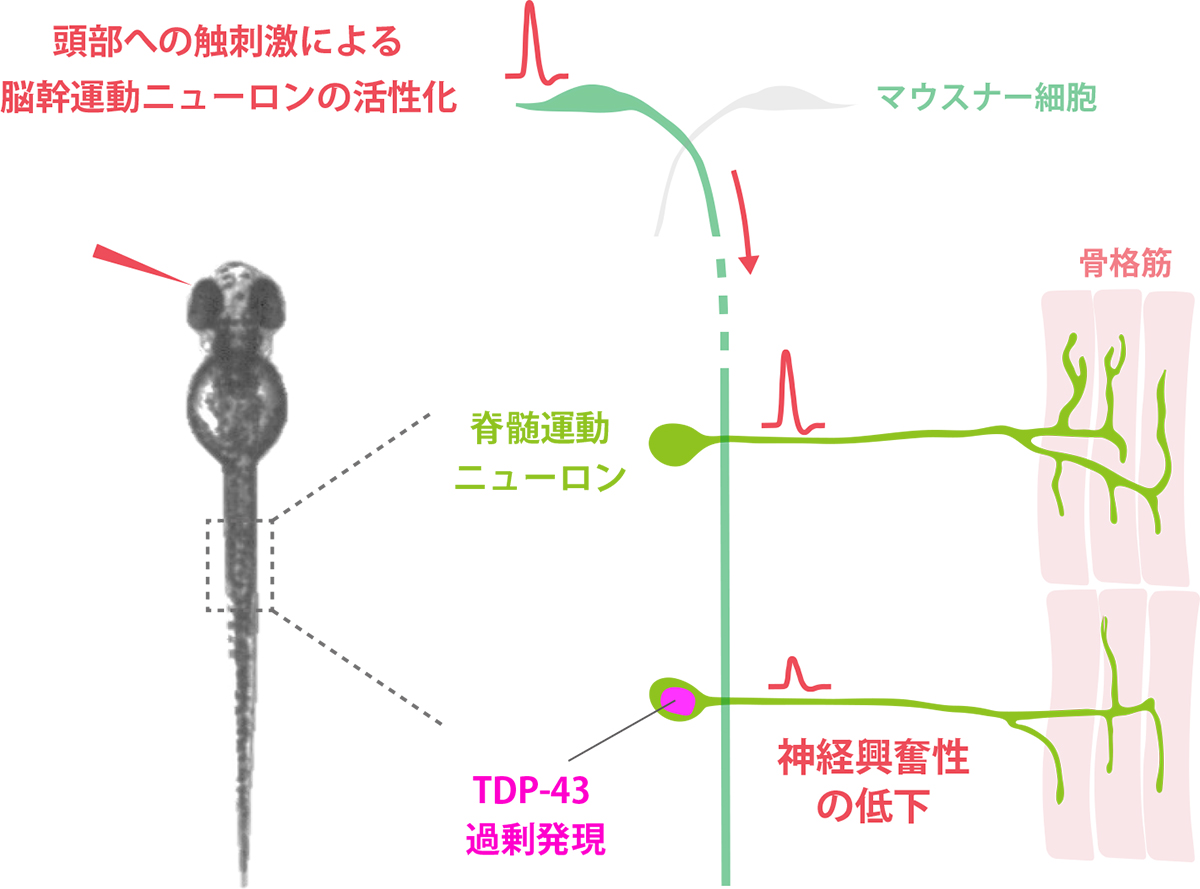
図:TDP-43の過剰発現は、運動ニューロンの神経興奮性を低下させる
夏季休業のお知らせ(8/15-16)
本研究所は、下記のとおり夏季一斉休業を実施します。
ご不便をおかけいたしますが、ご理解とご協力のほどお願いいたします。
令和5年(2023年) 8月15日(火)~16日(水)
トランスポゾンを用いた効率的な蛋白質生産
Efficient production of recombinant proteins in suspension CHO cells culture using the Tol2 transposon system coupled with cycloheximide resistance selection.
Keina Yamaguchi, Risa Ogawa, Masayoshi Tsukahara and Koichi Kawakami
Scientific reports (2023) 13, 7628 DOI:10.1038/s41598-023-34636-4
哺乳類細胞におけるDNA組み換え技術は、数十年にわたり治療用タンパク質の製造に応用されてきました。商業生産に使用するためには、確立された細胞株が高い生産性と人間への使用に適した品質で目的タンパク質を安定して発現する必要があります。従来のDNAトランスフェクション法では、優れた細胞株を選び出すために、多数の細胞プールやクローン細胞株から選択する必要があるため、スクリーニングプロセスは手間と時間がかかっていました。本研究では、Tol2トランスポゾンシステムとシクロヘキシミド耐性による細胞選択の組み合わせが、チャイニーズハムスター卵巣(CHO)細胞の浮遊培養において、ヒト抗体などの治療用タンパク質を発現するための効率的な方法であることを示しました。この方法によって得られた細胞株は、十分な培養期間を通じて、組換えタンパク質のコンスタントな生産性と細胞増殖を示しました。このアプローチが、医薬品の研究開発におけるタンパク質の生産に広く応用可能であると考えます。
本研究は、国立遺伝学研究所と協和キリン株式会社の共同研究として行われました。
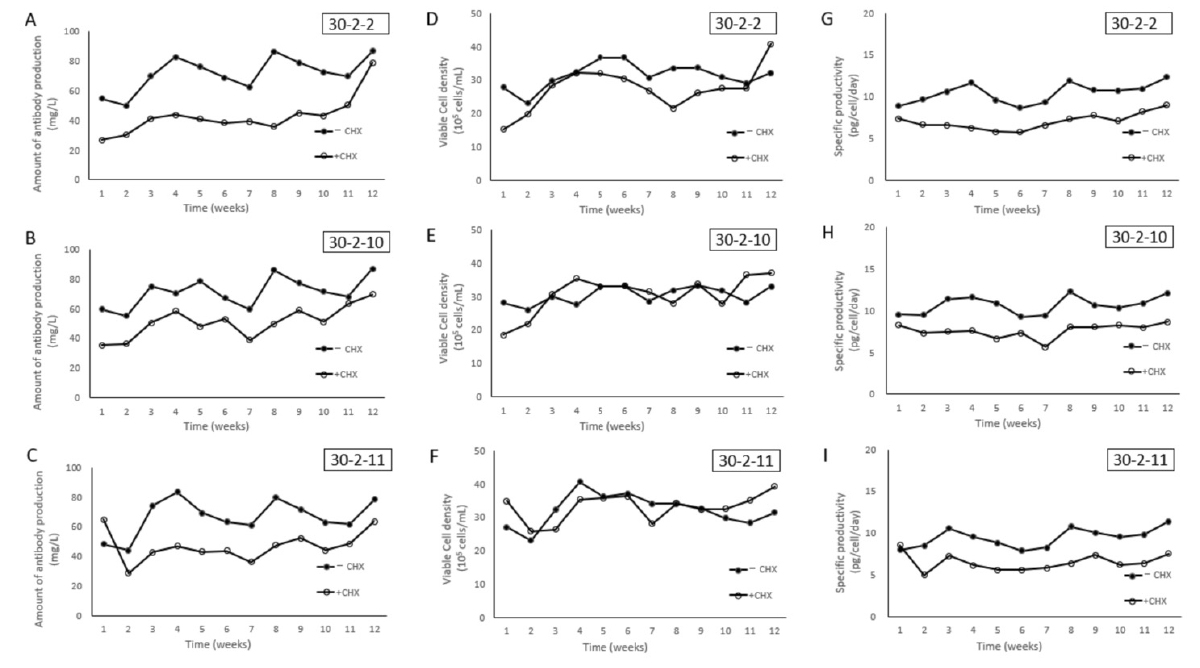
図:細胞株30-2-2、30-2-10、30-2-11のCHX選択の有無による抗体生産性と細胞増殖の変化。細胞株30-2-2、30-2-10、30-2-11をCHX選択圧の存在下(白丸)または非存在下(黒丸)で長期培養した場合の抗体生産性(A、B、C)、細胞増殖(D、E、F)、特異的抗体生産性(pg/細胞/日)(G、H、I)の変化。12週間にわかって高い抗体生産性と細胞増殖が見られた。
JST未来社会創造事業 本格研究キックオフシンポジウム 開催
「地球規模課題である低炭素社会の実現領域」 酸性水を用いた微細藻類の培養および利用形態の革新 キックオフシンポジウム開催
日時: 2023年8月23日(水曜日) 13:30-17:15
会場: オンライン開催(ZOOM)
申し込み先: Zoom ウェビナー登録
詳細は、こちらのPDF をご確認ください。ワサビの染色体レベルでのゲノム解読に成功
![]()
Haplotype-resolved, chromosomal-level assembly of wasabi (Eutrema japonicum) genome
Hiroyuki Tanaka, Tatsuki Hori, Shohei Yamamoto, Atsushi Toyoda, Kentaro Yano, Kyoko Yamane★, Takehiko Itoh★ ★責任著者 Scientific Data (2023) 10, 441 DOI:10.1038/s41597-023-02356-z東海国立大学機構 岐阜大学応用生物科学部山根京子准教授および学部四年生山本祥平氏(研究当時)、東京工業大学生命理工学院伊藤武彦教授および田中裕之研究員、学部四年生堀立樹氏(研究当時)、情報・システム研究機構国立遺伝学研究所豊田敦特任教授、東京都立大学矢野健太郎客員教授の研究グループは、世界に先駆けてワサビのハプロタイプレベルでの高精度な全染色体参照ゲノム解読に成功しました。
ワサビは日本原産の香辛野菜であり、日本食文化に欠かせない重要な食材です。近年の和食ブームの影響もあり世界的な需要も増加するなかで、抗酸化作用や癌抑制作用など、機能性食品としても注目されています。今回私たちはワサビの全ゲノムの高精度な解読に成功しました。用いた植物材料は、全国わさび品評会において常に上位入賞し、現在最も市場価値が高い品種‘真妻(まづま)’です。本研究では、次世代シーケンサー(PacBioおよびIllumina,)とHi-Cとよばれる染色体立体配座捕捉法を用いて染色体スケールのアセンブリを行いました。その結果、ワサビは7本の染色体が4組からなる異質四倍体生物であることを明らかにするとともに、7本x4組=合計28本の染色体から構成される合計1,512.1 Mbの配列データを明らかにしました。どのくらい長い配列をつなげられたかを示す指標であるN50の長さは55.67 Mbでした。さらに、リードマッピングと系統解析により、28本の染色体を二組のサブゲノム、更にはそれぞれを二組のハプロタイプの割り当てに成功しました。三種類の方法(Benchmarking Universal Single-Copy Orthologs、Merqury、Inspector)で評価した結果、得られたゲノム配列は高品質で完全性の高いものであることが示されました。今回明らかとなったゲノム配列は、遺伝や進化などの基礎研究、品種改良など農業分野、さらには在来や野生ワサビの保全のための情報整備など、多くの分野での活用が期待されます。
本研究は、日本学術振興会科研費(18K05616、16H06279 [先進ゲノム解析研究推進プラットフォーム(PAGS)])により実施されました。
本研究成果は、日本時間2023年7月11日にNature姉妹誌Scientific Dataのオンライン版で発表されました。
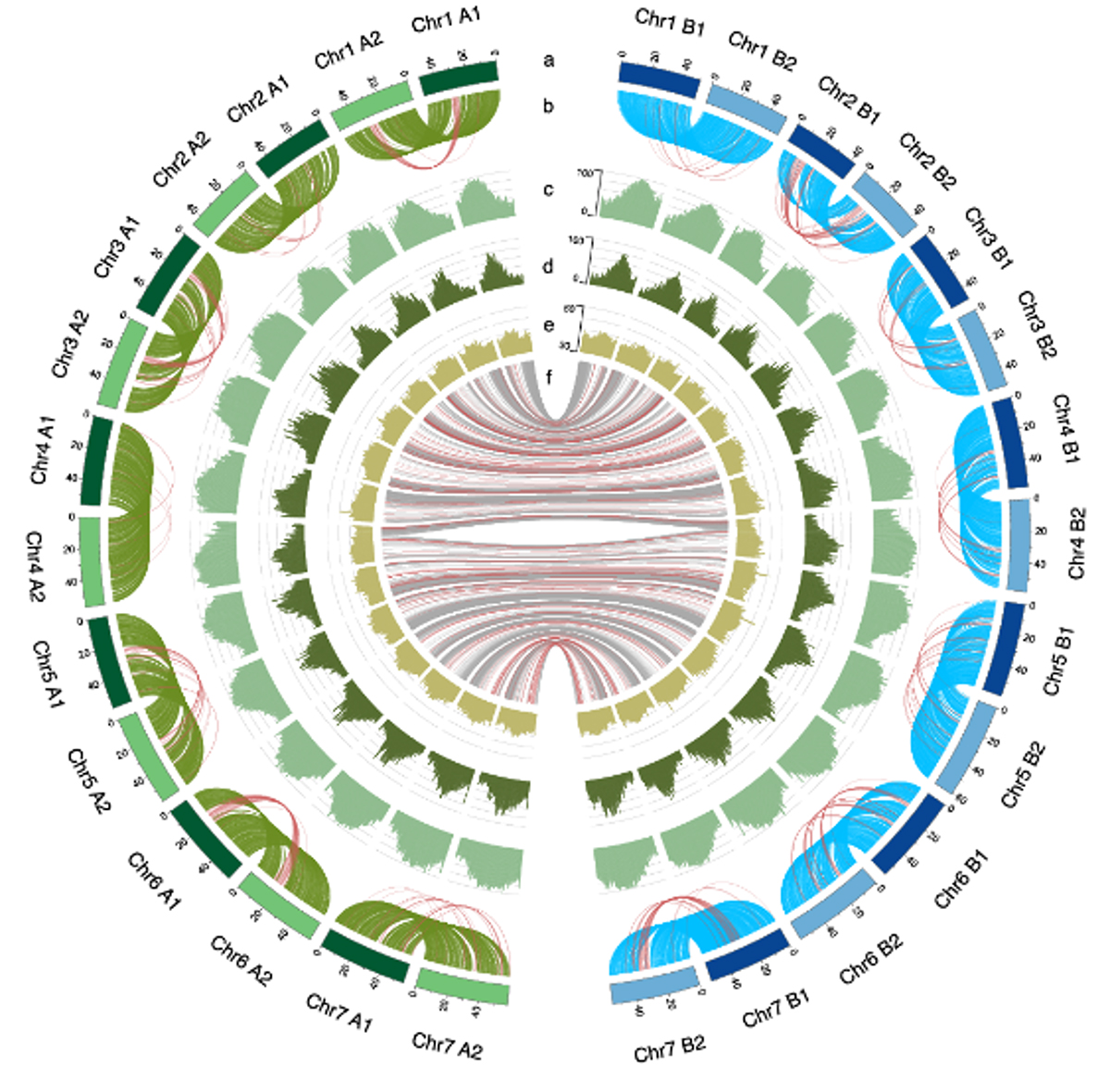
図: ワサビゲノムの特徴 サブゲノム内染色体および間の遺伝子の並びの保存性
「夏休み子ども遺伝学講座」を開催
植物はどうやって成長するの? ~イネの形ができるところを観察しよう~
日時: 令和5年7月26日(水曜日) 9:30~12:00
場所: 国立遺伝学研究所 講堂
講師: 佐藤 豊 先生(植物遺伝研究室 教授)
対象: 三島市内小学校4~6年生
定員: 40名(応募者多数の場合、抽選)
持ち物: 筆記用具、ルーペ(持っている人) 写真撮影できるスマホまたはタブレット (三島市から貸与されているタブレット端末可)
申し込み先:
三島市教育委員会 生涯学習課 申込用紙・はがき・電子申請でお申込みください。 7/12(水)までに ①氏名 ②フリガナ ③通学する小学校 ④学年 ⑤郵便番号 ⑥住所 ⑦電話番号 「夏休みこども遺伝学講座」と記入し、生涯学習センター4階生涯学習課へ。 〒411-0035 三島市大宮町1-8-38 電話:055-983-0881
電子申請:https://logoform.jp/form/pqff/2662592023年度国立遺伝学研究所「NIG-JOINT」共同研究(A)の追加募集を締切りました
ユークロマチンは本当に「ほどけて」いるのか?
Is euchromatin really open in the cell?
Kazuhiro Maeshima*#, Shiori Iida*, Masa A. Shimazoe, Sachiko Tamura, Satoru Ide
*cofirst authors; #corresponding author
Trends in Cell Biology 2023 June 27 DOI:10.1016/j.tcb.2023.05.007
ヒトのゲノムは、主に「ユークロマチン」「ヘテロクロマチン」の2つの領域に分類できるとされています。これまで長い間、頻繁に遺伝情報の読み出しが行われるユークロマチンは「ほどけて」いる一方、遺伝情報の読み出しが抑えられているヘテロクロマチンは凝縮して「塊」を形成している、と考えられてきました。
今回、情報・システム研究機構 国立遺伝学研究所 ゲノムダイナミクス研究室の前島一博 教授、飯田史織 総研大生(学振特別研究員 DC2)、島添將誠 総研大生、田村佐知子 テクニカルスタッフ、井手聖 助教は、Trends in Cell Biology誌に、この定説を覆すOpinion Paperを発表しました。この論文では、最近報告された超解像クロマチンイメージング、クロマチンのアクセシビリティをDNA消化酵素に対する感受性でゲノムワイドに調べた解析、さらには、密度勾配遠心法を用いたヌクレオソーム密度のゲノムワイドな解析をもとに、高等真核細胞ではユークロマチンも直径100-300 nm程度の凝縮した「塊 (ドメイン)」を形成していること、凝縮したドメインがクロマチンの基本構造であることを提唱しています。さらに、凝縮したドメインが存在することによって実現する転写制御のモデルや、分裂期染色体でのドメインの役割についても議論しています。
転写を司る転写複合体は、サイズが大きいため、クロマチンドメイン内部には侵入できず、転写は主にドメインの表面で行われると考えられます。転写の場所がドメイン表面に限定されることは、意図しない遺伝子の発現の抑制につながります。一方で、このドメインが固体のようにかたい構造を持つ場合、転写因子による転写活性化、すなわち読み出したい遺伝情報の検索を妨げる可能性があります。しかし、凝縮したドメインの内部は液体のような流動性をもつため、サイズの小さな転写因子はドメインの内部のDNAにも適度にアクセスでき、転写したい遺伝子をドメインの表面にもってくることで転写を活性化すると考えられます。この論文は、このようなユークロマチンの微細な構造と物理的性質が、高次の転写制御の仕組みに寄与する可能性を示しています。また、凝縮したクロマチンドメインが、細胞が分裂する際、分裂期染色体を作るためのレゴブロックのような基本単位としてはたらくことも提唱しています。
本研究は、日本学術振興会(JSPS) 科研費(JP21H02453, JP22H05606, JP21H02535)、学術変革領域 A「ゲノムモダリティ」(JP20H05936)、先進ゲノム支援(JP16H06279(PAGS))、日本学術振興会特別研究員 (JP23KJ0996(DC2))、科学技術振興機構JST 次世代研究者挑戦的研究プログラム(JPMJSP2104)の支援を受けました。
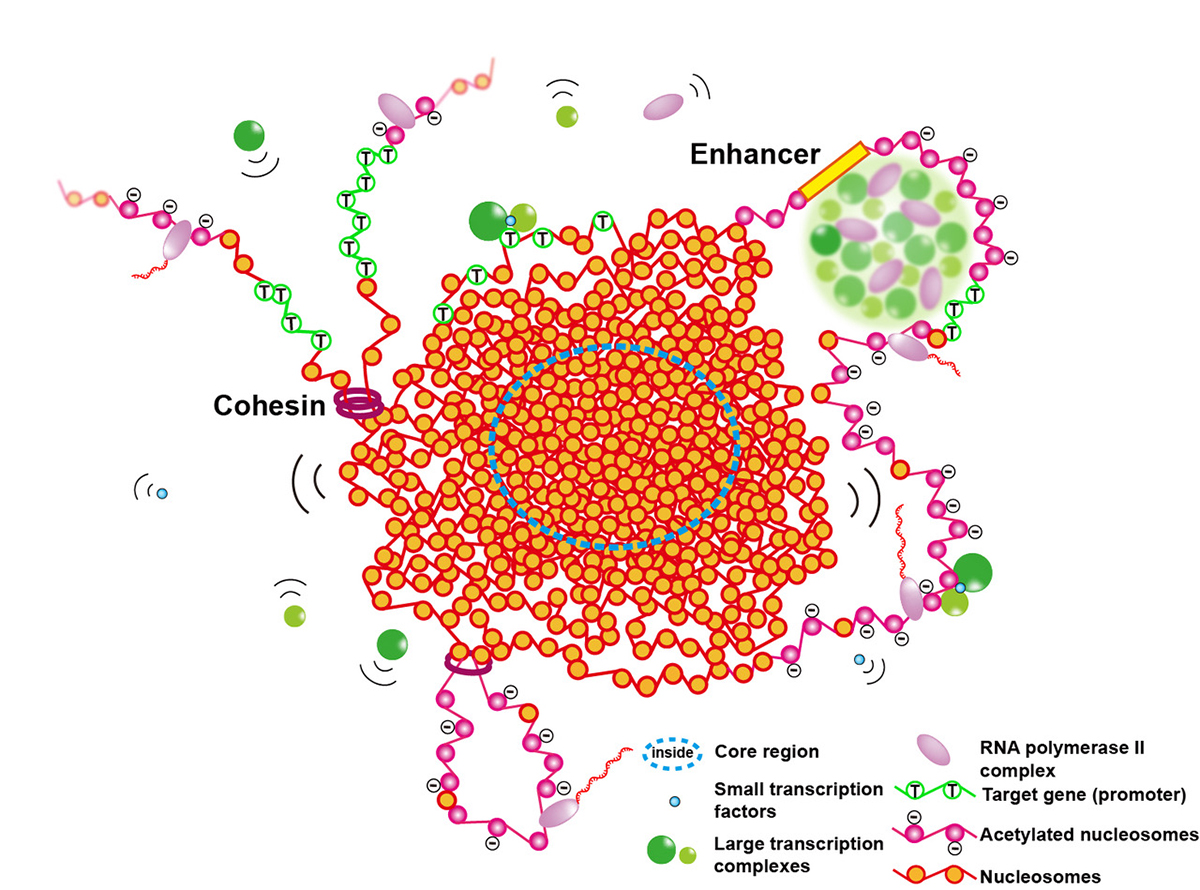
図:ユークロマチンは凝縮した「塊」(クロマチンドメイン)を形成する。RNA Pol II (紫)による転写は、ドメインの表面で行われている。ドメインの内部にはRNA Pol II (紫)は入れず、転写は起こりにくい。一方で、ドメインは液体のように流動的な性質を持つため、転写因子(緑)などの小さな分子は塊内部のDNAにもアクセスできる。目的の配列に結合した転写因子は「浮き」のようにはたらき、転写したい遺伝子をドメインの表面にもってくることで転写を活性化すると考えられる。細胞分裂期において、このドメインは、分裂期染色体を作るためのレゴブロックのような基本単位としてはたらくことも提唱している。
性染色体上の減数分裂ドライブ因子は種分化を促進するのか?
Do sex-linked male meiotic drivers contribute to intrinsic hybrid incompatibilities? Recent empirical studies from flies and rodents
Kitano, J. and Yoshida, K.
Current Opinion in Genetics and Development (2023) 81, 102068 DOI:10.1016/j.gde.2023.102068
生態遺伝学研究室の北野潤教授と吉田恒太特任助教は、Current Opinion in Genetics and Developmentのゲノムコンフリクト特集号に総説を発表しました。
雑種不稔や雑種致死などの内因性雑種不適合は、種間の生殖隔離機構のひとつとして重要です。性染色体を持つ生物では、内因性雑種不適合とくに雑種不稔は、ホールデイン則とラージX効果の2つの法則に従うことが多いと考えられています。この2つの法則を説明する仮説として、性染色体は減数分裂ドライブ因子などの利己的遺伝子の温床となりやすく、地理的に隔離された2集団で異なる減数分裂ドライブ因子が蓄積すると雑種異常を引き起こすという説が提唱されています。
この仮説はもっともらしく思われ、いくつかの経験的データもこの仮説と一致していますが、自然界での種分化、特に遺伝子流動を伴う種分化についても、このようなメカニズムで雑種異常が進化するのかについては、いまだに多くが不明です。そこで、性染色体の進化と種分化における減数分裂ドライブの役割を調べた最近二年間に発表された実証的研究をレビューしました。まだまだ野生生物でのデータ蓄積が必要であることが認識されました。
本成果は、科研費基盤S(22H04983)とJST・CREST(JPMJCR20S2)の支援を得て行われました。
オスの性染色体だけでバイセクシュアル種へ進化する
~緑藻ボルボックスの非モデル種の全ゲノム解析で解明~
![]()
Expanded male sex-determining region conserved during the evolution of homothallism in the green alga Volvox
Kayoko Yamamoto, Ryo Matsuzaki, Wuttipong Mahakham, Wirawan Heman, Hiroyuki Sekimoto, Masanobu Kawachi, Yohei Minakuchi, Atsushi Toyoda, Hisayoshi Nozaki iScience (2023) 26, 106893 DOI:10.1016/j.isci.2023.106893ボルボックス(Volvox)は緑の宝石に例えられる美しい緑藻類です。ボルボックスには卵と精子を形成するメスとオスの性(sex)があり、また、異なる遺伝子型でメスとオスが決まる「雌雄異株種」と、同じ遺伝子型の一個の培養株の中で卵と精子を形成する両性型の「バイセクシュアル種」が存在します。ボルボックスの仲間では雌雄異株種からバイセクシュアル種への進化が多く認められ、「生物多様性を生み出す性の多様性」という点で重要です。
今回、日本女子大学の山本荷葉子学術研究員(兼学振特別研究員)ら及び国立環境研究所の松﨑令高度技能専門員らは、国立遺伝学研究所、東京大学、コンケン大学、カラシーン大学の研究者との共同研究により、バイセクシュアル種への進化を探るためにタイ国産株のボルボックス・アフリカヌスの全ゲノム解析に取り組みました。
これまでボルボックスでは、雌雄が遺伝的に異なる雌雄異株種からバイセクシュアル種に進化するためには、メスの性染色体にオス特異的遺伝子が取り込まれることが必要と考えられており、性染色体は雌雄で異なっていて、各々メスまたはオスに特異的な遺伝子を保有するものと解釈されていました。しかし、タイ国産株のバイセクシュアル種では、メスの性染色体に相当する部分が全て欠落している一方で、オスの性染色体に相当する部分がほとんどそのまま残存していました。このことは、性染色体にはメスとオスを区別する以外の未解明の機能が存在することを示唆し、今後の研究が期待されます。
本研究の一部は文部科学省 科学研究費新学術領域研究 先進ゲノム支援(PAGS)(16H06279)の支援を受けて遂行されました。また、本研究の解析の一部は遺伝研スーパーコンピュータシステムを用いておこなわれました。
本研究成果は国際科学雑誌「iScience」に2023年6月16日に掲載されました。
- 詳細はこちら(国立環境研究所ウェブサイト)
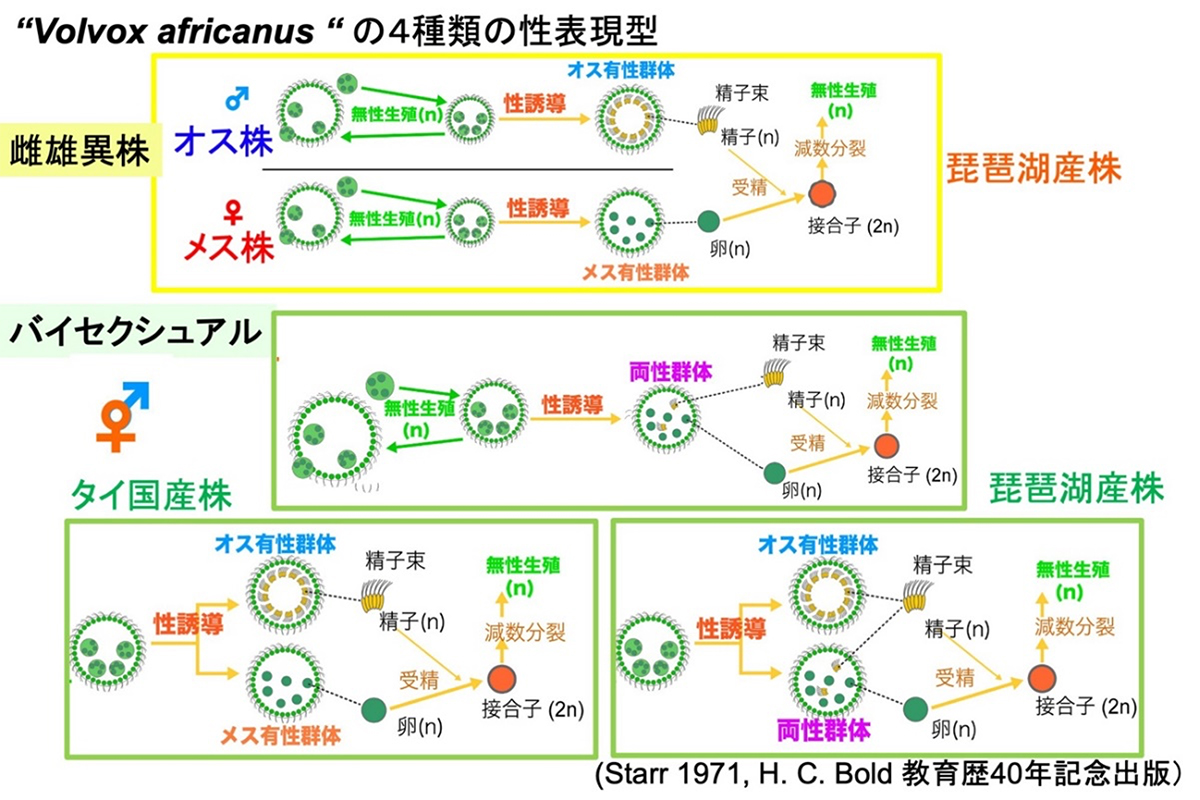
図: 緑藻ボルボックスにおける有性生殖の4タイプ。
分子細胞工学研究室 鳩山雄基さんが第27回DNA複製・組換え・修復(3R)ワークショップで学生発表賞を受賞
分子細胞工学研究室の鳩山雄基さん(総研大博士課程4年)が、2023年6月5日〜7日に九州大学医学部百年講堂で行われた、第27回DNA複製・組換え・修復(3R)ワークショップにおいて口頭発表を行い(演題:Enhanced AID2-based protein knockdown systems for the analysis of biological pathways)、学生発表賞を受賞しました。 本ワークショップは国内の3R研究者が二年毎に集まって開催している歴史ある研究会です。

二酸化炭素(CO2)を直接利用する微生物によるバイオものづくりの促進事業を開始しました
製品評価技術基盤機構(NITE)、東京大学、京都大学、茨城大学、海洋研究開発機構(JAMSTEC)、情報・システム研究機構 国立遺伝学研究所、情報・システム研究機構 データサイエンス共同利用基盤施設 ライフサイエンス統合データベースセンター(DBCLS)及びbitBiome株式会社は、共同で新エネルギー・産業技術総合開発機構(NEDO)のグリーンイノベーション基金事業「バイオものづくり技術によるCO2を直接原料としたカーボンリサイクルの推進」プロジェクトに参画し、「CO2固定微生物利活用プラットフォームの構築」事業を開始しました。
本事業では、CO2を原料とした有用物質の生産に寄与する多種多様な微生物とその関連情報(生育条件、ゲノム情報、有用遺伝子情報等)を整備するとともに、それらを利活用できるプラットフォームを構築し公開します。このプラットフォームを活用することで、産業界はCO2を直接原料とした微生物によるバイオものづくりの開発スピードを加速できます。
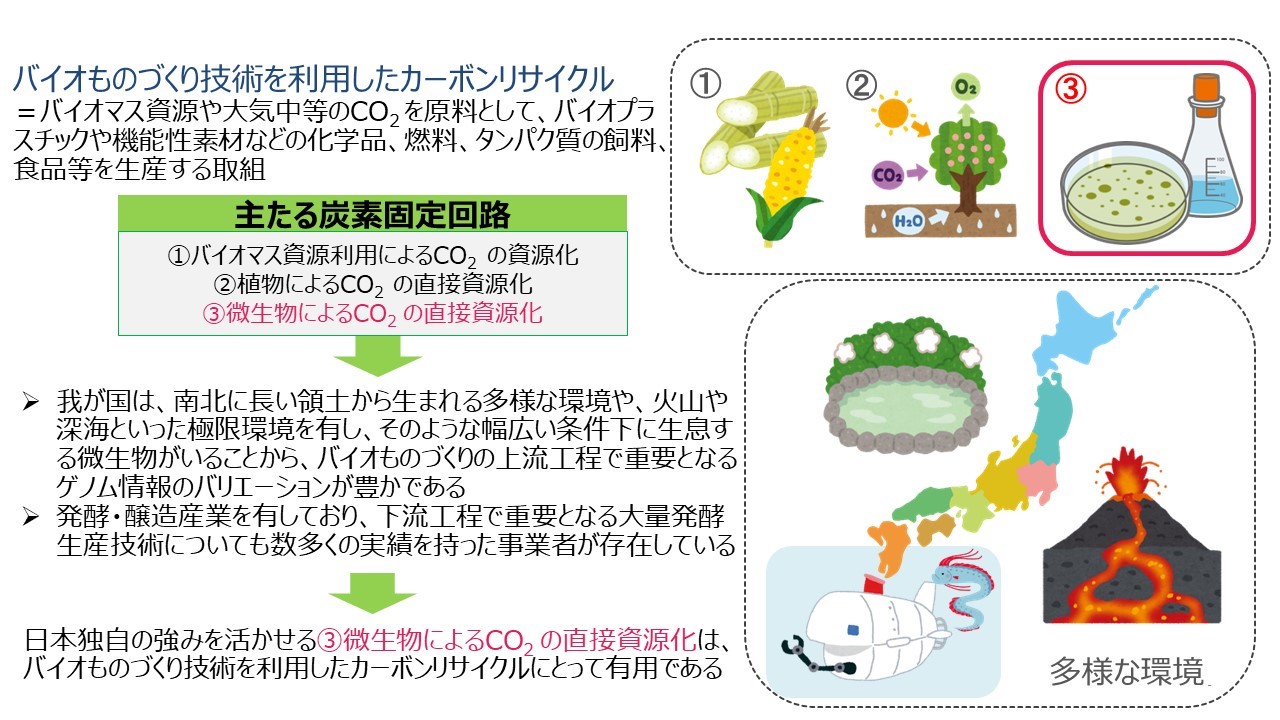
図: カーボンリサイクルにおける微生物への期待
ヒト希少疾患を引き起こすRNAポリメラーゼIの遺伝子バリアントを同定
POLR1A variant- and tissue-specific effects underlie phenotypic heterogeneity in craniofacial, neural and cardiac anomalies
Kelly Smallwood, Kristin E.N. Watt, Satoru Ide, Kristina Baltrunaite, Chad Brunswick, Katherine Inskeep, Corrine Capannari, Margaret P. Ada, Amber Begtrup, Debora R. Bertola, Laurie Demmer, Erin Demo, Orrin Devinsky, Emily R. Gallagher, Maria J. Guillen Sacoto, Robert Jech, Boris Keren, Jennifer Kussmann, Roger Ladda, Lisa A. Lansdon, Sebastian Lunke, Anne Mardy, Kirsty McWalters, Richard Person, Laura Raiti, Noriko Saitoh, Carol J. Saunders, Rhonda Schnur, Matej Skorvanek, Susan L. Sell, Anne Slavotinek, Bonnie R. Sullivan, Zornitza Stark, Joseph D. Symonds, Tara Wenger, Sacha Weber, Sandra Whalen, Susan M. White, Juliane Winkelmann, Michael Zech, Shimriet Zeidler, Kazuhiro Maeshima, Rolf W. Stottmann, Paul A Trainor, K. Nicole Weaver
The American Journal of Human Genetics (2023) 110, 809-825 DOI:10.1016/j.ajhg.2023.03.014
近年、次世代シークエンサー技術の進歩により、症例が少なく診断が難しい疾患(希少疾患)のゲノムも比較的容易に解析できるようになりました。その結果、希少疾患の原因となりうる遺伝子の変異(バリアント)が次々と同定されています。今回、シンシナティ小児病院医療センターN. Weaver博士らが率いる国際共同研究チームは、遺伝病が疑われる患者グループのゲノム解析をおこないました。この解析により、研究チームはRNAポリメラーゼIの遺伝子変異を多数発見しました。RNA ポリメラーゼIはタンパク質翻訳装置であるリボソームの構成RNA(rRNA)を合成することが知られています。これらの遺伝子変異をもつRNAポリメラーゼIは、RNA合成活性が低下または過度に上昇しました。またRNAポリメラーゼIの細胞内局在にも異常がみられました。これらの異常により、顔面の骨の形成不全や心臓疾患、てんかん等の神経合併症など、さまざまな症状が引き起こされることが明らかになりました(図A)。今後、これらの疾患の確定診断や疾患モデルマウスを利用した対処療法や治療法の開発が期待されます。
遺伝研の貢献
ゲノムダイナミクス研究室 井手聖助教と前島一博教授は、N. Weaver博士らと共同で、今回の患者で見つかった9種類の変異を持つRNAポリメラーゼIのrRNAの合成活性とその細胞内局在を調べました。機械学習を用いた画像分類法を利用した結果、変異型RNAポリメラーゼIはrRNAの合成活性に応じて、RNAポリメラーゼIが集まる核小体内で異なる局在パターンを示すことがわかりました(図B)。このことは、機械学習を用いた核小体の形態解析によって、rRNAの合成活性が予測できる可能性を示しています。
遺伝研の貢献部分は文部科学省科学研究費補助金・新学術領域研究「非ドメイン生物学」(22H05606)、科学研究費補助金(21H02535, 19H05273 ,20H05936)などの支援を受けて行われました。機械学習の利用に関して、がん研究会がん研究所 斉藤典子部長の協力を得ました。
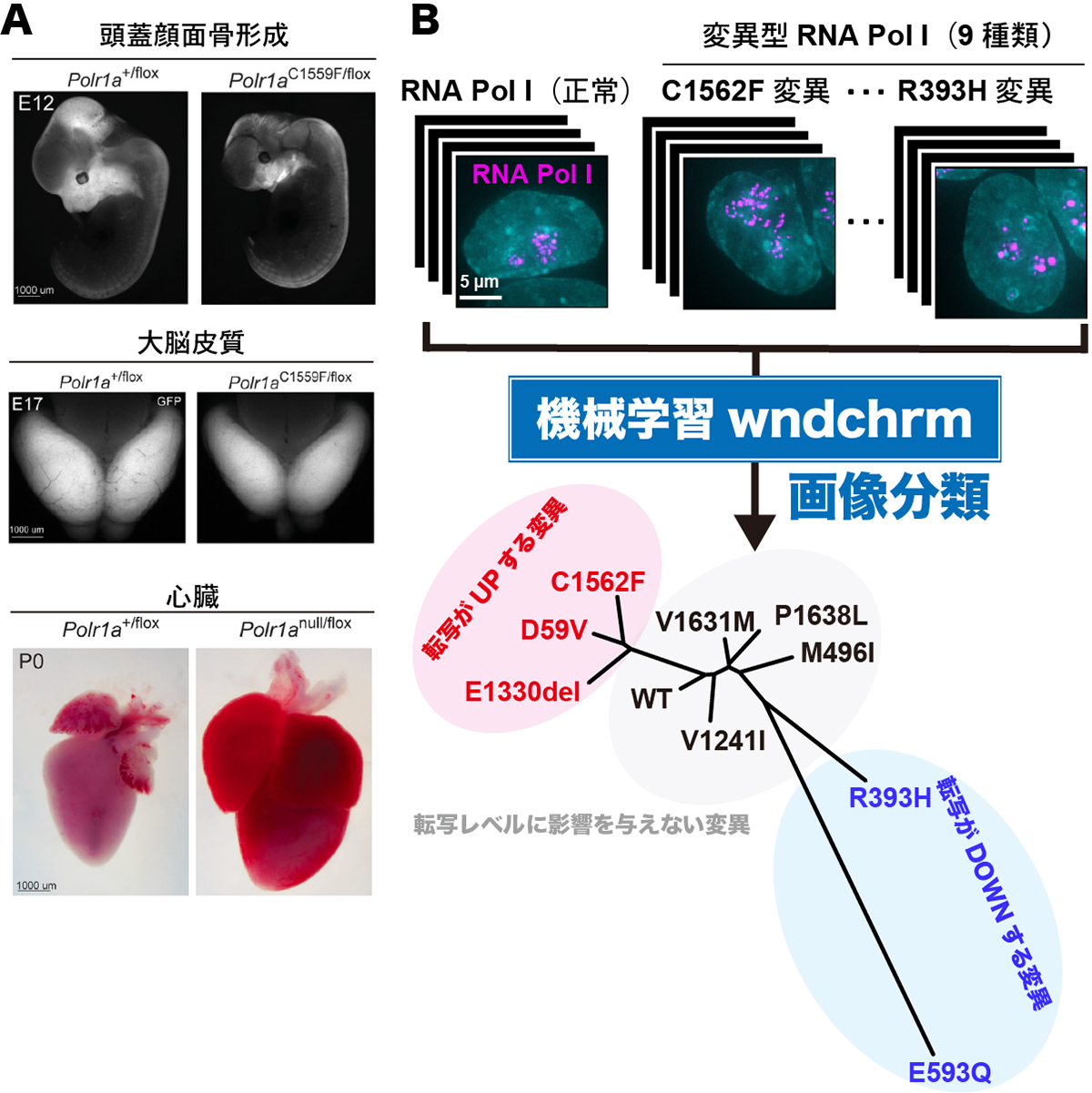
図:(A)疾患モデルマウスの表現型(左:正常、右:疾患モデル)。ヒト希少疾患の原因変異をもつRNAポリメラーゼIの遺伝子(POLR1A)を組織特異的にマウス内で発現させている。その結果、頭蓋顔面骨形成の不全(上段)、大脳皮質の萎縮(中段)、心臓の肥大化(下段)が観察された。(B)ヒト培養細胞で発現した9つの変異型RNAポリメラーゼI(RNA Pol I)と正常型(WT)の画像(細胞核:シアン、RNA Pol I:ピンク)。それらの特徴を、機械学習の一つである画像パターン認識アルゴリズムwndchrmにより抽出し分類した(類似関係を示す系統樹)。この局在パターンによる分類が、RNA Pol IのrRNAの合成活性による分類(転写が上昇する変異:赤、転写が低下する変異:青、転写が変化しない変異:黒色)と一致した。















 画像をクリックするとPDFが開きます
画像をクリックするとPDFが開きます

