Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
2023年度冬(2024年1月)に実施する入学者選抜試験に関する重要なお知らせ
植物の「水の通り道」の形を制御するタンパク質を発見
~細胞壁形成のしくみ解明へ大きな前進~
プレスリリース
Confined-microtubule assembly shapes three-dimensional cell wall structures in xylem
Takema Sasaki, Kei Saito, Daisuke Inoue, Henrik Serk, Yuki Sugiyama, Edouard Pesquet, Yuta Shimamoto, Yoshihisa Oda
Nature Communications (2023) 14, 6987 DOI:10.1038/s41467-023-42487-w
国立大学法人 東海国立大学機構 名古屋大学大学院理学研究科の佐々木 武馬 助教、杉山 友希 特任助教、小田 祥久 教授の研究グループは、大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所 遺伝メカニズム研究系の斎藤 慧 助教、島本 勇太 准教授、国立大学法人 九州大学 大学院芸術工学研究院の井上 大介 助教、ストックホルム大学(スウェーデン王国)のヘンリック サーク 博士、エドワール ペスケ 教授との共同研究により陸上植物の水の通り道を形づくるタンパク質を発見しました。本研究グループは、道管における細胞壁の微小な孔(壁孔)に存在するMAP70-5タンパク質に着目し、このタンパク質が微小管と呼ばれる細胞内の繊維を曲がりやすくすることにより、道管における壁孔の立体構造を決定していることを明らかにしました。
植物の細胞を覆う細胞壁は、細胞の形の維持に加え、水分・養分などの輸送も担います。壁孔を含め、植物の細胞壁の立体構造を決定する仕組みはほとんど明らかになっていません。本研究は植物の細胞壁の立体構造が、微小管の物理的な性質を制御することにより決定されることを世界ではじめて明らかにしました。これは植物の細胞壁の形成機構を理解する上で数少ない重要な知見です。また、本研究から得られた知見を利用して植物の細胞壁構造を改変することにより、将来的な植物細胞の形態や機能、さらには植物個体の性質や形態を人為的に制御する技術、利用しやすい木質バイオマスの生産技術にも繋がる可能性が考えられます。
本研究は、文部科学省の科学研究費補助金『19H05670』、『19H05677』、日本学術振興会の科学研究費補助金『21H02514』、『20K21435』、『23K18126』、『JP20K15141』、『JP21H05886』、『21K15128』、『22H02590』、公益財団法人三菱財団自然科学研究助成の支援のもとで行われたものです。
本研究成果は2023年11月13日午後7時(日本時間)付イギリス科学誌「Nature Communications」誌でオンライン公開されました。
遺伝研の貢献
物理細胞生物学研究室が持つ高解像の蛍光イメージング技術を使って微小管の曲げ剛性や束化能を細胞外で解析できる系を構築し、MAP70の分子特性を決定しました。
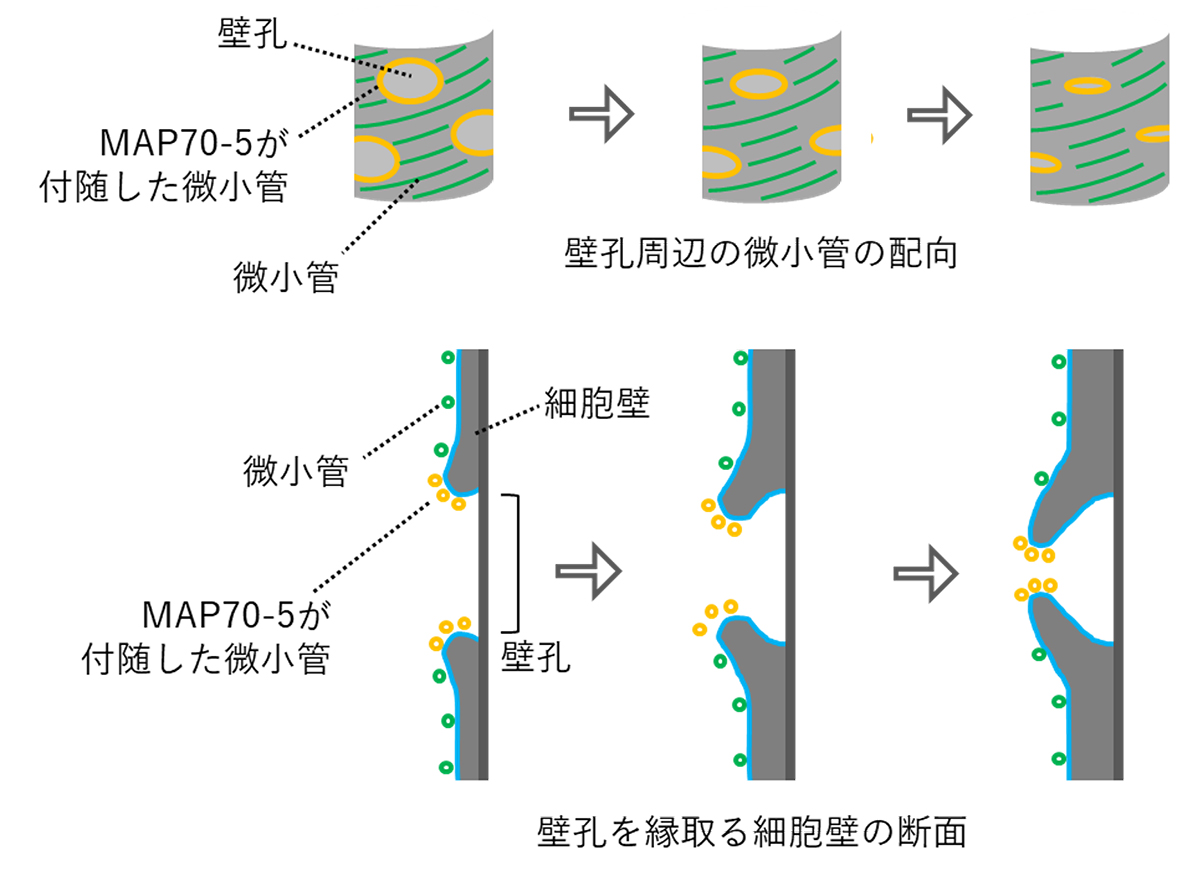
図1: 壁孔周辺の微小管とMAP70-5の局在
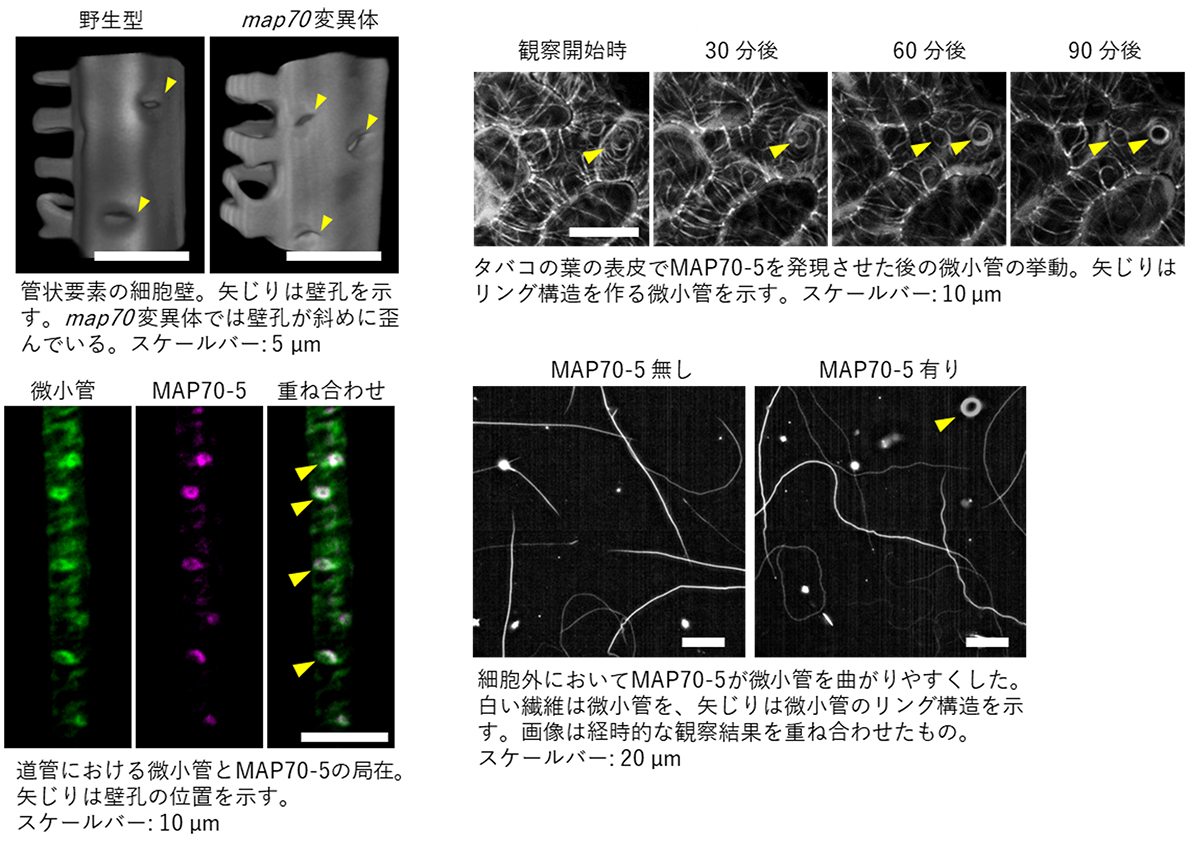
図2: MAP70-5の壁孔形成の制御と微小管に対する効果
細胞内で光合成を飼いならす
―何度やっても同じ危機対応―
Taming the perils of photosynthesis by eukaryotes: constraints on endosymbiotic evolution in aquatic ecosystems
Shin-ya Miyagishima
Communications Biology (2023) 6, 1150 DOI:10.1038/s42003-023-05544-0
真核生物による葉緑体つまり光合成能の獲得は、真核細胞内へのシアノバクテリア(光合成バクテリア)の一次共生(紅藻、緑藻、植物の共通祖先)の他、それによって生じた真核藻類の二次またはさらに高次の共生により(珪藻、渦鞭毛藻、ミドリムシなどのそれぞれの祖先)様々な系統で独立に何度も起きたことが知られています。また、細胞内に取り込んだ単細胞藻類の葉緑体を消化せずに数週間から数ヶ月間細胞内に保持し利用する生物(盗葉緑体性生物)、藻類を長期にわたって任意共生させる単細胞生物が多くの系統で発見されています。これらは環境によっては光合成性バイオマスの大部分を占めることもあり、二次または高次の共生による葉緑体伝搬の中間段階と見なされています。
光合成は有害な活性酸素種(ROS)を生じ、その量は強光下で増加し、場合によっては細胞死に至ります。また光合成装置の反応中心は光強度依存的に障害を受けるため、絶えず障害を受けた部品の交換が行われています。強光下では、ROSがこの修復を遅らせ、光合成活性が低下するだけでなく、修復が遅れるとさらに高濃度のROSが発生し、負の連鎖が起こります。これらの問題に対処するために、藻類や植物は様々な危機対応策を進化させています。これには、(1)細胞が移動し、細胞内に光吸収物質を産生し、または葉緑体の位置や向きを変えて、葉緑体に当たる光を減少させる、(2)高濃度のROSを発生する重度に損傷を受けた葉緑体を消化して取り除く、(3)核ゲノムと葉緑体ゲノムが協調し、光合成装置の構成を光強度に対して最適化する(4)ROSと光を感知して、これらの機構を調節するなどが含まれます。これらの機構は、一次共生由来の葉緑体を有する生物だけでなく、それぞれ独立に生じた二次共生由来葉緑体を有する生物においても独自に進化しています。
これまでに研究室で進めてきた研究内容と他の研究グループによる様々な系統の生物の研究結果をまとめ、比較しました。その結果、多種多様な系統でそれぞれ独立に何度も生じた盗葉緑体や光共生を行う生物も、(1)、(2)、(4)の機構を進化させており、一部の生物は(3)の機構も発達させていることが明らかになりました。さらに、藻食性の単細胞生物も(2)と(4)に対応する機構を独立に進化させていることが示されました。
この結果から、細胞内で光合成を行う真核生物は何度も独立に発生しましたが、光合成の毒性に対処するために、どの系統の生物もほぼ同じ機構を進化させたことが明らかになりました。さらに、光合成生物を細胞内に共生させ、葉緑体として利用するための機構は、藻類を捕食する段階から一時的な藻類細胞または葉緑体の保持の段階を経て漸進的に進化したことも示唆されます。
本研究は、日本学術振興会 科研費(20H00477)、科学技術振興機構 未来社会創造事業(22682397)の支援を受けました。
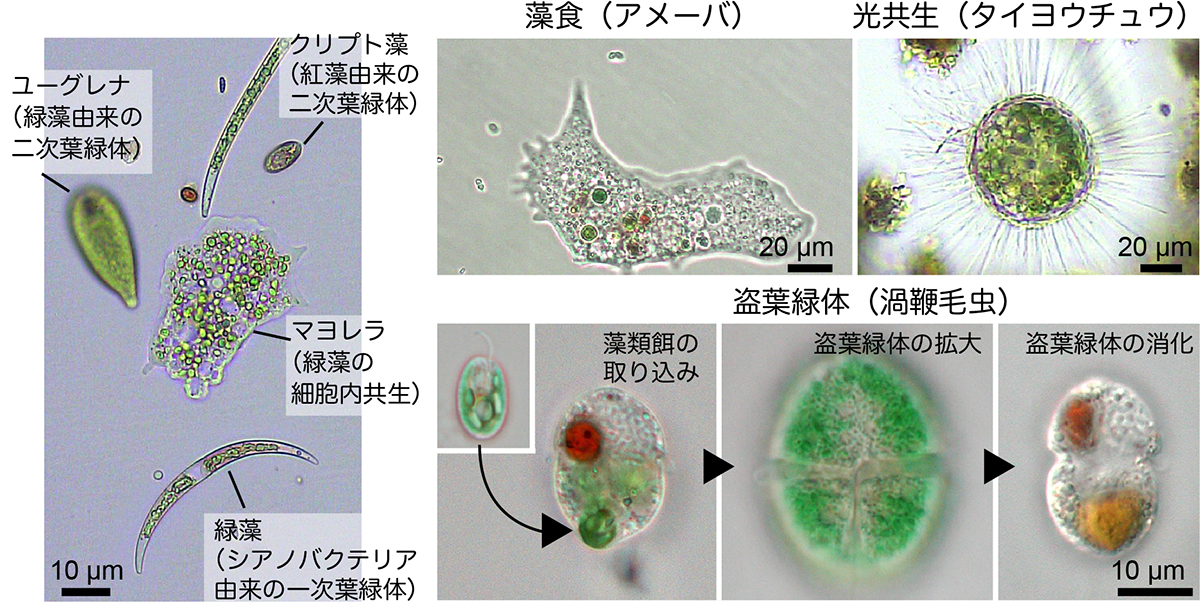
図:シアノバクテリア共生体起源の1次葉緑体、真核藻類の共生体起源の二次葉緑体を持つ単細胞生物と藻食、光共生性、盗葉緑体性の単細胞生物の例。
写真提供、大沼さん(神戸大)、岡田さん(遺伝研)。
種々のヘテロ接合度を考慮した実践的ゲノムアセンブル法の提案
A Practical Assembly Guideline for Genomes with Various Levels of Heterozygosity
Takako Mochizuki, Mika Sakamoto, Yasuhiro Tanizawa, Takuro Nakayama, Goro Tanifuji, Ryoma Kamikawa, Yasukazu Nakamura*
*Corresponding Author
Briefings in Bioinformatics (2023) 24, bbad337 DOI:10.1093/bib/bbad337
パシフィック・バイオサイエンシズ・オブ・カリフォルニア社のサブリードに代表されるロングリードシーケンシング技術の発展は、ゲノム配列の再構築に大きく貢献してきました。しかしながら、この技術は、ゲノム配列の再構築に役立つ長いリードを生成する一方で、高いシーケンスエラーを抱えています。このシーケンスエラーを克服し、長くて精度の高いコンティグセットの構築を目指す様々なde novo アセンブラが開発されてきました。
二倍体ゲノムのde novo アセンブリでは、ヘテロ接合度が増すにつれてより複雑になります。そのため、ヘテロ接合度はde novo アセンブリの完成度に影響を与える大きな要因の一つでありますが、ヘテロ接合度の異なる二倍対ゲノムに対するde novo アセンブラの体系的な評価は今まで行われていませんでした。
そこで、本研究では、ヘテロ接合度の異なるゲノムを用いて、ゲノムサイズやヘテロ接合度などのゲノム特性の推定、de novo アセンブリ、ポリッシング、アリルを含むコンティグの除去などの一連のプロセスを評価し、ヘテロ接合度の程度に応じたハプロタイプの代表セットを構築するための具体的なガイドラインを発表しました。
この研究は、JSPS科研費新学術領域研究 16H06279 (PAGS・先進ゲノム支援)、15H05606 、19H03274、20H03305、 17H03723 の助成を受けました。
本研究の一部は遺伝研スーパーコンピュータシステムを用いて遂行されました。
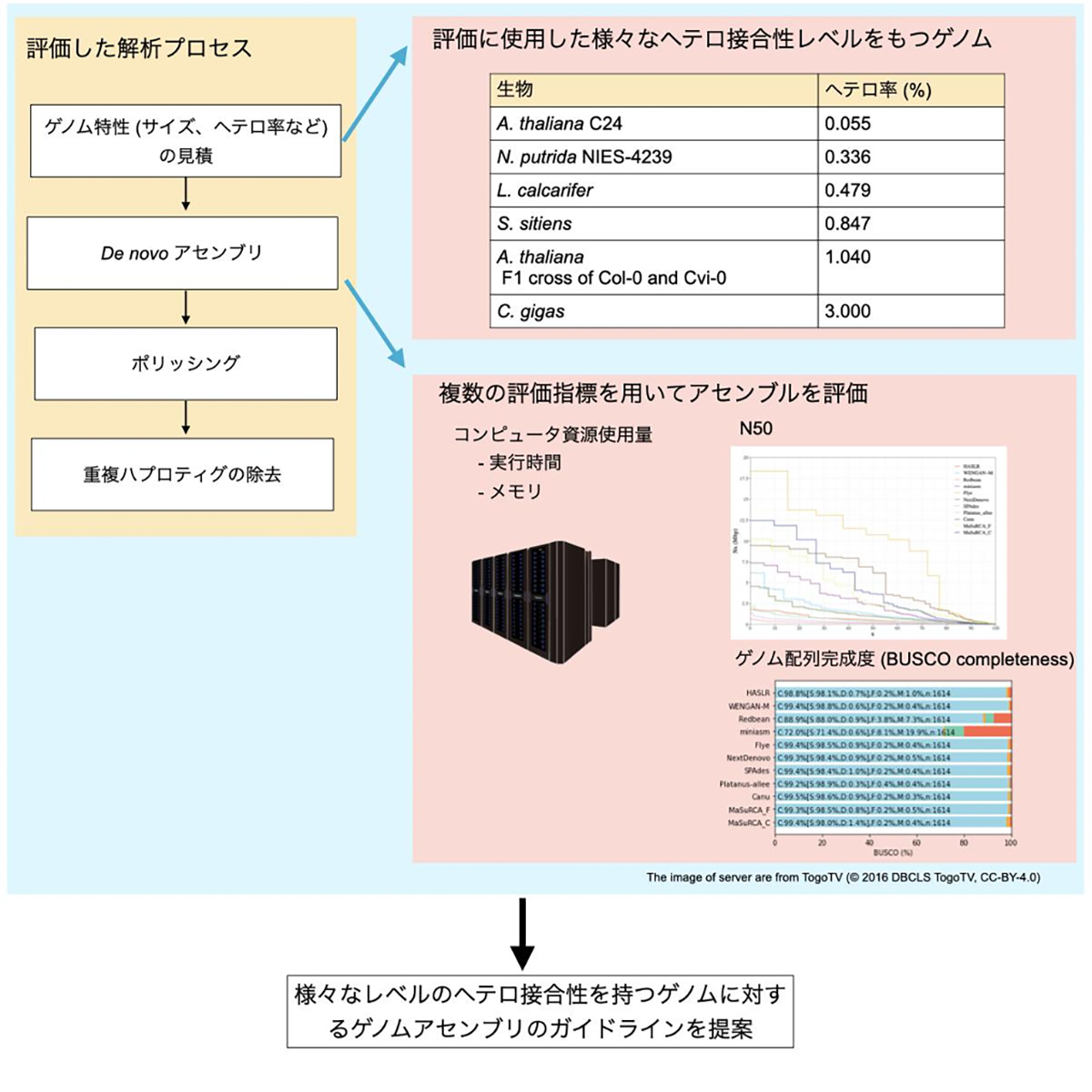
図:様々なヘテロ接合度のゲノムを用いたゲノムアセンブルの評価プロセス
琉球列島から日本初記録のテナガエビ類を報告
First record of Macrobrachium mammillodactylus (Thallwitz, 1891) (Crustacea, Decapoda, Palaemonidae) from Japan.
Yusuke Fuke, Tomoaki Maruyama.
Check List (2023) 19, 821-826 DOI:10.15560/19.6.821
淡水性の甲殻類であるテナガエビ属は熱帯を中心に繁栄しているグループで、これまでに270種以上が知られています。太平洋周辺の広域に分布する種の多くは両側回遊型の生活史を持ちます。すなわち、孵化後すぐに川を降り、海流に乗って分布を広げることができます。こうした分散力の高い種は、気候変動による生息環境の変化に対して、分布域のシフトという形で迅速に対応できると考えられています。そのため、詳細な分布域の情報を蓄積することは、両側回遊性の種が環境変化にどのように応答するのかを調べる上で重要です。
今回、国立遺伝学研究所の福家悠介 学振特別研究員PDとトレンドデザイン株式会社の丸山智朗氏は琉球列島・宮古島の河川から採集されたテナガエビ属の1種を遺伝解析と形態形質の検討に基づいてイボユビテナガエビ(新称)Macrobrachium mammillodactylus (Thallwitz, 1891)と同定しました。これは本種の日本の初記録であると同時に本種の分布の北限記録です。本種はこれまで、東南アジアを中心に、オーストラリアから台湾中部に分布していることが知られていました。今回得られた標本は成体であり、発見地で越冬したものと考えられます。これは、本種の分布域が琉球列島まで拡大したことを示唆します。
東南アジアから琉球列島や本州への分布拡大は、他の南方系の淡水エビ類でも知られています。分布域に関する基礎的なデータを蓄積することで、将来的に両側回遊性の生物の分布拡大の要因を特定や予測が可能になるかもしれません。

図:今回、日本での分布が初めて確認されたイボユビテナガエビ(新称)。和名は成体オスの第二胸脚のハサミの間に見られる顆粒にちなむ。丸山撮影。
「寺deサイエンス」を開催:12月1日(金) 19:00-
日 時: 2023年12月1日(金) 19:00~21:00
収録場所: 君澤山 蓮馨寺(三島市広小路町1-39)
内 容:
第1部:「ゲノムからみた日本人の起源」
講演:斎藤成也(国立遺伝学研究所 特任教授)
第2部:「古代人のゲノム解析から見た人類史」
講演:神澤秀明(国立科学博物館 人類研究部 研究主幹)
対 象: サイエンスに関心のある一般の方
定 員: 500人(Zoomでのライブ配信参加)、40人(現地での参加)
11/30(木) 正午 申込〆切(先着順)
参 加 費 : 無料(Zoomでのライブ配信参加)、1000円(現地での参加))
お申込先 : 専用フォーム
特 設 HP: 遺伝学普及会ページ
【問い合わせ】
〒411-8540 三島市谷田1111
公益財団法人遺伝学普及会
TEL:055-981-6857、 FAX:055-981-6877
Email:
サメから学ぶ脊椎動物の染色体進化
~板鰓類のゲノムシークエンスが明らかにした脊椎動物の核型構成における進化上の傾向~

Elasmobranch genome sequencing reveals evolutionary trends of vertebrate karyotypic organization
Kazuaki Yamaguchi, Yoshinobu Uno, Mitsutaka Kadota, Osamu Nishimura, Ryo Nozu, Kiyomi Murakumo, Rui Matsumoto, Keiichi Sato and Shigehiro Kuraku
Genome Research (2023) 33, 1527-1540. DOI:10.1101/gr.276840.122
それぞれの生物種の設計図ともいえる「ゲノム」から、遺伝子の単なる顔ぶれの情報以外に染色体の本数や長さなども知ることができる。そういったゲノムの構造にも動物の系統ごとに特徴があり、その特徴は、多くの種のゲノム情報を比べることで浮き彫りになる。今回、国立遺伝学研究所、沖縄美ら海水族館、理化学研究所を中心とする共同研究チームは、脊椎動物の中でもとくに染色体の情報が乏しい軟骨魚類に注目し、その一種であるトラフザメ(図1)の全ゲノム配列を取得した。トラフザメは絶滅危惧種とされているが、水族館で長年飼育している個体から採取した血液を活用することでこの研究が実現した。同時に、飼育歴世界一を継続中(2023年時点で28年)の沖縄美ら海水族館のジンベエザメ個体(オス、ジンタ)の全ゲノム情報も取得した。ジンベエザメ(図1)については、世界で複数のチームがゲノム情報を競って発表してきたが、染色体規模のDNA配列が得られるのは今回が初めてである。

図1:トラフザメとジンベエザメの系統関係と近縁性
まず、サメ類がもつ染色体の数が多めであることは以前から知られており、今回の解析の対象である2種も2n=102とまさにその典型であるが、今回の解析により、それらの染色体は、長さが短いほど塩基組成の偏り(GC含量)と遺伝子密度が高い、そしてDNA配列が変わりやすい、という特徴を持つことが示された。鳥類・爬虫類でも以前に示されたこのゲノム構築パターンは、非常に短い染色体(マイクロ染色体)を有する生物に共通の特徴であると考えられており、それ以外の生物での検討は不十分であった。本研究では、多様な長さの染色体をもつ軟骨魚類や、マイクロ染色体をもたないとされる両生類を比較に加えることにより、そのゲノム構築パターンが脊椎動物のより多様な系統で共通にみられることが示された。どういったゲノムにも不均一性を生む素地があり、それが配列の特徴だけではなく進化的な来歴や機能遺伝子の分布などとも関連している可能性があるようだ。
ジンベエザメはサメ類の中でもとくに注目度が高い。属するテンジクザメ目の他の種とも体の大きさや生態が大きく異なっていて、明確に近縁と思えるような種がおらず唯一の存在と感じられることもその魅力のひとつではないだろうか。その中でもとくに近縁な現生種のひとつがトラフザメである。ジンベエザメがトラフザメの系統から分岐したのは、約5千万年も前のことであると推定されている(図1)。今回、飼育個体を活用し、雌雄のDNA情報を取得し比較することにより、この2種の系統が分岐した時代から両者に共通に保持されてきたと考えられるX染色体を同定し、そのDNA配列を報告した(図2A、B)。性染色体のDNA配列が示されたのは軟骨魚類では初めての例であり、これまでに同定された他の脊椎動物の性染色体とは遺伝子構成が異なることから(図2C)、サメ類は、性染色体を独自に獲得したことが推測される。 研究チームでは、さらにY染色体の探索を行うとともに、他の多様なサメ・エイ類の解析も進めている。
本研究では、以前サメ・エイ類では消失していると考えられていたHoxC遺伝子群が、大量の反復配列の挿入によって隔てられながらも、想定される順序で染色体上に連続して配置されていることも示された。HoxC遺伝子は、他のHox遺伝子群と異なり、サメやエイのゲノムには存在しないと予測されていたのに反して、いくつかのサメ類に存在することを同チームが2018年に示した(Hara et al., Nat Ecol Evol 2018)。実は、それ以来他のどの研究チームからもいまだにサメ類やエイ類のHoxC遺伝子配列は報告されていない。その背景には、HoxC遺伝子の分子進化速度が大きく、配列の保存性が低いため、探索が困難であるためという理由が考えられる。興味深いことに、このHoxC遺伝子群はトラフザメのゲノム内ではX染色体上に位置しており、性染色体上にHox遺伝子が見つかるのは脊椎動物では初めてかもしれない。保持されているHoxCの顔ぶれはサメ・エイの種ごとに相違が大きく、研究チームでは、HoxC遺伝子の組み合わせが鰭の位置や数などの形態の違いを説明する可能性について今後調べていく。
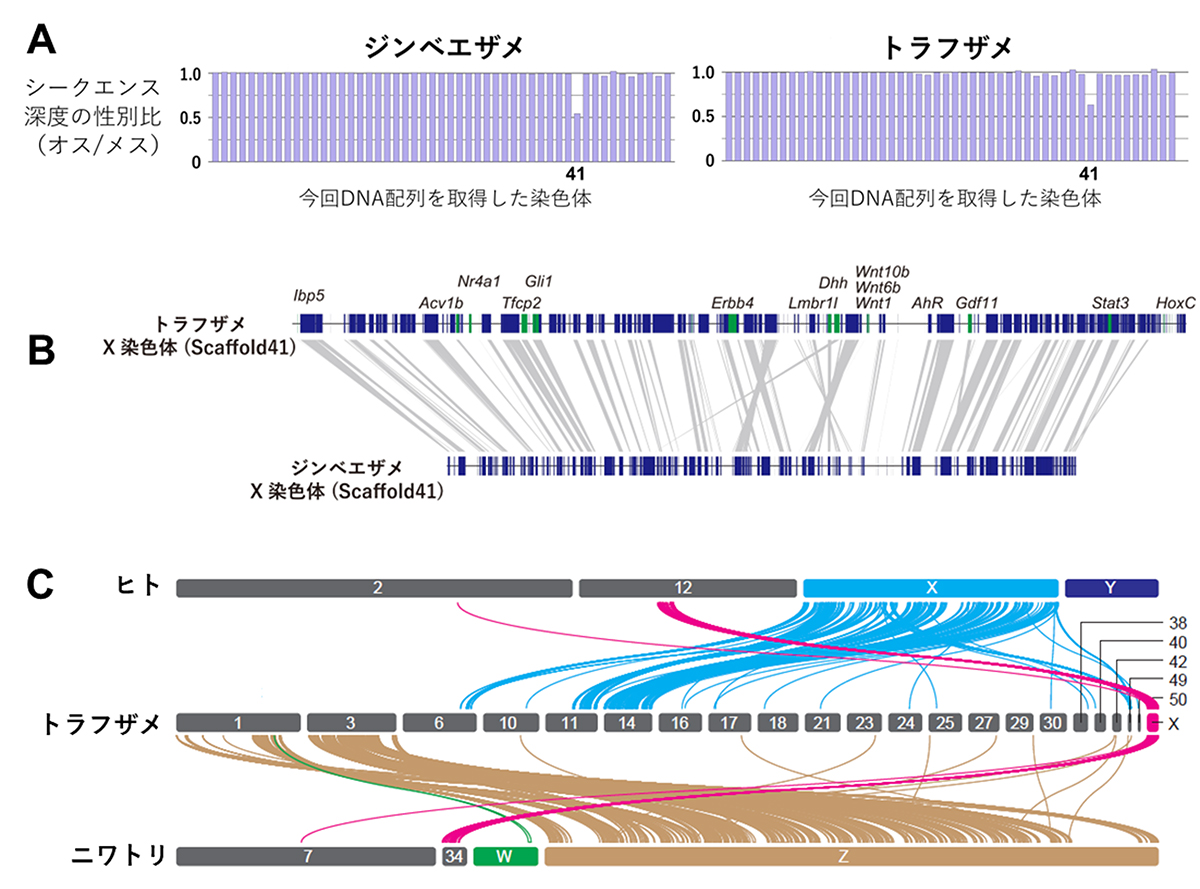
図2:サメのX染色体。(A)雌雄比較によるX染色体の同定。オスに対してメスで2倍の深度を示す染色体(長さの順に番号を付けた際の第41番染色体)が、オスでいわゆる「へテロ」の染色体、つまり、X染色体であると結論付けた。(B)サメ類2種間のX染色体(ともに第41番染色体)の対応。種の間をつなぐ直線は、双方の種の遺伝子の1対1のオーソロジー(種分岐を経た遺伝子の対応関係)を表す。(C)サメ類のX染色体と哺乳類および鳥類の性染色体との比較。種の間をつなぐ曲線は1対1のオーソロジーを表す。遺伝子構成を比較すると、トラフザメのX染色体は、ヒトでは12番染色体に、そしてニワトリでは34番染色体に対応する。いっぽう、ヒトのXおよびY染色体やニワトリのZおよびW染色体上の遺伝子に対応するトラフザメの遺伝子は、トラフザメのX染色体上には見られない。
生命情報・DDBJセンター 短時間雇用職員(技術補佐員) 募集
植物細胞遺伝研究室 Harsha Somashekarさんが「SOKENDAI 賞」を受賞

植物細胞遺伝研究室に所属するHarsha Somashekarさんが総合研究大学院大学(総研大)の第11回「SOKENDAI賞」を受賞しました。
SOKENDAI 賞は、特段に顕彰するに相応しい研究活動を行い、その成果を優れた学位論文にまとめて課程を修了し、学位を取得した学生を表彰するものとして、2018年度に創設されました。授賞式は2023年9月28日に学位記授与式の中で行われ、 永田学長から賞状とトロフィーが贈られました。Harshaさんは、SOKENDAI賞以外にも遺伝学コースの「森島奨励賞」を受賞しています。
▶ 学位論文タイトル:GLUCAN SYNTHASE-LIKE5 promotes anther callose deposition to maintain timely initiation and progression of meiosis in rice (Oryza sativa L.)
Harshaさんより受賞のコメントが届いておりますのでご紹介します。
I embarked on a journey at NIG in 2018 with a dream – to become an independent researcher, contribute to the world of knowledge, and address real-world challenges. Today, five years later, that dream stands fulfilled. This achievement owes itself to the unwavering support and guidance I have received from NIG, my nurturing parent institute of SOKENDAI University.
NIG is an extraordinary institution. It not only imparts knowledge but also instills in its students a unique perspective for tackling real-world issues. The most valuable lesson I’ve learned here is the art of creating new knowledge and doing science in a right way. Thanks to the high-quality training programs and courses provided at NIG, I have gained invaluable knowledge and skills in conducting research.
I extend my heartfelt gratitude to NIG for affording me this remarkable opportunity. I also want to recognize the immensely talented faculty members who have been my mentors and guides on this doctoral journey. Their enduring support and mentorship have been instrumental in shaping me as a researcher.
公開講演会「2023.11.18 きょうは遺伝研」
茎の節間は最後に生まれてくる-茎の発生学への挑戦-
プレスリリース
野々村研究室・植物細胞遺伝研究室
技術課 / 細胞建築研究室
Heat-shock inducible clonal analysis reveals the stepwise establishment of cell fates in the rice stem
Katsutoshi Tsuda, Akiteru Maeno, and Ken-Ichi Nonomura
Plant Cell 2023 Sep 27 DOI:10.1093/plcell/koad241
節と節間からなる「茎」は、種子植物一般に見られる地上部の軸構造で、隣接する葉と腋芽と共に茎頂分裂組織から生み出されます。茎は育種において草丈調節の最重要ターゲットになっているにもかかわらず、茎の発生過程の理解は、葉・根・花などの他の主要器官と比べて大きく遅れていました。
情報・システム研究機構 国立遺伝学研究所の津田勝利 助教、前野哲輝 技術専門職員、野々村賢一 准教授らは、多角的な解析手法を用いてイネの茎の構造と発生過程を詳細に調べました。さらに、遺伝子工学の手法を用いて、葉・茎・腋芽を一単位とするファイトマーを構成する細胞の各器官への運命決定がどのように起こるのかを解析しました。その結果、「発生に先立つファイトマーの確立」→「節になる細胞の出現とそれに伴う葉と茎の運命分岐」→「腋芽の運命確立」→「最後に節間への運命決定がごく少数の細胞で起こる」という、段階的なステップを経て茎の発生が進むことがわかりました。
本研究は、長らく不明であった茎の発生において鍵となるイベントとその時系列を明らかにしました。今後、本成果が茎の発生を分子レベルで理解するための基盤となり、将来的には理想的な草型設計に向けた茎形質の改良につながることが期待されます。
この研究は、新学術領域研究「植物多能性幹細胞」(18H04845・20H04891)、学術変革領域(A)「挑戦的両性花原理」(23H04754)、および科研費(22H02319・21H04729)の支援を受けておこなわれました。
本研究成果は、国際科学雑誌「Plant Cell」に2023年9月28日(日本時間)に掲載されました。
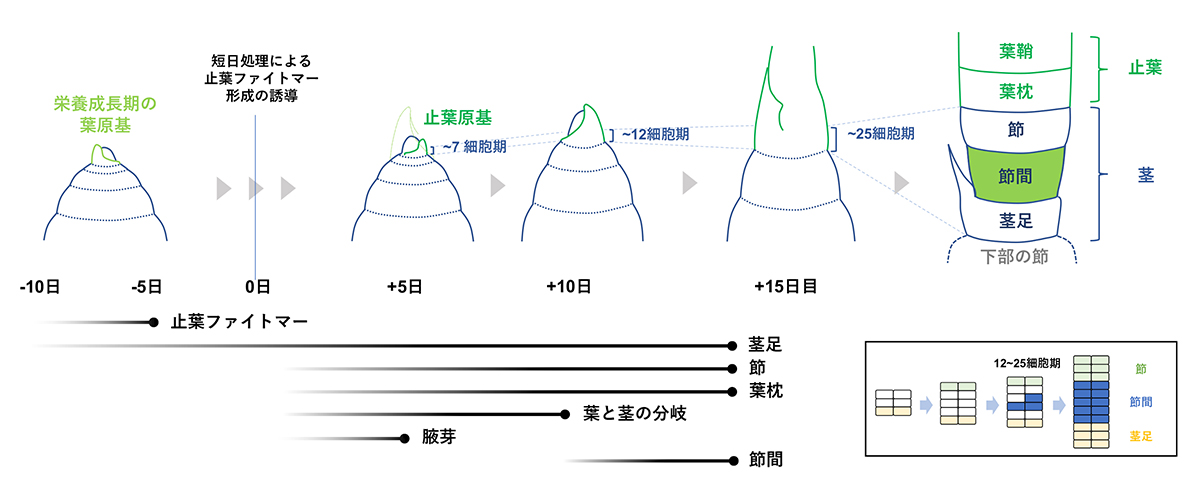
図: イネの止葉ファイトマーにおける各器官の細胞運命決定の時系列
止葉ファイトマーの運命はその発生開始の10-5日前に決定される。非伸長部(茎足や節・葉枕など)の運命決定は伸長部(葉鞘・節間)のそれよりも早期に開始する。腋芽の運命は止葉形成初期に確立する。節間になることが定まった細胞は、最も遅れて出現し始める。節間への運命決定はごく少数の細胞で始まる(右下部)。左下部黒線の左端は、運命が決定した細胞が現れ始めるタイミング、右端(黒丸)は、ある器官を構成する全ての細胞の運命が定まるタイミングを示す。
ゲノムダイナミクス研究室 総研大生・島添さんが第63回生物物理若手の会で優秀発表賞を受賞

ゲノムダイナミクス研究室の島添將誠さん (総研大遺伝学コースD2) が、2023年9月4日〜9月7日に滋賀で開催された、第63回生物物理若手の会・夏の学校でポスター発表をおこない、優秀発表賞を受賞しました。
分子細胞工学研究室 鐘巻将人教授が第23回山崎貞一賞を受賞

分子細胞工学研究室 鐘巻将人教授は、第23回山崎貞一賞の受賞が決定しました。
この賞は、一般財団法人材料科学技術振興財団が科学技術水準の向上とその普及啓発に寄与することを目的として平成13年に創設されたものです。財団は論文の発表、特許の取得、方法・技術の開発等を通じて、実用化につながる優れた創造的業績をあげている人を対象に、「材料」、「半導体及びシステム・情報・エレクトロニクス」、「計測評価」、「バイオ・医科学」の4分野について、毎年、交互に2分野ごと授賞しています。 今年は、「計測評価」、「バイオ・医科学」分野を表彰する年となっていますが、鐘巻教授はこのうち「バイオ・医科学分野」を受賞することとなりました。
贈呈式は2月に行われます。
静岡大学-遺伝研合同シンポジウムのご案内(10/19開催)
遺伝研と静岡大学は、相互の学術研究や教育の進行を推進するために包括連携協定を2014年に結び、様々な取り組みを行ってきました。この度、静岡大学と遺伝研の最新の研究を紹介する静大-遺伝研合同シンポジウムを開催いたします。
日時: 2023年10月19日(木) 13:30-17:00
会場: 静岡大学/静岡キャンパス理学部B棟202室
交通アクセス
対象: 研究者、大学院生/大学生、一般
参加申込: 必要ありません。会場に直接お越しください。
講演:
深層学習によるSAR-光学画像変換
薗部礼(静岡大学農学部・生物資源科学科)
NGSで加速する作物ゲノム情報の育種活用とその限界
山下寛人(静岡大学農学部・応用生命科学科)
ゲノム多倍数化は進化にとって有利なのか? ~複製、遺伝様式から考える~
大林龍胆(静岡大学理学部・生物科学科)
疾患に関わる非ワトソン・クリック型核酸構造
大吉崇文(静岡大学理学部・化学科)
脊椎動物の進化における遺伝子レパートリの変遷
工樂樹洋(国立遺伝学研究所・ゲノム・進化研究系)
DNA量変化を伴うゲノム変化のメカニズムとインパクト ~環状DNAの未知なるポテンシャルの解明を目指して~
佐々木真理子(国立遺伝学研究所・新分野創造センター)
備考:遺伝研研究者は送迎バスが利用できるので後ほど案内されます。
アジアABS学術フォーラム ― ABSシンポジウム2023を開催
花の構造色の発色に関与する因子の絞り込みに成功
Genome and transcriptome analyses reveal genes involved in the formation of fine ridges on petal epidermal cells in Hibiscus trionum
Shizuka Koshimizu*, Sachiko Masuda, Arisa Shibata, Takayoshi Ishii, Ken Shirasu, Atsushi Hoshino, Masanori Arita
* 責任著者
DNA Research 2023 Sep 11 DOI:10.1093/dnares/dsad019
構造色とは物質表面の微細な構造により発色する色を言い、昆虫や鳥類など様々な生物で観察されています。構造色は植物の花弁にも見られ、昆虫の誘引に寄与すると言われています(Moyroud et al., 2017)。
ギンセンカ(Hibiscus trionum)は、花弁に構造色を持つ植物の1つです。ギンセンカの花は、中心部が紫色、外側が薄い黄色を示します。紫色はアントシアニンの色素由来ですが、紫色を示す花弁の表皮細胞には微細な凹凸構造が存在するため、構造色も発色しています。写真では分かりづらいですが、角度を変えると色が変化して見えます。
本研究では、ギンセンカのゲノム解析やトランスクリプトーム解析を行い、構造色の発色に必要な微細構造の形成に関わる因子の絞り込みに成功しました。
絞り込んだ主な因子
・SHINE1:植物のクチクラ形成に関わる転写因子。
・CUTIN SYNTHASE 2:クチクラ成分の1つであるクチンの合成因子。
・CYP77Aファミリー遺伝子:同じくクチンの合成に関わる因子。
これらの因子は、モデル植物シロイヌナズナの花弁に存在する微細構造の形成に関わることが知られているため、ギンセンカ花弁の微細構造形成にも関与する可能性が高いと考えられます。
今後、絞り込んだ候補因子を皮切りに微細構造形成のメカニズムやその進化の解明を目指します。
本研究は、国立遺伝学研究所(越水静助教、有田正規教授)、理化学研究所(増田幸子研究員、柴田ありさテクニカルスタッフ、白須賢グループディレクター)、鳥取大学乾燥地研究センター(石井孝佳准教授)、基礎生物学研究所(星野敦助教)による共同研究グループによって実施されました。
また本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 ACT-X(JPMJAX21B6)、日本学術振興会(JSPS) 科研費(20H05909)、サッポロ生物科学振興財団、基礎生物学研究所・共同利用研究(20-341、21-223、22NIBB308、23NIBB314)の支援を受けて実施されました。

図:ギンセンカの花弁と表面構造の比較
Cold Spring Harbor Perspectives in Biologyの種分化特集号に総説を発表
Mechanisms of intrinsic postzygotic isolation: from traditional genic and chromosomal views to genomic and epigenetic perspectives.
Reifová, R., Ament-Velásquez, S. L., Bourgeois, Y., Coughlan, J., Kulmuni, J., Lipinska, A. P., Okude, G., Stevison, L., Yoshida, K., and Kitano, J.
Cold Spring Harbor Perspectives in Biology 2023 Sep 11 DOI:10.1101/cshperspect.a041607
このたび、生態遺伝学研究室の北野潤教授、吉田恒太特任助教、奥出絃太学振PDらは、Cold Spring Harbor Perspectives in Biologyの種分化の特集号に、内因性雑種異常に関する総説を発表しました。北野教授は、本総説の共責任著者をつとめるとともに、種分化特集号の遺伝メカニズムのセクション全体の取りまとめ責任者をつとめました。
内因性雑種異常は、種と種を隔てる重要な生殖隔離機構の一つです。かつては、2つの遺伝子の変異によって雑種異常が生じるとするドブジャンスキー・マラーモデルおよび接合異常や異常な配偶子を産生する染色体構造変化が主要なメカニズムとされてきました。近年、DNAの塩基配列がある程度分化すると接合異常が起こって減数分裂がストップなど別のメカニズムも明らかになりつつあります。本総説では提唱されている様々なメカニズムについて概観しました。

















