Archive
- Home
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
分子生命史研究室 川口 茜助教が日本発生生物学会 第1回JSDB Frontiers Prizeを受賞
2024年6月19日~22日に京都市・みやこめっせで開催された日本発生生物学会第57回大会において、分子生命史研究室の川口 茜助教が 新たに設立されたJSDB Frontiers Prizeの第1回(2024年度)を受賞しました。
受賞記念講演は6月21日に行われました。

川口助教より受賞のコメントが届いておりますのでご紹介します。
この賞は、設置されるまでに多くの方のご尽力があったと伺っております。
そんな第一回目のJSDB Frontiers Prizeを頂戴することができ、大変光栄に思うと同時に、身が引き締まる思いです。
学会関係者の皆様、私の研究活動に関わってくださっているすべての方々に感謝申し上げます。
今後とも、発生生物学研究者として邁進してまいります。
茎の節と節間ができるしくみを解明
~植物科学の未踏の地「茎の発生学」に挑む~
プレスリリース
野々村研究室・植物細胞遺伝研究室
技術課 / 細胞建築研究室
YABBY and diverged KNOX1 genes shape nodes and internodes in the stem
Katsutoshi Tsuda*, Akiteru Maeno, Ayako Otake, Kae Kato, Wakana Tanaka, Ken-Ichiro Hibara, and Ken-Ichi Nonomura
* 責任著者
Science (2024) 384, 1241-1247 DOI:10.1126/science.adn6748
節と節間の繰り返し構造からなる「茎」の発生メカニズムは、植物の主要器官の発生メカニズムの中で唯一研究が進んできませんでした。これは、多くの植物種で節と節間が不明瞭で、形態的特徴に乏しいことが理由として考えられます。
情報・システム研究機構 国立遺伝学研究所の津田勝利助教、前野哲輝技術専門職員、野々村賢一准教授、および広島大学の田中若奈准教授、吉備国際大学の桧原健一郎教授らの共同研究グループは、節と節間の区別が明瞭なイネの茎に着目し、茎の基本パターンが損なわれた矮性変異体を解析することで、茎の発生メカニズムの解明に挑みました。
その結果、(1)節は、「葉」の発生プログラムが「茎」に介入することで生まれること、(2)節間は、「葉」の発生プログラムの介入を「茎頂」の発生プログラムが適度に制限することで生まれること、(3)これらの発生プログラムのメカニズムは、3次元的な枝構造しか持っていなかった種子植物の祖先が葉を獲得する過程で生じた可能性が高いこと、を見出しました(図)。
本研究は、植物発生学における最後の砦とも言える茎の基本発生プログラムとその進化過程を明らかにしました。本成果によって、農作物の収量に影響する茎形質の改良につながることが期待されます。
この研究は、日本学術振興会(JSPS)科研費(18H04845, 20H04891, 22H02319, 23H04754, 21H04729)の支援を受けておこなわれました。
本研究成果は、国際科学雑誌「Science」に2024年6月14日(日本時間)に掲載されました。
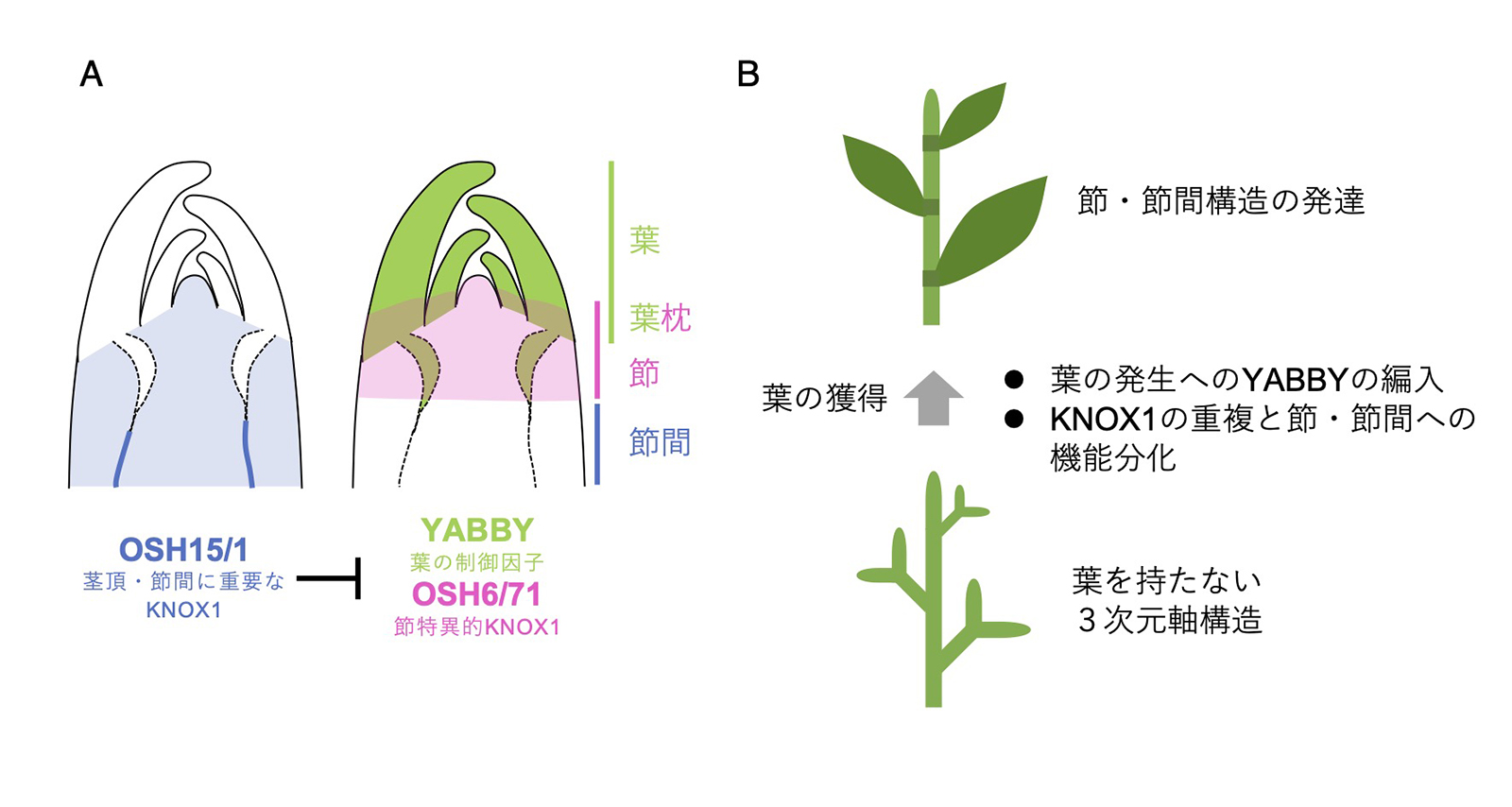
図: イネの茎における節と節間の発生メカニズム
(A)葉の制御遺伝子「YABBY」と機能分化した「KNOX1遺伝子ファミリー」の発現領域により節と節間が規定される。
(B) 上記のメカニズムは種子植物の祖先が「葉」を獲得した際に生じ、養分交換のための節と伸長に特化した節間を区別して発達させることができるようになったと考えられる。
「魚のヒレ」 長かったり、短かったり⁉ 仕組みを解明
―ヒレの多様な形成位置をもたらす単純なシステム―
プレスリリース
川上研究室・発生遺伝学研究室
技術課 / 細胞建築研究室
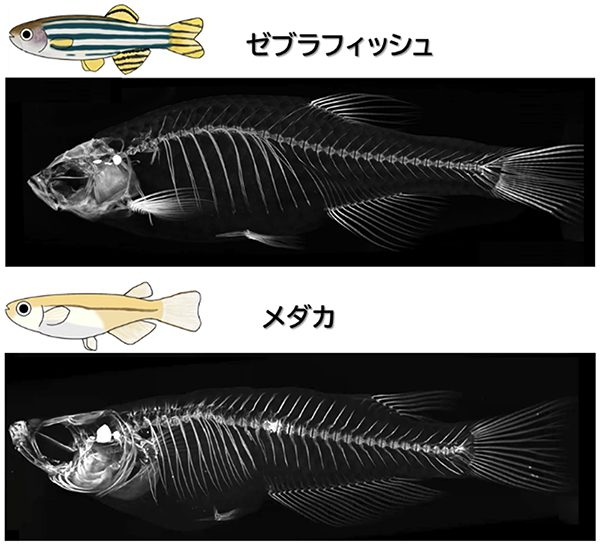
Teleost Hox code defines regional identities competent for the formation of dorsal and anal fins
Urara Adachi, Rina Koita, Akira Seto, Akiteru Maeno, Atsuki Ishizu, Sae Oikawa, Taisei Tani, Mizuki Ishizaka, Kazuya Yamada, Koumi Satoh, Hidemichi Nakazawa, Hiroyuki Furudate, Koichi Kawakami, Norimasa Iwanami, Masaru Matsuda, and Akinori Kawamura
PNAS (2024) 121, e2403809121 DOI:10.1073/pnas.2403809121
埼玉大学大学院・理工学研究科・生体制御学プログラム 川村哲規 准教授と安達うらら 大学院生(令和5年度博士前期課程修了)を中心とするグループは、宇都宮大学・バイオサイエンス教育研究センター 松田 勝 教授、岩波礼将 特任准教授、情報・システム研究機構 国立遺伝学研究所 川上浩一 教授、前野哲輝 技術専門職員、埼玉大学・理工学研究科 古舘宏之 助教らと共同で、魚のヒレの形成される位置がHox(ホックス)遺伝子によって制御されていることを初めて明らかにしました。この成果により、Hox遺伝子の働く場所が魚の種類によって異なることで、バラエティーに富んだヒレが生み出されることが示唆されました。つまり、多様なヒレの位置やヒレの幅の違いは、Hox遺伝子からなるシステムを一部、変化させることで生じていることが分かりました。さらに、本研究から、進化の過程で、魚のヒレの形成位置が変化してきた仕組みについて、新たなモデルが提唱されました。
本研究は、科学研究費補助金 基盤研究(C)18K06177, 23K05790および国立遺伝学研究所公募型共同研究「NIG-JOINT」38A2019, 7A2020, 66A2021, 18A2022, 31A2023の支援を受けて行われました。
本成果は、『米国科学アカデミー紀要』(PNAS、インパクトファクター12.8)に掲載されました。
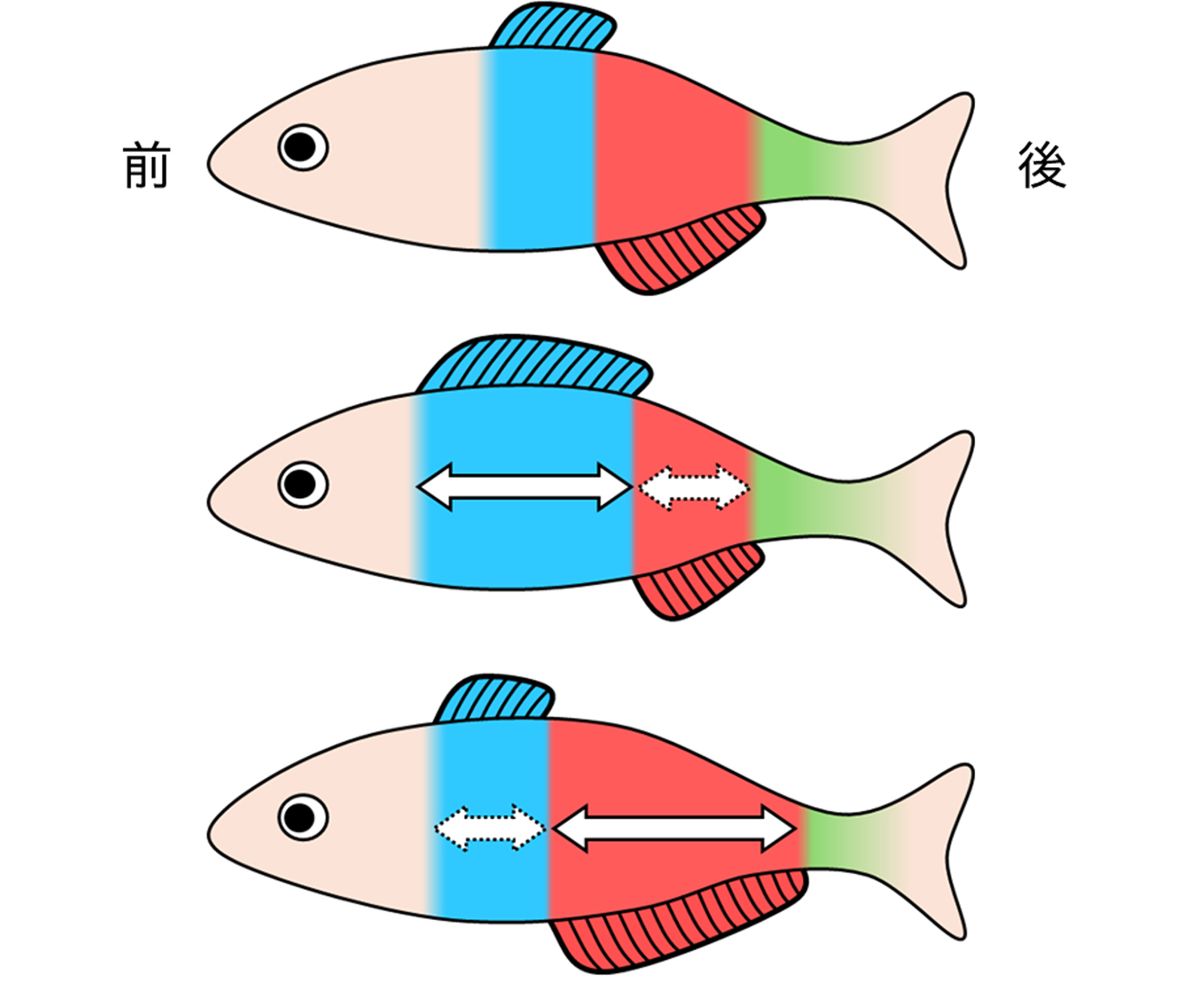
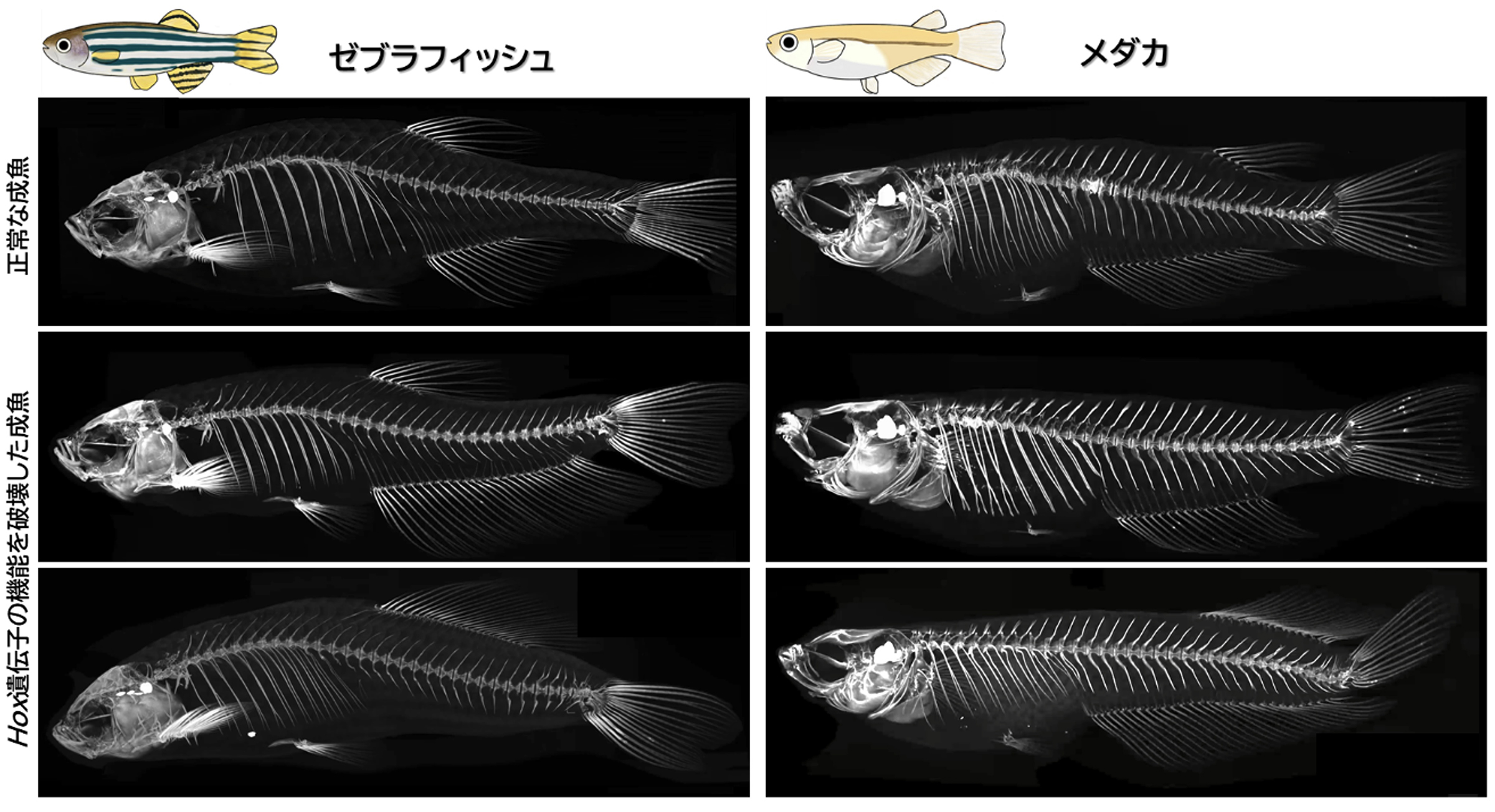
図:背ビレと臀ビレの形成されるからだの領域を規定するHox遺伝子
色で示すように、背ビレや臀ビレが形成される魚のからだの領域が、複数のHox遺伝子によって区分されている(図:上)。Hox遺伝子の働く場所は、前後にシフトすることが知られている。Hox遺伝子の働く場所が、パラメーターのように変化することで、形成位置や長さが大きく異なったヒレが生じることが示された。(図:中央、下)
「魚のヒレ」 長かったり、短かったり⁉ 仕組みを解明
―ヒレの多様な形成位置をもたらす単純なシステム―
プレスリリース
川上研究室・発生遺伝学研究室
技術課 / 細胞建築研究室

Teleost Hox code defines regional identities competent for the formation of dorsal and anal fins
Urara Adachi, Rina Koita, Akira Seto, Akiteru Maeno, Atsuki Ishizu, Sae Oikawa, Taisei Tani, Mizuki Ishizaka, Kazuya Yamada, Koumi Satoh, Hidemichi Nakazawa, Hiroyuki Furudate, Koichi Kawakami, Norimasa Iwanami, Masaru Matsuda, and Akinori Kawamura
PNAS (2024) 121, e2403809121 DOI:10.1073/pnas.2403809121
埼玉大学大学院・理工学研究科・生体制御学プログラム 川村哲規 准教授と安達うらら 大学院生(令和5年度博士前期課程修了)を中心とするグループは、宇都宮大学・バイオサイエンス教育研究センター 松田 勝 教授、岩波礼将 特任准教授、情報・システム研究機構 国立遺伝学研究所 川上浩一 教授、前野哲輝 技術専門職員、埼玉大学・理工学研究科 古舘宏之 助教らと共同で、魚のヒレの形成される位置がHox(ホックス)遺伝子によって制御されていることを初めて明らかにしました。この成果により、Hox遺伝子の働く場所が魚の種類によって異なることで、バラエティーに富んだヒレが生み出されることが示唆されました。つまり、多様なヒレの位置やヒレの幅の違いは、Hox遺伝子からなるシステムを一部、変化させることで生じていることが分かりました。さらに、本研究から、進化の過程で、魚のヒレの形成位置が変化してきた仕組みについて、新たなモデルが提唱されました。
本研究は、科学研究費補助金 基盤研究(C)18K06177, 23K05790および国立遺伝学研究所公募型共同研究「NIG-JOINT」38A2019, 7A2020, 66A2021, 18A2022, 31A2023の支援を受けて行われました。
本成果は、『米国科学アカデミー紀要』(PNAS、インパクトファクター12.8)に掲載されました。

図:背ビレと臀ビレの形成されるからだの領域を規定するHox遺伝子
色で示すように、背ビレや臀ビレが形成される魚のからだの領域が、複数のHox遺伝子によって区分されている(図:上)。Hox遺伝子の働く場所は、前後にシフトすることが知られている。Hox遺伝子の働く場所が、パラメーターのように変化することで、形成位置や長さが大きく異なったヒレが生じることが示された。(図:中央、下)
琵琶湖から新種アザイカワニナを発見
―カワニナ属2種群の平行的な多様化を示唆―
プレスリリース
Redescription of Semisulcospira reticulata (Mollusca, Semisulcospiridae) with description of a new species from Lake Biwa, Japan
Naoto Sawada, Yusuke Fuke, Osamu Miura, Haruhiko Toyohara, Takafumi Nakano
Evolutionary Systematics (2024) 8, 127–144 DOI:10.3897/evolsyst.8.124491
日本の中央に位置する古代湖である琵琶湖において大規模な種の多様化を遂げた淡水性巻貝のカワニナ属は、二つの種群から構成され、湖内の岩礁や砂浜、泥底などの様々な底質の環境に進出しています。このうち、岩礁や砂浜に暮らす種では、近年に両種群において分類の見直しが進展しています。対して、沖合の砂泥底や泥底では、一方の種群の種多様性が十分に評価されていませんでした。
京都大学大学院理学研究科 澤田直人 博士課程学生(研究当時)、中野隆文 同准教授、国立遺伝学研究所 福家悠介 研究員、高知大学 農林海洋科学部 三浦収 准教授、摂南大学 農学部 豊原治彦 教授(研究当時)の研究グループは、琵琶湖の砂泥底および泥底から得られたカワニナ属の遺伝解析と形態解析によって、カゴメカワニナSemisulcospira reticulataの分類学的位置を再定義するとともに、これまで学名がつけられていなかった新種アザイカワニナSemisulcospira nishimuraiを記載しました。アザイカワニナの和名は、このカワニナの既知の分布域が北近江の戦国大名である浅井氏の最大勢力に大まかに一致することに由来します。
琵琶湖の沖合に暮らすカゴメカワニナとアザイカワニナは、主に成貝殻の角度や彫刻の形態、胎児殻の大きさで他種から識別され、きめ細かな底質上で採餌を行うのに適していると考えられる尖った歯舌を持ちます。また、アザイカワニナが砂泥底から発見されたことで、琵琶湖の砂泥環境を好む種がカワニナ属の二つの種群で独立に出現していることが示されました。この研究成果によって、カワニナ属の種多様性が再評価されるとともに、本属の二種群が古代湖において平行的な多様化を生じたことが示唆されました。
本研究は、日本学術研究振興会 科学研究費助成事業(JP21J22917)および、水産無脊椎動物研究所 育成研究助成(IKU 2021-01)の支援を受けて実施されました。
本研究成果は2024年6月10日に系統分類学の国際学術誌「Evolutionary Systematics」にオンライン掲載されました。

図: 左からカゴメカワニナの成貝殻標本、新種アザイカワニナの成貝殻標本、アザイカワニナの生体。
多階層感覚構造研究室 短時間雇用職員(技術補佐員)募集
多階層感覚構造研究室では以下の業務を担当していただける短時間雇用職員(技術補佐員)を募集いたします。
| 【採用時期】 | 2024年8月以降(応相談) |
| 【職務内容】 | マウス飼育・実験補助(変更の予定なし) |
| 【募集人数】 | 1名 |
| 【応募資格】 | 経験は不問 生き物を素早くかつ丁寧に扱える方、手先が器用な方が適しています。 (※げっ歯類をご自宅で飼っている方はご遠慮ください) |
| 【勤務地】 | 国立遺伝学研究所 多階層感覚構造研究室(変更の予定なし) |
| 【給与・待遇】 | 遺伝研の規定に準ずる |
| 【勤務時間】 | 9:00-16:00(昼休憩1時間)週3日勤務(応相談) |
| 【休日】 | 土曜、日曜、祝日、12/29〜1/3 |
| 【雇用期間】 | 年度契約、評価に基づき3年まで更新可。 |
| 【応募】 | 封筒またはメール件名に「多階層感覚構造研究室 技術補佐員応募」と明記の上、履歴書(写真添付・メールアドレス記載)を下記宛先まで郵送またはメールでお送りください。 |
| 【応募締切】 | 適任者が見つかり次第、締め切ります。 |
| 【問合先・提出先】 | 〒411-8540 三島市谷田1111 大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所 多階層感覚構造研究室(055)981-6792 米原圭祐 (Email: ) |
新しい遺伝子トラップ系統の解析により明らかとなったcsrp3遺伝子の、心臓発生および再生における動的な発現パターンと重要な役割。
A novel gene‐trap line reveals the dynamic patterns and essential roles of cysteine and glycine‐rich protein 3 in zebrafish heart development and regeneration.
Shuzhang Liang, Yating Zhou, Yue Chang, Jiayi Li, Min Zhang, Peng Gao, Qi Li, Hong Yu, Koichi Kawakami, Jinmin Ma, and Ruilin Zhang.
Cellular and Molecular Life Sciences (2024) 81, 158 DOI:10.1007/s00018-024-05189-0
CSRP3/ MLP遺伝子は、横紋筋機能の重要な調節因子であり、肥大型心筋症(HCM)および拡張型心筋症(DCM)と関連している。しかし、心臓の発生および再生におけるCSRP3の役割は完全にはわかっていない。本研究では、csrp3遺伝子座に挿入を持つ新規ゼブラフィッシュ遺伝子トラップ系統gSAIzGFFM218Aの解析を行なった。我々は、csrp3が仔魚の心室心筋細胞(CM)で特異的に発現し、Csrp3欠損がCSRP3関連HCMおよびDCMの共通の特徴である過剰な梁柱形成を引き起こすことを発見した。さらにcsrp3の発現が心臓再生に重要な複数のシグナル経路によって制御され、さまざまな心臓損傷に応じて増加することを明らかにした。Csrp3欠損は、CMの脱分化を損ない、サルコメアの再構築を妨げ、CMの増殖を減少させながらアポトーシスを憎悪させることで心臓再生を阻害した。一方、Csrp3の過剰発現は、損傷後のCM増殖を促進し、複数のシグナル経路の薬理学的阻害によって引き起こされる心室再生の障害を改善した。我々の研究は、ゼブラフィッシュの心臓発生および再生におけるCsrp3の重要な役割を強化し、CSRP3関連の人間の心疾患の分子病理を解明するための価値ある動物モデルを提供した。
本研究は、武漢大学のZhang研究室と川上研究室の共同研究として行われた。NIG-JOINT(2015 Collaborative Research A1-8)の成果である。
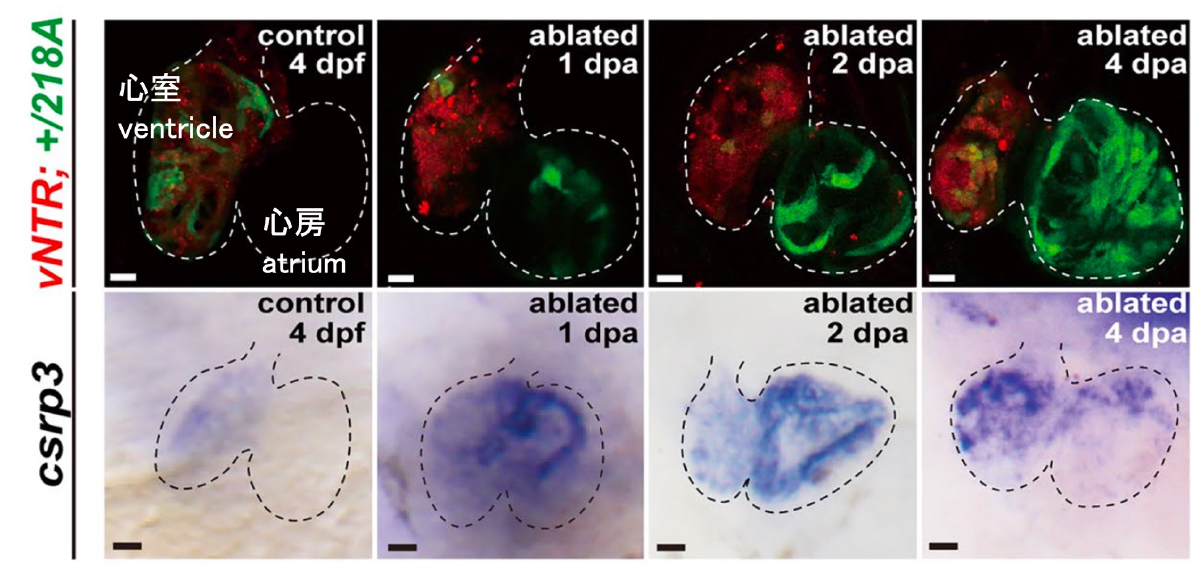
図:心室心筋細胞を除去した心臓の心房におけるcsrp3遺伝子の発現誘導
(赤)心室心筋細胞におけるmCherry-NTRの発現。MTZ添加により細胞を除去(ablated)。
(緑)心室心筋細胞除去を行なった心臓におけるcsrp3遺伝子の発現誘導
小型魚類遺伝研究室研究補助員募集
| 【仕事内容】 | グルクマ(サバ科の海産魚)の飼育補助(変更の予定なし) |
| 【採用時期】 | なるべく早い時期 |
| 【雇用期間】 | 2025年3月末まで |
| 【応募資格】 | 経験は問いません。体長30cm 程度の海産魚に触れることを厭わない方。 |
| 【勤務地】 | 国立遺伝学研究所・小型魚類遺伝研究室(変更の予定なし) |
| 【給与・待遇】 | 遺伝研の規定に準じて決定 |
| 【勤務時間】 | 週3~5日(応相談):月〜金 9:00-16:00(昼休憩1時間、週30時間以内) |
| 【採用人数】 | 1名 |
| 【応募方法類】 | 封筒またはメール件名に「小型魚類遺伝研究室 技術補助員応募」と明記の上、履歴書(写真添付・メールアドレス記載)、職務経歴書を下記宛先まで郵送またはメールにて送信下さい。書類選考通過者のみ面接を行い、採用を決定いたします。お送りいただきました履歴書等の応募書類は返却いたしませんのでご承知おき下さい。 |
| 【応募期間】 | 適任者が見つかり次第締め切ります。 |
| 【問合先・提出先】 | 〒411-8540 三島市谷田1111 国立遺伝学研究所 小型魚類遺伝研究室 Email: Tel:055-981-5849 担当:山田 志織 |
神経軸索の正中線交差を決定する進化的に保存された遺伝子ネットワーク
A conserved gene regulatory network tells neurons to send axons across the midline
Aki Masuda, Kazuhiko Nishida, Rieko Ajima, Yumiko Saga, Marah Bakhtan, Avihu Klar, Tatsumi Hirata, Yan Zhu*
* 責任著者
Science Advances (2024) 10, eadk2149 DOI:10.1126/Sciadv.adk2149
すべてのニューロンは、正中線を超えて軸索を投射するもの(commissural)と交差しないで同側に投射するもの(ipsilateral)の2つに大別される。この2大別は脳神経系に広く共通する原理でありながら、それを決める遺伝的プログラムはほとんどわかっていなかった。本研究では、進化的に保存された塩基性 helix-loop-helix転写因子のペアNhlh1/2が、脊髄から中脳に至るまでのニューロンをcommissuralたらしめ、これらの軸索を中心線(床板)を超えて反対側に投射させていることを明らかにした。このグローバルな正中交差メカニズムは、領域特異的なニューロンクラス決定因子と相互作用することで、多種多様なニューロンをcommissuralとipsilateralに2大別することを可能にする。我々の発見は、グローバルに作用する遺伝子プログラムと、局所的に作用する細胞系譜依存的な遺伝子プログラムとの相互作用が、多種多様なニューロンを生み出す運命決定の鍵であることを示している。
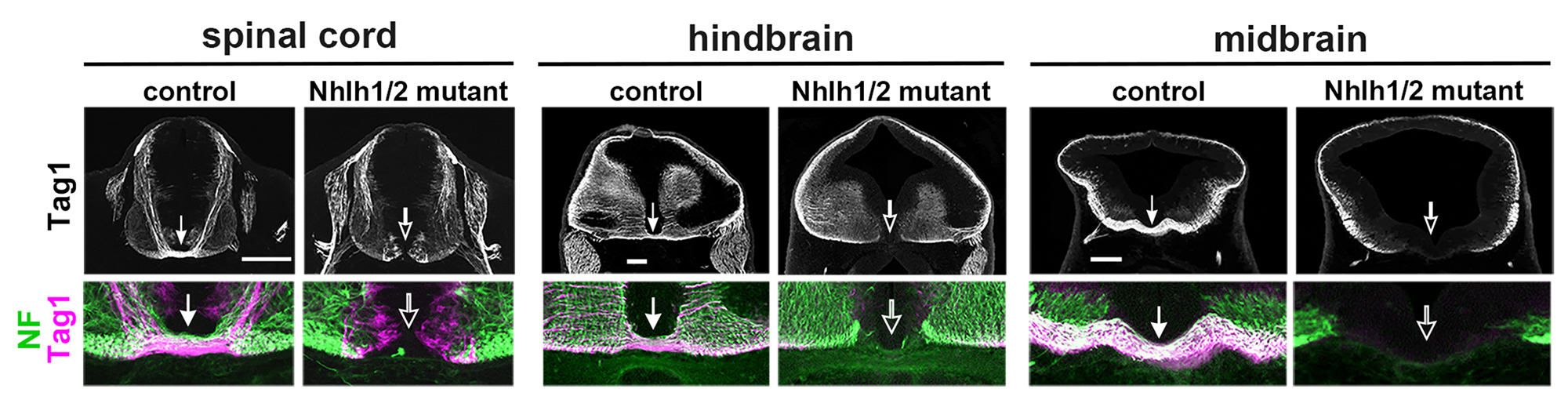
図1:Nhlh1/2二重変異マウスでは、神経管の正中線を横切る軸索が完全に欠如している。
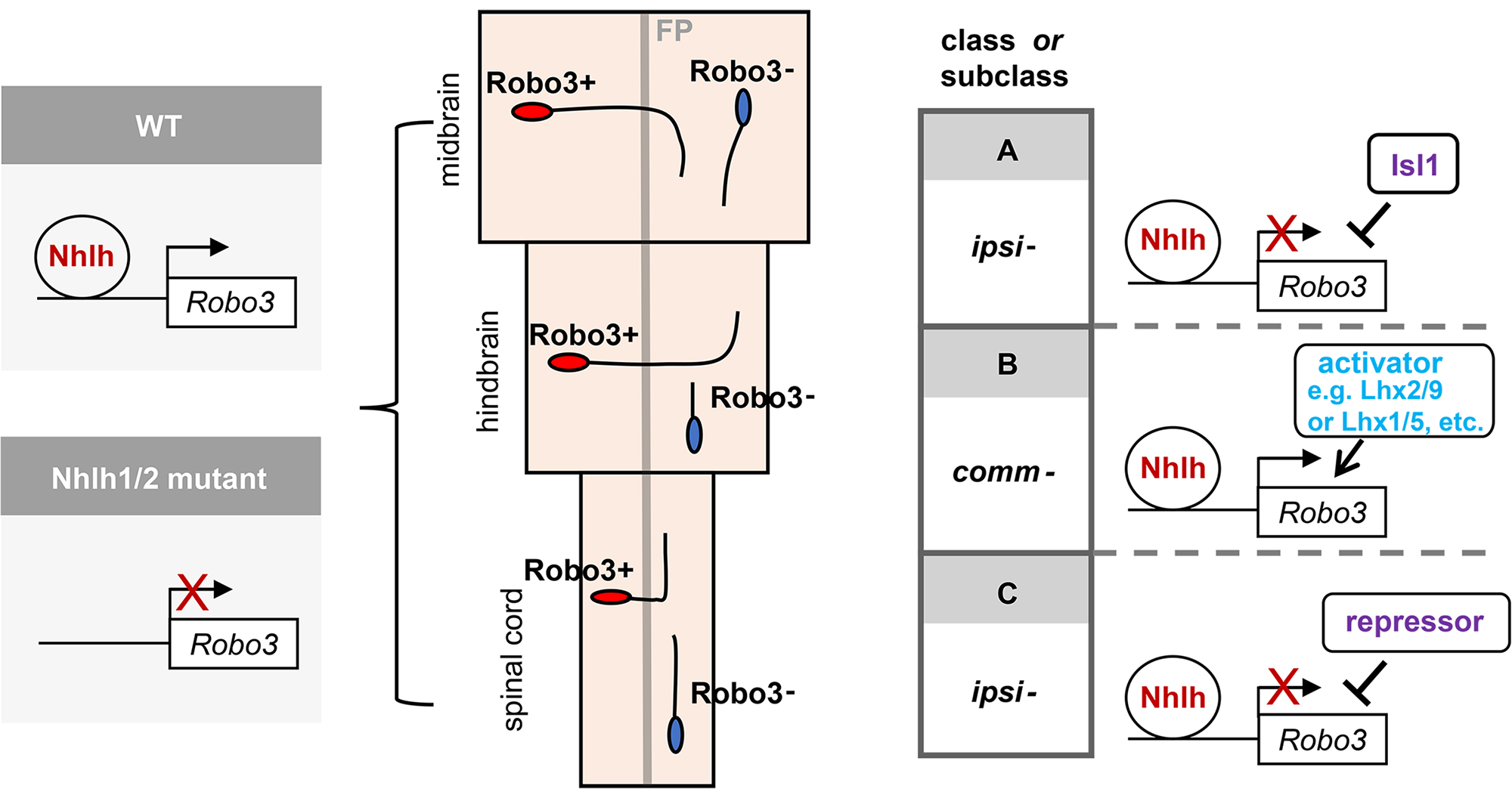
図2:転写因子Nhlh1/2はガイダンス受容体Robo3の調節領域に結合し、その転写を活性化する。Nhlh1/2を欠損させるとRobo3の発現が大きく減少し、その結果、神経管の正中線を横切る軸索が形成されなくなる。Nhlh1/2の活性は、Isl1やLhxのような領域特異的な転写因子によって制御される。
遺伝研の大学院(総研大) 体験入学随時コースの募集を開始
アセチル化変異型ヒストンH4を持つヌクレオソームの動態解析
前島研究室・ゲノムダイナミクス研究室
黒川研究室・ゲノム進化研究室
比較ゲノム解析研究室
Behaviors of nucleosomes with mutant histone H4s in euchromatic domains of living human cells.
Adilgazy Semeigazin, Shiori Iida, Katsuhiko Minami, Sachiko Tamura, Satoru Ide, Koichi Higashi, Atsushi Toyoda A, Ken Kurokawa, Kazuhiro Maeshima *
* 責任著者
Histochemistry and Cell Biology 2024 May 14 DOI:10.1007/s00418-024-02293-x
DNAは負に帯電したポリマーであり、正に帯電したコアヒストン八量体に巻き付き、ヌクレオソームを形成しています。コアヒストン八量体は、ヒストンH2A・H2B・H3・H4がそれぞれ二つずつ、合計8つのタンパク質で構成されています。それぞれのヒストンの末端には、特定の構造を持たず、さまざまな化学修飾を受ける「テール」と呼ばれる部分が存在します。ヒストンH2Aには2本のテールが存在するので、一つのヌクレオソームは合計で10本のヒストンテールを持っています。ヒストンテールの多数のリジン残基がアセチル化されると、その正電荷が中和され、DNAや隣接するヌクレオソームとの結合が弱まり、ヌクレオソーム間の相互作用が失われます。特に、ヒストンH4のテール上の特定のリジン残基のアセチル化は、試験管内でクロマチンの構造を劇的に変えることが知られていましたが、生きた細胞内で、特定のリジン残基のアセチル化が、そのアセチル化を持つヌクレオソームの動態にどのように影響するかは、これまで明らかではありませんでした。
今回、情報・システム研究機構 国立遺伝学研究所 ゲノムダイナミクス研究室のSemeigazin Adilgazy 総研大生 (国費外国人留学生)、飯田史織 総研大生 (元SOKENDAI特別研究員、学振特別研究員 DC2)、南克彦 総研大生(元SOKENDAI特別研究員、学振特別研究員 DC2)、田村佐知子 テクニカルスタッフ、井手聖 元助教(東京都医学総合研究所 研究員)、前島一博 教授のグループ、ゲノム進化研究室 東光一 助教、黒川顕 教授のグループ、比較ゲノム解析研究室 豊田敦 特任教授のグループは、ヒストンH4テールのアセチル化されるリジン残基を、脱アセチル化模倣型やアセチル化模倣型に変異させ、ユークロマチンにおけるその変異を含むヌクレオソームの局所的な動きを解析しました。その結果、変異体を含むヌクレオソームは、クロマチンドメイン(塊)に埋もれるため、変異によって動きは変化しないことが明らかになりました (図)。
本研究では、野生型(wt)または変異型ヒストンH4(H4K16の点変異、H4K5,8,12,16四重変異体、テールの欠失)をHaloTagと融合させ、HeLa細胞で異所的に発現させました。野生型およびH4-Halo変異型は、ユークロマチンに局在していました。また、wtH4-Haloヌクレオソームのゲノム領域は、ユークロマチンのHi-Cコンタクトドメインに対応していました。一分子ヌクレオソームイメージングを用い (動画)、H4の脱アセチル化やアセチル化を模倣したH4の変異のいずれも、その変異を含むヌクレオソームの平均の動きを変化させないことを発見しました。変異体を含むヌクレオソームは、多数の野生型が存在するクロマチンドメイン(塊)に埋もれるためと考えられます (図)。興味深いことに、H4の4 つのリジンをアルギニンに置換した変異型H4は、ヌクレオソームにあまり取り込まれず、大部分が核内を自由に拡散していました (図と動画)。さらに、テールを欠失した変異型H4は、ユークロマチンだけでなくヘテロクロマチンにも取り込まれていました (図)。本研究は、生きた細胞において、化学修飾の状態が異なる個々のヌクレオソームの挙動を理解するために、一分子ヌクレオソームイメージングが有効であることを示しています。
今年はRobert FeulgenによるDNA染色法発見100周年にあたります。本論文はそのことを記念した米国Histochemistry and Cell Biology誌の特集号” The Centennial of the Feulgen Reaction – Imaging the Genome”に掲載されました。
本研究は、日本学術振興会(JSPS) 科研費(24H00061, 21H02453, 23K17398, 22H05606, 21H02535, 23KJ0996、23KJ0998)、学術変革領域 A「ゲノムモダリティ」(20H05936)、科学技術振興機構(JST) JST 次世代研究者挑戦的研究プログラム(JPMJSP2104)、武田科学振興財団の支援を受けました。ゲノム解析については、先進ゲノム支援(22H04925(PAGS))の一環としておこなわれました。
動画: (左) 異所的に発現した野生型wtH4-Haloの動き。大部分がヌクレオソームに取り込まれ、その場でゆらいでいる。(右)脱アセチル化模倣型のH4四重変異体であるH4R-quadの動き。ヌクレオソームにあまり取り込まれず、大部分が自由に拡散する。
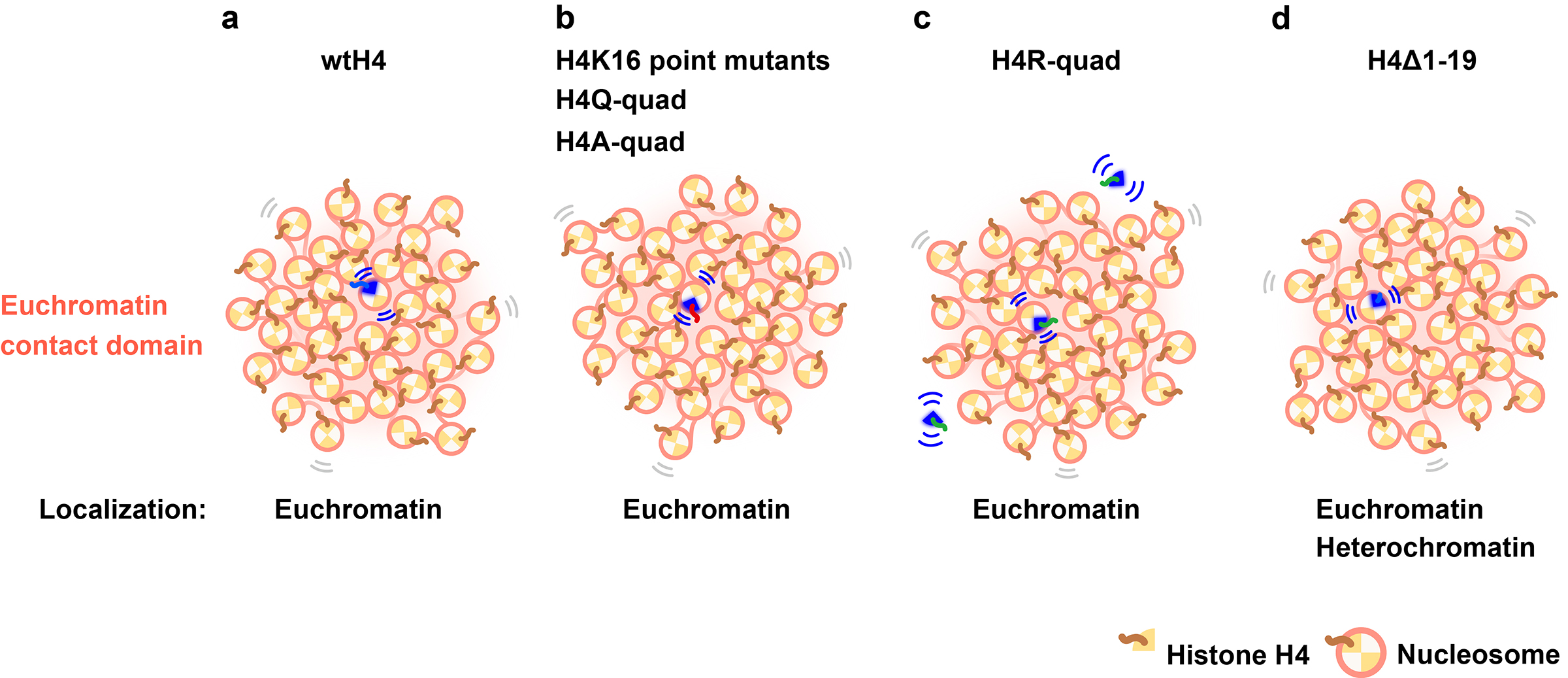
図:(a) 異所的に発現した野生型wtH4-Haloはユークロマチンのコンタクトドメインに局在し、H4テールを介して隣接するヌクレオソームと相互作用している。(b) H4テール上の変異(H4K16の点変異型、H4テールのリジンの四重変異型H4Q-quad、H4A-quad)は、局所的なヌクレオソームの動きには影響しなかった。これは、変異体を含むヌクレオソームが、凝縮したユークロマチンドメインに埋め込まれているためである。H4テール上の変異が隣のヌクレオソームとの相互作用を阻害したとしても、周囲の内在性 (野生型) H4を含む多数のヌクレオソームは、変異体を含むヌクレオソームとの接触を維持することができる。その結果、変異体を含むヌクレオソームの動きは変化しなかったと考えられた。(c) 脱アセチル化模倣型のH4四重変異型H4R-quadはヌクレオソームにあまり取り込まれず、大部分が自由に拡散する(動画参照)。しかし、取り込まれたものはwtH4-Haloと同様の動きを示す。(d)H4テール欠失変異体(H4Δ1-19)はユークロマチンとヘテロクロマチンの両方に取り込まれる。H4Δ1-19を含むヌクレオソームの平均の動きは、主にユークロマチンに局在するwtH4-Haloの平均の動きよりも小さかった。
モデル生物・ミジンコの雌雄が切り替わる要因の一端を明らかに!
性差を示す遺伝子アイソフォームを発見
~将来的なエビ・カニなどへの単性養殖技術の開発・応用に期待~
プレスリリース
Identification of gene isoforms and their switching events between male and female embryos of the parthenogenetic crustacean Daphnia magna
Yasuhiko Kato, Joel H. Nitta, Christelle Alexa Garcia Perez, Nikko Adhitama, Pijar Religia, Atsushi Toyoda, Wataru Iwasaki, Hajime Watanabe
Scientifc Reports (2024) 14, 9407 DOI:10.1038/s41598-024-59774-1
大阪大学大学院工学研究科の加藤泰彦准教授、渡邉肇教授らの研究グループは、情報・システム研究機構国立遺伝学研究所の豊田敦特任教授、東京大学新領域創成科学研究科のニッタ ジョエル特任助教(現在千葉大学国際学術研究院・准教授)、岩崎渉教授との共同研究において、環境に応じて雌雄を生み分けるミジンコの転写産物をロングリードシーケンス法により解析し、各遺伝子のアイソフォームの多様性、またその性差を明らかにしました。
これまでミジンコの遺伝子発現解析は、遺伝子アイソフォーム毎にはなされてきませんでしたが、今回の解析では、各遺伝子アイソフォームの全長の配列決定を行いました。結果、解析した遺伝子の半数以上が複数のアイソフォームを合成することを見出しました。さらに、遺伝子によっては性差を示すアイソフォームを発現していることを突き止めました。本研究で新たに見出されたアイソフォームの機能解析を行うことで、ミジンコが環境に応じて雌雄を切り替えられる機構の解明に迫ることが期待されます。
なお、本研究は、JSPS 科学研究費 基盤研究(B) 21H03602、挑戦的研究(萌芽) 21K19298の助成、文部科学省 学術変革領域研究(A)「非ドメイン型バイオポリマーの生物学:生物の柔軟な機能獲得戦略」(領域代表:中川真一)22H05598、 学術変革領域研究(A)「性スペクトラム – 連続する表現型としての雌雄」(領域代表:立花誠)20H04923、18H04884の助成、及び「先進ゲノム支援(PAGS)」16H06279の支援を受けて行われました。
本研究成果は、英国科学誌「Scientific Reports」に、4月30日(火)に公開されました。
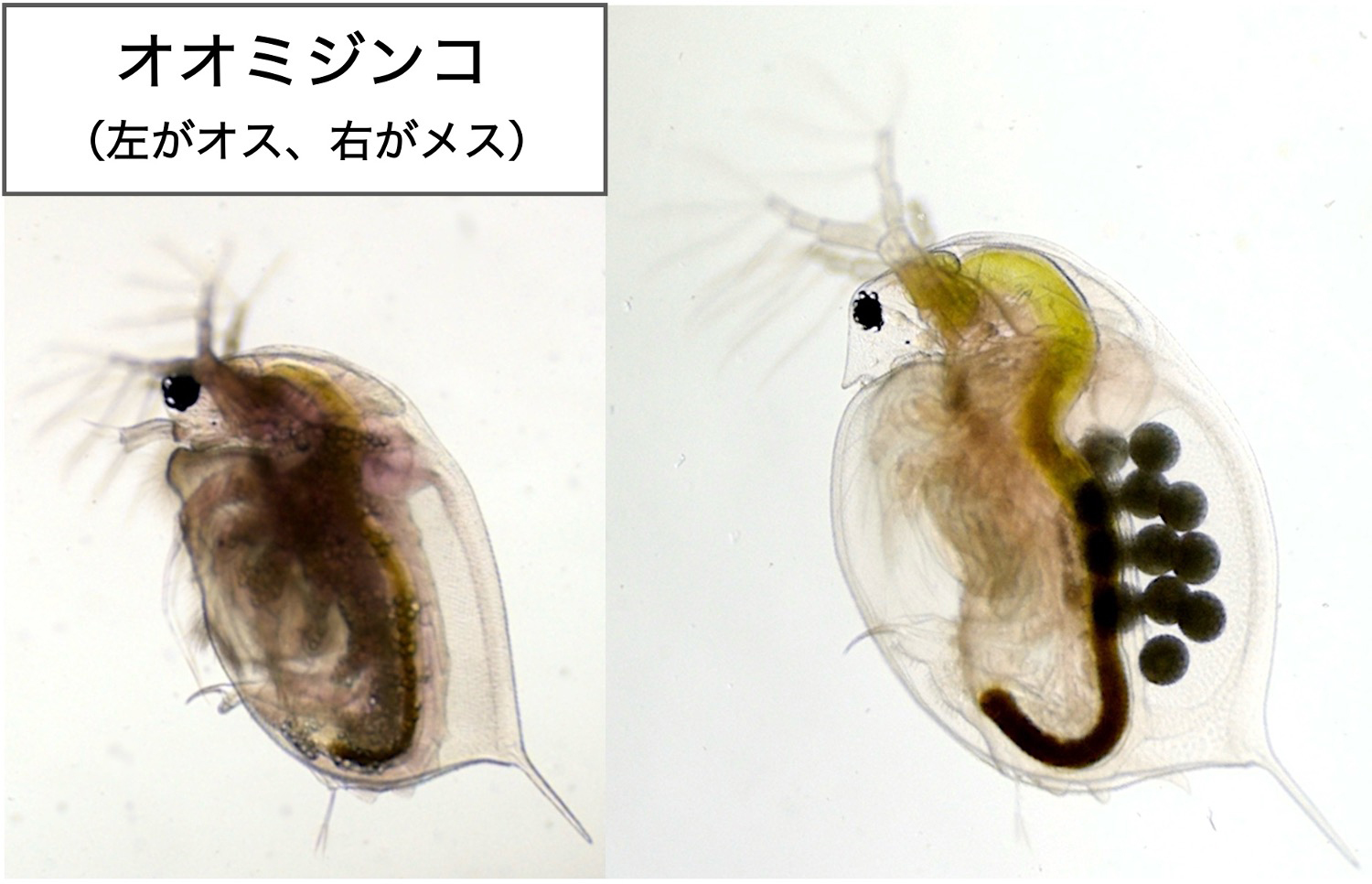
図: 環境に応じて雌雄を生み分けるミジンコ
「下水サーベイランスにより従来の疫学調査で未確認だった新型コロナウイルス変異株を検知」の事業成果を公表
プレスリリース
ヴェオリア・ジェネッツ株式会社、浜松ウォーターシンフォニー株式会社、株式会社AdvanSentinel、浜松市、金沢大学、情報・システム研究機構(国立遺伝学研究所、データサイエンス共同利用基盤施設)、新潟大学による合同チームは、高感度RNA/DNA解析手法を用いた「下水サーベイランス)」によって、新型コロナウイルス変異株を同定し、臨床検体によるゲノム疫学調査で未確認だった新型コロナウイルス変異株の浜松市への流入があったことを明らかにしました。
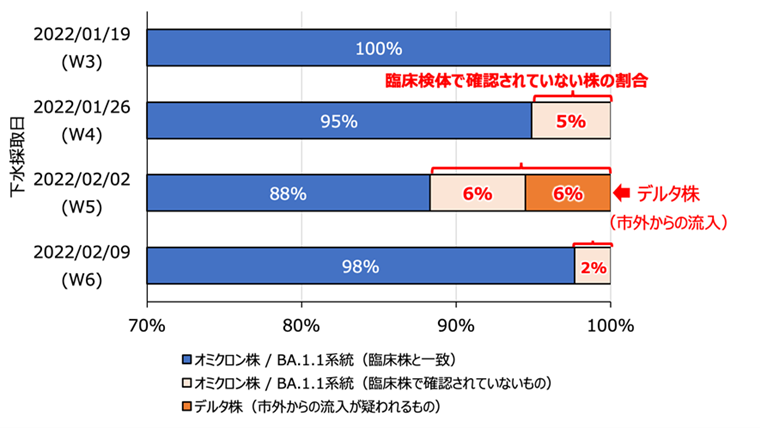
図: 下水サーベイランスによるゲノム疫学調査に基づく浜松市における変異株の割合。同一配列が1万以上カウントされたアンプリコン配列のみを解析対象とした。
神経回路構築研究室 テクニカルスタッフ募集
国立遺伝学研究所の神経回路構築研究室では、マウスを用いた脳科学研究をサポートしていただけるテクニカルスタッフを下記の内容にて募集いたします。
| 【募集人数】 | 1名 |
| 【勤務地】 | 国立遺伝学研究所(静岡県三島市谷田1111) |
| 【契約期間】 | 年度ごと。更新可(「国⽴遺伝学研究所特定有期雇⽤職員等の契約更新に関する判断基準 」に基づく) |
| 【職務内容】 | ・マウス飼育管理の補助 ・生物学実験の補助(動物実験、組織切片作製、PCR等) ・その他、研究室内の研究補助業務 |
| 【応募資格】 | ・協調性と責任感があり、丁寧にてきぱきと仕事ができる方。 ・未経験者可(新しいことを学ぶ意欲のある方)。 ・自宅でのげっ歯類、ウサギ類飼育不可。動物アレルギーの無い方。 |
| 【採用時期】 | 採用決定以降のできるだけ早い時期(応相談) |
| 【勤務形態】 | ・週30時間:月~金、10:00~17:00(休憩1時間)(応相談) ・休日:土日、祝祭日、夏季休暇、年末年始等 ※ 動物飼育管理上、休日勤務をお願いすることがあります。 |
| 【給与・待遇】 | ・研究所の給与規定に準じます(時給1,013 円~1,300円) ・健康保険、年金、雇用保険、労災保険に加入。通勤手当(条件による)。 ・車通勤可 |
| 【応募書類】 | ・履歴書(写真貼付、メールアドレス、及び、日中の電話番号明記) ・自己アピール文(職務経歴書等) |
| 【応募書類提出】 | ・メール添付にて、岩里(
)にお送りください。 ・メールタイトルは「テクニカルスタッフ応募」でお願いします。 |
| 【応募締切】 | 適任者が決まり次第。 |
| 【選考方法】 | 書類選考通過者のみ面接を行います。(面接日時はメール又は電話にて連絡) |
| 【備考】 | ・問い合わせは、岩里(教授:
)、又は、佐藤(研究室事務:
, 055-981-6774)までお願いします。 ・研究室に関しては(https://iwasato-lab.sakura.ne.jp/)をご覧ください。 ・応募書類は、情報・システム研究機構個人情報保護規定に則り厳重に管理、採用審査の用途に限り使用し、本募集の終了とともに採用者の分を除き責任を持って破棄いたします。 |
タイムラプス撮影で胚の細胞分裂の謎を解明
Ran-GTP assembles a specialized spindle structure for accurate chromosome segregation in medaka early embryos
Ai Kiyomitsu, Toshiya Nishimura, Shiang Jyi Hwang, Satoshi Ansai, Masato T. Kanemaki, Minoru Tanaka & Tomomi Kiyomitsu
Nature Communications (2024) 15, 981 DOI:10.1038/s41467-024-45251-w
メダカ、CRISPR、最新のイメージング技術を用い、生命の初期段階における細胞分裂の研究で新たな基準を打ち立てました。
生命の誕生は謎に包まれています。有糸分裂の複雑な動態は、いわゆる体細胞(皮膚細胞や筋肉細胞のような特殊な機能を持つ細胞)ではよく研究されていますが、私たちの体の最初の細胞である胚細胞に関しては、いまだ解明されていません。脊椎動物における胚性有糸分裂の研究は困難であることが知られています。というのも、ライブイメージングでの機能解析が技術的に限られており、胚形成中の細胞を追跡することが難しいからです。
このほど、沖縄科学技術大学院大学(OIST)の細胞分裂動態ユニットの研究チームは、名古屋大学(現北海道大学)の西村俊哉助教、名古屋大学の田中実教授、東北大学(現京都大学)の安齋賢特定准教授、国立遺伝学研究所の鐘巻将人教授らと共に、学術誌『ネイチャーコミュニケーションズ』に論文を発表しました。本研究は、新しいイメージング技術、CRISPR/Cas9ゲノム編集技術、最新のタンパク質ノックダウンシステム、そしてモデル生物としてミナミメダカ(Oryzias latipes)を用いることによって、胚性有糸分裂の解明のための、最初の大きな一歩となりました。研究チームが作成したタイムラプスは、胚で染色体が均等に分かれる複雑なプロセスについての根本的な理解に役立つとともに科学的探求の次のフロンティアにつながります。本研究の責任著者である清光智美准教授は、タイムラプスについて次のように語っています。「タイムラプスの画像自体も美しいのですが、胚の有糸分裂の解明につながる新たな基礎を築いた点も評価できます。」
胚性有糸分裂の主な謎は、細胞のすべての遺伝情報を保持する染色体が整列し、娘細胞に均等分配されるという重要なステップにあります。このプロセスの鍵を握るのが有糸分裂の紡錘体です。紡錘体は微小管(細胞内の構造形成と輸送に使われる長いタンパク質繊維)でできており、紡錘体の両極から放射状に伸び、中央で染色体に接着します。紡錘体は複製された染色体を適切に捕らえ、分裂の際に娘細胞に均等に分配します。紡錘体の形成を決定する因子は数多くありますが、その一つにRan-GTPというタンパク質があります。Ran-GTPは、中心体(微小管を組み立てる役割を担う細胞小器官)を持たない女性の生殖細胞の分裂では必須の役割を果たしますが、中心体を持つ小さな体細胞では必須ではありません。しかし、Ran-GTPが脊椎動物の初期胚の紡錘体形成に必要であるかどうかは長い間不明でした。脊椎動物の初期胚には中心体がありますが、細胞サイズが大きいなどの特徴があります。
哺乳類の初期胚とは対照的に、魚類の胚細胞は透明で、均一な単細胞層で同時に分裂し、発生を進行するため、観察が極めて容易です。ミナミメダカは適応できる温度範囲が広く、毎日卵を産み、比較的小さなゲノムを持つため、研究に特に適した魚であることが分かりました。温度耐性があるということは、ミナミメダカの胚細胞は室温でも生存できるということであり、長時間生きたままでのタイムラプス撮影に特に適しています。
メダカは頻繁に卵を産み、ゲノムサイズが比較的小さいことから、CRISPR/Cas9を用いたゲノム編集に適しています。このゲノム編集の技術を用いて、実際に胚の有糸分裂に関与する特定のタンパク質の動態を可視化する遺伝子組み換えメダカを作り出しました。
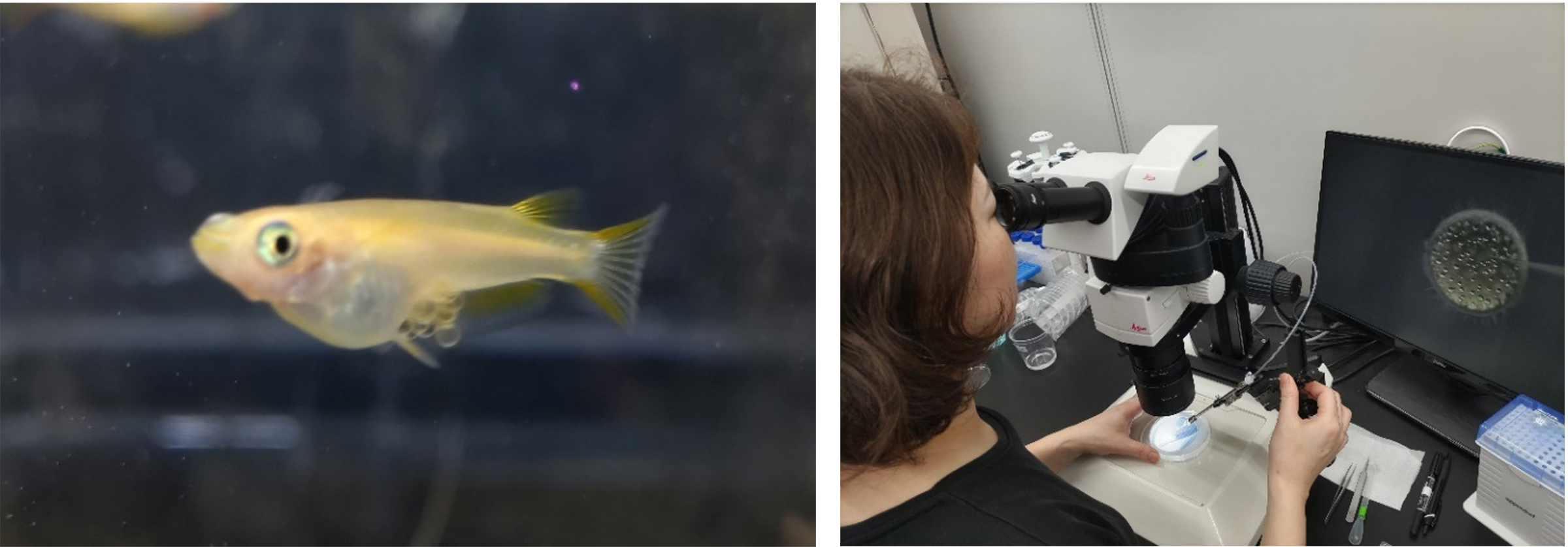
図:(左)卵を抱えたメダカ。(右)論文の筆頭著者である細胞分裂動態ユニットの清光愛博士が、CRISPR/Cas9を用いたゲノム編集プロセスの一環として、メダカ胚にRNAを注入する様子。写真提供:清光智美(OIST)
遺伝子組み換えメダカの胚で、分裂中の有糸分裂紡錘体をタイムラプス観察したところ、大きな初期胚は体細胞紡錘体とは異なる独自の紡錘体を組み立てていることを発見しました。また、初期胚の分裂ではRan-GTPが紡錘体形成に決定的な役割を果たしますが、後期胚ではあまり重要ではありません。これは、発生の過程で細胞が小さくなるにつれ、紡錘体構造がリモデリングされるためと考えられますが、正確な理由については、さらなる研究が必要です。
研究チームはまた、ほとんどの体細胞に特徴的な、染色体が分離前に正しく整列するときの紡錘体チェックポイントが、初期胚細胞には存在しないことも発見しました。清光准教授は「チェックポイントが活性化していないにもかかわらず、染色体の分離は非常に正確なのです。これは、胚細胞が非常に速く分裂する必要があることで説明できるかもしれませんが、さらに研究を進める必要があります」と話します。
メダカの遺伝子組み換えと初期胚の研究は、胚性有糸分裂に関する新たな知見につながりましたが、清光准教授と研究チームにとって、これはほんの始まりに過ぎません。後期段階におけるRan-GTPの役割の減少や、紡錘体形成チェックポイントの欠落に関する疑問に加えて、清光准教授はタイムラプスにおける細胞分裂の対称性の面白さを指摘します。「紡錘体の形成は高度な対称性を特徴としています。細胞は等しい大きさになるように、かつ規則的な方向に分裂しているように見え、紡錘体は一貫して細胞の中心にあります。紡錘体はどのようにして規則正しく配向し、どのようにして毎回、細胞の中心を見つけることができるのでしょうか?」
タイムラプスだけでなく、研究チームは、胚細胞研究のモデルとなる遺伝子組み換えメダカの種類を増やし、この新しい基盤をさらに強固なものにすると同時に、ゲノム編集プロセスを最適化したいと考えています。最終的には、他の生物においても胚性有糸分裂を研究することで、今回の発見が一般化可能かどうかを検証し、次の段階では、紡錘体形成と胚分裂の進化を探求することで、ヒトの胚発生をより深く理解し、ヒト不妊症の診断・治療法の開発にも貢献したいと考えています。
「この論文で、確かな基礎が築けました」と清光准教授は総括します。「と同時に、新たなフロンティアも開かれました。胚性有糸分裂は美しく、神秘的で、研究しがいのあるものです。私たちの研究によって、生命の始まりの複雑なプロセスの理解に少しでも近づけることを願っています。」

本研究に携わった3人。遺伝子組み換えメダカの入った水槽の前で。(左から右へ) OISTの清光愛博士、京都大学(元東北大学)の安齋賢特定准教授、OISTの清光智美准教授。写真提供:清光智美(OIST)
ヤマアラシ亜目における嗅覚・フェロモン・味覚受容体遺伝子の同調的進化
~グルメな動物は鼻も良い!?~
(西アフリカで食用にされている大型げっ歯類グラスカッターの全ゲノムを解読)
プレスリリース
Synchronized expansion and contraction of olfactory, vomeronasal, and taste receptor gene families in hystricomorph rodents
Yoshihito Niimura*, Bhim B. Biswa, Takushi Kishida, Atsushi Toyoda, Kazumichi Fujiwara, Masato Ito, Kazushige Touhara, Miho Inoue-Murayama, Scott H. Jenkins, Christopher Adenyo, Boniface B. Kayang, Tsuyoshi Koide*
*共同責任著者
Molecular Biology and Evolution Mol. Biol. Evol. (2024) 41, msae071 DOI:10.1093/molbev/msae071
宮崎大学農学部獣医学科新村芳人教授、国立遺伝学研究所小出剛准教授・豊田敦特任教授、ふじのくに地球環境史ミュージアム岸田拓士准教授(研究当時。現在は日本大学生物資源科学部教授)、京都大学野生動物研究センター村山美穂教授らは、ガーナ大学との共同研究として、嗅覚・フェロモン・味覚の受容体遺伝子は、進化の過程で、同調的に増えたり減ったりしていることを示しました。
霊長類は、高度な視覚をもつ反面、嗅覚はあまり発達していません。また、ハクジラ類(イルカ)では、嗅覚や味覚は退化していますが、音波で外界を探索する反響定位の能力を進化させてきました。限られたエネルギーを異なる感覚系に振り分けなければならないため、「感覚のトレード・オフ」が起きると考えられています。しかしながら、異なる化学感覚―嗅覚・フェロモン・味覚―間でトレード・オフが起きるかどうかは、よくわかっていませんでした。ヤマアラシ亜目の進化系統樹(図1)の各枝において、遺伝子の重複・欠失がそれぞれ何回起きたかを分子進化学的な手法によって推定しました。解析の結果、ヤマアラシ亜目の系統樹の各枝で起きた重複(または欠失)数が、4種の化学感覚受容体遺伝子間で正の相関があることが分かりました(図2)。つまり、進化の過程において、ある生物の系統で、嗅覚受容体遺伝子の数が増える(減る)と、同時にフェロモンや味覚の受容体遺伝子の数も増える(減る)ということです。このことから、化学感覚間では感覚のトレード・オフは起きず、化学感覚受容体遺伝子は同調して増えたり減ったりしていることが示されました。
また、本研究ではグラスカッターのゲノムを高精度で解読し、新たにゲノム情報のウェブブラウザを作成しました(https://grasscutter.nig.ac.jp/)(図3)。グラスカッターは西アフリカ地域で食用に好まれている大型齧歯類です。現在、ガーナ大学においてグラスカッターの家畜化プロジェクトを進めており、本成果を家畜化の推進に活用されることが期待されます。
本研究は、新村芳人教授に対する科学研究費助成事業(18K06359および22K06341)および小出剛准教授に対する科学研究費助成事業(19KK0177)、その他、科学技術振興機構 持続可能開発目標達成支援事業aXis(JPMJAS2017)、国立遺伝学研究所共同研究NIG-JOINT(1B2020) 、村山美穂教授に対する味の素ファンデーション「食と栄養」国際支援プログラムの支援を受けて実施されました。
本研究結果は、2024年4月23日に「Molecular Biology and Evolution」に掲載されました。
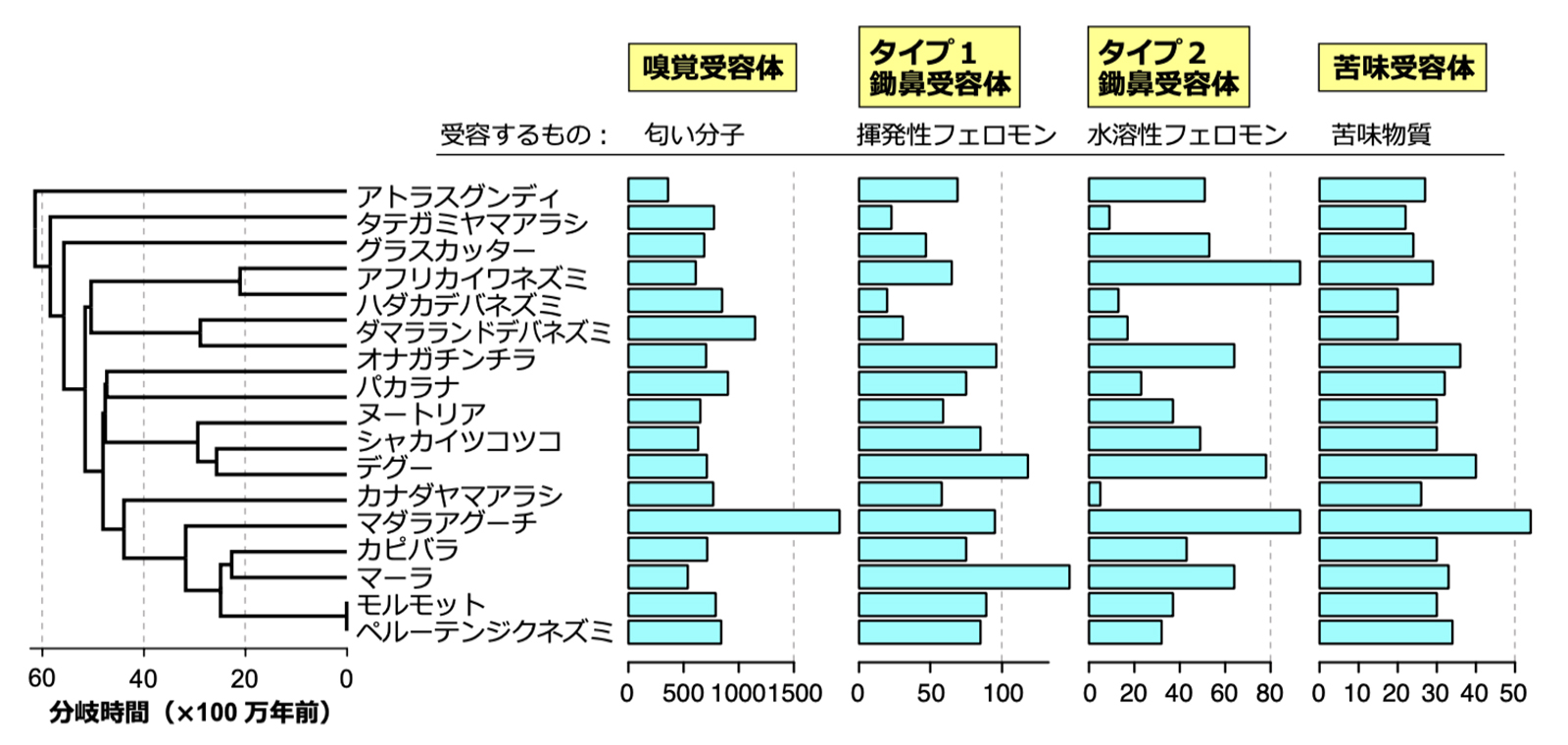
図1: 17種のヤマアラシ亜目のもつ4種の化学感覚受容体遺伝子の数
種名の左側に、17種のヤマアラシ亜目の系統樹と分岐年代を示した。
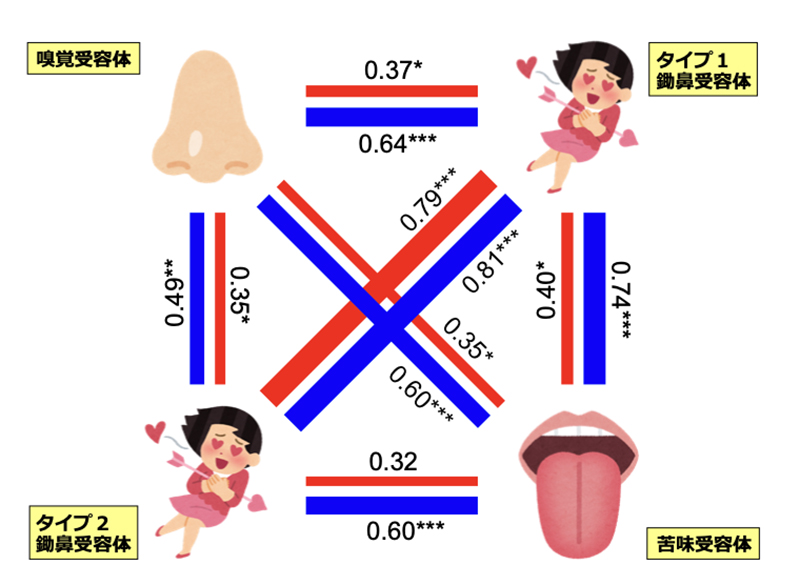
図2: ヤマアラシ亜目の進化過程における、4種の化学感覚受容体遺伝子の増減の相関
赤線は遺伝子数の増加、青線は遺伝子数の減少に対する相関を示す。線の近くにある数値は相関係数を表す(*, **, ***はそれぞれ有意水準5%, 1%, 0.1%で有意)。
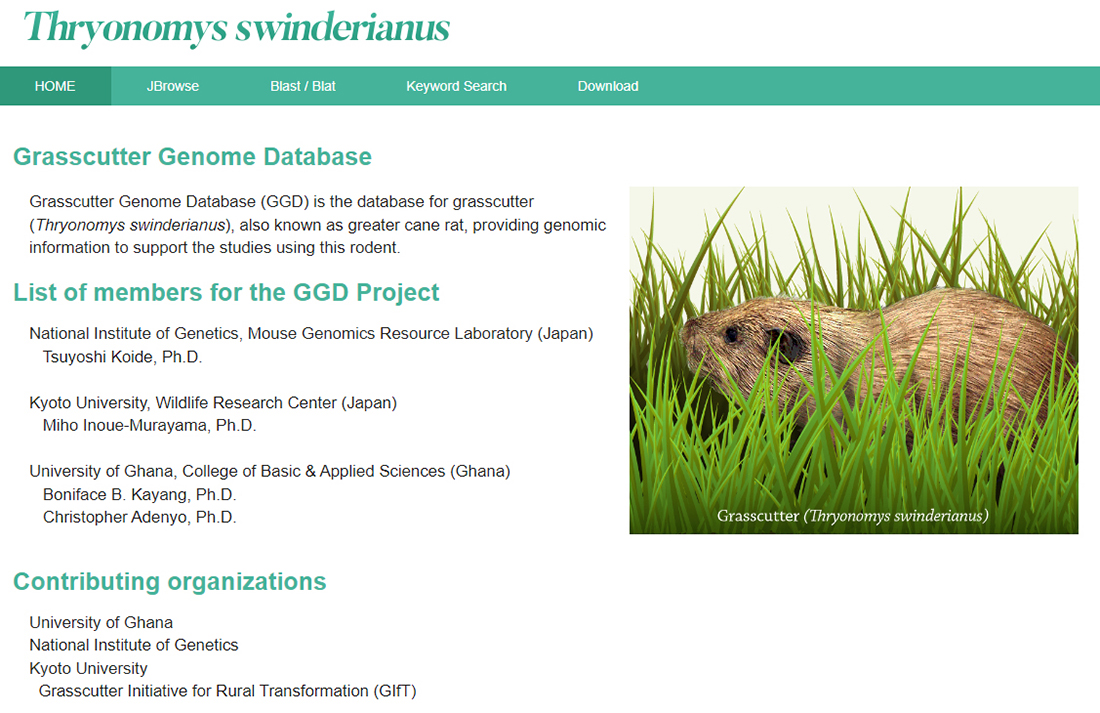
図3: 新たに作成したグラスカッターのゲノムウェブブラウザ
iPS細胞を利用したEYS関連網膜色素変性の病態解明
-視細胞変性への光暴露の関与が明らかに-
プレスリリース
Phototoxicity avoidance is a potential therapeutic approach for retinal dystrophy caused by EYS dysfunction
Yuki Otsuka, Keiko Imamura, Akio Oishi, Kazuhide Asakawa, Takayuki Kondo, Risako Nakai, Mika Suga, Ikuyo Inoue, Yukako Sagara, Kayoko Tsukita, Kaori Teranaka, Yu Nishimura, Akira Watanabe, Kazuhiro Umeyama, Nanako Okushima, Kohnosuke Mitani, Hiroshi Nagashima, Koichi Kawakami, Keiko Muguruma, Akitaka Tsujikawa, Haruhisa Inoue
JCI Insight. (2024) 9, e174179 DOI:10.1172/jci.insight.174179
理化学研究所(理研)バイオリソース研究センターiPS創薬基盤開発チームの大塚悠生研修生(京都大学大学院医学研究科眼科学講座大学院生(いずれも研究当時))、今村恵子客員研究員(京都大学iPS細胞研究所特定拠点講師)、井上治久チームリーダー(京都大学iPS細胞研究所教授)、関西医科大学医学部iPS・幹細胞応用医学講座の六車恵子教授、京都大学大学院医学研究科眼科学講座の辻川明孝教授、国立遺伝学研究所発生遺伝学研究室の川上浩一教授、埼玉医科大学医学部ゲノム応用医学の三谷幸之介教授らの共同研究グループは、患者由来の人工多能性幹細胞(iPS細胞)から3次元網膜オルガノイドを作製およびゼブラフィッシュeys変異を作製して解析することにより、光刺激による視細胞の細胞死がEYS関連網膜変性疾患の病態に重要な役割を果たしていることを発見しました。
本研究成果は、未知であったEYS関連網膜変性疾患の病態メカニズムを明らかにするとともに、特定の波長光への暴露を遮断することが治療の選択肢の一つになる可能性を示唆しています。
日本を含む多くの国では、遺伝性網膜変性疾患(Inherited retinal dystrophies:IRD)の最も多い原因としてEyes shut homolog(EYS)遺伝子の変異が知られています。ただし、EYSはマウス、ラットなどにおいては喪失しており、哺乳類における研究モデルがないという課題がありました。
今回、共同研究グループは、健常者と網膜変性疾患患者それぞれのiPS細胞から網膜オルガノイドを作製し、病態解析を行いました。健常者由来オルガノイドの視細胞においてEYSタンパク質は結合線毛や外節[6]領域に局在していたのに対し、患者由来オルガノイドではこれらの領域での局在量が低下し、細胞質内に局在異常を生じていました。EYSは視細胞外節で働くタンパクの一つであるG-protein-coupled receptor kinase(GRK7)という分子と直接結合し、その外節への輸送に関与していることを発見し、患者由来オルガノイドでは外節へのGRK7の輸送量が低下していることを見いだしました。また、患者由来オルガノイドでは光刺激後に視細胞の細胞死が誘導されることが分かりました。さらに、ゼブラフィッシュeys遺伝子変異体を作製し解析を行い、ゼブラフィッシュモデルにおいても光刺激により視細胞の細胞死が誘導されることを明らかにしました。
本研究の一部は、国立研究開発法人日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療研究中核拠点(課題番号JP23bm1323001)の助成により行われました。また、本研究には理研バイオリソース研究センターから提供されたバイオリソース(ヒトiPS細胞株HPS3920、HPS5234、HPS3933、HPS3927、HPS0063、HPS1042)が使⽤されました。
本研究は、科学雑誌『JCI Insight』オンライン版(4月22日付:日本時間4月23日)に掲載されました。
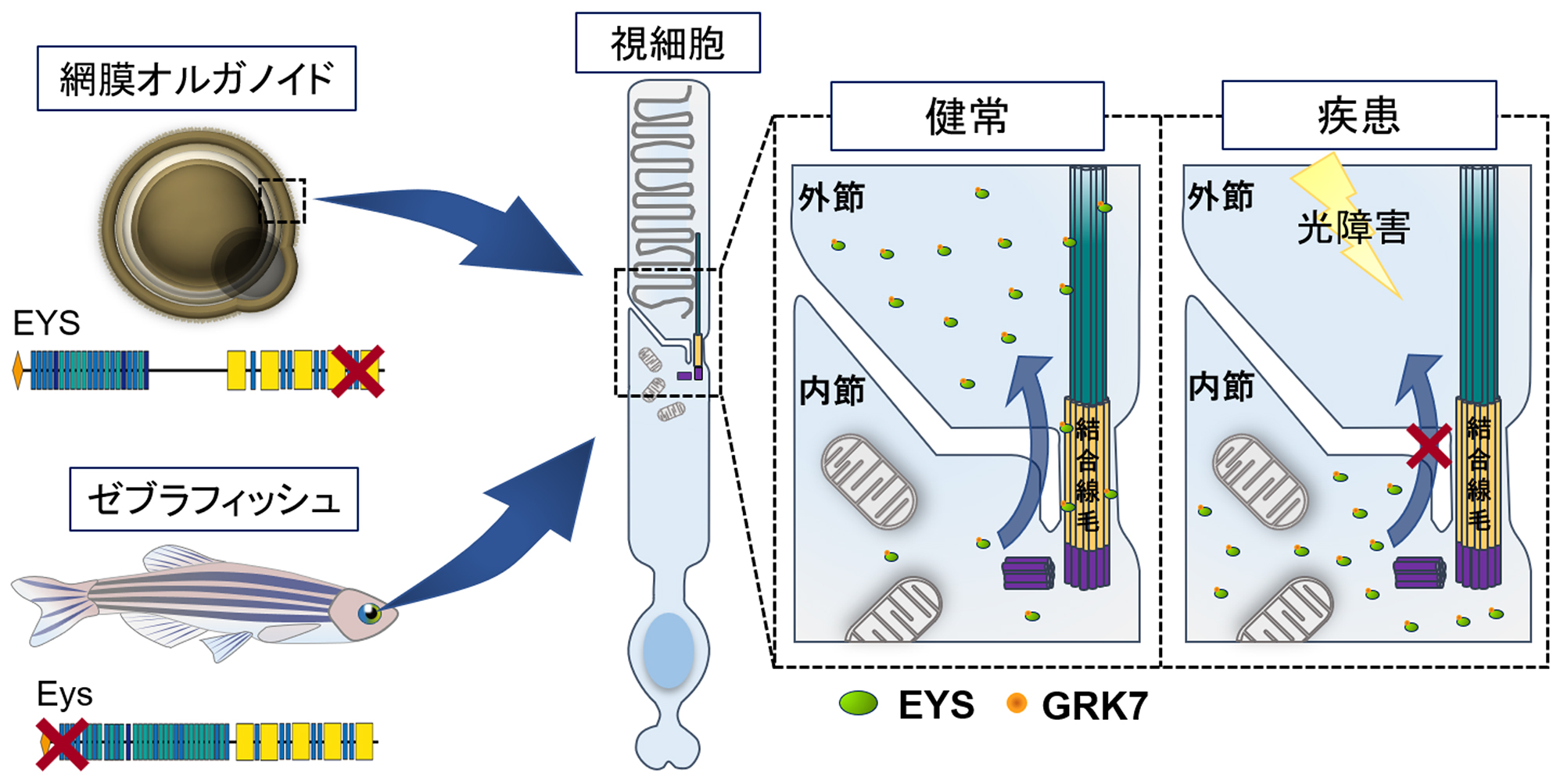
図: 本研究に基づくEYS関連網膜変性疾患の病態の概略図
東アジアのハツカネズミが明かす進化の秘密
~亜種間交雑によるゲノム進化のメカニズムを解明~
プレスリリース
Inference of selective force on house mouse genomes during secondary contact in East Asia
Kazumichi Fujiwara, Shunpei Kubo, Toshinori Endo, Toyoyuki Takada, Toshihiko Shiroishi, Hitoshi Suzuki, Naoki Osada
Genome Research 2024 April 18 DOI:10.1101/gr.278828.123
北海道大学大学院情報科学研究院の長田直樹准教授、国立遺伝学研究所の藤原一道特任研究員(同大学大学院情報科学院博士後期課程(研究当時))、理化学研究所バイオリソース研究センターの高田豊行開発研究員、城石俊彦センター長らの研究グループは、北海道大学大学院地球環境科学研究院などとの共同研究により、日本列島や中国などの東アジア地域から集められた野生ハツカネズミの全ゲノム配列を多数決定し、東アジアにおける野生ハツカネズミの遺伝的多様性とその進化の歴史を明らかにしました。
人類の活動により世界中に広がったハツカネズミは、南アジア周辺に起源をもち、三つの主要な亜種に分類されます。これらの亜種は、人類とともにそれぞれ別の経路を通って世界中に拡散し、その後、亜種集団同士の二次的接触を起こしました。今回の解析では、日本列島及び中国南部で広く亜種間雑種が形成されていることが示されました。また、二つの亜種が異所的に分布しているにもかかわらず、一方の亜種がもつ特定の型のY染色体が東アジア全体に急速に広まったことが示されました。そのメカニズムとして、X染色体とY染色体の対立による性比のゆがみが原因であるという仮説が立てられました。さらに、日本のハツカネズミにおける遺伝的構造は、免疫関連遺伝子や嗅覚受容体/フェロモン受容体遺伝子を含む特定の領域で一方の亜種からの影響を強く受けており、これが雑種ゲノムにはたらく自然選択や性選択によるものであることが示されました。
本研究では、ハツカネズミが人間の活動を通じてどのように遺伝的特徴を形成し、亜種間での遺伝的混合がどのように進行しているのかについて、新たな見解を提示しました。野生ハツカネズミのゲノム解析は、人間と密接に関連する他の生物種の進化を理解する上での重要な手掛かりとなることが期待されます。
本研究は、文部科学省新学術領域(複合領域)「ヤポネシアゲノム」及び学術変革領域(A)「統合生物考古学」の助成を受けたものです。
なお、本研究成果は、2024年4月19日(金)公開のGenome Research誌に掲載されました。
遺伝研の貢献
マウス開発研究室(小出研究室)の藤原一道特任研究員は、北海道大学の長田直樹准教授、理化学研究所バイオリソース研究センターの城石俊彦センター長、高田豊行開発研究員と協力し、主に東アジアで捕獲された野生のハツカネズミの全ゲノム配列を解読しました。
この研究に使用された野生ハツカネズミのサンプルの多くは、国立遺伝学研究所の故・森脇和郎名誉教授が世界中で収集した「森脇バッテリー」からのものです。以前はこの収集サンプルについて、ミトコンドリアDNAの一部を対象にした研究を行っていましたが、今回の研究では全ゲノムの解読により、より深い遺伝学的分析が可能となりました。さらに、Y染色体の遺伝学的分析を通じて、あるハツカネズミの亜種のY染色体が東アジアで急速に広がったことや、亜種間の雑種が形成される過程で自然選択や性選択が重要な役割を果たしていることが示唆されました。
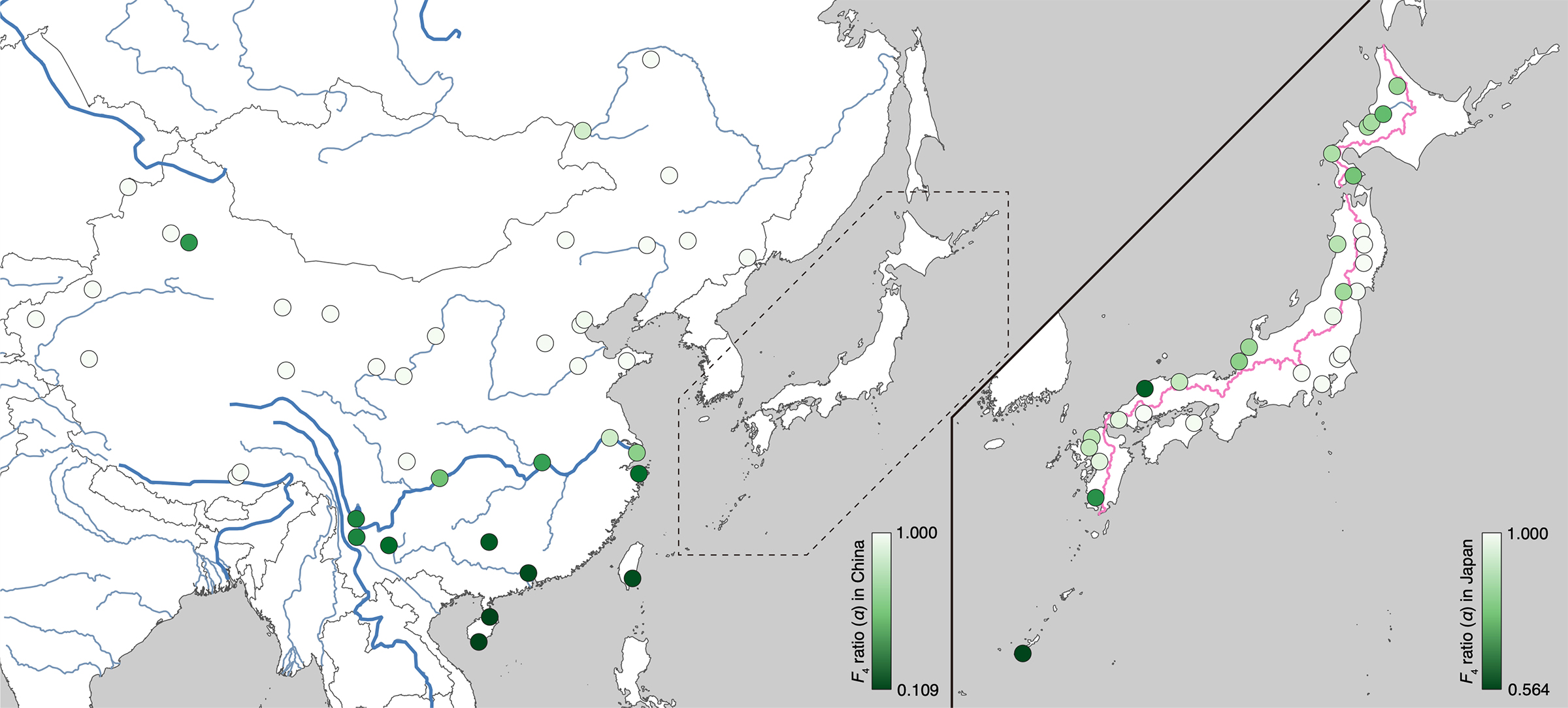
図: 全ゲノム解析を用いて可視化した、東アジア地域のハツカネズミの遺伝的多様性。緑色が南方由来であるcastaneus亜種の遺伝的成分の強さを表している。