Archive
- Home
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
精子形成の新しいメカニズムを解明
〜tRNAの化学修飾が鍵〜
プレスリリース
Mettl1-dependent m7G tRNA modification is essential for maintaining spermatogenesis and fertility in Drosophila melanogaster
Shunya Kaneko, Keita Miyoshi, Kotaro Tomuro, Makoto Terauchi, Ryoya Tanaka, Shu Kondo, Naoki Tani, Kei-Ichiro Ishiguro, Atsushi Toyoda, Azusa Kamikouchi, Hideki Noguchi, Shintaro Iwasaki, and Kuniaki Saito
Nature Communications (2024) 15, 8147 DOI:10.1038/s41467-024-52389-0
tRNAの化学修飾は特定の酵素により決まった位置のヌクレオチドに導かれることで、tRNAの機能を制御し、正常なタンパク質合成を実現します。本研究では、ショウジョウバエ個体においてRNA修飾酵素Mettl1(Methyltransferase-like 1)がm7G46(tRNA 46位のN7-メチルグアノシン)という化学修飾を特定のtRNAに導くことで精子形成に必要なタンパク質の合成を進める新たなメカニズムを発見しました。
情報・システム研究機構 国立遺伝学研究所の金子隼也 総合研究大学院大学 大学院生(現 国立遺伝学研究所 特任研究員)、三好啓太 助教、近藤周 助教(現 東京理科大学 准教授)、齋藤都暁 教授らの研究グループは戸室幸太郎 大学院生リサーチアソシエイト(理化学研究所 開発研究本部 岩崎RNAシステム生化学研究室)、岩崎信太郎 主任研究員(理化学研究所 開発研究本部 岩崎RNAシステム生化学研究室)らの研究グループと共同で、m7G46修飾を持たないショウジョウバエの変異体を用いて、精巣でのタンパク質合成をリボソームプロファイリングという手法を駆使して測定しました。その結果、m7G46が失われると、雄性の配偶子である精子形成において重要な遺伝子のタンパク質合成が止まり、精子形成が破綻してしまうことを発見しました。(図)
tRNA修飾の異常はがん、脳・神経疾患、などの原因となることが報告されており、m7G46もその例外ではありません。本研究は、m7G46の異常が引き起こす病気の理解に貢献することが期待されます。
本研究成果は、情報システム研究機構 国立遺伝学研究所・無脊椎動物遺伝研究室(金子隼也 総研大大学院生[現 国立遺伝学研究所 特任研究員]、三好啓太 助教、近藤周 助教 [現 東京理科大学 准教授]、齋藤都暁 教授)、理化学研究所 開発研究本部 岩崎RNAシステム生化学研究室(戸室幸太郎 大学院生リサーチアソシエイト、岩崎信太郎 主任研究員)との共同研究成果です。
本研究は、日本学術振興会(JSPS)科研費(JP18H02379, JP16H06279, JP23H02415, JP22H02669)、武田科学振興財団、山田科学財団、内藤科学技術財団、上原記念財団、AMED(JP20gm1410001)、熊本大学発達医療研究センター、及び、高深度オミクス共同利用・共同研究拠点(IMEG)のプログラムにより支援されました。
本研究は、2024年9月24日に「Nature Communications」にオープンアクセスとしてオンライン出版されました。
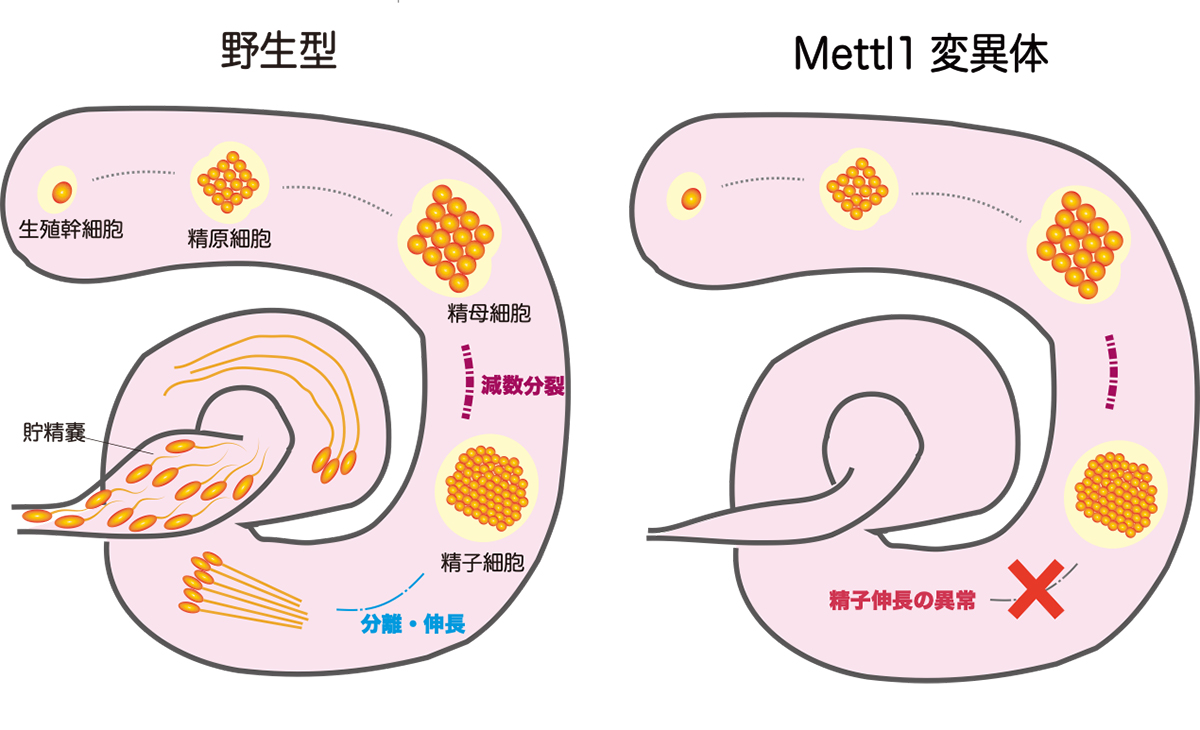
図: キイロショウジョウバエの精巣では生殖幹細胞が4回の有糸分裂を経て精原細胞となったのち、精母細胞が作られる。精母細胞は2回の減数分裂を繰り返して精子細胞となり、分離、伸長の過程を経て成熟した精子となる。作られた精子は貯精嚢に蓄えられている(野生型 左図)。一方でMettl1変異体では、精巣内で精子細胞の存在は確認されたものの、分離、伸長した精子細胞は見られなかった(Mettl1変異体 右図)。これは、精子の分離、伸長に関連するタンパク質が合成されなくなったことによるものであると考えられる。
総研大生 Biswa, Bhim Bahadurさんが森島奨励賞を受賞

総合研究大学院大学 遺伝学コースが独自に行っている「森島奨励賞」の選考が、2024年度前期の学位出願者に対して行われ、マウス開発研究室 小出研究室に所属するBiswa, Bhim Bahadurさんが受賞しました。
・Biswa, Bhim Bahadur(マウス開発研究室 小出研究室)
「Role of gut bacteria in domestication of mice」
授与式が2024年9月10日に行われ、花岡所長から賞状と研究奨励金が贈られました。
▶ 森島奨励賞とは
総研大遺伝学専攻で優秀な研究成果を発表して学位を取得した学生に、その研究内容を称えるとともに今後のさらなる発展を促す目的で贈られます。
▶ 遺伝学の先達
動植物において雑種異常を引き起こす原因遺伝子を網羅的に分析
Causative genes of intrinsic hybrid incompatibility in animals and plants: What we have learned about speciation from the molecular perspective
Kitano, J. and Okude, G.
Evolutionary Journal of the Linnean Society (2024), kzae022 DOI:10.1093/evolinnean/kzae022
生態遺伝学研究室の北野潤教授と奥出絃太研究員は、これまでに動植物において雑種異常を引き起こすとして報告されている原因遺伝子をリスト化し、どのような傾向がみられるかを調べました。本成果は、リンネ協会発行のEvolutionary Journal of the Linnean Societyの種分化特集号に掲載されました。
雑種異常は、種分化すなわち集団間の遺伝子流動が低下する過程において重要な役割を果たす生殖隔離機構の一つになりえます。これまでに雑種異常を引き起こす遺伝子が複数報告されており、特定の分類群に限った総説はあったものの、雑種異常を引き起こす遺伝子の全貌をまとめた総説はありませんでした。そこで、2024年の8月時点で報告されていた動物23例、植物72例を本総説でリスト化し、どのようなパターンが存在するかについて考察しました。
その結果、動植物に共通してその大半の事例で、個体の適応度とは無関係に同じ個体の別の遺伝領域を出し抜いて増幅あるいは次世代に伝達するような利己的遺伝子の作用(このような現象をゲノムコンフリクトという) が重要であることが示唆されました。
一方で、動植物間には違いもあり、植物では雑種の自己免疫反応による成長異常やミトコンドリアのキメラ遺伝子による雄性不稔の事例が多く報告されていますが、動物ではこれに該当するような明らかな事例はまだ見つかっていません。この動植物間の違いは免疫システムの違いやミトコンドリア遺伝子間の組換えの起こりやすさの違いに起因しているのかもしれません。また、動物ではX染色体に座乗する雑種異常に関与する遺伝子の報告が多数ありましたが、植物ではまだありません。これは、そもそも植物では性染色体をもつ種が少ないことに起因していると思われました。
動物の研究はショウジョウバエ、植物の研究はイネとシロイヌナズナに大きく偏っており、これらを定量的に検証して普遍的なパターンを見出すためには、より多様な分類群、特に野生生物に関するさらなる研究が必要と思われます。そこで、生態遺伝学研究室では、日本産トゲウオをモデルにして、この課題に現在取り組んでいます。
本研究は、科研費・基盤S、JST・CRESTなどの支援を受けて実施しました。
総研大生・大塚碧さんが「First-place Poster Award」を受賞
ゲノムダイナミクス研究室の大塚碧(総研大遺伝学コースD4・SOKENDAI特別研究員) さんが、2024年8月30日-9月1日に台湾・桃園市で開催された「Physical Models of Living Matters – The 3rd Symposium of Physical Biology and Biological Physics」でフラッシュトークとポスター発表をおこない、「First-place Poster Award」を受賞しました。
本シンポジウム参加にあたって、学術変革領域A「ゲノムモダリティ」の若手研究者サポートを受けました。

First-place Poster Awardを受賞した大塚さん
混雑した環境が分裂期染色体の凝縮を促す
~「密度」イメージングによる新たな発見~
プレスリリース
Orientation-Independent-DIC imaging reveals that a rise in depletion attraction contributes to mitotic chromosome condensation
Shiori Iida , Satoru Ide , Sachiko Tamura, Masaki Sasai, Tomomi Tani , Tatsuhiko Goto , *Michael Shribak , *Kazuhiro Maeshima
*責任著者
Proceedings of the National Academy of Sciences (2024) 121(36), e2403153121 DOI:10.1073/pnas.2403153121
細胞が分裂するとき、ゲノムDNAは小さく折りたたまれて「分裂期染色体」という棒状の構造体に凝縮します。この凝縮は、細胞分裂のときに染色体にかかる強い張力によるゲノムDNAの切断を防いでいます。本研究では、分裂期染色体の凝縮を引き起こす新たなメカニズムを発見しました。
情報・システム研究機構 国立遺伝学研究所の飯田史織 総合研究大学院大学 大学院生、 井手聖 助教(現 東京都医学総合研究所 研究員)、田村佐知子 テクニカルスタッフ、前島一博 教授らの研究グループは、米国ウッズホール海洋生物学研究所(MBL) のMichael Shribakシニアサイエンティストと共同で、生きた細胞内の密度(混雑度)を定量できる顕微鏡を用い、分裂期染色体の周辺環境の混雑度の一過的な上昇が分裂期染色体の凝縮に寄与していることを明らかにしました。
細胞内は、タンパク質やRNA、DNAなどの巨大分子が小さな空間に詰め込まれた、非常に混雑した環境です。このような混み合った環境において大きな構造物が集合しやすくなる「枯渇力」は、物理学では古くから知られた現象です。本研究により、細胞が分裂するときに、分裂期染色体の周辺環境の混雑度が上昇すること、またそれによって枯渇力が上昇し、分裂期染色体の凝縮を促進することが明らかになりました(図)。
分裂期染色体が正常に凝縮しないと、ゲノムDNAの切断が誘発され、細胞死や細胞のがん化など、さまざまな異常をもたらし、関連する疾患も知られています。本研究は、このような細胞の異常が起こる仕組みの解明にも貢献することが期待されます。
本研究成果は、情報・システム研究機構 国立遺伝学研究所・ゲノムダイナミクス研究室 (飯田史織 総研大 大学院生[元 SOKENDAI 特別研究員、現 学振特別研究員 DC2]、井手聖 元助教[現 東京都医学総合研究 所ゲノム医学研究センター 外部支援研究員]、田村佐知子 テクニカルスタッフ、前島一博 教授) 、京都大学 (笹井理生 研究員)、産業技術総合研究所(谷知己 研究グループ長)、帯広畜産大学(後藤達彦 准教授)、 米国ウッズホール海洋生物学研究所(MBL)(Michael Shribak シニアサイエンティスト)との共同研究成果です。
本研究は、日本学術振興会(JSPS) 科研費(21H02453, 22H05606, 21H02535, 23K17398, 23KJ0996, 24H00061)、学術変革領域 A「ゲノムモダリティ」(20H05936)、JST 次世代研究者挑戦的研究プログラム (JPMJSP2104)、武田科学振興財団、総研大遺伝学教育コース派遣助成、総研大研究派遣プログラムの支援 を受けました。

図: 細胞分裂前の間期には、核膜が細胞質と核を隔てている。細胞質や核小体の密度は核よりも高い。細胞が分裂する際、核膜や核小体が崩壊することで、細胞質に存在するリボソームなどの大きなタンパク質複合体や細胞小器官が分裂期染色体に接触できるようになる。これによって上昇した枯渇力が、分裂期染色体の凝縮に寄与する。
東海・北陸地区国立大学法人等技術職員合同研修(生物・生命コース)
目 的: 東海・北陸地区の国立大学法人等に所属する技術職員に対し、その職務遂行に必要な専門的な知 識及び技術等を修得させ、技術職員としての資質の向上を図るとともに職員相互の交流に寄与することを目的とする。
主 催: 国立大学協会及び東海・北陸地区国立大学法人等の共催
期 間:令和 6 年 8 月 28 日(水) ~ 令和 6 年 8 月 30 日(金)
会 場:
・国立大学法人 静岡大学(静岡県静岡市大谷 836) 静岡キャンパス 遺伝子実験棟 1 階セミナー室
・大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所(静岡県三島市谷田 1111)研究実験 W 棟
受講者:東海・北陸地区国立大学法人等に勤務する技術職員で、各機関の長が推薦する者とする。
総研大生・丹羽さんが学生口頭発表賞最優秀賞を受賞
分子生命史研究室の丹羽大樹さん(総研大遺伝学コースD5・学振特別研究員)は8月21~24日に開催されました 第26回日本進化学会神奈川大会 にて学生口頭発表賞の最優秀賞を受賞しました。

丹羽大樹さん(右)と工樂教授(左)
柴﨑祥太研究員が研究奨励賞を受賞
理論生態進化研究室の柴﨑祥太特任研究員は2024年の日本数理生物学会 研究奨励賞を受賞しました。
来年の学会において受賞記念講演が行われる予定です。

柴﨑祥太 特任研究員
柴﨑祥太研究員より受賞のコメントが届いておりますのでご紹介します。
この度、日本数理生物学会研究奨励賞を受賞できましたことを、大変光栄に思います。
これまでの受賞者には、研究室のPIである山道先生をはじめ、多くの素晴らしい研究者の方々がいらっしゃいます。
この賞に恥じぬよう、今後も研究に努めてまいります。
動物飼育実験施設 技術補佐員募集
| 【業務内容】 | マウス飼育施設作業員 [マウス飼育器材洗浄、滅菌作業等](変更予定なし) |
| 【応募資格】 | 防疫の為ウサギ、ネズミ、ハムスターをペットにされている方はご遠慮下さい。 |
| 【給与】 | 時給 1,013円~1,300円(経歴による) |
| 【勤務時間】 | (月~金) 9:00~12:00 ※1日3時間程度 |
| 【勤務地】 | 国立遺伝学研究所 動物飼育実験施設(変更の予定なし) |
| 【休日】 | 土・日・祝日 |
| 【待遇】 | 通勤手当(条件による) |
| 【応募】 | まずは、履歴書(写真貼付)を郵送してください。 順次、書類選考の上、追って面接日をご連絡します。 |
| 【応募締め切り】 | 採用者が決まり次第応募を締め切ります。 |
| 【その他】 | 採用人数:1名 勤務開始:令和6年10月~ 未経験者歓迎します。男性活躍中です。 |
【問合先・提出先】〒411-8540 静岡県三島市谷田1111
国立遺伝学研究所 動物飼育実験施設(事務担当/室伏)
ダブルデグロン開発により標的タンパク質の超高効率・超迅速分解に成功
―DNA複製がなくとも分裂期まで細胞周期は進行する―
プレスリリース
Combination of AID2 and BromoTag expands the utility of degron-based protein knockdowns
Yuki Hatoyama*, Moutushi Islam*, Adam G. Bond, Ken-ichiro Hayashi, Alessio Ciulli and Masato T. Kanemaki.
EMBO Reports (2024) Aug 23. DOI:10.1038/s44319-024-00224-4
国立遺伝学研究所・鐘巻将人教授のグループはこれまでに、目的タンパク質の分解除去によりタンパク質機能解析を可能にするオーキシン誘導デグロン(AID)法を開発し、さらに近年改良型AID2法を発表してきました(Nishimura et al., Nat. Meth., 2009; Yesbolatova et al., Nat. Commun., 2020)。しかし、鐘巻グループは一部のタンパク質にはAID2法を用いても分解除去が不十分なケースがあることに気づきました。そこで本研究では、AID2とBromoTagという別のデグロンを組み合わせたダブルデグロン技術を開発し、標的タンパク質の超高効率かつ超迅速な分解除去誘導に成功しました。これにより、従来解析が難しかったタンパク質の機能評価を可能にしました。さらに、AID2とBromoTagにより、二つの標的タンパク質を独立に分解制御できることも示しました。
本研究ではさらに、ダブルデグロン技術の応用例として、DNA複製因子を超高効率分解した結果、DNA複製の完全な抑制に成功し、その際に細胞周期がDNA複製なしに分裂期まで進行することを見出しました。この結果は、細胞はこれまで予想されていたDNAが倍化したかどうかを認識するシステムを持たないことを示唆します。本成果はデグロン技術の拡張性を証明するとともに、DNA複製と細胞周期のより深い関係性の理解につながると期待されます。
本研究は国立遺伝学研究所の鐘巻将人教授の研究グループが中心となり、英ダンディー大学のAlessio Ciulli教授、岡山理科大学の林謙一郎教授との共同研究により行われました。
本研究は日本学術振興会科研費(21H04719, 23H04925)、日本科学技術振興機構 CREST(MJCR21E6)によりサポートされ、総研大生博士課程の鳩山雄基は学術振興会特別研究員(DC2)、同Moutushi Islamは文科省国費留学生奨学金を受給しています。
本成果は国際学術誌「EMBO Reports」に2024年8月23日に掲載されました。
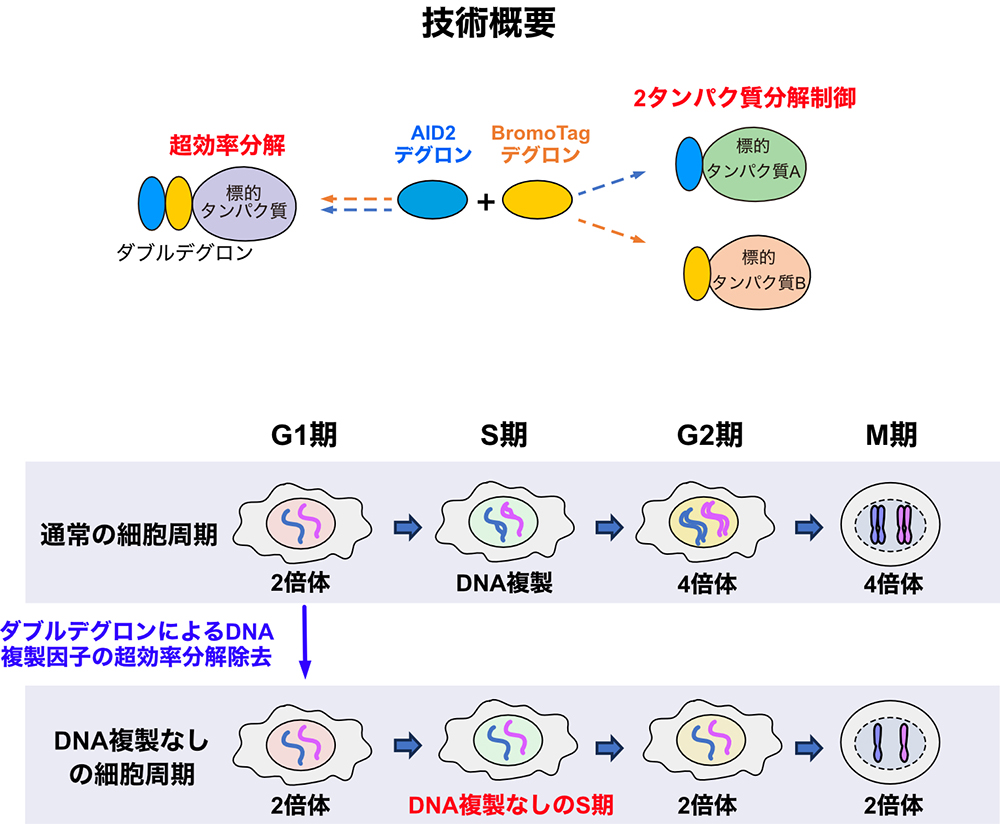
図: デグロン技術の組み合わせによる拡張性の概要と、その利用によりDNA複製なしの分裂期までの細胞周期進行を誘導した例。
総研大生・Ayjan Urazbayevaさんが「Best Presentation Award」を受賞
多階層感覚構造研究室のAyjan Urazbayeva(総研大遺伝学コースD4・文科省国費留学生) が、2024年8月17日-21日に京都で開催された the 18th International Zebrafish Conference の “Shaping the Future of Early-Career Zebrafish Researchers” ワークショップで発表をおこない、「Best Presentation Award」を受賞しました。

Ayjan さん
超解像顕微鏡が解き明かす染色体凝縮の仕組み
~コンデンシンが「DNAクリップ」として働く~
Single-nucleosome imaging unveils that condensins and nucleosome-nucleosome interactions differentially constrain chromatin to organize mitotic chromosomes.
Kayo Hibino, Yuji Sakai, Sachiko Tamura, Masatoshi Takagi, Katsuhiko Minami, Masa A. Shimazoe, Toyoaki Natsume, Masato T. Kanemaki, Naoko Imamoto, Kazuhiro Maeshima*
*責任著者
Nature Communications (2024) 15, 7152 DOI:10.1038/s41467-024-51454-y
細胞が分裂するためには、複製された長いゲノムDNAが分裂期染色体として凝縮し、それが2つの娘細胞に正確に分配される必要があります。これにはコンデンシンというタンパク質が重要な役割を果たすと考えられていますが、コンデンシンがどのようにしてゲノムDNAに働き、染色体を凝縮させるのかは不明でした。このたび、情報・システム研究機構 国立遺伝学研究所 日比野佳代 助教、田村佐知子 テクニカルスタッフ、南克彦 大学院生、島添將誠 大学院生、前島一博 教授のグループ、夏目豊彰 助教、鐘巻将人 教授のグループは、横浜市立大学大学院生命ナノシステム科学研究科 境祐二 特任准教授、理化学研究所 高木昌俊 専任研究員、今本尚子 主任研究員のグループと共同で、分裂するヒト細胞の染色体内をナノメートルレベルで可視化できる超解像蛍光顕微鏡を用い、ゲノムDNAの動きを観察・解析しました。
その結果、高度に凝縮した分裂期染色体においても、ゲノムDNAが揺らいでいることを発見しました。そして染色体が凝縮する過程で、DNAの揺らぎが次第に抑えられ、コンデンシンが「クリップ」のようにDNA同士を結びつけ、DNAの揺らぎを抑えていることが分かりました。また、DNAがヒストンというタンパク質に巻きついた構造であるヌクレオソーム同士の相互作用も、染色体全体を凝縮させる役割を果たすことが明らかとなりました。これらの実験結果は、計算機シミュレーションで作られたモデル染色体でも再現できました。今回の発見は、細胞が分裂する際、長いゲノムDNAから染色体がどのように作られるかを解明するものです。細胞分裂の異常に関連する「がん」などの疾患の理解・治療につながることが期待されます。
本研究成果は、国立遺伝学研究所・ゲノムダイナミクス研究室の日比野佳代 助教(JST さきがけ研究 員)、田村佐知子 テクニカルスタッフ、南克彦 総研大大学院生(元 SOKENDAI 特別研究員、現 学振特別研 究員 DC2)、島添將誠 総研大大学院生(学振特別研究員 DC1)、前島一博 教授 、分子細胞工学研究室・夏 目豊彰 助教(現 東京都医学総合研究所 研究員)、鐘巻将人 教授、横浜市立大 境祐二 特任准教授、 理化学研究所・の高木昌俊 専任研究員、今本尚子 主任研究員(現 滋慶医療科学大学大学院教授)との 共同研究成果です。
本研究は、日本学術振興会(JSPS) 科研費(JP20K06482, JP21H02453, JP23K17398, JP24H00061, JP23KJ0998, JP20K06594, JP21H0419, JP23H04925)、学術変革領域 A「ゲノムモダリティ」 (JP20H05936)、科学技術振興機構(JST) PRESTO (JPMJPR21ED)、CREST (JPMJCR21E6)、 JST 次世 代研究者挑戦的研究プログラム(JPMJSP2104)、武田科学振興財団の支援を受けました。
本研究は、2024年8月21日に「Nature Communications」にオープンアクセスとしてオンライン掲載されました。
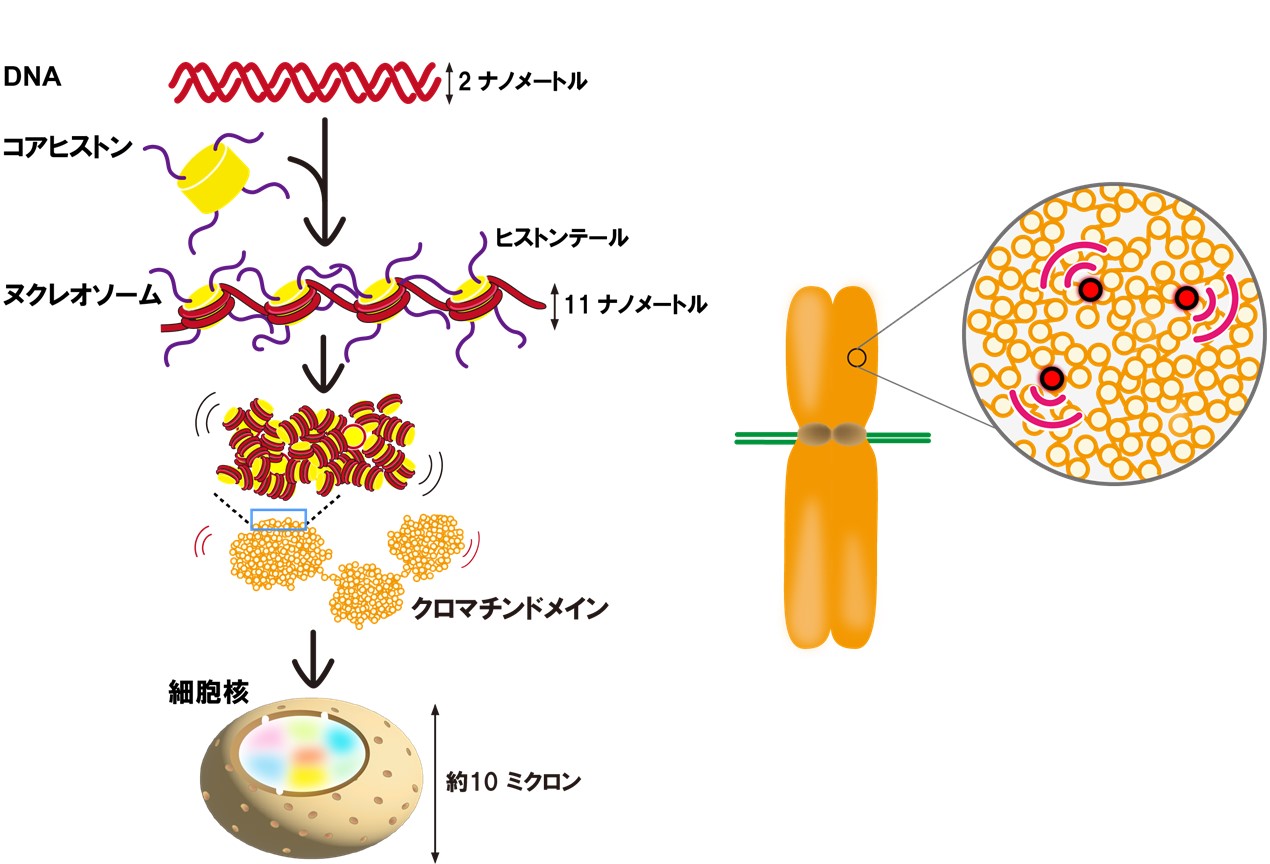
図1: (左)DNAはヒストンに巻かれてヌクレオソームを形成する。ここでは4 個のヌクレオソームが描かれているが、1つの細胞あたり3000万個ものヌクレオソームが存在する。ヌクレオソームは不規則に折り畳まれて塊(クロマチンドメイン)を形成し、細胞の核のなかに収められている。(右)本研究によって、分裂細胞の染色体のなかの単一のヌクレオソーム(赤)を標識する技術が開発され、その振る舞いが明らかになった。
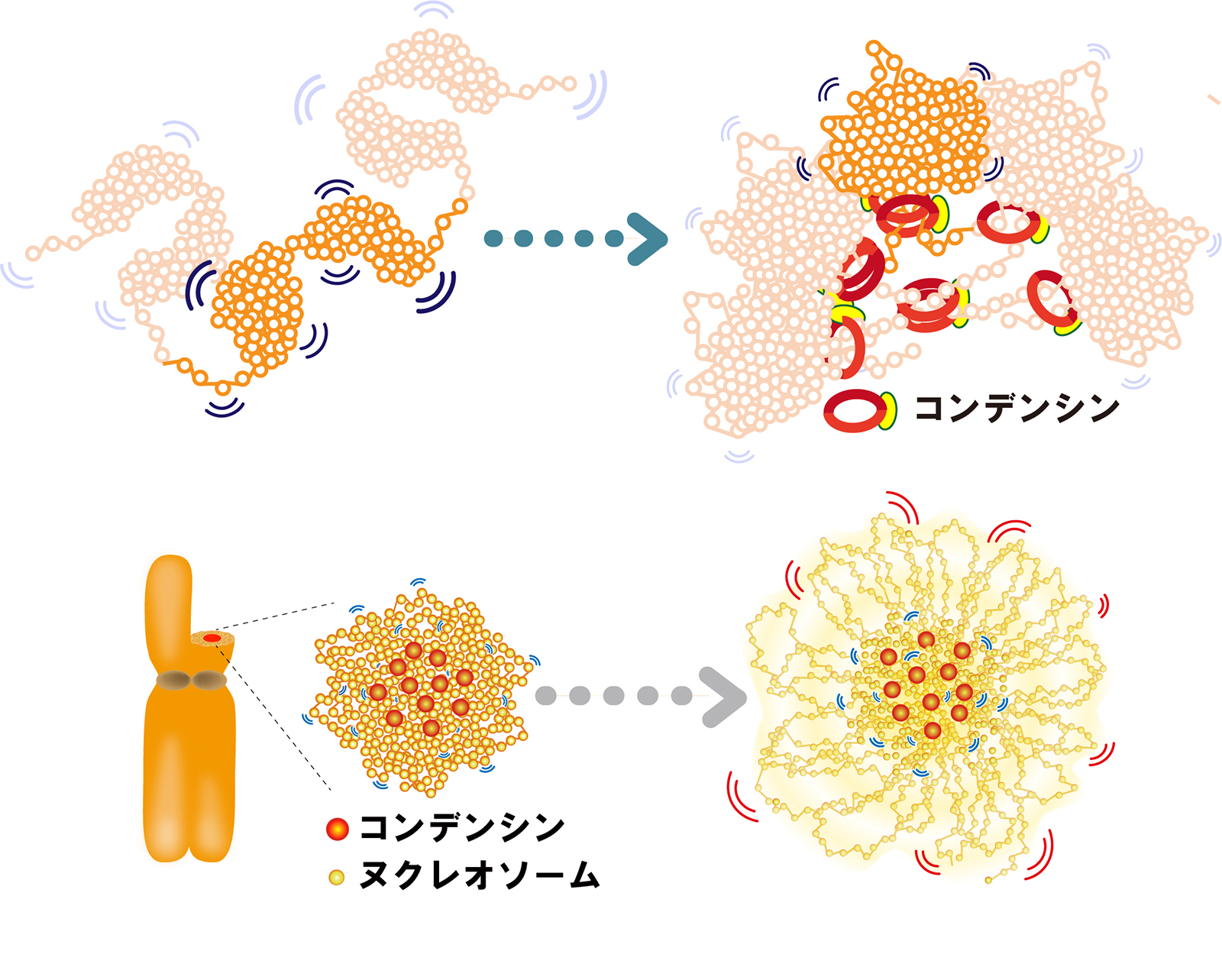
図2: (上段)コンデンシンは、染色体の中心付近でクロマチンドメイン同士を「クリップ」のように結びつけ、ヌクレオソームの揺らぎを抑えている。(下段)ヒストンのテール(尾部)を介したヌクレオソーム間の相互作用を阻害すると染色体が脱凝縮する。ヌクレオソーム間の相互作用も重要な役割を果たしている。
動画: 超解像蛍光顕微鏡により観察された生きた細胞の核内(左)と染色体(右) におけるヌクレオソームのゆらぎの動画。個々のドットが単一のヌクレオソームを示している。左下は秒表示。
細胞壁成分の変化がイネ花粉母細胞の細胞間連絡に与える影響
野々村研究室・植物細胞遺伝研究室
小出研究室・マウス開発研究室
Callose Deficiency Modulates Plasmodesmata Frequency and Extracellular Distance in Rice Pollen Mother and Tapetal cells.
Harsha Somashekar, Keiko Takanami, Yoselin Benitez-Alfonso, Akane Oishi, Rie Hiratsuka, Ken-Ichi Nonomura
Annals of Botany (2024) mcae137. DOI:10.1093/aob/mcae137
陸上植物では、隣接する細胞の細胞質は直径40〜50nmのチューブ状構造を介してつながっています。これは原形質連絡(PD)と呼ばれ、細胞間の物質輸送やシグナル伝達に重要な役割を果たします。カロース(用語説明1)はPD膜の外側に沈着し、PDの直径や形成頻度の調節を介して細胞間輸送効率を制御します。
葯では、花粉形成および受精に向けて減数分裂(用語説明2)が行われます。減数分裂細胞同士、および減数分裂細胞と周辺体細胞はPDで相互に連結していますが、減数分裂移行後、それらのPDは徐々に消失します。それと並行して、減数分裂細胞の細胞壁主要成分がセルロースからカロースに大規模転換します。減数分裂進行におけるカロースの重要性が先行研究から示されましたが、カロースとPD消失の関係は不明でした。
総合研究大学院大学の大学院生 Somashekar Harshaと植物細胞遺伝研究室の野々村賢一准教授らの研究グループは、透過型電子顕微鏡を用いて葯のカロース蓄積が欠損するイネ変異体の葯構造を観察し、減数分裂細胞のPD頻度の維持におけるカロース機能を明らかにしました(図)。すなわちカロースは、減数分裂細胞をつなぐPDの拙速な消失を抑制することで、正常な減数分裂進行を維持していたのです。さらに、PDは減数分裂細胞間の物理的な距離の維持に機能することも明らかにしました。細胞間の距離は、PD以外の経路による細胞間輸送効率に影響する可能性が考えられます。
今回の成果から、カロース依存的なPD頻度の調節を介した細胞間輸送の制御が、植物の減数分裂進行に重要な役割を果たす可能性が推察されました。
本研究は、学術振興会科研費(21H04729)、二国間交流事業共同研究(JPJSBP120213510)、文科省国費留学生制度の支援を受けて実施しました。
(用語説明1)カロース (β-1,3-グルカン):
細胞壁の主成分であるセルロース(β-1,4-グルカン)と同しく、膜上の合成酵素によりUDP-グルコースから合成されて細胞間隙に蓄積する。細胞板形成や花粉管伸長、篩管の篩板形成など、植物の細胞分裂や器官発生で重要な役割を果たすほか、病原体感染や各種ストレスによる細胞障害により誘導されて植物防御機構の一端を担う。また、特定の大きさ以上の分子を通さない分子篩(ふるい)としての機能、あるいは隣り合った細胞の間をつなぐ輸送経路(原形質連絡)の輸送効率の調整など、細胞間のシグナル伝達制御にも重要な役割が知られる。
(用語説明2)減数分裂:
受精に向けて染色体数を半減させる特殊な細胞分裂。有性生殖を行う全ての生物は、受精と減数分裂を交互に繰り返すことで染色体数を子々孫々一定に保っている。減数第一分裂で、両親から受け継がれた同じ構造をもつ染色体(相同染色体)が整列し、染色体腕の一部を交換することで、両親とは異なる新たな遺伝子組合せをもつ染色体が創出され、次世代へと伝達される。相同染色体間の整列と減数分裂組換えを伴う第一分裂の前中期では、減数分裂特有の染色体凝縮パターンがみられる。

図:カロース蓄積がイネの花粉母細胞間の原形質連絡(PD)頻度に与える影響
(A) 減数分裂直前の葯における花粉母細胞間PD(黄矢印)の観察。Osgsl5-3は、カロース合成酵素 OsGSL5が機能欠損し、葯室の細胞間隙にカロースが蓄積しない変異体。
(B) 隣接する花粉母細胞の細胞間隙の中央線に沿って計測したPD頻度の平均値。正常イネ (WT) の葯では、減数分裂直前から減数分裂初期にかけてPD頻度が徐々に低下するが(緑)、Osgsl5-3ではWTと比較してPD頻度が有意に減少する(黄)。
九州北部におけるカワリヌマエビ類の記録
Records of Neocaridina denticulata from Uku Island, N. davidi from Fukue Island, Goto Islands, and N. ikiensis from mainland Kyushu, Japan
Yusuke Fuke, Shota Kunimatsu, Jun Nakajima
Cancer (2024) 33: 47–55. DOI:10.18988/cancer.33.0_47
小型の十脚甲殻類であるカワリヌマエビ属(Neocaridina)は、一生を淡水域で過ごす陸封型の生活史をもつことが特徴のグループです。本州とその周辺の島嶼には、ミナミヌマエビ(Neocaridina denticulata)と壱岐島の固有種であるイキシマカワリヌマエビ(Neocaridina ikiensis)が分布しています。近年、中国や韓国、台湾が原産の外来種シナヌマエビ(Neocaridina davidi)が日本各地に定着し問題になっています。
この度、国立遺伝学研究所の福家悠介 研究員、京都大学大学院理学研究科の国松翔太氏、福岡県保健環境研究所の中島淳 専門研究員の研究グループは、九州北部においてカワリヌマエビ類の調査を行いました。その結果、長崎県の五島列島宇久島においてミナミヌマエビ、九州本土においてイキシマカワリヌマエビを確認し、標本に基づく記録として初めて報告しました。ミトコンドリアDNA解析の結果、これらの今回発見された集団は在来であると考えられました。一方、福岡県、長崎県、大分県、熊本県の計8地点において外来種シナヌマエビが確認されました。特に、在来種ミナミヌマエビの生息が1地点でしか確認されていない福江島においてシナヌマエビが発見されたのは衝撃で、貴重な在来集団の保全のために早急な対応が必要です。

図:宇久島から得られたミナミヌマエビ。固有のミトコンドリアDNAハプロタイプを持つことから、在来集団であると結論付けられた。(中島淳 撮影)
ナンヨウテナガエビの追加記録と新規識別形質を報告
Additional records of the freshwater prawn Macrobrachium ustulatum (Crustacea: Decapoda: Palaemonidae) from the Ryukyu Islands, Japan
Yusuke Fuke, Taigi Sato, Naoto Shimizu, Naoto Inui
Cancer (2024) 33: 41–46. DOI:10.18988/cancer.33.0_41
ナンヨウテナガエビMacrobrachium ustulatumはザラテテナガエビ Macrobrachium australeに形態的に類似した淡水性の十脚甲殻類で、2017年に有効種として再記載されるまでザラテテナガエビのシノニムとされていました。両種とも西太平洋域の広域に分布しており、分布の北限は日本です。ザラテテナガエビは主に琉球列島に分布し、本州でもしばしば発見されている、いわゆる普通種です。一方、ナンヨウテナガエビはこれまでに国内から2個体のみしか得られていないため、本種の日本における分布や生息環境に関する情報は不足していました。
この度、生態遺伝学研究室の福家悠介研究員、琉球大学大学院理工学研究科の佐藤大義氏、沖縄県石垣市の清水直人氏、東京大学大学院理学系研究科の乾直人氏の研究グループは、琉球列島の新産地を含む複数地点から得られたナンヨウテナガエビ10個体を報告しました。さらに、標本検討の過程で明らかになった新規判別形質、すなわちナンヨウテナガエビはザラテテナガエビと比較して太い胸脚を持つことを報告しました。著者らの定性的な観察では,同一河川内でもナンヨウテナガエビは緩やかな流れのある環境を、ザラテテナガエビは淀んだ環境に生息する傾向が確認されており、ナンヨウテナガエビにみられる頑強な胸脚は流水環境において適応的な形質である可能性が示唆されました。

図:ナンヨウテナガエビ(上)近縁種ザラテテナガエビ(下)。著者ら撮影。
標準和名リュウグウヒメエビに対応するタクソンを整理
Confusion between Caridina laoagensis and Caridina tupaia in Japan
Yusuke Fuke & Tomoaki Maruyama
Cancer (2024) 33: 15–23. DOI:10.18988/cancer.33.0_15
小型の淡水エビ類である「リュウグウヒメエビ」は、和名に対応する学名Caridina laoagensisの形態的特徴と必ずしも一致しないことが知られており、その扱いにおいて混乱が生じていました。国内の図鑑や文献では、本種は頭胸甲と腹節下部に見られる黒色斑が特徴とされています。しかし、黒色斑が全く見られない個体も報告されており、同じくリュウグウヒメエビとして扱われています。
今回、国立遺伝学研究所の福家悠介研究員とトレンドデザイン株式会社の丸山智朗氏は、本州および琉球列島から得られた「リュウグウヒメエビ」について、遺伝解析と形態形質の検討を行い、本種に2つのタクソンが含まれていることを認めました。先行研究の比較から、これらはC. laoagensisとC. tupaiaと同定されました。両種を区別できる形態形質に基づいて、過去の記録を精査したところ、和名リュウグウヒメエビを与えられたタクソンはC. tupaiaである可能性が高いことが判明しました。そこで本研究は、C. tupaiaに標準和名リュウグウヒメエビを、C. laoagensisには新標準和名ウンモンヒメエビを与えることを提案しました。

図:リュウグウヒメエビ(左)と今回新しく和名が提唱されたウンモンヒメエビ(右)。著者撮影。
神経回路構築研究室(岩里研究室)特任助教募集 応募締切:2024年11月15日(金)正午必着
募集の背景:
私達の研究室では哺乳類の脳神経回路の生後発達(特に活動依存的発達)を、分子から動物個体まで統合的に理解することを目指して、マウス体性感覚野(バレル野)を主要なモデルとして研究を行っています。これまで、様々な脳領域や細胞種に特異的な遺伝子ノックアウト法(Emx1-Creマウス等)の開発、単一細胞での遺伝子発現・ノックアウト法(Supernova法)の開発など、先端的マウス遺伝学を駆使した研究を展開してきました。最近では、新規の蛋白質急速ノックダウン法を幼若マウス脳に適用することに成功し(論文準備中)、神経回路の生後発達メカニズムの理解に新しい角度から切り込もうとしています。また、二光子顕微鏡を用いて、新生仔マウスの大脳皮質の中で樹状突起が標的軸索の方向に特異的に成長するダイナミクスのin vivoイメージングに世界で初めて成功、さらに新生仔マウスの体性感覚野において新規の時空間パターンをもつ自発神経活動を発見し、現在、それらの意義及びメカニズムの解明に取り組んでいます。今後も新しい技術やアイデアを積極的に導入し、哺乳類脳の神経回路発達・機能の問題に、オリジナルな視点から切り込んでいきたいと考えています。
(最近の主な発表論文)
Nakagawa, N. and Iwasato, T. Cell Rep. 42, 112843 (2023)
Nakazawa S. et al., J. Neurosci. 40, 7637-50 (2020)
Nakazawa S. et al., Nature Commun. 9, 3106,(2018)
Mizuno H. et al., Cell Rep. 22, 123-135 (2018)
Mizuno H. et al., Neuron 82, 365-379 (2014)
※ 研究室website:https://iwasato-lab.sakura.ne.jp もご覧ください。
※ 国立遺伝学研究所の位置する静岡県三島市の近辺は、東京への新幹線通勤・通学圏内です(三島-品川:35分~49分)。
仕事内容:
マウスを用いた神経回路の発達・機能の研究への興味を共有し,岩里琢治教授と協力して、主体的に研究に取り組む意欲のある研究者を募集します。ラボ運営や大学院生(少数)の指導への協力も期待します。
※ 研究以外のdutyが少なく、研究に専念できる環境です。
※ 希望により、総合研究大学院大学(遺伝学コース)教員との兼務も可能です。
勤務形態: 裁量労働制適用職員(任期あり)
任用期限: 2029年3月31日まで。
募集人員: 1名
応募資格:
① 博士学位取得者(取得見込みを含む)。
② 当研究室の研究テーマ(マウスを用いた脳神経回路の生後発達の研究)への興味を共有できる方。
③ 岩里琢治教授と協力して主体的に研究を推進できる方。
※ 当研究室と親和性の高い独自研究テーマ(の芽)を持ち、それを育む場を探している方の応募も歓迎します。相互にメリットのある共同研究の形を模索したいと思いますので、興味を持っていただける方は、是非お問い合わせください。
④ マウスを用いた神経科学研究の経験と、経歴に応じた実績があることが望ましい。
待遇: 助教と同等
年俸制(12月分割で支給)※学歴、経験に応じ決定
通勤手当(条件付)、文部科学省共済、労災保険・雇用保険適用。
募集期間: 2024年11月15日(金)正午必着(適任者の採用が決まり次第、募集を締め切る可能性があります。応募書類準備前のお問い合わせ、歓迎します。)
※ 海外在住の方など事情に応じて、オンラインでの面接も可能です。
着任時期: 決定後できるだけ早い時期を希望しますが、それぞれの方の事情に配慮します。
応募書類:
【応募書類(任意様式)】
□ 履歴書:年号は西暦でお願いします。
□ 業績リスト:業績リスト:査読付き原著論文(応募者の貢献を明記)、総説等、主な学会発表、競争的資金獲得実績(もし、あれば)、その他。
□ 主要論文のPDF
□ これまでの研究内容の概略: A4 1-2ページ程度。
□ 着任した場合の抱負、将来の希望、自己アピールなど: A4 1-2ページ程度。
※ キャリアアップに向けて、できる限りのサポートをいたします。
□ 応募者に関して意見を聞くことができる方2名以上:氏名、所属、電話番号、Eメールアドレス等
【提出方法等】
・ 電子メールに応募書類を添付して岩里( )まで送付願います。メールのタイトルは,「特任助教応募(応募者名)」としてください。
・ 応募に係る個人情報は個人情報保護法及び本機構規定に基づいて適切に管理し、選考及び採用の目的以外には使用いたしません。
遺伝研では、受動喫煙の防止など、職員の安全と健康に配慮した環境整備に努めています。(屋内禁煙、屋外に喫煙場所設置)
選考・結果通知:
・ 書類選考のうえ、必要に応じて面接日をご連絡します。
・ セミナーをお願いすることがあります。
・ 面接、セミナーは、事情により、オンラインで行う選択も可とします。
・ 決定後速やかに、本人あてに電子メール等にて通知します。
連絡先:
〒411-8540 静岡県三島市谷田1111
国立遺伝学研究所神経回路構築研究室
教授 岩里琢治
(Eメール)
(研究室HP)https://iwasato-lab.sakura.ne.jp
総研大生・Semeigazinさんが「Poster Award」および「Travel Award」を受賞
ゲノムダイナミクス研究室のAdilgazy Semeigazin(総研大遺伝学コースD4・文科省国費留学生) が、2024年8月4日-8日にイタリア・ローマで開催されたFASEB Research Conference「Biology of Acetylation in Health and Disease」でフラッシュトークとポスター発表をおこない、「Second-place Poster Award」を受賞しました。さらに、「Travel Award」にも選出されました。
本conference参加にあたって、SOKENDAI研究派遣プログラムのサポートも受けました。

Semeigazinさん
イネコムギはイネのミトコンドリアを持つ新たなコムギであった!
~世界初!コムギにイネの遺伝子資源の導入に成功~
プレスリリース
Wheat cybrid plants, OryzaWheat, regenerated from wheat-rice hybrid zygotes via in vitro fertilization system possess wheat–rice hybrid mitochondria
Tety Maryenti, Shizuka Koshimizu, Nonoka Onda, Takayoshi Ishii, Kentaro Yano, Takashi Okamoto
Plant and Cell Physiology (2024), pcae074 DOI:10.1093/pcp/pcae074
コムギとイネは世界の主要作物ですが、異なる亜科に属していることから交雑することができず(交雑不全1)、それらが持つ優良遺伝資源を相互に利用することはできませんでした。
東京都立大学大学院理学研究科のTety Maryenti(当時・大学院生、現・インドネシア大 助教)、恩田乃々佳(大学院生)、岡本龍史 教授、鳥取大学国際乾燥地研究教育機構・乾燥地研究センターの石井孝佳 准教授、国立遺伝学研究所の越水静 助教らは、先行研究により作出されたコムギとイネの交雑植物(イネコムギ)(2021年10月発表)のゲノム解析を行い、イネコムギがイネのミトコンドリアをもつ細胞質雑種コムギであることを明らかにしました。
今回の研究では、図Aのように、コムギおよびイネの花から単離した配偶子(卵細胞と精細胞)を任意の組み合わせで顕微授精法2により融合させることで、イネとコムギの交雑植物(イネコムギ,oryzaWheat)を作出し、それらのゲノムの配列と組成を決定しました。その結果、イネコムギは、コムギゲノムに加えて、イネとコムギのミトコンドリアゲノムを持つ細胞質雑種3コムギ(Cybridコムギ)であることが示されました。(図B)。また、ゲノム解析を行った1個体では、イネの核ゲノムがコムギの核ゲノムの中に一部残ったイネコムギも確認することができました。しかし、このイネコムギがキメラ4であったため、次世代へのイネゲノムの伝達は確認できませんでした。これらの結果は、コムギにイネの遺伝子資源を導入できたことを世界で初めて示したものであり、顕微授精法による交雑植物(イネコムギなど)の作出手法は新たな育種技術としても期待されます。

図: 顕微授精法によるイネーコムギ雑種植物(イネコムギ)の作出(A)とイネコムギのゲノム構成(B)
(A)コムギ精細胞、イネ卵細胞、コムギ卵細胞の組み合わせで作出した交雑受精卵(異質倍数性)は、交雑不全を示すことなく植物体にまで発生する。
(B)イネコムギ細胞の核ゲノムおよびミトコンドリアゲノムの構成
神経回路構築研究室 テクニカルスタッフ(週30時間) 募集
国立遺伝学研究所の神経回路構築研究室では、マウスを用いた脳科学研究をサポートしていただける方を下記の内容にて募集いたします。
| 【募集人数】 | 1名 |
| 【勤務地】 | 国立遺伝学研究所(静岡県三島市谷田1111) |
| 【契約期間】 | 年度ごと。更新可(「国⽴遺伝学研究所特定有期雇⽤職員等の契約更新に関する判断基準 」に基づく) |
| 【職務内容】 | ・マウス実験(マウスの手術・解剖など)の補助 ・生物学実験(組織切片作製・染色・顕微鏡観察、プラスミド構築、PCR等)の補助 ・その他、研究室内の研究補助業務 |
| 【応募資格】 | ・責任感をもって、丁寧に注意深く仕事をしていただける方。 ・幅広い実験に意欲的に取り組んでいただける方(手先の器用さが要求される実験に対応できる方、歓迎) ・生物学実験の知識・経験のある方、歓迎(新しいことを学ぶ意欲があれば、未経験者も可) ・ 自宅でのげっ歯類(マウス、ハムスター等)、ウサギ類飼育不可。動物アレルギー不可。)。 |
| 【採用時期】 | 採用決定以降のできるだけ早い時期(応相談) |
| 【勤務形態】 | ・週30時間:月~金、10:00~17:00(休憩1時間)(応相談) ・休日:土日、祝祭日、夏季休暇、年末年始等 |
| 【給与・待遇】 | ・研究所の給与規定に準じます(時給1,013 円~1,300円) ・健康保険、年金、雇用保険、労災保険に加入。通勤手当(条件による)。 ・車通勤可 |
| 【応募書類】 | ・履歴書(写真貼付、メールアドレス、及び、日中の電話番号明記) ・自己アピール文(職務経歴書等) |
| 【応募書類提出】 | ・メール添付にて、岩里( )宛てにお送りください。 ・メールタイトルは、「テクニカルスタッフ(30時間)応募」でお願いします。 |
| 【応募締切】 | 適任者が決まり次第 |
| 【選考方法】 | 書類選考通過者のみ面接を行います。(面接日時はメール又は電話にて連絡) |
| 【備考】 | ・仕事内容や勤務条件は、応募者の方のご都合に合わせて調整できる可能性があります。応募前のお問合せ歓迎します。岩里(教授: )、又は、佐藤(研究室事務: , 055-981-6774)までお問合せください。 ・研究室に関しては(https://iwasato-lab.sakura.ne.jp/)をご覧ください。 ・応募書類は、情報・システム研究機構個人情報保護規定に則り厳重に管理、採用審査の用途に限り使用し、本募集の終了とともに採用者の分を除き責任を持って破棄いたします。 |















