Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
切れたDNAをどう直す?
〜細胞が修復法を選択する仕組みを発見〜
RIF1 Controls Replication Initiation and Homologous Recombination Repair in a Radiation Dose-Dependent Manner
Yuichiro Saito, Junya Kobayashi, Masato T. Kanemaki, Kenshi Komatsu Journal of Cell Science 2020 May 20. DOI:10.1242/jcs.240036生命の遺伝情報を担うゲノムDNAはその化学的性質から内的、外的な要因により日常的に損傷を受けています。特に電離放射線はDNAを切断することでDNA二重鎖切断(DSB)を誘発し、その結果、細胞死やがん化を引き起こします。DSBはエラーの生じやすい『非相同末端結合』、または正確に修復可能な『相同組換え』により修復されることが知られており、二つの修復経路を適切に使い分けることがゲノムを維持するために重要だと考えられます。
これまで高線量の放射線を用いた研究結果から、ヒト細胞では非相同末端結合による修復が優位だと考えられてきました。しかし、高線量の放射線を用いた結果を一般化できるかはわかりません。そこで我々は低線量(弱)、高線量(強)の二種類の放射線を使い分け、ヒト細胞でのDSB修復活性を解析しました。その結果、低線量の放射線を照射した細胞では相同組換えがDSBを効率的に修復すること、放射線量が増加すると相同組換えの活性が弱まることを発見しました。この結果は、細胞がDNA損傷の『量』を感知し、適切な修復経路を使い分けていることを示唆すると考えられます。さらにDNA複製に関与するRIF1タンパク質が放射線量に依存して相同組換えの活性を弱めることを見出しました。これらの研究結果は、放射線治療においてがん細胞をより効率的に排除する手法の開発などに貢献すると期待されます。
本件研究は、斎藤(責任著者)が中心となり京都大学放射線生物研究センター小松研究室と国立遺伝学研究所鐘巻研究室にておこなわれました。
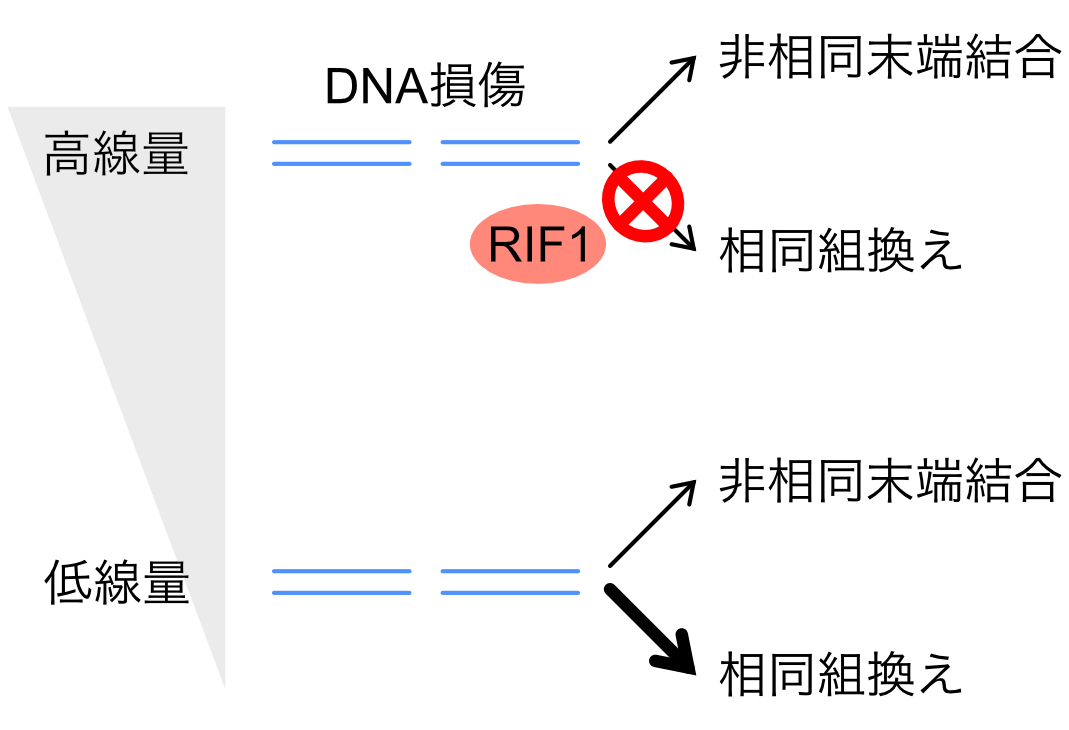
図:ゲノムに生じたDNA二重鎖切断は非相同末端結合または相同組換えにより修復されます。放射線量が増加するとRIF1タンパク質の働きにより、相同組換え修復が行われなくなることを見出しました。
- 第1著者の斎藤裕一朗博士研究員が同雑誌の「First person」で紹介されました。
国立遺伝学研究所とかずさDNA研究所が連携協定を締結

かずさ DNA 研究所は、1994 年に世界初の DNA 専門研究機関として発足し、世界の DNA 研究を先導するとともに、医療、農業、産業、教育の分野で幅広く社会に貢献しています。
弊所とはこれまでも共同研究を進め、最近では、イエネコ(アメリカンショートヘア種)やイチジク近縁種のイヌビワのゲノム解読や、ダイズ根圏に殺虫活性物質オカラミンを発見するなど成果を挙げていますが、これまでの学術交流を基に新たな共同研究へと発展します。
生態遺伝学研究室 石川助教が 日本進化学会研究奨励賞 を受賞

石川麻乃助教
生態遺伝学研究室 石川麻乃助教が日本進化学会 研究奨励賞を受賞しました。
この賞は進化学や関連する分野において,研究業績上大きな発展が期待される若手研究者に授与されます。
受 賞 名:2020年 日本進化学会 研究奨励賞
受賞テーマ:生活史進化の分子遺伝機構の解明
発表日:2020年6月5日
石川助教は翌6月6日には日本動物学会 奨励賞を受賞し、また今年4月には、令和2年度文部科学大臣表彰「若手科学者賞」も受賞しています。
日本動物学会 奨励賞受賞記事
文部科学大臣表彰「若手科学者賞」受賞記事
生態遺伝学研究室 石川助教が 日本動物学会 奨励賞 を受賞

石川麻乃助教
生態遺伝学研究室 石川麻乃助教が日本動物学会 奨励賞を受賞しました。
この賞は活発な研究活動を行い、将来の進歩、発展を強く期待される若手研究者に授与されるものです。
受 賞 名:2020年 日本動物学会 奨励賞
受賞テーマ:生活史の適応進化をもたらす遺伝基盤の解明
発表日:2020年6月6日
石川助教は 6月5日には、日本進化学会研究奨励賞を受賞し、また今年4月には、令和2年度文部科学大臣表彰「若手科学者賞」も受賞しています。
日本進化学会研究奨励賞受賞記事
文部科学大臣表彰「若手科学者賞」受賞記事
ドロボウは共生のはじまり!?
―盗葉緑体性渦鞭毛虫から探る葉緑体獲得の進化
Changes in the transcriptome, ploidy, and optimal light intensity of a cryptomonad upon integration into a kleptoplastic dinoflagellate
Ryo Onuma, Shunsuke Hirooka, Yu Kanesaki, Takayuki Fujiwara, Hirofumi Yoshikawa, Shin-ya Miyagishima
The ISME Journal (2020) DOI:10.1038/s41396-020-0693-4
Link to “Behind the Paper” the Nature Research Microbiology Community
植物や藻類の葉緑体は、もともと他の生物を捕食していた単細胞性の真核生物が、光合成生物を自身の細胞内に取り込み、統合したことによって誕生しました。このような葉緑体獲得は真核生物のさまざまな系統で独立に複数回起こったとされ、生態系に多様な藻類を生み出した進化の原動力であると考えられています。しかしながら、捕食-被食関係が永続的な共生関係に至った過程については多くのことが不明です。
盗葉緑体現象は、自前の葉緑体をもたない生物が他の藻類またはその葉緑体を自身の細胞内に取り込み、細胞内で一時的に維持する現象で、真の葉緑体を獲得する手前の進化段階であると考えられています。盗葉緑体性渦鞭毛虫Nusuttodinium aeruginosum(ヌスットディニウム アエルギノーサム)は、クリプト藻という単細胞藻類を取り込み、細胞内でその葉緑体を元のサイズの20倍以上に拡大することが知られています(図1A)。以前の観察結果から葉緑体の拡大にはクリプト藻の核が必要でことが示唆されましたが(Onuma & Horiguchi, 2015, Protist)、その詳細は明らかになっていませんでした。
そこで本研究では、N. aeruginosumと、それが取り込むクリプト藻を対象とし、クリプト藻核のトランスクリプトーム解析、様々な光条件での培養実験などを行い、盗葉緑体現象におけるクリプト藻核の役割を明らかにしました。その結果、渦鞭毛藻に取り込まれたクリプト藻核は(1)転写活性を維持しており、取り込まれる前よりも代謝・翻訳・DNA合成に関する遺伝子群の発現が上昇すること、(2)核分裂せずにDNA複製が持続し多倍体化すること(図1B)、(3)明暗の切り替えに応答した遺伝子発現変化がなくなること、(4)特に、光合成酸化ストレスを生じる強光条件下で宿主渦鞭毛藻の生存を支えていることが明らかになりました。
今回、盗葉緑体現象において見られた、取り込まれた藻類核の多倍体化と転写制御の喪失は、真の葉緑体をそれぞれ独立に確立した様々な生物群にも共通する現象です。つまり、これらの現象は、永続的な共生関係を確立する前から起こりうること、真の葉緑体をもつ生物群も太古の昔には盗葉緑体性生物であった可能性が示唆されます(図1C)。
本研究に至る過程をNature Research Microbiology CommunityのBehind the Paperで別途紹介しています。
本研究は、国立遺伝学研究所共生細胞進化研究室の大沼亮研究員(学術振興会特別研究員)、宮城島進也教授を中心として、国立遺伝学研究所、静岡大学、東京農業大学との共同研究チームによって行われました。
本研究は、科学研究補助金(17H01446、15H06834、17K15168、18J01089)、文科省私立大学戦略的研究基盤形成支援事業(S1311017)などの助成のもとに実施されました。
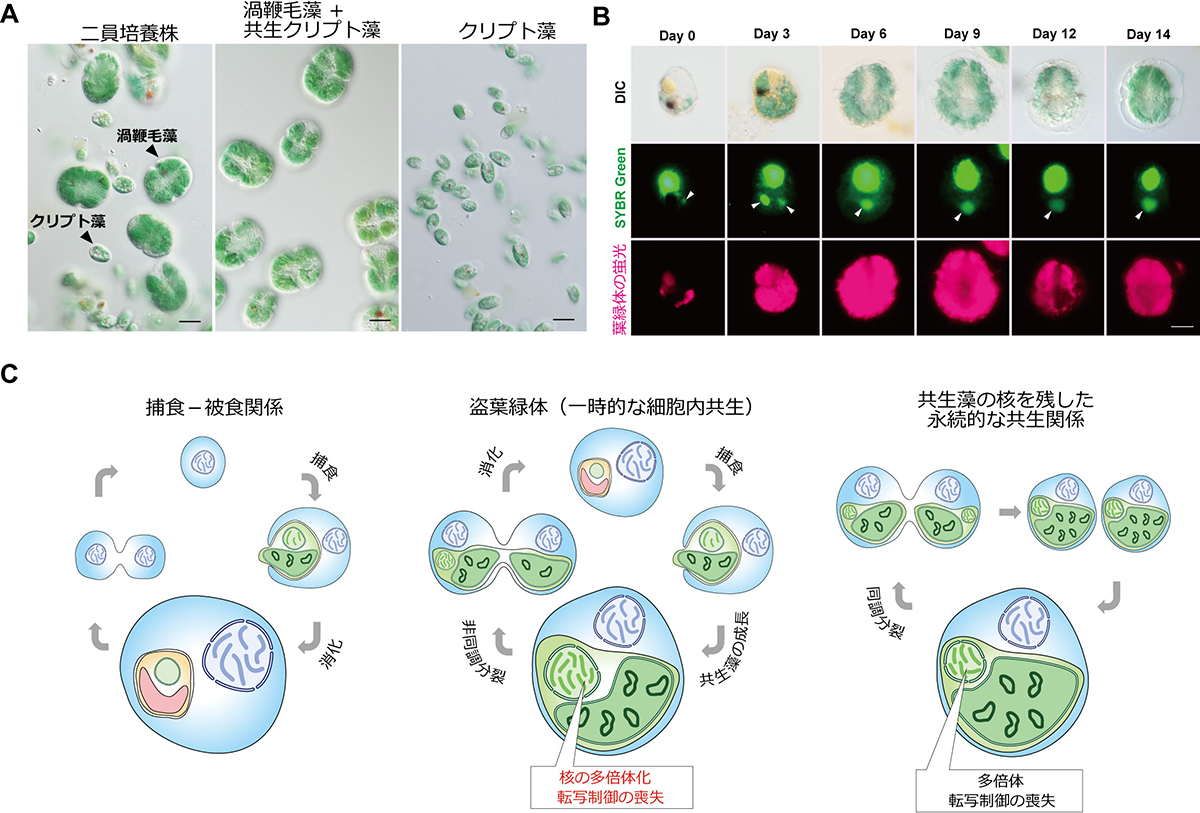
図:Nusuttodinium aeruginosumの盗葉緑体現象
(A) 渦鞭毛虫とクリプト藻の二員培養(左)、クリプト藻取り込んで維持している渦鞭毛藻(中央)、取り込まれる前のクリプト藻(右)の写真。スケールバーは10 µm。
(B) 渦鞭毛虫に取り込まれた後のクリプト藻核(矢尻;緑の蛍光)と葉緑体(赤の蛍光)の変化。渦鞭毛藻に取り込まれたクリプト藻核と葉緑体は徐々に拡大する。スケールバーは10 µm。
(C) 本研究の結果から示唆される、捕食-被食関係から永続的な共生関係への進化過程。捕食-被食関係では、捕食者は被食者をすぐに消化する(左)。葉緑体とその起源となった細胞の縮退核をもつ一部の藻類は、葉緑体と縮退核を自身の細胞分裂に同調させることで、永続的な共生関係を維持している。その縮退核は多倍体化しており、環境変動に応じた転写制御が無くなっていることが知られている(右)。N. aeruginosumに見られる盗葉緑体現象でも、取り込まれた藻類核の多倍体化と転写制御能の喪失がおこる(中央)。
新型コロナウイルス感染症に関する遺伝研の対応について【2020年5月27日版】
生態遺伝学研究室 石川助教が 令和2年度文部科学大臣表彰 若手科学者賞を受賞
生態遺伝学研究室 石川麻乃助教が令和2年度文部科学大臣表彰 若手科学者賞を受賞しました。
本賞は、萌芽的な研究、独創的視点に立った研究等、高度な研究開発能力を示す顕著な研究業績をあげた40歳未満の若手研究者に授与されるものです。
授 賞 式:残念ながら今年は授賞式は見送られました
受 賞 名:令和2年度文部科学大臣表彰 若手科学者賞
受賞テーマ:生活史の適応進化を担う分子遺伝機構の研究
令和2年度科学技術分野の文部科学大臣表彰受賞者等の決定について (MEXT)
[追記]
2020 5/27 後日撮影された喜びの様子


石川麻乃助教(遺伝研正面玄関) 北野研の皆様と (ともに若手科学者賞の賞状を手にした石川助教と北野教授)
イエネコ(アメリカンショートヘア種)の高精度な全ゲノム解読に成功 〜ゲノム獣医療への応用を目指して〜
Press release
AnAms1.0: A high-quality chromosome-scale assembly of a domestic cat Felis catus of American Shorthair breed
Sachiko Isobe, Yuki Matsumoto, Claire Chung, Mika Sakamoto, Ting-Fung Chan, Hideki Hirakawa, Genki Ishihara, Hon-Ming Lam, Shinobu Nakayama, Shigemi Sasamoto, Yasuhiro Tanizawa, Akiko Watanabe, Kei Watanabe, Masaru Yagura, Yasukazu Nakamura
BioRχiv Posted May 19, 2020. DOI:10.1101/2020.05.19.103788
※このプレスリリースは査読を経ていないプレプリント段階でのプレスリリースであり、今後、内容が修正される可能性があります(2020/06/08)
アニコム先進医療研究所株式会社、情報・システム研究機構国立遺伝学研究所、公益財団法人・かずさDNA研究所および香港中文大学(香港)は共同で、アメリカンショートヘア種のイエネコの全ゲノム解析を、19本の染色体レベルでほぼ全長、高精度で行うとともに、既存のアビシニアン種のゲノム構造との比較を行いました。
アメリカンショートヘア種は国内だけでなく、世界的にも人気のある猫種の一つです。これまでイエネコのゲノム配列は、遺伝的に均一なアビシニアン種でのみ調べられており、また、未解明のゲノム構造もあることから、利用できる塩基配列情報が限られていました。
今回の研究で、アメリカンショートヘア種の全ゲノム配列が染色体レベルで明らかになったことで、アメリカンショートヘア種に特徴的な疾患や形質に関わる遺伝子の研究だけでなく、ネコの健康を守るためのゲノム獣医療に繋がる研究を一層進めることができます。
本研究成果は、BioRχivにおいて5月20日(水)にオンライン公開されました。
遺伝研の貢献
国立遺伝学研究所のグループは伴侶動物の個別化医療ならびに予防医療の確立を目的とした、最高精度の本イエネコゲノム塩基配列決定プロジェクトの全体像の提案と、決定されたゲノム塩基配列と転写配列を組み合わせた遺伝研スーパーコンピュータを活用した網羅的な遺伝子発見ならびにゲノムデータベースCats-I の構築に貢献しました。
- 本研究により得られた情報は、データベースCats-I: Cats’ genome Informaticsでご覧いただけます。
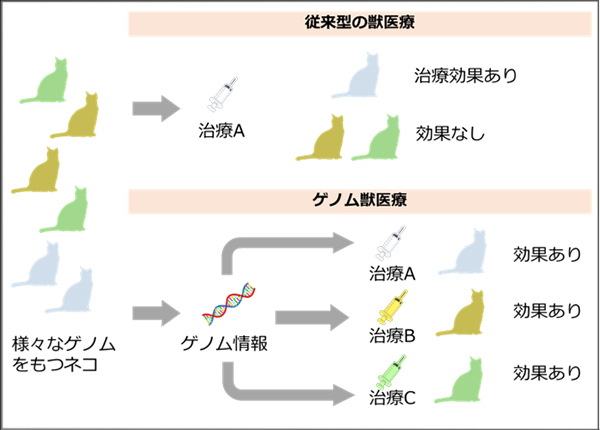
図: 従来型の獣医療では、どの個体にも同じ治療を行っており、治療法によって効果がでないネコも存在していました。ゲノム獣医療では、ゲノム情報に基づいて個体の体質に適した治療を行うことで、より効果的、効率的に獣医療を進めることが可能になります。
色素を欠損したアルビノウニの系統作製に成功
〜ウニ研究へ分子遺伝学導入の試み〜
Press release
Establishment of homozygous knock-out sea urchins
Shunsuke Yaguchi, Junko Yaguchi, Haruka Suzuki, Sonoko Kinjo, Masato Kiyomoto, Kazuho Ikeo, Takashi Yamamoto Current Biology Volume 30, 2020, Pages 427-429 DOI:10.1016/j.cub.2020.03.057筑波大学生命環境系(下田臨海実験センター)の谷口俊介准教授、谷口順子研究員、大学院生命環境科学研究科博士課程後期2年鈴木智佳(日本学術振興会特別研究員)は、国立遺伝学研究所遺伝情報分析研究室の池尾一穂准教授、金城その子研究員、お茶の水女子大学基幹研究院の清本正人教授、広島大学大学院統合生命科学研究科の山本卓教授との共同研究により、ハリサンショウウニ(Temnopleurus reevesii)を用いて、ノックアウトウニの系統作製に成功しました。
ウニは採集しやすく、卵や精子といった配偶子も取得が容易なので、発生生物学や細胞生物学、進化学の優れた研究材料として長く生命科学の現場で使われてきました。しかし、世代交代周期が1〜2年と長いため、遺伝子変異系統などを利用して正確な遺伝子機能の解析を試みる遺伝学の導入が見送られていました。本研究では、ウニ研究に導入可能な遺伝学的手法を模索する過程で、ハリサンショウウニが約半年という比較的短い期間で世代を回せることを発見し、その性質を利用してノックアウトウニを作製しました。
具体的には、ゲノム編集技術のCRISPR-Cas9システム(注2)を用い、体の色素合成に必要なポリケチド合成酵素(Polyketide Synthase; Pks1)の遺伝子領域に欠損を誘導し、色素を失ったハリサンショウウニのアルビノ個体を作製しました。さらに、それらの子孫を掛け合わせることで、ホモ接合型(注3)ノックアウトウニを作製することに成功しました。これにより、ウニを用いた研究に、分子遺伝学の手法を導入することが可能であることが証明されました。今後、より正確な遺伝子の機能解析や発現調節解析等が進むことが期待されます。
本研究の成果は、2020年5月18日(日本時間19日午前1時)付で米国の学術誌「Current Biology」で公開されました。
本研究はJSTさきがけ(多細胞)、日本学術振興会科学研究費若手研究(2019-21)と特別研究員奨励費(17-19及び19-21年度)、AMED創薬等先端技術支援基盤プラットフォーム (2017)、東レ科学技術研究助成金(2018)、武田科学振興財団ライフサイエンス研究奨励(2015)によって実施されました。
遺伝研の貢献 国立遺伝学研究所のグループは、ハリサンショウウニのゲノムアセンブリおよびアノテーション(遺伝子領域予測および機能推定)を行うことで、今回ゲノム編集の対象となったポリケチド合成酵素の遺伝子領域予測およびオフターゲット領域の選定に貢献しました。

図: F2世代の正常型(左)とPks1ホモ接合型変異体(右)
新型コロナウイルス感染症に関する遺伝研の対応について【2020年5月15日版】
【事業を終了しました】遺伝研緊急支援事業 〜マウス胚及び精子凍結保存〜
皆様
国立遺伝学研究所生物遺伝資源センターでは、コロナウイルスの感染拡大に伴いマウスの飼育が困難な事態に直面している研究者に対して、マウス胚及び精子凍結保存の緊急支援を2020年4月10日により実施していました。国内における新型コロナ感染の発生から1年が経過し、緊急支援としての役目を終えたと考えられますので、2021年1月15日をもちまして本事業を終了しました。
担当者:相賀裕美子、小出剛
遺伝研「マウス胚及び精子凍結保存事業」再開のお知らせ
新型コロナウイルスによる緊急事態対応事業として、国立遺伝学研究所生物遺伝資源センターでは、コロナウイルスの感染拡大に伴いマウスの飼育が困難な事態に直面している研究者に対してマウス胚及び精子凍結保存の緊急支援を2020年4月10日により開始しました。静岡県も緊急事態宣言が発令したため、4月17日を最後に新規の受け付けを停止しておりましたが、静岡県の緊急事態宣言が解除されたため、本日(5月15日)より受付を再開いたします。
担当者:相賀裕美子、小出剛
国立遺伝学研究所では生物遺伝資源センターのマウス事業として、マウス胚及び精子凍結保存の緊急支援を行います。今回の新型コロナウイルスの拡大防止の措置の影響で研究室でのマウス系統の維持が困難になっている研究者に対して、マウス胚及び精子凍結保存の作業を無償で支援するものです。
支援を必要とする研究者は、本緊急マウス保存事業の要項を確認ののち下記の担当部署にご連絡ください。
本緊急マウス保存事業の要項 (pdf)支援の概要
- 1.凍結胚の作製と保存 C57BL/6J未授精卵とIVFによりヘテロで保存
- 2.凍結精子の作製と保存 ストローで凍結し保存
受け入れ可能の上限(凍結胚は20系統、凍結精子は100系統)に達した場合は、その後の受け入れはお断りします。1件あたり最大でも5系統とします。
緊急支援として無料。
連絡先
E-mail: nigmouse@nig.ac.jp
担当者:相賀裕美子、小出剛
国立遺伝学研究所 動物飼育実験施設
〒411-8540 静岡県三島市谷田1111
TEL: 055-981-6829(相賀)、055-981-5843(小出)
2020年度夏に実施する入学者選抜試験に関する重要なお知らせ
2020年度夏に実施する入学者選抜試験における英語能力評価に関するお知らせ
【Webセミナー】海外生物資源の入手と利用についての説明会 (事前申込〆切:5月28日)
「がん遺伝子」として働くのか?
組換え酵素Rad52が染色体異常を引き起こすことを発見
Press release
DNA replication machinery prevents Rad52-dependent single-strand annealing that leads to gross chromosomal rearrangements at centromeres
Onaka AT, Su J, Katahira Y, Tang C, Zafar F, Aoki K, Kagawa W, Niki H, Iwasaki H, & Nakagawa T. Communications Biology (2020) 3:202 DOI:10.1038/s42003-020-0934-0大阪大学大学院理学研究科の中川拓郎准教授らの研究グループは、東京工業大学科学技術創成研究院の岩崎博史教授、情報・システム研究機構国立遺伝学研究所の仁木宏典教授、明星大学理工学部の香川亘教授との共同研究により、組換え酵素Rad52が反復配列を介した染色体異常を引き起こすことを明らかにしました
これまで、ヒトなどでは相同組換え因子BRCA2やRad51が正常に機能しないと、染色体異常が起こり、細胞がガン化することが知られていた(図)。また、本研究で使用する分裂酵母※7においても、Rad51遺伝子を破壊すると反復配列を「のりしろ」にした染色体異常が高頻度に起ることが知られていた。しかし、実際に、染色体異常が起きる分子メカニズムについては解明されていませんでした。
今回、中川拓郎准教授らの研究グループは、DNAアニーリング活性が低下した変異型酵素を用いることで、組換え酵素Rad52が染色体異常を引き起こすことを明らかにしました(図)。染色体異常の誘導因子を同定したことで、今後、BRCA2などの遺伝子変異により生じる遺伝性乳がん卵巣がん症候群(HBOC)※8の治療薬の開発がより一層進むことが期待されます。
本研究は、日本学術振興会科学研究費補助金の基盤研究の一環として行われました。
本研究成果は、Springer Nature社のオープンアクセス・ジャーナル「Communications Biology」に4月30日(木)18時(日本時間)に公開されました。
遺伝研の貢献 国立遺伝学研究所のグループでは、変異体のゲノム解析を担当しDNAポリメラーゼαの活性部位に変異が生じて いることを特定しました。これによりRad52タンパク質が複製装置と関連して働いていることが明らかになりました。
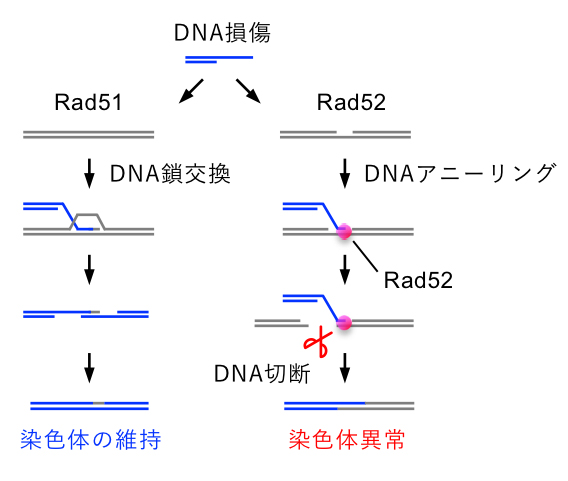
図: Rad51によるDNA鎖交換を介したDNAの正確な修復(左)とRad52によるDNAアニーリングを介した染色体異常(右)
【調達情報】入札説明会(官報号外政府調達第73号掲載)について
細胞画像のわずかな特徴の違いの見分け方を教えてくれるAIの開発に成功
Press release
Robust Classification of Cell Cycle Phase and Biological Feature Extraction by Image-Based Deep Learning
Yukiko Nagao, Mika Sakamoto, Takumi Chinen, Yasushi Okada, Daisuke Takao Molecular Biology of the Cell 22 Apr 2020 DOI:10.1091/mbc.e20-03-0187東京大学大学院医学系研究科の高尾大輔 助教と東京大学薬学部の長尾幸子 学部生(研究当時)の研究チームは、国立遺伝学研究所の坂本美佳 特任研究員、東京大学大学院薬学系研究科の知念拓実 助教、東京大学国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN)の岡田康志 主任研究者(東京大学大学院医学系研究科・大学院理学系研究科 教授、理化学研究所生命機能科学研究センター(BDR)チームリーダー)らと共同で、ディープラーニングと定量解析により細胞画像から未知の情報を抽出する技術の開発に成功しました。大量の細胞画像から一つ一つの細胞を自動的に切り出し、ディープラーニングにより細胞周期などを判定するAIツールと、その情報をさらに解析することで、細胞周期によって変動する核の形状やゴルジ体の配置パターンなどを抽出する技術を確立しました。これは、人間の目ではとらえにくいわずかな細胞内の変動をAIが発見し、研究者に教えてくれる技術です。
細胞周期によって細胞内の組成や構造は大きく変わることが予想されますが、実際に何がどのように変動するのかを顕微鏡画像から網羅的かつ定量的に解析するためのアプローチは限られていました。具体的に細胞内の何に着目すればいいのかを知るために、今回、共同研究チームはディープラーニングを使って、細胞周期によって変動するパラメータを画像の中から見つける技術を開発しました。これまで研究者が「なんとなく」「経験的に」とらえていた現象や、そもそも見過ごされていた情報を、AIの手助けにより発掘・定量化しようという試みです。その結果、本研究で開発したAIは、DNAやゴルジ体の染色画像の中から、細胞周期によってわずかに変動する特徴を発見しました。この情報を使って共同研究チームが画像を詳しく解析したところ、核やゴルジ体の面積などの特定のパラメータを測定することで画像から細胞周期を分類できることが分かりました。すなわち「画像のどこに着目すれば目的の情報が得られるのかAIが教えてくれる」という研究サポートツールの開発に成功しました。
本研究で開発したツールは汎用性が高く、他の多くの研究への応用を想定しています。細胞周期以外の判定はもちろん、細胞画像以外の画像データへの応用も可能なため、細胞・発生生物学から医療画像の解析など、基礎から応用まで幅広い分野の研究をサポートする強力なツールとなることが期待されます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 チーム型研究(CREST)「統合1細胞解析のための革新的技術基盤」(研究総括:菅野 純夫 東京医科歯科大学 非常勤講師)における「超解像3次元ライブイメージングによるゲノムDNAの構造、エピゲノム状態、転写因子動態の経時的計測と操作」(研究代表者:岡田 康志)および文部科学省世界トップレベル研究拠点プログラム 東京大学国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN)の支援のもとで行われたものです。
また、本研究の一部は以下の事業による支援を受けて行われました。 ・文部科学省 科学研究費 新学術領域研究「学術研究支援基盤形成」先端バイオイメージング支援プラットフォーム(ABiS) ・文部科学省 科学研究費 新学術領域研究「情報物理学でひもとく生命の秩序と設計原理」 ・日本学術振興会科学研究費基盤研究(C)「分子ダイナミクスの定量・操作と数理モデリングによる中心体複製メカニズムの理解」 ・武田科学振興財団 ・島津科学振興財団 ・コニカミノルタ科学技術振興財団
本研究の成果は、2020年4月22日に米国細胞生物学会誌 Molecular Biology of the Cell に掲載されました。
遺伝研の貢献
AI(人工知能)技術を含む細胞画像解析のための情報と技術サポートを提供しました。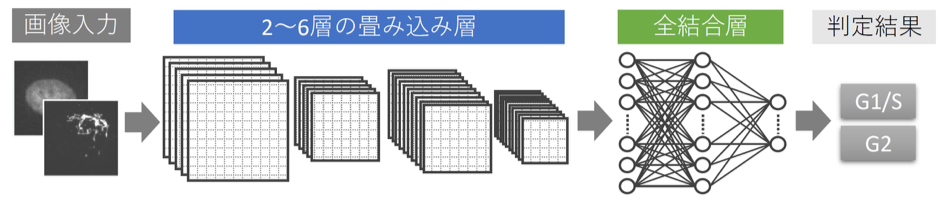
図: AIモデルの模式図 畳み込みニューラルネットワークを使ったディープラーニングモデルを開発した。
新型コロナウイルス感染症に関する遺伝研の対応について【2020年4月21日版】
液体のように振る舞うクロマチン
Fluid-like chromatin: Toward understanding the real chromatin organization present in the cell
Kazuhiro Maeshima, Sachiko Tamura, Jeffrey C. Hansen and Yuji Itoh
Current Opinion in Cell Biology (2020) 64, 77-89. DOI:10.1016/j.ceb.2020.02.016
真核生物のクロマチンはゲノムDNA、ヒストンや他の様々なタンパク質からなる、負に帯電したポリマーです。その電荷に富んだ性質から、クロマチンの構造は、伸びた10-nm線維や折り畳まれた30-nm線維、凝集体/液滴など、周囲の環境に応じて変化します。この10年新たに開発された技術によって、クロマチンは規則正しい構造ではなく、局所的に液体のようにダイナミックで、不規則な構造を持つことがわかってきました。しかし、一つのイメージング (またはゲノミックス) 手法ではクロマチン構造の一側面しか知ることはできません。また私たちは美しいイメージやモデルに感銘を受けがちですが、それらが実際のクロマチンの姿を示していない可能性があります。したがって、細胞内のクロマチンの真の姿を捉えるためには、多くの技術的アプローチに基づいた、幅広い解析を行うことが重要です。この総説論文では、クロマチンに関する現在の知見と、その知見を得るための方法についてクリティカルに論じました。
本研究は、JST CREST (JPMJCR15G2)、JSPS科研費(19K23735, 16H04746, 16H06279 (PAGS), 19H05273)、武田科学振興財団、アメリカ国立科学財団(1814012)、国立遺伝学研究所博士研究員、JSPS特別研究員(PD)の支援を受けました。
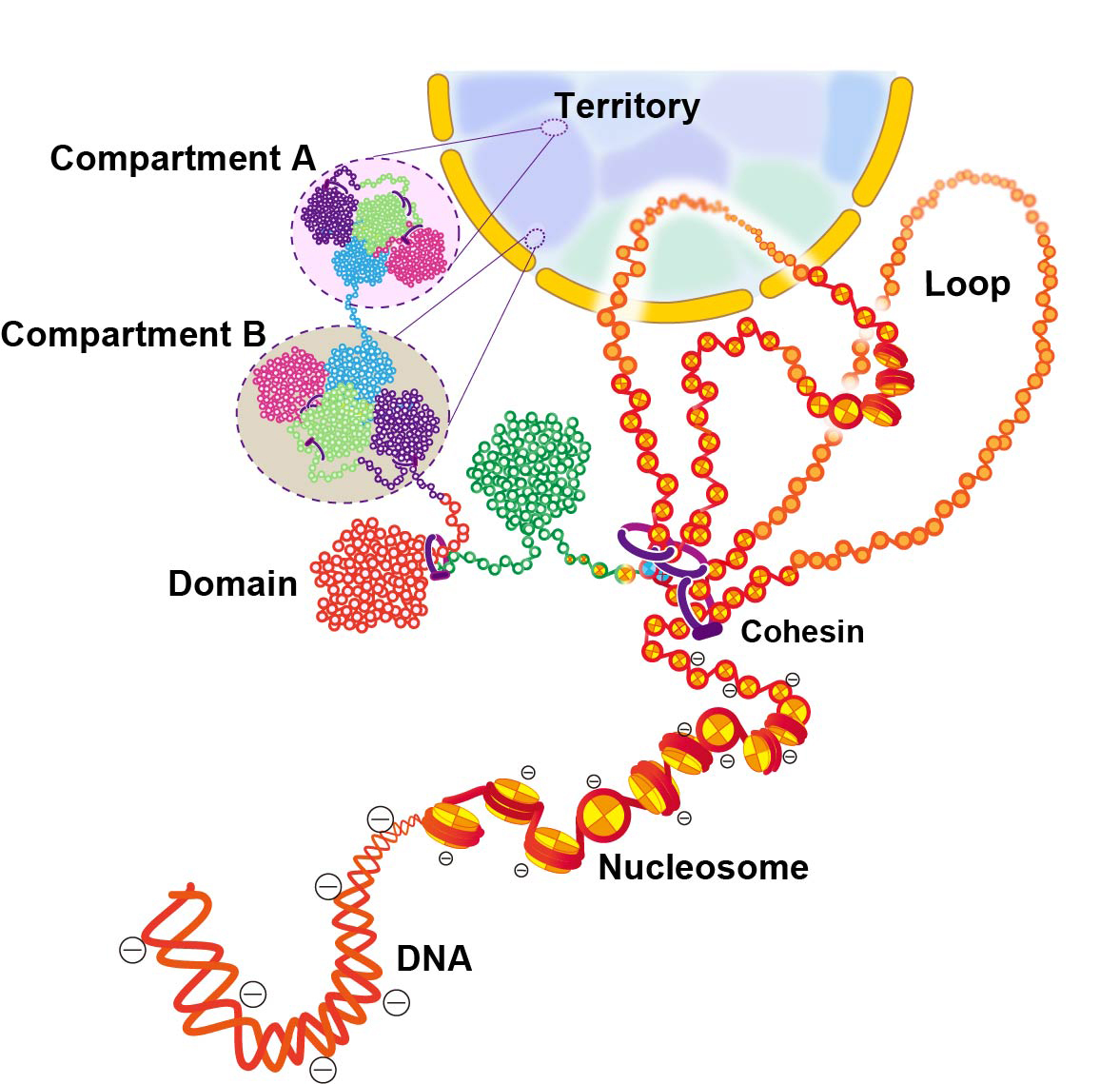
図:細胞核内のクロマチン階層構造の模式図
DNAはヒストン八量体に巻き付き、ヌクレオソームを形成している。10-nmクロマチン線維は、コヒーシンや他のタンパク質によって、ループ構造を形成する。ヌクレオソームの鎖はコンパクトなクロマチンの塊 (ドメイン) を形成し、ドメイン同士が相互作用することでコンパートメントができる。コンパートメントAとBはそれぞれ、転写がアクティブなクロマチンと、転写が不活性なクロマチンを表すと考えられている。間期の染色体は、染色体領域を形成する複数のコンパートメントからなる。この模式図は、現在考えられているモデルを単純化して示したものであり、実際はもっと複雑な階層構造を形成しているとも考えられる。
国立遺伝学研究所の入館制限について
全ての来客を禁止します。来所業者の方には、マスク及び手指のアルコール消毒の徹底と所定の場所以外(各研究棟)への出入りは控えるようにご協力をお願いします。
国立遺伝学研究所長 花岡文雄
お問い合わせ
国立遺伝学研究所 総務・企画係
E-mail: webmaster@nig.ac.jp















