Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
細胞制御研究室の杉山友希博士が令和2年度日本植物学会若手奨励賞を受賞
細胞制御研究室の杉山友希博士(日本学術振興会特別研究員)が令和2年度日本植物学会若手奨励賞を受賞しました。
この賞は 日本植物学会が、優れた研究を行う若手研究者に授与するものです。
▶ 受賞日:令和2年 9月20日
▶ 研究テーマ:二次細胞壁の形成を制御する細胞骨格付随タンパク質の研究
▶ 日本植物学会 2020年度(第17回)日本植物学会賞の選考結果報告ページ
▶ 細胞制御研究室

杉山博士より受賞のコメントが届いておりますのでご紹介します。
この度は若手奨励賞を受賞し、大変光栄に思っております。このような賞をいただけたのは特別共同利用研究員制度等による支援の下、遺伝研の恵まれた環境で研究を続けることができたおかげです。
本研究の遂行にあたりお世話になったすべての方々に厚く御礼申し上げます。
堀田凱樹 元遺伝研所長が、文化功労者に選出されました
本研究所の元所長である堀田凱樹博士が、文化功労者に選出されました。
文化功労者顕彰式は4日に東京・虎ノ門の「The Okura Tokyo」で行われます。
略歴:
1963年東京大学医学部卒、医学博士(東京大学、1968)(江橋節郎研究室)。米国カリフォルニア工科大学生物学部門博士研究員(Seymour Benzer研究室)、東京大学理学部教授等を経て、国立遺伝学研究所所長(第7代、1997~2004)、大学共同利用機関法人情報・システム研究機構長(2004~2011)。
専門は行動遺伝学、発生遺伝学、分子神経生物学。紫綬褒章受章(2013)。
功績:
堀田博士は、行動遺伝学、発生遺伝学等の分野で活躍されました。特にショウジョウバエを用いたモザイク解析と統計数理の手法から、行動異常の原因となる体の異常部位をマッピングした研究は、多くの研究者に影響を与えました。その他にも、脳細胞を構成するグリア細胞の運命決定を指示するglial cell missing (gcm)遺伝子を発見しました。また、日本にゼブラフィッシュを用いた研究を導入したのも堀田博士でした。国立遺伝学研究所では、所長としてゲノム解析や新分野創造研究の礎を作るなど、常に未来の遺伝学を意識した活動を展開されました。
転写は「液滴」によって制御されていた!
Press release
Transcriptional suppression of ribosomal DNA with phase separation
Satoru Ide, Ryosuke Imai, Hiroko Ochi, and Kazuhiro Maeshima
Science Advances 6,eabb5953(2020) DOI:10.1126/sciadv.abb5953
近年、細胞内には核小体(図1左上)のような膜のない構造体があることがわかってきました。膜のない構造体の多くは「液-液相分離」と言われ、その実態は油と水の分離に見られる原理によって作られる「液滴」です。この液滴は、試験管内ならさまざまなタンパク質によって作られることが示されている一方で、細胞の中で「どのように液滴が作られるのか?」「その液滴の変化が細胞の機能にどのように結びつくのか?」は不明でした。
ゲノムダイナミクス研究室の井手聖助教、大地弘子研究支援員、今井亮輔元総研大生、前島一博教授らの研究グループは、生きたヒト細胞の大きな液滴である核小体に着目し、その中に存在するリボソームRNA遺伝子(rDNA)と、その転写装置であるRNAポリメラーゼIの振る舞いを、超解像蛍光顕微鏡を駆使して分子レベルで詳しく観察することに成功しました。その結果、液滴である核小体において、rDNAの転写が停止することにより、新たな液滴が作られることがわかりました(図1)。重要なことに、ヒト遺伝性疾患の原因となる変異型RNAポリメラーゼIによっても、転写が停止して、同じような液滴が作られることがわかりました(図2)。
本研究により、RNAポリメラーゼIの変異が液滴の変化を起こし、リボソーム合成異常に起因するヒト遺伝性疾患を引き起こすことが明らかとなりました。本研究によって、今後、このような細胞の異常や関連疾患の理解が進むことが期待されます。また、生きた細胞内で分子の動きを追跡できる超解像蛍光顕微鏡が細胞内のさまざまな液滴を調べる上で有効であることがわかりました。
本研究は科学技術振興機構(JST) 戦略的創造研究推進事業(CREST) (JPMJCR15G2)、文部科学省科学研究費補助金・新学術領域研究「クロマチン潜在能」(JP19H05273)、科学研究費補助金(JP16H04746、JP15K18580, JP15H01361、JP16H04746)および武田科学振興財団の支援を受けて行われました。
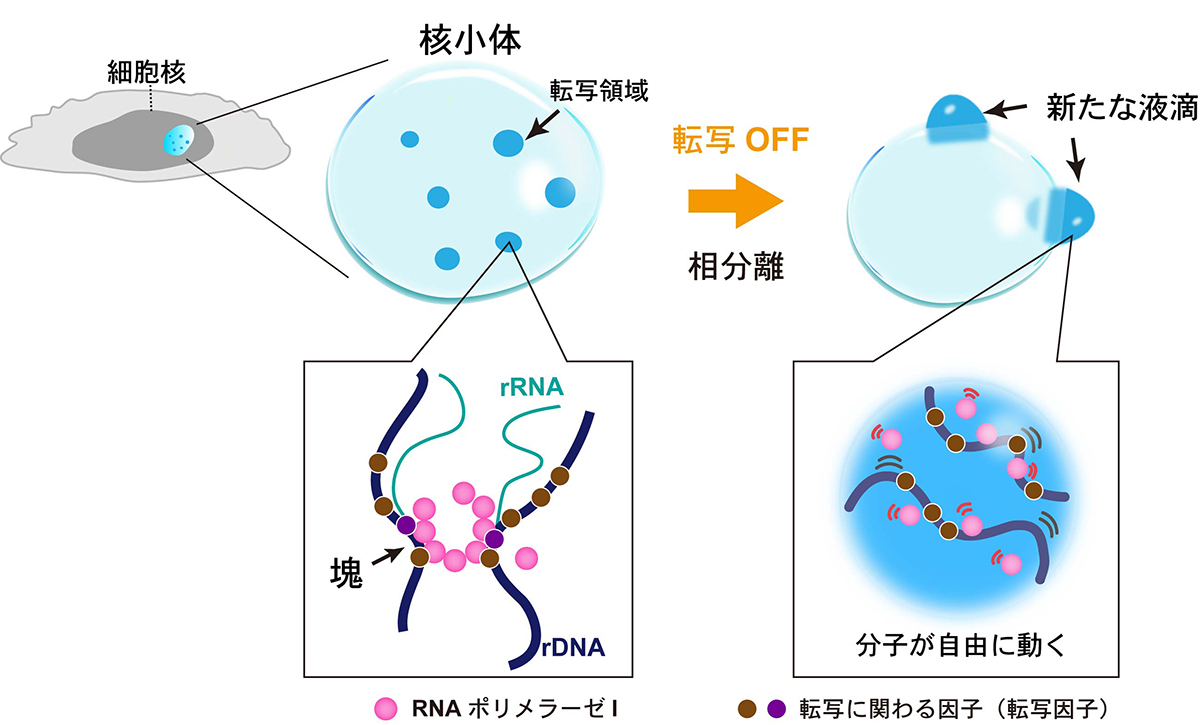
図1: (左上)細胞の核の中にある液滴である核小体(水色)。(左)リボソームRNA(rRNA)の転写が行なわれているときは、rRNA遺伝子(rDNA)とRNAポリメラーゼIが液滴全体に散らばっている(青色)。(左下)RNAポリメラーゼI(ピンク)が遺伝子(紺色曲線)上で塊を作る。(右)転写が抑えられると、散らばっていたRNAポリメラーゼIやrRNA遺伝子が集まり、新たな液滴ができる。(右下)液滴の中ではRNAポリメラーゼIがrDNAから外れ、共に自由に動き回る。
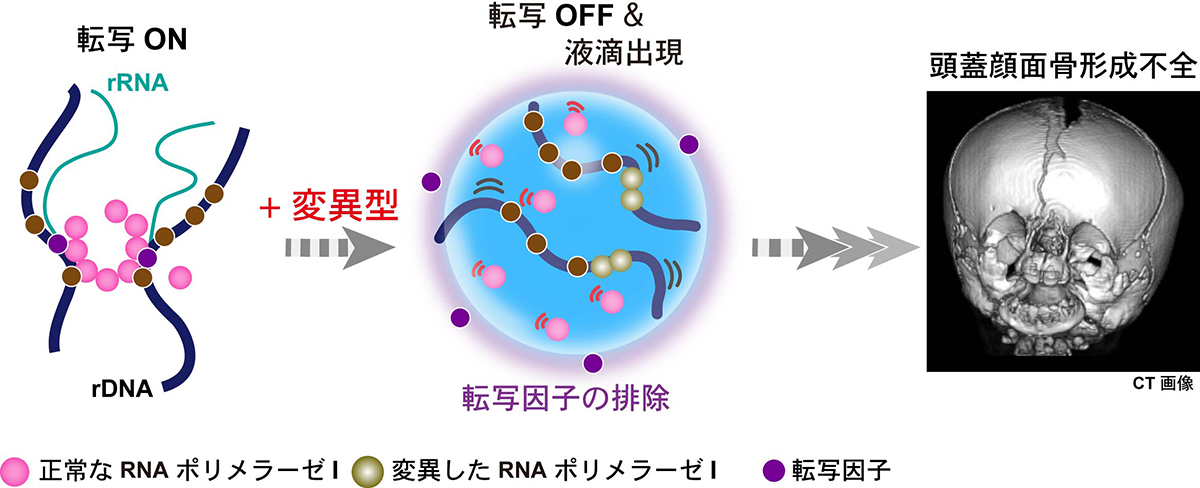
図2: ヒト遺伝性疾患の原因となる変異したRNAポリメラーゼIを発現させると、阻害剤を投与した時と同様に液滴である核小体の中に新たな液滴が作られる(中央)。その際、転写に必要なタンパク質(紫色のボール)が液滴から追いだされる(中央)。そのため液滴内に残るrRNA遺伝子と正常なRNAポリメラーゼIによる転写は起きない。このように生じるリボソーム合成過程の異常がトリーチャー・コリンズ症候群などに見られる頭蓋骨や顔の骨の形成不良を引き起こすと考えられる(右、上あごと下あごの形成異常を表す。画像提供:Cincinnati Children’s Hospital Medical Center • K. Nicole Weaver博士)。
オオコウモリ2種の全ゲノム配列を解読
-高い抗ウイルス免疫力や独自の食性進化に迫る-
Press release
Comparative genomic analyses illuminate the distinct evolution of megabats within Chiroptera
Masato Nikaido, Shinji Kondo, Zicong Zhang, Jiaqi Wu, Hidenori Nishihara, Yoshihito Niimura, Shunta Suzuki, Kazushige Touhara, Yutaka Suzuki, Hideki Noguchi, Yohei Minakuchi, Atsushi Toyoda, Asao Fujiyama, Sumio Sugano, Misako Yoneda, Chieko Kai DNA Research 2020 September 23 DOI:10.1093/dnares/dsaa021東京工業大学 生命理工学院 生命理工学系の二階堂雅人准教授、同 総合理工学研究科の張子聡大学院生、国立遺伝学研究所の近藤伸二特任准教授および東京大学 生産技術研究所の甲斐知惠子特任教授らの共同研究グループは、デマレルーセットオオコウモリとエジプトルーセットオオコウモリ(写真)の全ゲノム配列を解読しました。
オオコウモリはココウモリの一部から分岐したグループであり、その急速な適応進化については多くの研究者が注目していました。今回の研究では、全ゲノム配列を解読したオオコウモリ2種に加えて、ココウモリを含む22種の哺乳類を対象とした網羅的な比較ゲノム解析を実施し、オオコウモリ独自の進化に関わる遺伝子の探索を行いました。
その結果、オオコウモリのゲノム中において、免疫やタンパク質代謝、そして嗅覚系の遺伝子において適応進化の痕跡(用語1)を検出することに成功しました。これらはオオコウモリが持つ高い抗ウイルス免疫力や、果実食という特殊な食性の獲得と深く関連していると考えられるのです。本結果は、オオコウモリの適応進化について重要な知見を与えるだけでなく、人獣共通感染症ウイルスの感染・発症メカニズムに関わる医学研究への足がかりになると期待されます。
研究の成果は9月23日に『DNA Research』に公開されました。
遺伝研の貢献 Illumina社のHiSeq 2500システムを用いたゲノム配列の解読、ゲノムアセンブリの構築およびゲノムの注釈づけを実施いたしました。また、比較ゲノム解析による正の選択を受けた遺伝子候補の探索やRNA-seqデータを用いた遺伝子発現量解析を行いました。

図: 今回全ゲノム配列を解読したルーセットオオコウモリ 左:デマレルーセットオオコウモリ(Rousettus leschenaultia) 右:エジプトルーセットオオコウモリ(Rousettus aegyptiacus) 写真提供:長谷川政美 統計数理研究所名誉教授
「大学共同利用機関シンポジウム2020」を10月17-18日に開催
タンパク質・DNA間の結合に新機構を発見
分子の揺らぎを利用する化学ラチェットの可能性
Press release
Dependence of DNA length on binding affinity between TrpR and trpO of DNA
Nobuo Shimamoto*, Mikito Toda*, Shigetoshi Nara, Tamiki Komatsuzaki, Kiyoto Kamagata, Takashi Kinebuchi, Jun-Ichi Tomizawa *は責任著者
Scientific Reports 10, 15624 (2020). DOI:10.1038/s41598-020-71598-3
国立遺伝学研究所名誉教授 嶋本伸雄と杵淵隆(元博士研究員)、奈良女子大学教授 戸田幹人、岡山大学大学院自然科学研究科特命教授(研究) 奈良重俊、北海道大学電子科学研究所教授 小松崎民樹、東北大学多元物質科学研究所准教授 鎌形清人、国立遺伝学研究所元所長 富澤純一(故人)から成る研究チームは、DNAとタンパク質の結合に関して新たなメカニズムを発見しました。
このメカニズムは、DNA・タンパク質の結合において、これら生体分子の揺らぎが重要な役割を果たしている可能性を示唆しており、生命現象の基幹を成す原理として、新たな指針を与えることが期待できます。
本研究は、JSPS科研費、物質デバイス共同研究拠点の助成のもとに行われました。
本研究成果は、令和2年(2020年)9月24日(木)に、英国科学誌「Scientific Reports」にオンライン掲載されました。
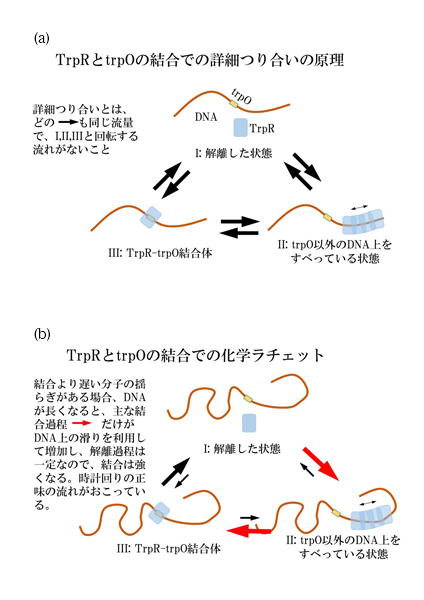
図: (a)詳細つり合いが成り立つ場合 (b)詳細つり合いが破れている場合
転写因子Ebf3は前骨芽細胞の形成を制御する
Transient and lineage-restricted requirement of Ebf3 for sternum ossification
Mao Kuriki, Fuminori Sato, Hiroyuki N Arai, Maina Sogabe, Mari Kaneko, Hiroshi Kiyonari, Koichi Kawakami, Yuki Yoshimoto, Chisa Shukunami, Atsuko Sehara-Fujisawa Development 147, dev186239 (2020). DOI:10.1242/dev.1862391. 背景 脊椎動物の発生過程において、骨芽細胞(Osteoblast)は間葉系幹細胞(mesenchymal stem cell)から分化してきます。また間葉系幹細胞は、軟骨細胞(chondrocyte)、腱細胞(tenocyte)、筋結合組織(muscle connective tissue)など骨の周辺細胞へ分化します。しかしながら、これらの細胞がどのようにできてくるのか? 詳細な細胞系譜はわかっていませんでした。
2. 結果 本研究で私たちは、ゼブラフィッシュのエンハンサートラップ系統の解析から、転写因子Ebf3がゼブラフィッシュ 稚魚期の腱細胞および筋結合組織で発現していることを見出しました。マウスにおいてEbf3をノックアウトしたところ、軟骨形成には影響を与えませんでしたが、Runx2を発現する前骨芽細胞の生成に欠損を示し、胸骨の骨化の欠損を引き起こしました。Ebf3の条件付きノックアウトマウスを作製し解析したところ、Ebf3は側板中胚葉細胞(LPM)、特に腱/筋肉結合組織細胞形成に重要であること、および胚の発生段階の9.5-10.5日において必要であることを明らかにしました。
3. 今後の期待 本研究は、側板中胚葉由来の細胞の発生文化におけるEbf3の重要な役割を示しました。Ebf3の標的遺伝子の同定側板中胚葉の分化についての詳細なメカニズムの理解につながるでしょう。
本研究は、京都大学ウィルス•再生医科学研究所瀬原敦子教授の研究室との共同研究として行われました。本研究は部分的にNBRPに支援されました。
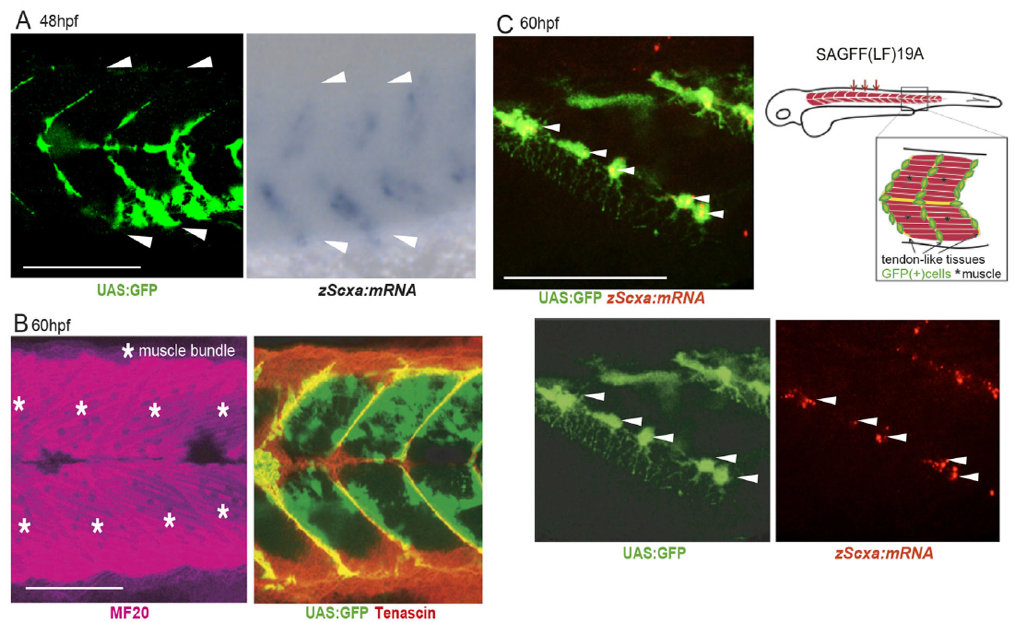
図1:ゼブラフィッシュ ebf3遺伝子トラップ系統におけるGFP(Gal4)の腱細胞および筋結合組織での発現(受精後48時間および60時間後)。
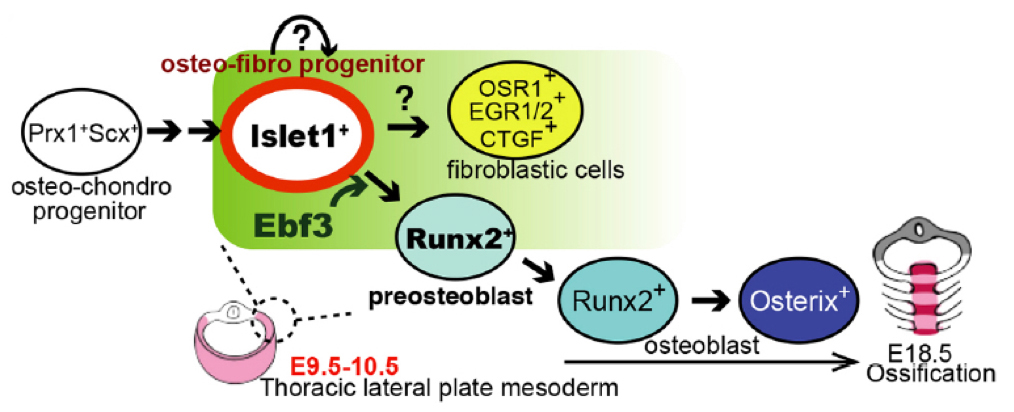
図2:前骨芽細胞形成におけるEbf3の役割。
新型コロナウイルス感染症(COVID-19)の研究データへの迅速アクセスを提供
〜「COVID-19データポータルJAPAN」を公開~
Press release
大学共同利用機関法人 情報・システム研究機構(ROIS)、機構長:藤井良一、東京都港区)の、国立情報学研究所(NII、所長:喜連川 優、東京都千代田区)オープンサイエンス基盤研究センター(RCOS、センター長:NIIコンテンツ科学研究系教授 山地 一禎)と国立遺伝学研究所(NIG、所長:花岡 文雄、静岡県三島市)の生命情報・DDBJセンター(センター長:NIG生命ネットワーク研究室教授 有田 正規)は、国内外に散在する新型コロナウイルス感染症(COVID-19)に関する研究データへ研究者が迅速にアクセスできるよう、オープンデータの調査と収集を実施し、その結果を「COVID-19データポータルJAPAN」として公開しました。

図: このポータルサイトでは、収集したCOVID-19関連の研究データやツールを分野別にリスト化しており、それぞれの説明を参考に各リソースに迅速にアクセスすることができる。
さくらインターネット株式会社と国立遺伝学研究所が包括的連携の協定を締結
【動画配信中】公開講演会2020「どこでも遺伝研」
縄文人が感染していた古代ウイルスのゲノム配列を特定
~縄文人ウイルスから解き明かすウイルス進化過程~
Press release
Identification of ancient viruses from metagenomic data of the Jomon people
Luca Nishimura, Ryota Sugimoto, Jun Inoue, Hirofumi Nakaoka, Hideaki Kanzawa-Kiriyama, Ken-ichi Shinoda, Ituro Inoue
Journal of Human Genetics 2020 September 30 DOI:10.1038/s10038-020-00841-6
過去に日本列島で生活していた縄文人のゲノム配列を調べることにより、縄文人のルーツや目の色、お酒に強いかなど、さまざまなことがわかってきました。一方で、縄文人がどのようなウイルスに感染していたのかをはじめとしてわからないことも種々残されています。
情報・システム研究機構 国立遺伝学研究所の西村瑠佳さん (総研大遺伝学専攻大学院生) と井ノ上逸朗教授らの研究グループは、縄文人の歯髄から得られたDNAを用い、そこに含まれるウイルスのゲノム配列を決定し、解析を行いました。その結果、11種類のウイルスのゲノム配列が見つかりました。中でもSiphovirus contig89 (CT89)と呼ばれるヒトの口腔内に生息するウイルスについては完全長のゲノム配列データを得ることができました。さらに現代のCT89ウイルスとゲノム配列を比較した結果、本研究で見つかったCT89のゲノム配列は、CT89の祖先型ゲノム配列を反映していることが示唆されました。
今後は、CT89ウイルスがどれくらいの速さで進化してきたのか、どのような進化過程を辿ったのかなどを詳細に解析するとともに、糞石をはじめとする縄文人化石の他の部位にも注目し、縄文人に感染していたと思われる古代ウイルスを多く見つけていく予定です。
本研究は、科研費(18H05506)によって支援されました。本研究で用いた縄文人由来の塩基配列データはヤポネシアゲノムプロジェクトで得られたデータです。
本研究成果は、日本人類遺伝学会誌「Journal of Human Genetics」に2020年9月30日午前10時(日本時間)に掲載されました。
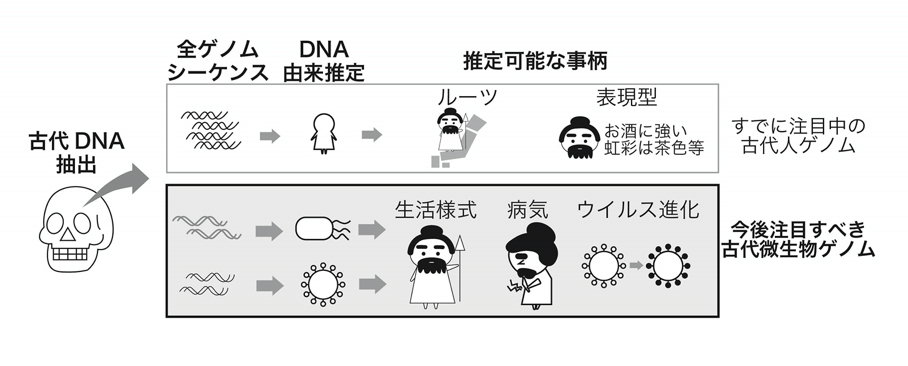
図: 古代DNAからわかるさまざまなことの今と未來
古代人骨の化石に残存するDNAを抽出し、そのゲノム配列を調べることで、どの生物由来のDNAか推定できる。多くのDNAは古代人に由来し、それらの情報によって古代人のルーツや表現型などの解析が盛んに行われてきた。
一方で、古代人骨からDNAを採取すると、古代人に感染していた細菌やウイルスに由来するDNAも含まれていることがわかってきた。細菌やウイルスのゲノム情報に注目することで、古代人の生活様式や病気、ウイルス進化について推定できる。
- 筆頭著者西村瑠佳さん (総研大遺伝学専攻大学院生) のインタビュー記事はこちら
生命ネットワーク研究室 多田さんが「研究科長賞」を受賞

総合研究大学院大学の各研究科において、特段に顕彰するに相応しい研究活動を行い、修了する学生に対し、研究科長賞が授与されます。
生命ネットワーク研究室 に所属する多田 一風太さんが、2020年度前期の生命科学研究科 研究科長賞を受賞しました。
・多田 一風太(生命ネットワーク研究室 有田研究室)
「Untargeted Metabolomics: Data Analysis Platform for All-Ion Fragmentation Mass Spectrometry」
授与式が2020年9月28日に行われ、花岡専攻長から賞状が贈られました。
多田さんは今回、遺伝学専攻の「森島奨励賞」も受賞しています。
生命ネットワーク研究室 多田さんが「森島奨励賞」を受賞

総合研究大学院大学 遺伝学専攻が独自に行っている「森島奨励賞」の選考が、2020年度前期の学位出願者に対して行われ、生命ネットワーク研究室 有田研究室に所属する多田 一風太さんが受賞しました。
・多田 一風太(生命ネットワーク研究室 有田研究室)
「Untargeted Metabolomics: Data Analysis Platform for All-Ion Fragmentation Mass Spectrometry」
授与式が2020年9月28日に行われ、花岡専攻長から賞状と研究奨励金が贈られました。
▶森島奨励賞とは
総研大遺伝学専攻で優秀な研究成果を発表して学位を取得した学生に、その研究内容を称えるとともに今後のさらなる発展を促す目的で贈られます。
▶遺伝学の先達
森島啓子名誉教授
経口投与によるRNA干渉法を用いた害虫の早期食害停止の誘発に成功
Press release
Oral RNAi of diap1 results in rapid reduction of damage to potatoes in Henosepilachna vigintioctopunctata
Yasuhiko Chikami, Haruka Kawaguchi, Takamasa Suzuki, Hirofumi Yoshioka, Yutaka Sato, Toshinobu Yaginuma and Teruyuki Niimi Journal of Pest Science 2020 September 10 DOI:10.1007/s10340-020-01276-w近年、化学農薬とは異なる害虫防除法として、RNA干渉(RNAi)法を利用した防除法(RNA農薬)が注目されています。RNA農薬は、二本鎖RNAを害虫種に投与し、RNAiを誘導することで、内在遺伝子の機能を阻害し、害虫の駆除を目指すものです。効果的なRNA農薬の実現には、最適な標的遺伝子の選定が必須となります。しかし、RNA農薬の候補としてこれまでに標的にされてきた致死や成長阻害をもたらす遺伝子の場合、効果の誘発までに時間を要するため、その間も農作物への食害が進行してしまう点が課題となっていました。
今回、基礎生物学研究所及び総合研究大学院大学の千頭康彦大学院生と新美輝幸教授らのグループは、中部大学の鈴木孝征准教授、名古屋大学の吉岡博文准教授、柳沼利信名誉教授、国立遺伝学研究所の佐藤豊教授との共同研究により、ナス科(主にジャガイモやトマトなど)の害虫であるニジュウヤホシテントウにおいてプログラム細胞死を阻害する遺伝子(diap1)の二本鎖RNAの経口投与により、 24時間以内という速効的な食害停止の誘発に成功しました。さらに、本研究成果に基づき、共同研究チームはRNA農薬の標的遺伝子選定の新たな評価基準として早期の食害停止効果を提案しました。
本研究は、総合研究大学院大学学融合推進センター、大学共同利用機関法人自然科学研究機構産学連携支援事業(01511902)などの助成を受けて行われました。
本研究成果はJournal of Pest Scienceに掲載予定で、2020年9月10日にオンライン先行公開されました。
遺伝研の貢献 遺伝研は小分子RNAによる遺伝子発現解析に貢献しました。
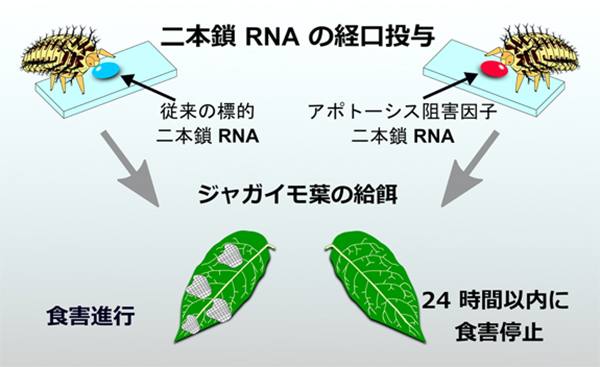
図:本研究の概略図
抗甲状腺薬の重篤な副作用である無顆粒球症の新規リスク因子としてHLA-B*39:01:01を同定
HLA-B*39:01:01 is a novel risk factor for antithyroid drug-induced agranulocytosis in Japanese population
Saya Nakakura, Kazuyoshi Hosomichi, Shinya Uchino, Akiko Murakami, Akira Oka, Ituro Inoue, Hirofumi Nakaoka
The Pharmacogenomics Journal 2020 September 22 DOI:10.1038/s41397-020-00187-4
グレーブス病は自己免疫機構により甲状腺の活動性が亢進する疾患です。グレーブス病の治療として抗甲状腺薬の投与を受けた患者のうち、0.1%~0.5%に重篤な副作用である無顆粒球症という副作用が起こります。無顆粒球症とは血液中の顆粒球(主に好中球)が500/mm3以下に低下した状態を指し、免疫力の低下によって生命の危険を伴う重症感染症を引き起こす可能性があります。抗甲状腺薬の服用によって無顆粒球症が引き起こされるメカニズムはほとんど解明されていません。しかし、特定のタイプのヒト白血球抗原(HLA)遺伝子型が無顆粒球症の発症リスクに関連することから、免疫システムを介した細胞傷害が発症機序に関わっていると考えられています。
HLAは非常に多型性の高い遺伝子群であり、人種によって多型のパターンが大きく異なることが知られています。日本人集団において、無顆粒球症発症リスクに関連するHLA遺伝子型を網羅的に探索する研究は行われていませんでした。本研究では、我々の研究室で開発したHLA遺伝子配列決定法を用いて、新たな無顆粒球症発症リスク因子の同定を試みました。
抗甲状腺薬投与後に無顆粒球症を発症したグレーブス病の患者87例および無顆粒球症を発症していないグレーブス病の患者384例に対して、次世代シーケンサーを用いてHLA遺伝子配列を決定しました。統計解析、連鎖不平衡解析、ハプロタイプ解析を行った結果、HLA-B*39:01:01を新たな無顆粒球症発症リスク因子として同定しました。HLA-B*39:01:01と無顆粒球症発症リスクの関連について再現性を確認するため、他の研究グループによる先行研究からHLA-B*39:01:01の頻度情報を抽出して再解析を行いました。その結果、中国、台湾、ヨーロッパのいずれの集団においてもHLA-B*39:01:01が無顆粒球症発症リスクと統計的に有意な関連を示すことが確認されました。これらの結果から、HLA-B*39:01:01が集団を越えた無顆粒球症発症リスク因子であることを明らかにしました。本研究によって、抗甲状腺薬によって引き起こされる無顆粒球症においてHLAを介した過敏性反応が重要な役割を果たしていることが示唆されました。
本研究は国立遺伝学研究所・井ノ上研究室の中倉沙弥(総研大遺伝学専攻)が中心となり、野口病院、金沢大学、東海大学、佐々木研究所との共同研究として行われました。
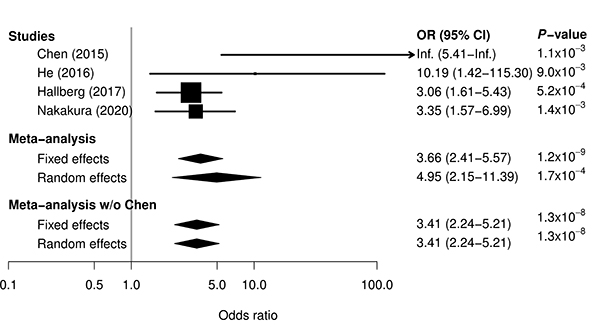
図:HLA-B*39:01:01と抗甲状腺薬によって引き起こされる無顆粒球症の関連についてメタ解析という統計手法によって評価した結果。台湾(Chen 2015)、中国(He 2016)、ヨーロッパ(Hallberg 2016)の3つの集団における先行研究からデータを抽出して再解析を行った結果、いずれの集団においても一貫して統計的に有意な関連が認められた。先行研究と本研究の結果を統合するメタ解析を行った結果、高度な統計的有意差をもって、HLA-B*39:01:01と抗甲状腺薬によって引き起こされる無顆粒球症の関連を支持するエビデンスが得られた。
生命ネットワーク研究室 川島助教が 国際生物学オリンピックの感謝状を授与されました
2020年8月11日-12日に、IBO Challenge 2020が開催されました。これは、Covid-19のために中止となった2020年度の国際生物学オリンピック長崎大会の代替イベントとして開催されたものです。
本大会の開催にあたっては、川島武士助教(生命ネットワーク研究室)がバイオインフォマティクス実技試験の作題責任者として参加しており、リモート開催時の運営としても、アマゾンジャパンおよびFusic社の協力のもと、AWSのリモートサーバを利用した実技問題の配信に尽力しました。これにより、当初の想定を上回る47カ国、186名の生徒の参加があり、成功裡に終えています。

下段 IBO Challenge 2020 記念品
目の錯覚から紐解く脳の仕組み
―錯視を用いた視覚神経回路の「要所」の発見―
Press release
An Optical Illusion Pinpoints an Essential Circuit Node for Global Motion Processing
Yunmin Wu, Marco dal Maschio, Fumi Kubo*, Herwig Baier *責任著者
Neuron 2020 September 22 DOI:10.1016/j.neuron.2020.08.027
私たち人間を含む多くの動物は、外界の動きを視覚によって感知します。この感知には、特定の方向への動きに反応する「方向選択性細胞」と呼ばれる神経細胞が中心的な役割を果たします。方向選択性細胞は、脊椎動物において脳の広い領域に数多く存在することが知られていました。しかしながら、これらの数多くの方向選択性細胞のうち、どの細胞群が視覚にとって重要な役割を担っているのかはわかっていませんでした。
情報・システム研究機構 国立遺伝学研究所の久保郁准教授らとドイツ、マックス・プランク神経生物学研究所Yunmin Wu博士、Herwig Baier博士らの共同研究グループは、モデル生物のゼブラフィッシュを用いて、目の錯覚の一つとして知られる「運動残効」を使用し、錯視刺激に反応する方向選択性細胞を探索しました。運動残効とは、一定方向に動く物を見続けると静止している物が反対方向に動くように見える目の錯覚(錯視)のことです。その結果、錯視に反応する方向選択性細胞は脳の視覚領域のひとつである前視蓋の限られた領域に存在していることがわかったのです。このようにして同定した方向選択性細胞は、ゼブラフィッシュが動きの視覚情報を感知するのに重要な役割を持っていました。(図)
本成果により、錯視反応を利用することによって、動きを感知する神経回路の鍵となる「要素」を新たに突き止める道を拓いたのです。
本研究は、マックス・プランク協会およびドイツ研究振興協会(DFG)の支援を受けて実施されました。
本研究成果は、米国科学雑誌「Neuron」に2020年9月23日0時(日本時間)に掲載されました。
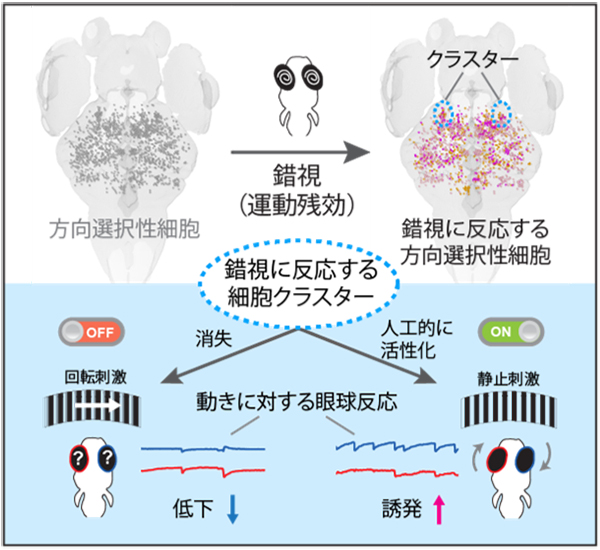
図: 錯視現象を利用した、動きを感知する神経回路の要所の発見
(上)動きに反応する神経細胞(=方向選択性細胞)は脳内に多数存在しているが、そのうち錯視に反応する神経細胞は、前視蓋にクラスターを形成していた。
(下)錯視に反応する細胞クラスターを消失させるとゼブラフィッシュは動きを視覚的に感知できなくなった(左図)。一方で、これらの細胞を人工的に活性化させると、静止したものに対しても、あたかも動きを感知しているかのような行動を示した(右図)。これらの結果から、この細胞クラスターが動きの視覚情報処理に必須であることが明らかになった。
















