Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
年末年始の帰省、忘年会、新年会等についての国立遺伝学研究所の取り組み
早いもので今年も余すところ10日弱となり、年末年始に合わせて帰省を予定されている方もいらっしゃるかと思います。また年の区切りに忘年会や新年会を計画されている方もおられるかもしれません。
残念ながら新型コロナウイルス感染のいわゆる第三波は衰えるどころか益々深刻さを増しており、年末年始に帰省した場合、高齢者や普段会っていない人々と会ったり会食をしたりと感染リスクが高くなります。忘年会や新年会も、当然ながらマスクを外して会話する時間が増え、感染の危険性が大幅に増えます。
今は特別な時期です。遺伝研では、年末年始の帰省は出来る限り控えますが、どうしても必要な場合には、往復の交通機関や帰省先でのマスクの着用、手指の消毒や大声、3密(密閉、密集、密接)を避けることや換気などの基本的な感染防止対策を徹底します。また、施設等を訪ねる場合も感染防止に極力配慮し、屋外でもマスクをすることを徹底します。併せて健康観察票による日々の健康観察も励行します。
新型コロナウイルスに年末年始はありません
私たちは気を抜かずに、慎重な判断と行動をおこないます。そして健康な体で新たな年を迎える所存です。
2020年12月23日
情報・システム研究機構
国立遺伝学研究所長
花岡 文雄
マウスの家畜化には脳の遺伝子発現の変化が関わる
Combined Change of Behavioral Traits for Domestication and Gene‐Networks in Mice Selectively Bred for Active Tameness
Yuki Matsumoto, Hiromichi Nagayama, Hirofumi Nakaoka, Atsushi Toyoda, Tatsuhiko Goto, Tsuyoshi Koide
Genes Brain Behav. 2020 December 13 DOI:10.1111/gbb.12721
動物の家畜化に重要な役割を果たす従順性は、能動的従順性と受動的従順性の2つの要素に分けることができます。8系統の近交系を遺伝的に混ぜた野生由来の混合集団を使用して、より高い能動的従順性を示す個体の選択交配を実施しました(図1A)。従順性を定量化する行動テストにより得られる9つの行動特性について分析したところ、5つの特性が世代を通じて対照群と比較して選択群で変化したことがわかりました。
そこで、 9つの特性間の関係を評価するためのクラスター分析を実施しました。その結果、選択対象とした能動的従順性は、対照群において他の行動特性に隠れてみられなかったものの、選択集団では顕著にみられるようになりました。このような能動的従順性の変化に関連する分子ネットワークを明らかにするために、家畜化に関連すると考えられる脳の海馬領域における遺伝子発現の解析を実施しました。その結果、高い能動的従順性を示す選択群と対照群では、136の遺伝子で発現量の違いが検出され、それにより遺伝子ネットワークの変化がみられることが分かりました(図1B)。
この結果は、選択交配によるマウスの家畜化で、脳の遺伝子発現の変化が生じて、それにより高い能動的従順性を示すようになったことを示唆しています。
本研究は、国立遺伝学研究所マウス開発研究室(小出研究室)の元大学院生松本悠貴(現アニコム先進医療研究所株式会社)と他の共著者らが行いました。科学研究費補助金15H01298, 15H05724, 16H01491, 15H04289, 24658240、日本学術振興会特別研究員奨励費(15J03197)などの助成により実施されました。
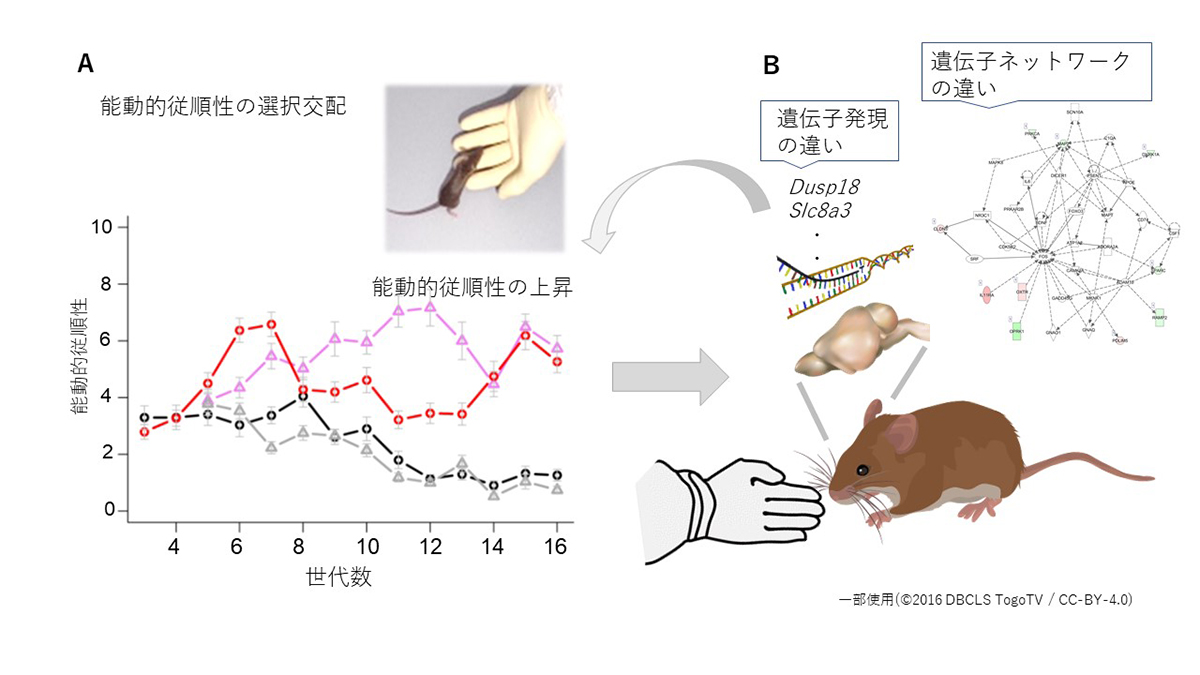
図:野生由来の遺伝的混合集団を4つの集団に分けて、2つの集団について能動的従順性について選択し、他の2つの集団は選択をしない対照群としました。A:世代が進むにしたがって、2つの選択集団では能動的従順性が増加していくのに対して、2つの対照群では顕著な増加は見られませんでした。B:選択群と対照群のマウスの脳(海馬)から採取したサンプルを用いてRNA-seq解析を行いました。その結果、選択群と対照群で発現量の異なる遺伝子が見いだされ、遺伝子ネットワークの違いも見出されました。
オンライン大学院見学会を2月17日(水)に開催(申込〆切:2月16日)
植物ミトコンドリアと葉緑体の傷ついたDNAを修復する仕組みの一端を解明
Holliday junction resolvase MOC1 maintains plastid and mitochondrial genome integrity in algae and bryophytes
Yusuke Kobayashi, Masaki Odahara, Yasuhiko Sekine, Takashi Hamaji, Sumire Fujiwara, Yoshiki Nishimura, Shin-ya Miyagishima
Plant Physiology 184, 1870-1883 (2020) DOI:10.1104/pp.20.00763
地球上の多くの生命を支える植物細胞には、呼吸を行うミトコンドリアと光合成を行う葉緑体という細胞内小器官があります。これらは、今から10〜20億年前にプロテオバクテリアとシアノバクテリアが細胞内に共生することによって誕生したと考えられており、それぞれ独自のゲノムDNAを持っています。ミトコンドリアと葉緑体のDNAには呼吸や光合成に重要な遺伝子がコードされており、DNAに傷が蓄積すると呼吸や光合成ができなくなり、最終的には植物は死んでしまいます。しかしながらこれまで、植物のミトコンドリアや葉緑体のDNAに生じた損傷がどのように修復されるのか、よくわかっていませんでした。今回、茨城大学大学院理工学研究科理学野の小林優介助教(前遺伝研 学術振興会特別研究員)を中心とした、茨城大学、国立遺伝学研究所、理化学研究所、京都大学、産業技術総合研究所からなる研究グループは、植物のミトコンドリアと葉緑体のDNAの傷を修復する仕組みの一端を明らかにしました。
傷ついたDNAを修復する代表的な機構として、相同組換え経路があります(図1A)。相同組換えでは、傷ついたDNAを同じ情報を持つDNA(相同DNA)を鋳型として利用することで修復します。相同組換えはRECAと呼ばれる組換え酵素がHollidayジャンクションと呼ばれる組換え中間体を形成することで開始され、さらにこのHollidayジャンクションが、ハサミとして機能する酵素によって切断されることで終結します(図1A)。我々は最近、葉緑体DNAが不均等分配される変異体の解析から、真核藻類と植物のみが有する葉緑体局在型のHollidayジャンクション切断酵素MOC1を発見しました (Kobayashi et al., Science 2017)。(1)しかしながら、MOC1が葉緑体DNAの相同組換え修復に関わるかどうか不明でした。(2)さらに、酵母では、ミトコンドリア型のHollidayジャンクション切断酵素CCE1が見つかっていましたが、他の生物においてはCCE1をはじめとするミトコンドリア型のHollidayジャンクション解消酵素は見つかっておらず、植物ミトコンドリアにおけるHollidayジャンクション解消機構は謎のままでした。
(1)我々はまず単細胞性藻類のクラミドモナスを用いて、MOC1が葉緑体DNAの相同組換えによる修復に寄与していることを明らかにしました。また、(2)シャジク藻類、苔類、蘚類、シダ類に加えて一部の種子植物において、MOC1が葉緑体だけでなくミトコンドリアにも局在することを示唆する結果を得ました。さらに、蘚類ヒメツリガネゴケにおいてMOC1が葉緑体とミトコンドリアの両方に局在すること、葉緑体とミトコンドリア双方のにおいてDNA修復に関与することを明らかにしました。一方で、MOC1がミトコンドリアに局在しない植物種もあり、植物ミトコンドリアの相同組換え機構が多様化していることも明らかになりました(図1B)。
本研究は、科学研究費補助金、日本学術振興会特別研究員奨励費(18J01993)、若手研究(20K15812)と基盤研究A(17H01446)などの助成によって実施されました。
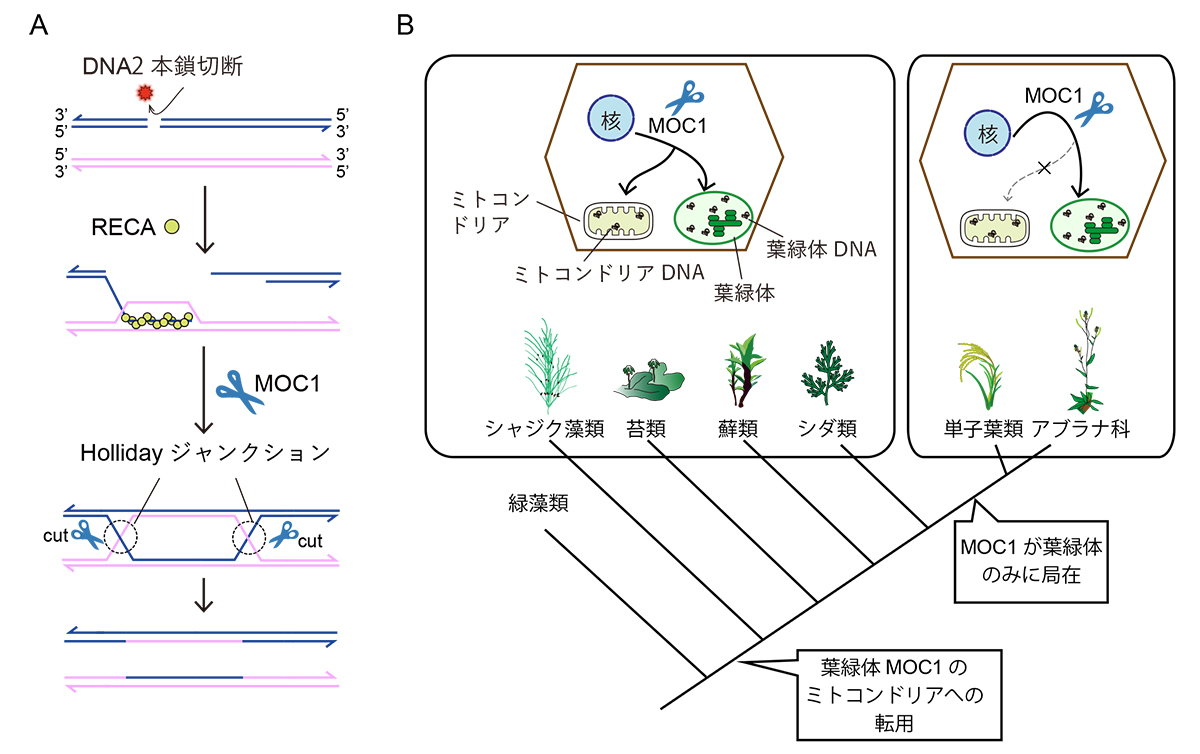
図:植物ミトコンドリアと葉緑体のDNA修復機構とその進化。A、DNA 相同組換えとHollidayジャンクション形成過程の模式図。MOC1はHollidayジャンクションを切断するハサミとして機能する。B,本研究の結果から示唆される、植物ミトコンドリアと葉緑体における相同組換え機構の進化。陸上植物進化の初期に分岐した植物種では、MOC1はミトコンドリアと葉緑体の相同組換えに必要であるが、その後、ミトコンドリアの相同組換えにMOC1を必要としない植物種が誕生したと考えられる。一方で、MOC1の葉緑体局在は藻類から植物まで観察されたことから、葉緑体におけるHollidayジャンクション解消機構は高度に保存されていると考えられる。
ヒレのリズミカルな運動をコントロールする神経回路
Neuronal Circuits That Control Rhythmic Pectoral Fin Movements in Zebrafish
Yuto Uemura, Kagayaki Kato,Koichi Kawakami, Yukiko Kimura, Yoichi Oda, and Shin-ichi Higashijima The Journal of Neuroscience 40, 6678-6690 (2020). DOI:10.1523/JNEUROSCI.1484-20.20201. 背景 中枢パターン生成器(セントラルパターンジェネレータ;CPG)は、外部からのリズミックな入力なしに、脊椎動物における歩行や遊泳の際の左右交互の動きのような、リズミックな運動出力パターンを形成する回路です。CPGは脊髄に局在しており、興奮性ニューロンと抑制性ニューロンで構成され、興奮性ニューロンがリズムそのものを駆動し、抑制ニューロンが出力のタイミングおよび活動パターンを形成していると考えられていますが、その実体―神経回路―は、よくわかっていません。
2. 結果 魚類は左右のヒレを交互に動かします。ゼブラフィッシュの幼生の胸鰭(むなびれ)の動きは、リズミカルな付属肢の動きの原型と考えることができます。片側のひれにおいては外転筋と内転筋の交互の運動(屈筋と伸筋の動きに対応)が見られ、両側のひれにおいては左右の交互の運動が見られます。本研究では、リズミカルな胸鰭の動きの基盤となる神経回路を解析しました。私たちは、外転筋と内転筋の両方の運動神経が、それぞれ活動期と非活動期にリズミカルな興奮性シナプス入力と抑制性シナプス入力を受け取ることを明らかにしました。これは、運動神経の活動がプッシュプル方式で制御されていることを示しています。さらに、dmrt3aを発現する交叉型抑制性ニューロンが外転筋運動神経に対して抑制的にはたらくことを明らかにしました。
3. 今後の期待 本研究の成果により、リズミカルなひれの動きを作り出す中枢パターン生成器(セントラルパターンジェネレータ)の神経基盤の実体についての理解が進みました。また、四肢動物の歩行の際の左右の四肢の交互の動きを生み出す神経回路の実体の解明にもつながることが期待できます。
本研究は、基礎生物学研究所 神経行動学研究部門/生命創成探究センター 東島眞一教授との共同研究として行われました。本研究は部分的に、NBRPおよびNBRP基盤技術整備プログラムに支援されました。
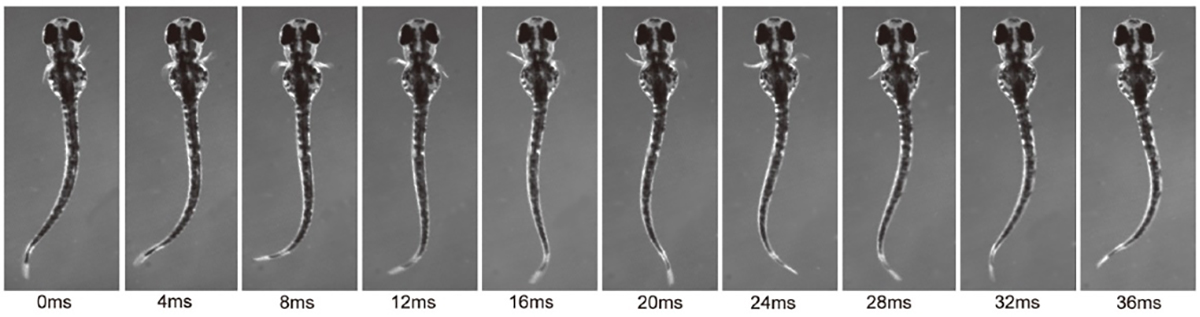
図1:ゼブラフィッシュ幼生の遊泳時における左右交互の胸鰭の動き。
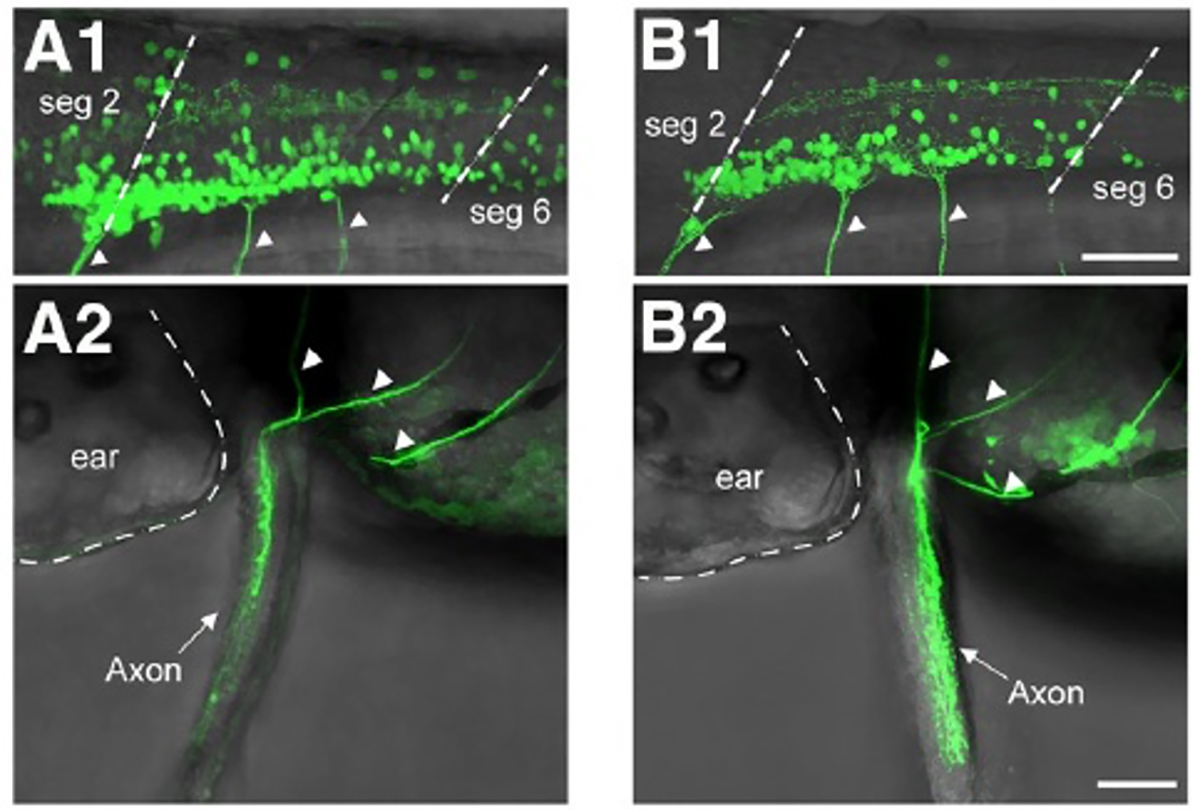
図2:A1、A2 胸鰭の外転筋を支配する運動神経をラベルしたトランスジェニックフィッシュ。 B1、B2 胸鰭の内転筋を支配する運動神経をラベルしたトランスジェニックフィッシュ。
ゲノムの可動性DNAを鎮静化する機構
RNA interference-independent reprogramming of DNA methylation in Arabidopsis
Taiko Kim To, Yuichiro Nishizawa, Soichi Inagaki, Yoshiaki Tarutani, Sayaka Tominaga, Atsushi Toyoda, Asao Fujiyama, Frédéric Berger, Tetsuji Kakutani
Nature Plants 2020 November 30 DOI:10.1038/s41477-020-00810-z
動物や植物のゲノムは、可動性で増殖する性質のDNA(transposable element: 以下TEと略する)を多量に含み、これがゲノムの不安定化や癌などの疾病の原因になります。TEを不活性化する機構として、ヒストンH3のリジン9(H3K9)のメチル化やDNAのシトシンメチル化などが知られています。このような抑制目印は、細胞分裂後にもエピジェネティックに継承、維持されます。「維持」に加え、抑制目印を「確立」するための機構として、短いRNAによるRNA干渉という機構が動物でも植物でもよく研究され、その重要性が示されてきました。
本研究では、抑制目印の「維持」に必要な因子におけるシロイヌナズナの変異体を用いて、ゲノム中のTEからこれら抑制目印が喪失した後に、抑制修飾をになう酵素を再導入することで、抑制目印の「確立」を直接調べました。その結果、驚いたことに、TE中の遺伝子コード領域(TEの増殖に必要な酵素などをコードする遺伝子領域)においては、良く知られたRNA干渉経路とは独立の経路によって、抑制目印が正確、かつ効率的に回復することがわかりました。さらに、抑制目印が回復しない少数のTEを調べることで、ヒストンH3K9meの除去に関わる酵素、ヒストンH2Aバリアント、 転写開始点付近のCG配列のメチル化、およびこれらの目印への転写からのフィードバックが抑制修飾の新規確立に重要なことが示唆されました。これらの因子は植物のみならず動物にも保存されています。本研究から明らかとなりつつある植物の抑制目印を確立する機構が、他の生物にも保存されている可能性があります。
本研究は、情報・システム研究機構 新領域融合研究プロジェクト「生命システム」として実施しました。
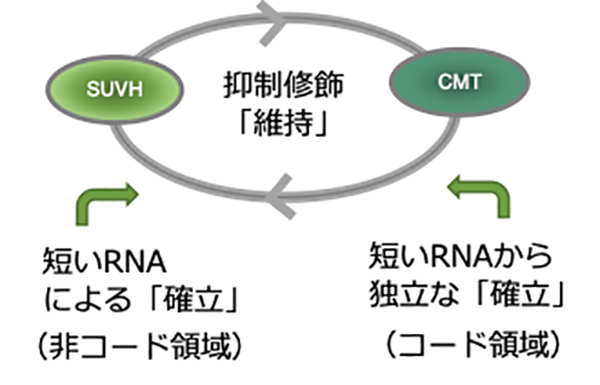
図:転移因子を抑制する機構のモデル図
SUVH(H3K9メチル化酵素)とCMT(非CG配列のDNAメチル化酵素)との相互増強によって抑制修飾が維持される。一方、抑制修飾の確立は、RNA干渉の経路に加え、これとは独立の経路がコード領域で働く。維持経路は修飾を拡張するため、RNA干渉による経路とよらない経路とが相互に補いあう。
2021年度第1回「先進ゲノム支援」支援課題の公募について
「子ども遺伝学講座」を開催
「ひとの遺伝子のふしぎ」
~君は自分の家系図を作れるかな?~
日時: 令和3年1月23日(土曜日) 午前9時30分~午前12時00分
場所: 三島市生涯学習センター3階 講義室
講師: 斎藤 成也 教授(国立遺伝学研究所 集団遺伝研究室)
対象: 三島市内の小学生4年生から6年生
定員: 30名(応募者多数の場合、抽選)
持ち物: 筆記用具
締め切り: 12/21(月)
申し込み先:
三島市政策企画課 まで お電話・電子メール・電子申請でお申込みください。
①氏名(読み仮名必須) ②通学する小学校 ③学年 ④郵便番号 ⑤住所 ⑥電話番号
をお伝えください。
ポスターのQRコード、以下の三島市ページから電子申請もできます。
E-mail: seisaku@city.mishima.shizuoka.jp
三島市ページ:https://www.city.mishima.shizuoka.jp/ipn044058.html
新型コロナウイルス感染症に関する遺伝研の対応について【2020年12月1日版】
お米(イネ胚乳)の生長を制御する遺伝子を同定
〜受粉無しでデンプンを蓄積〜
Press release
Mutation of the imprinted gene OsEMF2a induces autonomous endosperm development and delayed cellularization in rice.
Kaoru Tonosaki, Akemi Ono, Megumi Kunisada, Megumi Nishino, Hiroki Nagata, Shingo Sakamoto, Saku T. Kijima, Hiroyasu Furuumi, Ken-ichi Nonomura, Yutaka Sato, Masaru Ohme-Takagi, Masaki Endo, Luca Comai, Katsunori Hatakeyama, Taiji Kawakatsu, Tetsu Kinoshita. The Plant Cell 2020 November 25 DOI:10.1093/plcell/koaa006横浜市立大学 木原生物学研究所 木下 哲 教授、岩手大学 殿崎 薫 助教(前 横浜市立大学 特任助教)らの研究グループは、イネの可食部にあたる胚乳の発生に関する研究から、デンプン合成を含めお米の生長を制御している遺伝子を同定することに成功しました。
イネの胚乳は、花粉がめしべに受粉受精することでその生長を開始します。今回、遺伝子発現の制御機構の一つであるヒストン修飾に関わるポリコーム複合体の構成因子OsEMF2a遺伝子の機能をゲノム編集によって欠損させた変異体で、受精していない子房においても自律的に胚乳が発生して肥大し、デンプン合成過程まで進行することを発見しました(図)。このことから、受精によって開始される一連の生長過程がOsEMF2aによって抑制されていることが考えられます。
イネの花粉は環境の影響を受けやすく、例えば気温が低い際には花粉が正常に形成されず冷害の主要因になることが知られています。本研究をさらに発展させることで、花粉を用いることなく充実した胚乳(お米)を作ることのできる品種を開発できれば、環境変化に左右されることのない安定したお米の生産が可能になると期待されます。
本研究は、文部科学省科研費 新学術領域研究「植物新種誕生の原理」、日本学術振興会(JSPS)若手研究B、科学技術振興機構(JST)ALCA「人為的アポミクシス誘導技術の開発による植物育種革命」などの支援を受けて、日本、アメリカの2カ国、計7研究機関の国際共同研究として遂行しました。また本研究は公募型共同研究「NIG-JOINT」の成果です。
本研究は『The Plant Cell』に掲載されました。(11月24日オンライン)
遺伝研の貢献 実験材料の育成と試料収集などで本研究に貢献しました。
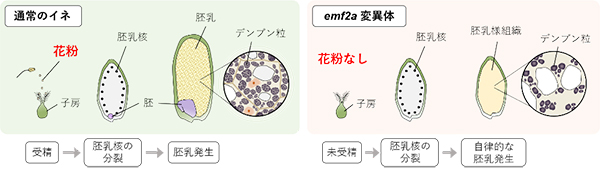
図: 通常のイネにおける胚乳発生(左)とemf2a変異体における自律的な胚乳発生(右) emf2a変異体では花粉を受粉しない場合でも、受粉した通常イネと同様に胚乳が肥大し、デンプン粒が形成される。
【大学院生対象】2021年度特別共同利用研究員 随時受入中
染色体DNAをつかまえろ!〜コヒーシンローダーの役割〜
DNA Binding by the Mis4Scc2 Loader Promotes Topological DNA Entrapment by the Cohesin Ring.
Yumiko Kurokawa and Yasuto Murayama.
Cell Reports 33, 108357(2020) DOI:10.1016/j.celrep.2020.108357
生命の遺伝情報はDNAに書き込まれており、細胞の核内で染色体のかたちでコンパクトにまとめられています。細胞分裂時にはコピーされた後に一時的に割り箸のように接着しています(姉妹染色分体間接着)。姉妹染色分体間接着の形成は遺伝情報を均等に分配されるために必須であり、「コヒーシン」と呼ばれるリング状のタンパク質がそのリングの中にDNAを2本取り込むことで、DNA同士を束ねていると考えられています。しかし、コヒーシンがDNAをリング内に取り込む(トポロジカルなDNA結合)詳細なメカニズムは明らかになっていませんでした。
新分野創造センター・染色体生化学研究室の黒川裕美子特任研究員と村山泰斗准教授は、分裂酵母コヒーシンの姉妹染色分体間接着の形成に必須のコヒーシンローダータンパク質Mis4に着目しました。Mis4はこれまでの研究からコヒーシンのトポロジカルなDNA結合を促進することが明らかになっていますが、Mis4がどのようにコヒーシンの反応を促進するのかは不明でした。今回の研究により、Mis4が2か所でDNAと直接結合することが明らかとなり、このDNA結合によってコヒーシンーDNA―Mis4の3者複合体の形成だけでなく、コヒーシンリング内へのATPase依存的なDNAの取り込みが可能となることが明らかになりました。
本成果によりコヒーシンの染色体結合に重要なメカニズムが明らかになりました。コヒーシンやローダーの機能欠損は様々な疾患や不妊と相関があることが知られており、これらの原因究明や予防治療法の開発に繋がると期待されます。
本研究成果は、2020年11月10日 (米国東部時間) に米国科学雑誌 Cell Reports に掲載されました。
本研究は、科学研究補助金 (19H03160)、武田科学振興財団特定助成、内藤記念科学奨励金の支援を受けておこなわれました。
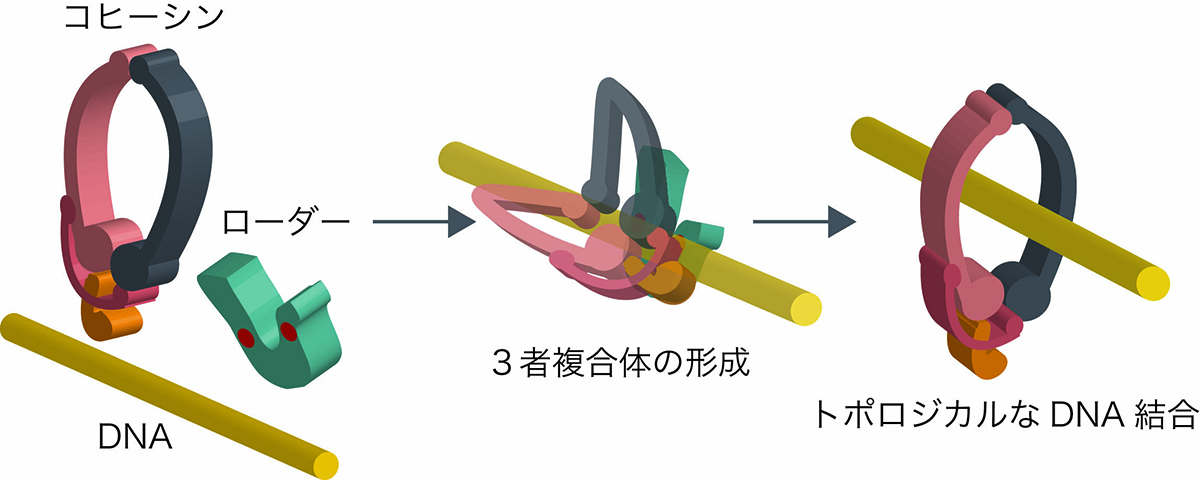
図:ローダーによるコヒーシンのトポロジカルなDNA結合促進モデル。DNAはローダーとコヒーシンに挟み込まれる形となり、安定な3者複合体が形成される (赤丸が同定したDNA結合部位)。その後、コヒーシンの構造変化が促されてリングの一部が開けられ、DNAがリング内へ押し込まれることでトポロジカルなDNA結合が完了する。
遺伝学的タンパク質除去:AID2による細胞及びマウス個体におけるタンパク質高速分解
Press release
The auxin-inducible degron 2 technology provides sharp degradation control in yeast, mammalian cells, and mice
A Yesbolatova, Y Saito, N Kitamoto, H Makino-Itou, R Ajima, R Nakano, H Nakaoka, K Fukui, K Gamo, Y Tominari, H Takeuchi, Y Saga, K Hayashi, MT Kanemaki
Nature Communications 11, 5701(2020) DOI:10.1038/s41467-020-19532-z
タンパク質の働きを調べるには、そのタンパク質を除去して何が起きるのかを調べることが有効です。また、狙ったタンパク質の除去を任意のタイミングで制御できれば、タンパク質の機能を制御することができます。このようなニーズの中で、近年、「プロテインノックダウン」と呼ばれる、細胞内のタンパク質分解系を利用して標的タンパク質を分解する方法が注目されています。
国立遺伝学研究所の鐘巻将人教授を中心とする研究グループは、目印になる「デグロンタグ」を付加したタンパク質を分解除去する「AID2法」を開発し、出芽酵母、培養細胞、マウス個体において本方法が機能することを示しました。この方法では、タンパク質の分解を5-Ph-IAAという化合物と変異型TIR1ユビキチンリガーゼによって制御します。本技術により、狙ったタンパク質を必要な時のみ、素早く分解除去することが可能になったのです。AID2法を利用したタンパク質の発現操作は、生命科学の基礎研究に役立つのみならず、医学および創薬研究にも役立つことが期待されます。
本研究は国立遺伝学研究所の鐘巻将人教授が中心となり、同研究所の相賀裕美子教授、岡山理科大学の林謙一郎教授、東京大学の竹内春樹特任准教授、佐々木研究所の中岡博史部長、ファイメクス株式会社による共同研究により行われました。
本研究は日本学術振興会科研費(16K15095, 18H02170, 18H04719, 20H05396)、科学技術振興機構A-STEP(AS2915150U)、武田財団特定研究助成、AMEDナショナルバイオリソースプロジェクト基盤技術整備プログラムの支援により遂行されました。
本成果は英国科学雑誌Nature Communicationsに2020年11月11日(水)午後7時(日本時間)に掲載されました。
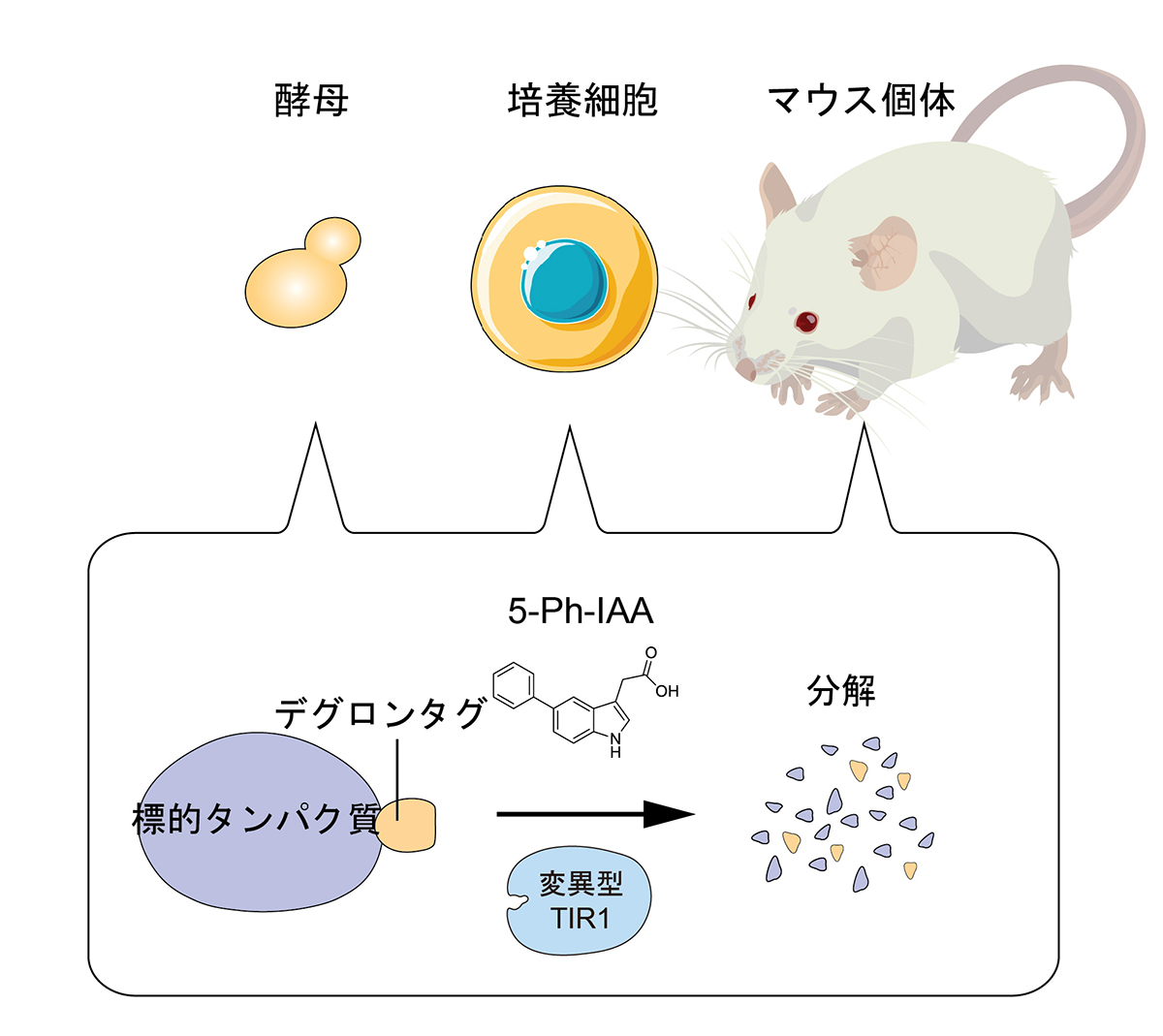
図: AID2により、酵母、培養細胞、マウス個体において迅速な標的タンパク質分解制御が可能になった。
- EurekAlert! の関連記事(英語) Genetic eraser: Newly developed technology precisely and rapidly degrades targeted proteins
- ファイメクス株式会社による別の視点からのニュースリリースはこちら
- 鐘巻将人教授のインタビュー記事(英語)はこちら
2020年度冬に実施する入学者選抜試験に関する重要なお知らせ
2020年度冬に実施する入学者選抜試験における英語能力評価に関するお知らせ
第3回「寺deサイエンス」を開催:12月10日(木)
日 時: 令和2年12月10日(木)19:00~21:00
場 所: 君澤山 蓮馨寺(三島市広小路町1-39)
内 容:
第1部:コンピューターグラフィクスによる科学的再現
~「Nスぺ恐竜超世界」制作舞台裏~
講演:植田和貴氏(NHKエンタープライズ自然科学番組 チーフ・ディレクター)
鼎談:植田和貴氏、
五條堀孝 (遺伝学普及会 共同代表理事、KAUST特別栄誉教授)、
小林武彦 (遺伝学普及会 共同代表理事、東京大学教授)
第2部:遺伝学から見た新型コロナウィルス
鼎談:中川草氏(東海大学医学部講師)、五條堀孝、小林武彦
対 象: サイエンスに関心のある一般の方
定 員: 200人(Zoomでのライブ配信参加)、20人(収録場所での参加)
12/9正午 申込〆切(先着順)遺伝学普及会維持会員 は優先します。
参加費: 無料(Zoomでのライブ配信参加)、1000円(収録場所での参加)
お申込: 専用フォーム
【問い合わせ】
〒411-8540 三島市谷田1111
公益財団法人遺伝学普及会
TEL:055-981-6857、 FAX:055-981-6877
Email:genetics@nig.ac.jp
旭化成ファーマとの創薬バイオインフォマティクス分野での連携について
母性のホルモン:「オキシトシン」がオスの交尾行動を脊髄レベルで 促進する新たな局所神経機構‘ボリューム伝達’を解明
Press release
Oxytocin influences male sexual activity via non-synaptic axonal release in the spinal cord.
Takumi Oti, Keita Satoh, Daisuke Uta, Junta Nagafuchi, Sayaka Tateishi, Ryota Ueda, Keiko Takanami, Larry J. Young, Antony Galione, John F. Morris, Tatsuya Sakamoto, Hirotaka Sakamoto Current Biology 2020 October 29 DOI:10.1016/j.cub.2020.09.089岡山大学大学院自然科学研究科(理)の坂本浩隆准教授と神奈川大学理学部生物科学科の越智拓海特別助教(研究当時、大学院自然科学研究科院生)、川崎医科大学、富山大学、国立遺伝学研究所、米国エモリー大学、英国オックスフォード大学の国際研究グループは、脳で合成される母性のホルモン、「オキシトシン」が哺乳類の脊髄に存在する勃起/射精専用回路(性機能センター)を活性化させ、オスの交尾行動を促進させることを明らかにしました。これらの研究成果は、日本時間10月30日0:00(米国東部時間10月29日11:00)、米国のCell Pressより発行されている科学雑誌「Current Biology(カレントバイオロジー)」に掲載されます。
これまで脊髄の性機能センターが脳からどのようにコントロールされているのかはわかっていませんでした。今回、間脳視床下部に存在するオキシトシン・ニューロンが、脳から遠く離れた脊髄まではたらきかけ、脊髄レベルでオスの交尾行動を促進させることを明らかにしました。さらに、この脊髄におけるオキシトシンの作用は、いわゆるシナプス結合を介した‘配線伝達’ではなく、オキシトシンによる新たな局所神経機構‘ボリューム伝達’ を介したものであることも明らかにしました。この新たな脊髄内局所神経機構は、Wi-Fiとシステムが似ており、シナプスによる‘配線伝達’を‘Ethernet’と喩えるならば、‘ボリューム伝達’は‘Wi-Fi’と喩えることができるかもしれません。
本研究成果により、オスの性機能専用の脳-脊髄神経回路とその調節メカニズムが明らかとなり、今後、心因性の性機能障害の治療法の開発に寄与できることが期待されます。
遺伝研の貢献 ex vivo免疫電子顕微鏡解析、実験動物への薬物微量投与、および行動解析に貢献しました。
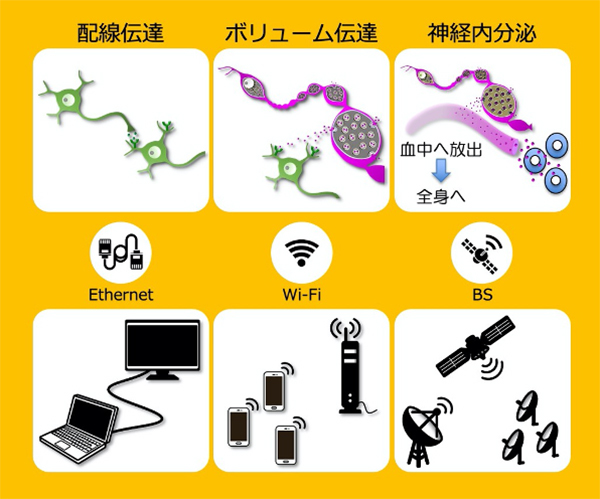
図: 作用部位まで軸索突起をのばし、脳から遠く離れた脊髄で局所的に放出・拡散されることによってコミュニケーションする新たな脊髄内局所神経機構‘ボリューム伝達’を明らかにしました。ボリューム伝達は、配線伝達(シナプス系)と神経内分泌系の2つの要素をあわせ持っていると考えられます。ホルモンによる神経内分泌は、血流を介して全身に作用するシステムで、いわば‘BS(Broadcasting Satellite)放送’のようなものです。シナプスによる‘配線伝達’を‘Ethernet’と喩えるならば、‘ボリューム伝達’は、‘Wi-Fi’と喩えることができるかもしれません。
カブトムシの角の形を決めるメカニズムを明らかに
〜「折り畳み方」を決める仕組み〜
Press release
Genetical control of 2D pattern and depth of the primordial furrow that prefigures 3D shape of the rhinoceros beetle horn.
H Adachi, K Matsuda, T Niimi, S Kondo, H Gotoh
Scientific Reports 10, 18687 (2020) DOI:10.1038/s41598-020-75709-y
カブトムシの角は蛹への脱皮の時に「突然」現れます。これは脱皮に先立って、幼虫の頭の殻の内側で角を「折り畳んだ状態」で作り、脱皮時にエアバックのように角を展開することで可能になっています。この角のもとになる「原基」の折り畳みが、角の最終形態を決めますが、どのようなメカニズムが折り畳みパターンを決めているのかはわかっていませんでした。
情報・システム研究機構 国立遺伝学研究所の後藤寛貴博士研究員、大阪大学の近藤滋教授、基礎生物学研究所の新美輝幸教授らの研究グループは、カブトムシの角の形成に関わることが知られる様々な遺伝子の機能を失わせたときに、どのように原基の折り畳みパターンが変わるかを調べました。その結果、折り畳み皺(しわ)の「深さ」のみが変わるケースと、皺の「方向(パターン)」のみが変わるケースがあることが分かりました。これにより、皺の「深さ」と「方向」は異なる独立したメカニズムで決まっていることが示されたのです。
角の原基の折り畳み皺の「深さ」と「方向」のどちらが変わっても、角の最終的な形態は変化しました。昆虫の角形成メカニズムはこれまでも研究されてきましたが、今回、「折り畳み皺」に着目したことで複数の異なる分子メカニズムが独立に角形成や角の形の決定に関わっていることがわかりました。
世界のカブトムシの仲間には角を持つ種類が多く、その角の形や大きさは様々です。これらカブトムシのそれぞれの角の形はいずれも原基の折り畳み皺によって決まっていることが予想されます。今後は、種間で角の形状が異なる要因が皺の「深さ」なのか「方向」なのか、あるいは両方なのかを調べることで、多様な角の形態を作り出すメカニズムが明らかになると期待されます。
本研究は、科研費 新学術領域「3Dロジック」の支援を受けて行われました。
本研究成果は、英国科学雑誌「Scientific Reports」に2020年10月29日午後7時(日本時間)に掲載されました。
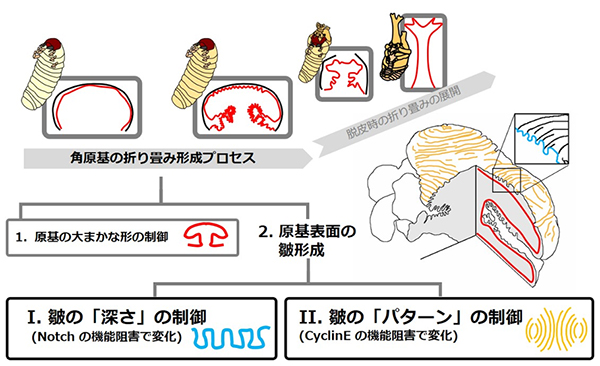
図: カブトムシの角は、脱皮に先立って「折りたたまれた状態で」作られる。どのような「折り畳み皺」を作るかで最終的な角の形が決まる。本研究では、原基表面の皺に着目し、その深さとパターンは異なる分子メカニズムで制御されていることを明らかにした。
- 後藤寛貴博士研究員のインタビュー記事はこちら

















