Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
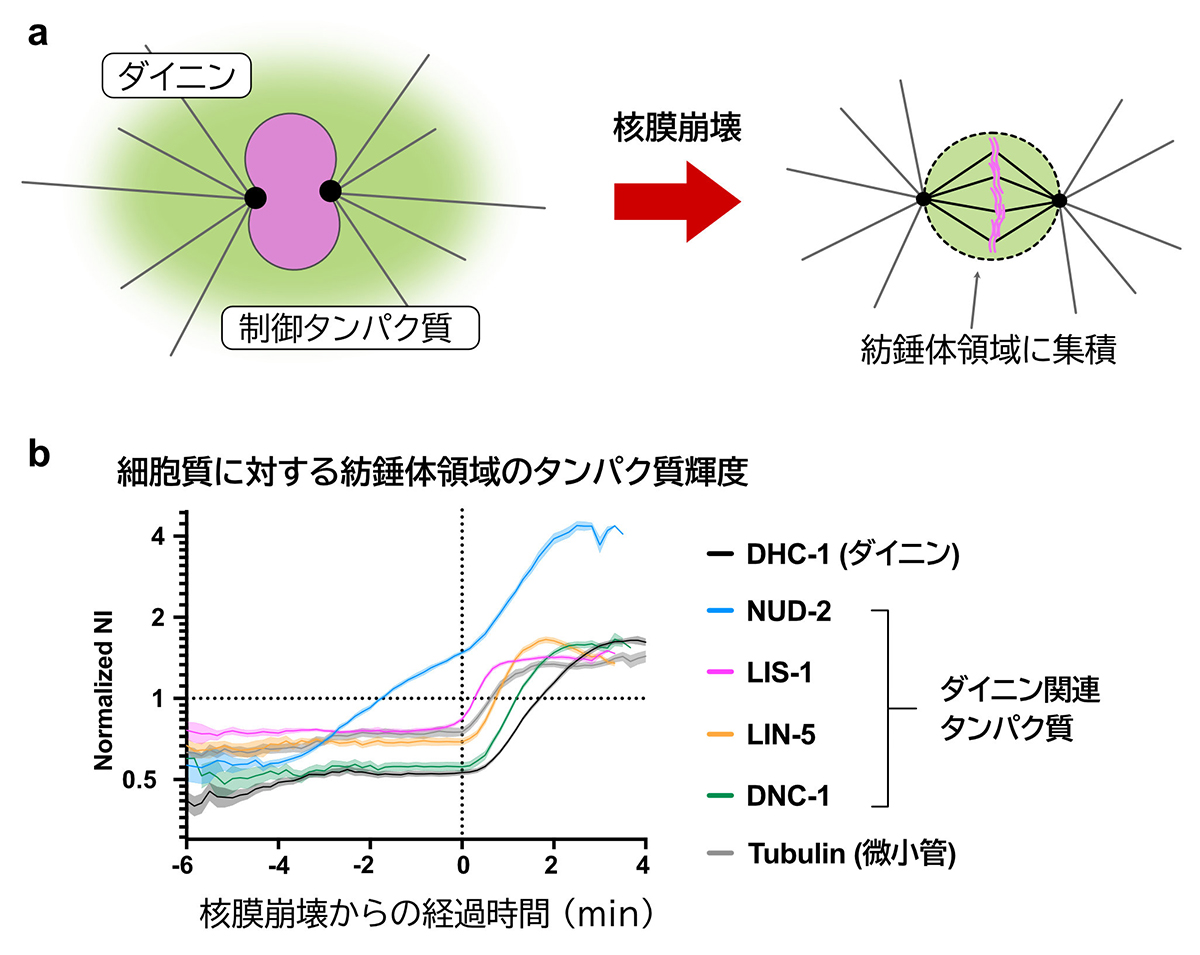
モータータンパク質「ダイニン」は、その制御因子群と細胞内で適切な順番で出会う
Sequential accumulation of dynein and its regulatory proteins at the spindle region in the Caenorhabditis elegans embryo
Takayuki Torisawa, & Akatsuki Kimura
Scientific Reports (2022) 12, 11740 DOI:10.1038/s41598-022-15042-8
細胞の中では、物質の輸送や染色体の分配など、ものを運ぶために力が必要とされる場面が多くあり、そのような細胞内での力発生の多くは、分子モーターと呼ばれるタンパク質酵素によって担われています。その分子モーターの中でも、細胞質ダイニンといわれるタンパク質は、細胞の分裂や細胞内での物質輸送など、多岐にわたるプロセスを通じて生命活動の維持に役立っています。ダイニンはその様々な細胞での役割を担うために、多くの「ダイニン制御因子」による制御を受けることが知られており、ダイニンは場所や役割に応じて複数の制御因子と会合し多様な複合体を形成します。これらの複合体が分子レベルでどのような構成のもとでどのような振る舞いをするのか、精製したタンパク質分子を用いた試験管内再構成実験から多くのことが明らかになりつつあります。その上で、実際の細胞の中でダイニンがどのようにして適切なタイミングで適切な場所において適切な制御因子と出会うことができるのかを知ることが、課題となっていました。
このたび、細胞建築研究室の鳥澤助教と木村教授は、線虫C. elegansの初期胚を用いて、細胞が分裂する際にダイニンなどのタンパク質が紡錘体が形成される領域に集積する過程を観察し、細胞内でのダイニン制御に関連する知見を得ました。 本研究では、紡錘体領域へのタンパク質集積現象(図a)について、i) 選択性、ii) 集積場所の違い、さらに iii) 集積順序があることが明らかになりました。選択性とは、「ダイニン制御因子」の中でも集積するものとそうでないものとの間にはっきりとした違いがあるということを指しています。集積場所の違いとは、集積するものの中でも紡錘体のどの場所に集積するかがタンパク質ごとに異なっているということを指しています。いくつかのタンパク質は紡錘体を形成する微小管や染色体ではない領域に集積することが明らかになりました。さらに、鳥澤助教らは、タンパク質が集積する過程の時系列を解析することで、集積がある順序に従って生じていることも明らかとしました(図b)。ここで明らかになった集積順序は、過去の研究から明らかになっていたダイニンの制御の仕組みと照らし合わせると、理にかなったものであり、細胞内では効率的にダイニンを活性化するように、ダイニン制御因子との出会いが時間的にも空間的にも制御されていることが示唆されました。
さらに、鳥澤助教らは順序だった集積の中でも最も早く集積してくるタンパク質であるNUD-2とよばれるタンパク質に着目して研究を続けました。このタンパク質の早期集積が他のタンパク質が集積状態を維持するのに寄与していることを明らかにし、さらに早期集積に必要なNUD-2のアミノ酸領域の特定も行いました。
この過程において開発された線虫胚に対するタンパク質インジェクション法は、分子モーターや細胞分裂の研究を超えて、幅広い目的に対して役立つものであることが期待されます。
本研究で得られた結果は、ダイニンの細胞内での制御複合体形成のダイナミクスの理解を進めると同時に、紡錘体が形成されるときにタンパク質が集められるメカニズムとして普遍的な制御を含んでいると考えられます。
本研究はJSPS科研費 JP19K16094、JP18H02414、 JP18H05529 、JP18KK0202 の支援を受けて行われました.
本研究成果は科学雑誌「Scientific Reports」に2022年7月11日に掲載されました。
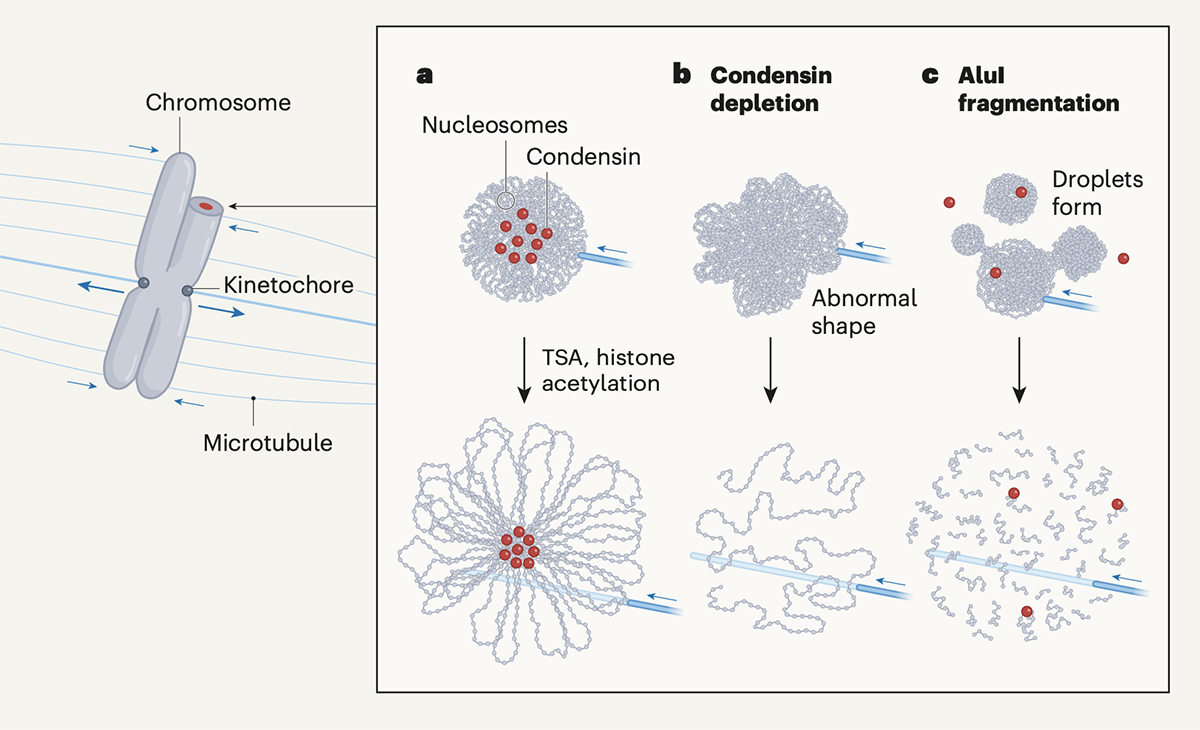
染色体は相転移する
A phase transition for chromosome transmission when cells divide
Kazuhiro Maeshima
Nature 2022 August 03 DOI:10.1038/d41586-022-01925-3
染色体は細胞分裂の際、DNAがコンパクトに凝集した構造体で、次世代へ受け渡される遺伝情報そのものです。この染色体は微小管などから物理的な力を受けることで、母細胞から娘細胞へと分配されます。つまり、染色体はこのような力に耐えうる、機械的強度を持つ必要があります。
最近、Vienna BioCenterのDaniel W. Gerlich博士らのグループは、染色体が相転移することによって凝縮し、そのような機械的強度を得ていることを明らかにしました(Schneider et al. “A chromatin phase transition protects mitotic chromosomes against microtubule perforation” Nature (2022) doi: 10.1038/s41586-022-05027-y)。本論文では分裂期染色体においてヒストンがグローバルに脱アセチル化されることでクロマチンの相転移が起き、染色体が凝縮して物理的な力に耐性を持つようになることを報告しています。また染色体凝縮に必須であるとこれまで考えられてきたコンデンシンと呼ばれるタンパク質複合体は、染色体の凝縮そのものには関与しないことも示されました。
ゲノムダイナミクス研究室の前島一博 教授は本論文に対する解説論文をNature誌のNews & Views欄に執筆しました。前島教授は本論文への解説と共に、ヒストンの脱アセチル化がどのように染色体の凝縮を引き起こすのか?を議論し、また、棒状の染色体を形作るためのコンデンシンの役割(クロマチンループ形成メカニズム)を考察しています。
オンライン特別講義「生態遺伝学入門」の見逃し配信 のお知らせ
遺伝研・生態遺伝学研究室の北野潤教授により、 2022年 4/25から 7/11に、 6回にわたって「生態遺伝学入門」のオンライン特別講義を実施しました(下記)。 Zoomの人数制限上 300名までしか登録できず、募集を始めてから数日で定員に達し、募集を閉じざるを得ませんでした。このたび、講義の様子を収録した動画と資料を登録者限定で見逃し配信いたします。全国の大学・研究所の学生さん、ポスドク研究員、その他にも新たに生態遺伝学を学びたい研究者の方々の登録をお待ちしています。
日程と講義内容(全6回)
| (1) | 生態遺伝学のための集団遺伝学 |
| (2) | 適応進化(適応度から遺伝子へ) |
| (3) | 適応進化(ゲノム配列から適応遺伝子を探る) |
| (4) | 適応進化の分子メカニズム |
| (5) | 種分化の遺伝・ゲノム学 |
| (6) | 性的二型の進化・性染色体進化など |
講師陣:
ファシリテーター:山﨑曜(遺伝研・生態遺伝学研究室・助教)・石川麻乃(東大・新領域・准教授)
配信登録: こちらから ご登録ください 配信は終了しました
(確認メールが届かない場合は、スパムメールと認識されていることがありますので、迷惑メールフォルダ等をご確認ください。)
閲覧期限: 2022年 12月末
昆虫類の形態に雌雄差をもたらす仕組みの進化的起源を推定
プレスリリース
Evolutionary history of sexual differentiation mechanism in insects
Yasuhiko Chikami, Miki Okuno, Atsushi Toyoda, Takehiko Itoh, Teruyuki Niimi
Molecular Biology and Evolution (2022) 39, msac145 DOI:10.1093/molbev/msac145
カブトムシのオスは「角」でメスを巡り争い、オスのスズムシは翅に備わる「発音器官」を奏してメスを誘います。このように、昆虫類の形態には、繁殖の成功に基づく淘汰の結果として、様々な雌雄差(性的二型)を認めます。昆虫類の性的二型は、doublesexと呼ばれる遺伝子で制御されることが知られています。完全変態類昆虫のdoublesexは、雌雄で異なるスプライシング調節を受け、ひとつの遺伝子にもかかわらず、性的二型形成に関する遺伝子の転写を雌雄で正反対に調節して、雌雄それぞれの特徴の形成を制御します。昆虫類以外の節足動物の研究から、doublesexは、進化の過程で、元々オスの形態形成を促進していましたが、後にメスの形態形成を促進する機能を獲得したと推定されています。doublesexが如何にメスの形態形成への機能を獲得したかという疑問は、動物の性に関する謎の一つです。
今回、基礎生物学研究所 進化発生研究部門の千頭康彦研究員(元・総合研究大学院大学 大学院生)と新美輝幸教授、久留米大学の奥野未来助教、国立遺伝学研究所の豊田敦特任教授、東京工業大学の伊藤武彦教授からなる研究グループは、昆虫進化の初期に出現したシミ類に着目してdoublesexの機能を解析し、その祖先状態を推定しました。その結果、シミ類マダラシミのdoublesexは雌雄で異なるスプライシング調節を受けますが、メスの形態形成への機能をもたないことが明らかになりました。一方、マダラシミのdoublesexは幾つかの遺伝子の発現をメスで促進することが分かりました。これらの結果は、doublesexは昆虫進化の初期段階で既に雌雄で異なるスプライシング調節を受け、メスに特異な幾つかの遺伝子の発現を促進する機能をもち、そして完全変態類出現後にメスの形態形成に対する機能を獲得した可能性が高いことを示唆しています。では、doublesexのどのような変化がメスの形態形成への機能と関連したのでしょうか。本研究では、メスの形態形成に対する機能をもつ種のDoublesexタンパク質に特有なアミノ酸配列を発見しました。この結果から、本研究は、アミノ酸配列の変更によってdoublesexは新機能を獲得したとする仮説を提唱しました。本研究成果は、有翅昆虫類と昆虫類以外の節足動物との間にあった知見のギャップを埋めることに成功し、doublesexの特殊な進化史を新たに推定するものです。
本研究は、科学研究費助成事業(JP25660265, JP16H02596, JP16H06279 [先進ゲノム解析研究推進プラットフォーム(PAGS)])と日本科学協会の笹川科学研究助成による支援を受けて遂行されました。
本成果は、日本時間2022年7月13日付で「Molecular Biology and Evolution」誌に掲載されました。
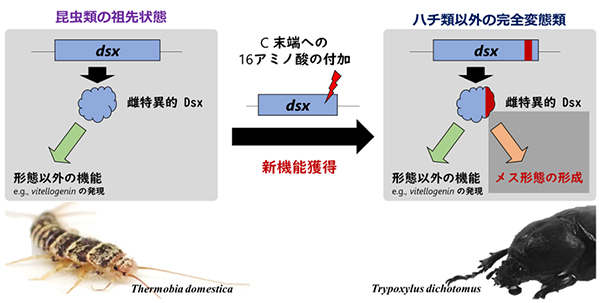
昆虫類の祖先状態を保持していると推定される代表としてマダラシミThermobia domestica、ハチ類以外の完全変態類の代表例としてカブトムシTrypoxylus dichotomusを示してある。
国立遺伝学研究所における新型コロナウイルス感染症罹患者の公表場所の変更について
2022年 7月25日
大学共同利用機関法人 情報・システム研究機構
国立遺伝学研究所
2022年7月25日以降の新型コロナウイルス感染症罹患者の情報については、Information欄に代わって、下記のページ内にて公表することとなりました。
新型コロナウイルス感染症に関する遺伝研の対応について
https://www.nig.ac.jp/nig/ja/about-nig/covid19bcp
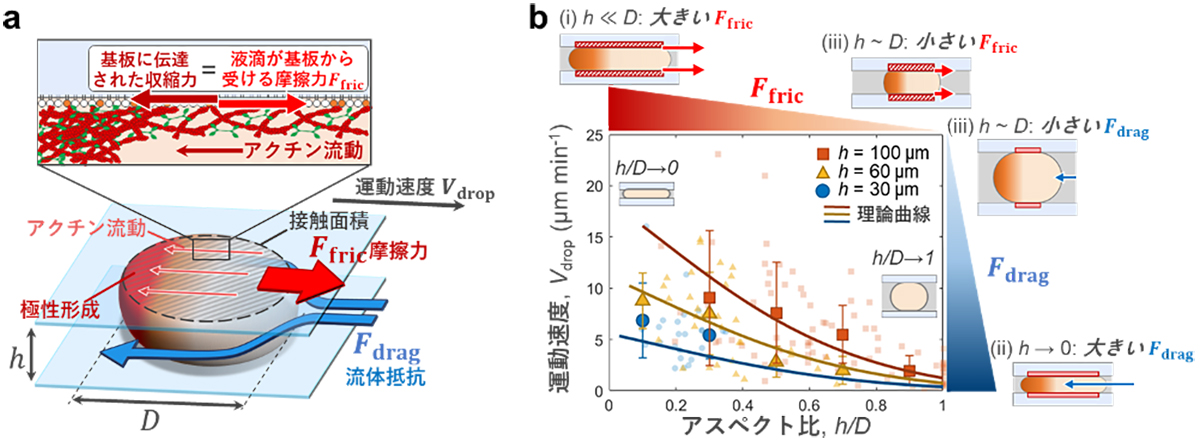
動きまわる人工細胞、その鍵は摩擦にあり
~細胞が狭い空間を利用して運動する仕組みを解明~
プレスリリース
Geometric trade-off between contractile force and viscous drag determines the actomyosin-based motility of a cell-sized droplet
Ryota Sakamoto, Ziane Izri, Yuta Shimamoto, Makito Miyazaki, and Yusuke T. Maeda
PNAS (2022) 119, e2121147119 DOI:10.1073/pnas.2121147119
私たちの体の生体組織は細胞と細胞外基質から構成され、細胞間の隙間はコラーゲン線維などの細胞外基質で埋め尽くされた狭い空間です。この生体組織内を移動するガン細胞から白血球の運動に至るまで、単一細胞の自律運動では細胞内から細胞外への力伝達が不可欠です。そこでは,細胞内に網目状に張り巡らされたアクチン細胞骨格の収縮力が外部の基板に伝達され、細胞を前進させます。しかし、効率的な力伝達を可能にする仕組みは細胞の複雑さのため研究が困難でした。
九州大学理学研究院 前多裕介准教授、坂本遼太同博士課程学生(現:イェール大学 ポストドクトラルフェロー)、Ziane Izri同学術研究員(現:ミネソタ大学 ポストドクトラルフェロー)らの研究グループは、京都大学白眉センター 宮﨑牧人特定准教授、情報・システム研究機構国立遺伝学研究所 島本勇太准教授らと共に、生体内を移動するガン細胞を模した、自律的に運動する「人工細胞」を開発し、力伝達の仕組みを初めて明らかにしました。本研究チームは、脂質膜に囲まれた液滴のカプセルにアクチンを閉じ込めて単純化した人工細胞を作成しました。この人工細胞を2枚のガラス板に挟むと、アクチンの流れが人工細胞の表面とガラス基板の間に摩擦力を生み、自律的に運動できることを世界で初めて発見しました。さらに、狭い空間に拘束された運動を記述する新しい理論モデルを構築し、界面摩擦力と流体抵抗のバランスで運動速度が決まることを解明しました。本研究により、効率的な力の伝達に不可欠な物理的要因を明らかにしたことは、生体組織内を運動する細胞運動の力伝達メカニズムの理解に貢献する成果です。今後、ガン細胞の転移を抑えこむ方法論の開発の一助となり、狭い空間を移動するマイクロ・ロボットの設計などへの波及効果が期待されます。
本研究はJSPS科研費 JP18H05427、JP20H01872、JP21K18605(研究代表者:前多裕介)、JP19J20035(研究代表者:坂本遼太)、JP 19H05393(研究代表者:宮﨑牧人)、JP19H03201,JP20K21404(研究代表者:島本勇太)、Human Frontier Science Program研究グラント(RGP0037/2015、研究代表者:前多裕介)、JST戦略的創造研究推進事業さきがけ(JPMJPR20ED、研究代表者:宮﨑牧人)、京都大学白眉センター(研究代表者:宮﨑牧人)の助成を受けたものです。
本研究成果は、2022年7月20日 (米国東部時間)に米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America」で公開されました。
遺伝研の貢献
遊走する人工細胞作製の鍵となる細胞質抽出液をアフリカツメガエルの卵から高活性で精製する技術を提供しました。
新型コロナウイルス感染症に関する遺伝研の対応について【2022年7月19日版】
夏季休業のお知らせ(8/15-16)
本研究所は、下記のとおり夏季一斉休業を実施します。
ご不便をおかけいたしますが、ご理解とご協力のほどお願いいたします。
令和4年(2022年) 8月15日(月)~16日(火)
「夏休み子ども遺伝学講座」を開催
「進化する昆虫・進化しない昆虫」
~身近にいるふしぎな生き物たち~
日時: 令和4年7月29日(金曜日) 9:30~12:00
場所: 三島市生涯学習センター3階 講義室
講師: 中島 一豪先生(中央大学教育技術員)
対象: 三島市内小学校4~6年生
定員: 30名(応募者多数の場合、抽選)
持ち物: 筆記用具、ルーペ(持っている人)
締め切り: 7/14(木)
申し込み先:
三島市教育委員会 生涯学習課
申込用紙・はがき・電子申請でお申込みください。
①氏名(読み仮名必須) ②通学する小学校 ③学年 ④郵便番号 ⑤住所 ⑥電話番号
「夏休みこども遺伝学講座」と記入し、生涯学習センター4階生涯学習課へ。
〒411-0035 三島市大宮町1-8-38
電話:055-983-0881
新分野創造センターのテニュアトラック教員がテニュア獲得
2022年7月1日付けで新分野創造センターの村山泰斗准教授がテニュアを獲得しました。
遺伝研の新分野創造センター(Center for Frontier Research)は,「あたらしい人材」と「あたらしい分野」を同時に育成するためのインキュベーションセンターです。遺伝研の卓越した研究環境や様々なサポートを活用して若手の優れた研究者がテニュアトラック独立准教授として研究室を運営し、遺伝学とその周辺領域に新しい分野を開拓する研究を行っています。テニュアを獲得した教員は遺伝研に新しい研究部門を創り、自らが創成に貢献している新分野を牽引していきます。

- 村山泰斗 准教授
イネ栽培化の初期過程に重要な役割を果たした3つの遺伝子
プレスリリース
A stepwise route to domesticate rice by controlling seed shattering and panicle shape
Ryo Ishikawa, Cristina Cobo Castillo, Than Myint Htun, Koji Numaguchi, Kazuya Inoue, Yumi Oka, Miki Ogasawara, Shohei Sugiyama, Natsumi Takama, Chhourn Orn, Chizuru Inoue, Ken-Ichi Nonomura, Robin Allaby, Dorian Q Fuller and Takashige Ishii
PNAS (2022) 119, e2121692119 DOI:10.1073/pnas.2121692119
神戸大学大学院農学研究科を中心とした、国立遺伝学研究所、英国・ユニバーシティカレッジロンドン、ウォーリック大学、ミャンマー・イエジン農科大学、カンボジア・農務省からなる国際共同研究チームは、栽培イネ(Oryza sativa L.)が野生イネ(O. rufipogon)から分化する初期過程で、3つの遺伝子の変化がコメの収量を飛躍的に向上させた可能性を明らかにしました。
種子脱粒性(用語説明)の喪失は、収量の増加につながる栽培化の重要なステップです。研究チームは、戻し交雑により野生イネの脱粒性関連遺伝子を栽培イネの遺伝子に置き換え、栽培化の過程を実験的に再現することを試みました。すると、これまで栽培化の主要因と考えられてきた脱粒性遺伝子sh4の栽培イネ型への置換だけでは不十分で、新たに同定したqSH3遺伝子とsh4遺伝子がともに栽培イネ型に置換されることで、野生イネのもつ脱粒性がさらに抑制されることがわかりました。それでも自然環境下ではかなりの種子が脱粒し、収穫効率の向上には更なる因子が必要と思われました。
野生イネは穂が開帳しており、栽培イネの穂とは大きく形が異なります(図1)。研究チームは、qSH3とsh4に加え、穂の開帳性を制御するSPR3遺伝子を栽培イネ型に置換した野生イネ、すなわち脱粒性喪失かつ穂が閉じた野生イネでは、飛躍的に収量が増大することを見出しました(図1)。穂が閉じる性質は、脱粒した種子が互いに絡まり合い、穂に留まり易くなって収穫増加につながることから、栽培化因子のひとつと考えられています。また、構造力学解析の結果から、閉じた穂では重力による種子基部の離層への負荷が開いた穂よりも小さいため、脱粒性の抑制と更なる収量増をもたらした可能性が考えられました(図2)。
今回の成果は、種子脱粒性の人為的な制御による新たな多収イネ品種の開発につながる可能性があります。本研究の一部は遺伝研共同研究事業(NIG-JOINT 83A2016-2018)として実施されました。文部科学省ナショナルバイオリソース(NBRP)イネの支援を受けて遺伝研が保存する野生イネ系統が貢献しています。
(用語説明)
種子脱粒性:野生植物が種子を飛散させて繁殖するための性質。種子基部に離層組織が形成されて引き起こされる。
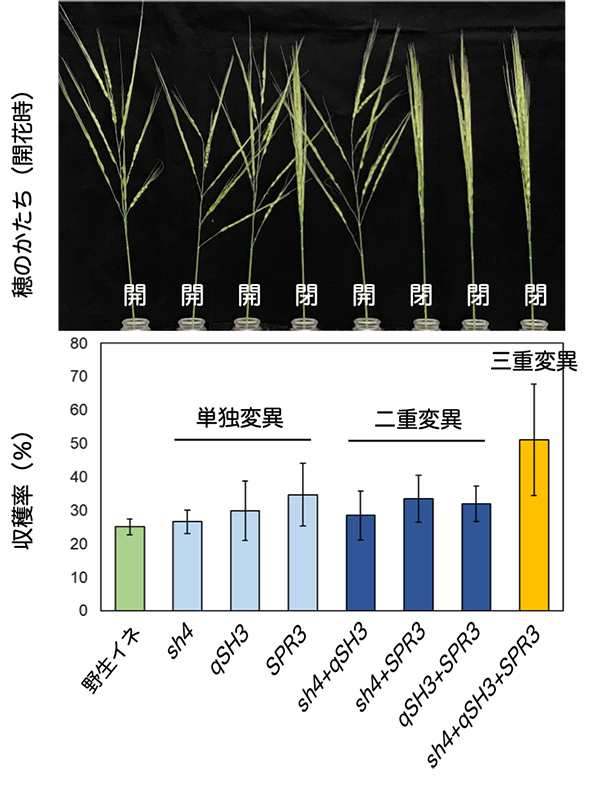
(上段)3つの遺伝子 (sh4, qSH3, SPR3) の栽培イネ型変異を様々な組み合わせで導入した野生イネ (O. rufipogon) 個体の穂の形。それぞれの個体の遺伝子組み合わせは下段の並びに対応。(下段)それぞれの遺伝子組み合わせの野生イネ個体における収穫率。 3つの変異を一緒に導入した個体では収穫率が顕著に上昇した。
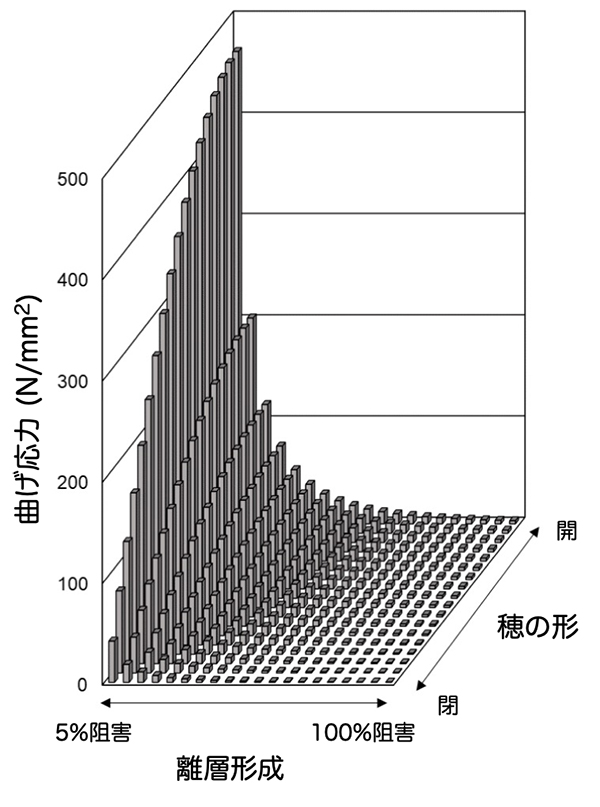
種子基部にかかる負荷、すなわち曲げ応力が高いほど種子は脱粒しやすくなる。sh4やqSH3などの導入で離層形成が阻害されるほど、またSPR3のような遺伝子の導入で穂の開帳度合いが低くなるほど曲げ応力は小さくなる。すなわち、野生イネの栽培化初期過程でsh4とqSH3に変異導入で脱粒性が低下したことに加え、SPR3変異導入により穂が閉じた形になることで、より高い収穫率が実現した可能性が高い。
考古学的遺物から見つかる古代ウイルスとその進化研究
Detection of Ancient Viruses and Long-Term Viral Evolution
Luca Nishimura, Naoko Fujito, Ryota Sugimoto, and Ituro Inoue*
Viruses (2022) 14, 1336 DOI:10.3390/v14061336
古代人の遺骨をはじめとする考古学的遺物には古代DNAや古代RNAが含まれています。これらのDNAやRNAには古代人や古代人に感染していた細菌、ウイルスなどのゲノム情報が含まれています。このゲノム情報を探索することにより、1997年から現在に至るまで遺骨やミイラ化した組織から20種類を超える古代ウイルスが見つかってきました。これらの古代ウイルスの中には100年前にスペイン風邪をもたらしたインフルエンザウイルスや1万年ほど前の遺骨から見つかったB型肝炎ウイルスなどが含まれています。これらの古代ウイルスゲノムを解析することにより、現代のウイルスだけからはわからない複雑かつ長期的なウイルスの進化過程などを明らかにすることができます。本総説では古代ウイルスの探索手法やこれまでに報告のあった古代ウイルスを紹介し、それらのゲノム情報を使ったウイルス進化研究や今後の展望について議論しています。
国立遺伝学研究所・人類遺伝研究室の西村瑠佳 学振特別研究員 (総研大生) と井ノ上逸朗教授らのグループによって執筆され、Viruses誌の特別号Virus Bioinformatics 2022に掲載されました。
謎のグルコース代謝経路「ポリオール経路」の生理機能を解明
~進化的に保存されたポリオール経路によるグルコース感知機構~
プレスリリース
The polyol pathway is an evolutionarily conserved system for sensing glucose uptake.
Hiroko Sano*, Akira Nakamura, Mariko Yamane, Hitoshi Niwa, Takashi Nishimura, Kimi Araki, Kazumasa Takemoto, Kei-ichiro Ishiguro, Hiroki Aoki, Yuzuru Kato, Masayasu Kojima
*責任著者
PLOS Biology 2022 June 10 DOI:10.1371/journal.pbio.3001678
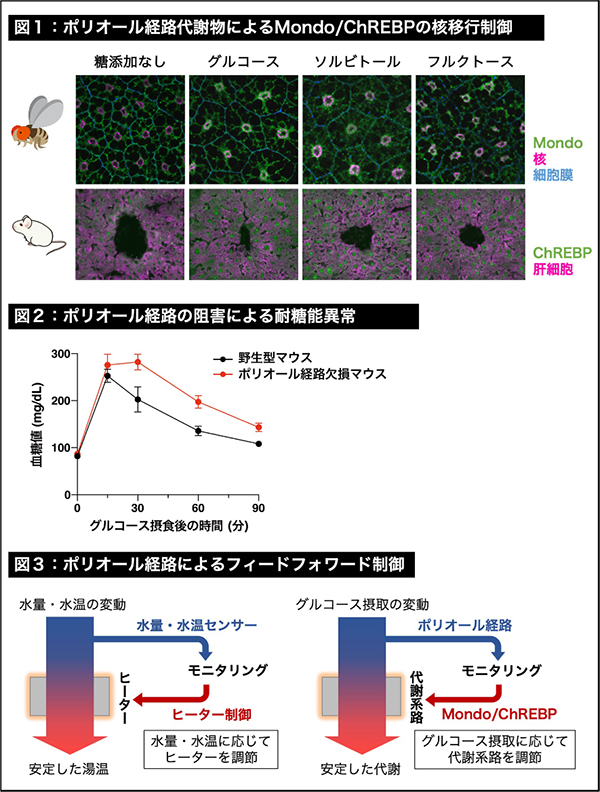
グルコース(ブドウ糖)は動物にとってエネルギー源でありDNAやRNAなどの生体分子の素にもなる重要な栄養素です。我々人間を含む動物は摂食で増える血中のグルコースを感知してグルコースを利用する仕組み(代謝)をうまく調節する必要があります。メタボリック症候群や糖尿病などの代謝疾患は、この調節がうまくいかなくなる病気です。動物がどのように血中のグルコースを感知しているかはまだ良く分かっていません。
今回、久留米大学分子生命科学研究所の佐野浩子講師は、これまで働きが分かっていなかった「ポリオール経路」と呼ばれる代謝経路がグルコース摂取の感知に重要であることを明らかにしました。この発見は久留米大学循環器病研究所、熊本大学発生医学研究所、同大学生命資源研究・支援センター、群馬大学生体調節研究所、国立遺伝学研究所との共同研究の成果です。
本研究は以下の研究支援事業の支援を受けて行われました。 日本学術振興会科学研究費助成事業 [16H06276 (AdAMS), 17H03686, 17K07419, 19H05743, 20H03265, 20K06647, 21H02489]、熊本大学発生医学研究所共同研究、群馬大学生体調節研究所内分泌・代謝学共同研究拠点共同研究、金原一郎記念医学医療振興財団基礎医学医療研究助成、文部科学省高深度オミクス医学研究拠点ネットワーク形成事業研究助成、文部科学省私立大学戦略的研究基盤形成支援事業
研究成果は2022年6月10日、生命科学系学術誌「PLOS Biology」に掲載されました。
遺伝研の貢献
画像解析技術を用いてMondo/ChREBPの核内局在を定量化しました。これにより、ポリオール経路がショウジョウバエとマウスでグルコース摂取依存的にMondo/ChREBPを活性化することが明らかになりました。
生きた細胞でのクロマチンのふるまい:1分子ヌクレオソームイメージングから学ぶ
Chromatin behavior in living cells: lessons from single-nucleosome imaging and tracking
*Satoru Ide, Sachiko Tamura, *Kazuhiro Maeshima *責任著者
BioEssays 2022 June 03 DOI:10.1002/bies.202200043
真核細胞において、長いDNAは糸巻きとして働くヒストンに巻かれ、ヌクレオソーム(直径約11nm)を形成します。このヌクレオソームに様々なタンパク質、RNAが結合したものをクロマチンと呼びます。細胞内でクロマチンはどのように収納されているのでしょうか?近年多くの証拠によって、クロマチンは従来考えられていたような30-nm線維を含む規則正しい階層構造ではなく、不規則かつ流動的な塊として存在することがわかってきました。クロマチンはゲノムDNA上で起きる化学反応 (転写やDNA複製など)の場として機能することから、クロマチンの折りたたみやその動きの観察はゲノムの機能を理解する上で重要です。
この総説論文では、生きた細胞におけるクロマチンのふるまいを観察するために非常に有力な手法であるヌクレオソーム1分子イメージングについて議論しました。この技術によってヌクレオソーム分子の動きを直接見ることで、ヌクレオソームが構成する構造やその物性を知るためのさまざまな情報が得られます。このイメージングはヌクレオソームの代わりに別のタンパク質を同様に蛍光標識すれば、核小体のような核内構造体の解析にも有効です。今後の1分子ヌクレオソームイメージングの汎用化が期待されます。
本研究は、日本学術振興会(JSPS) 科研費(21H02535、20H05936、21H02453)、上原記念生命科学財団の支援を受けました。
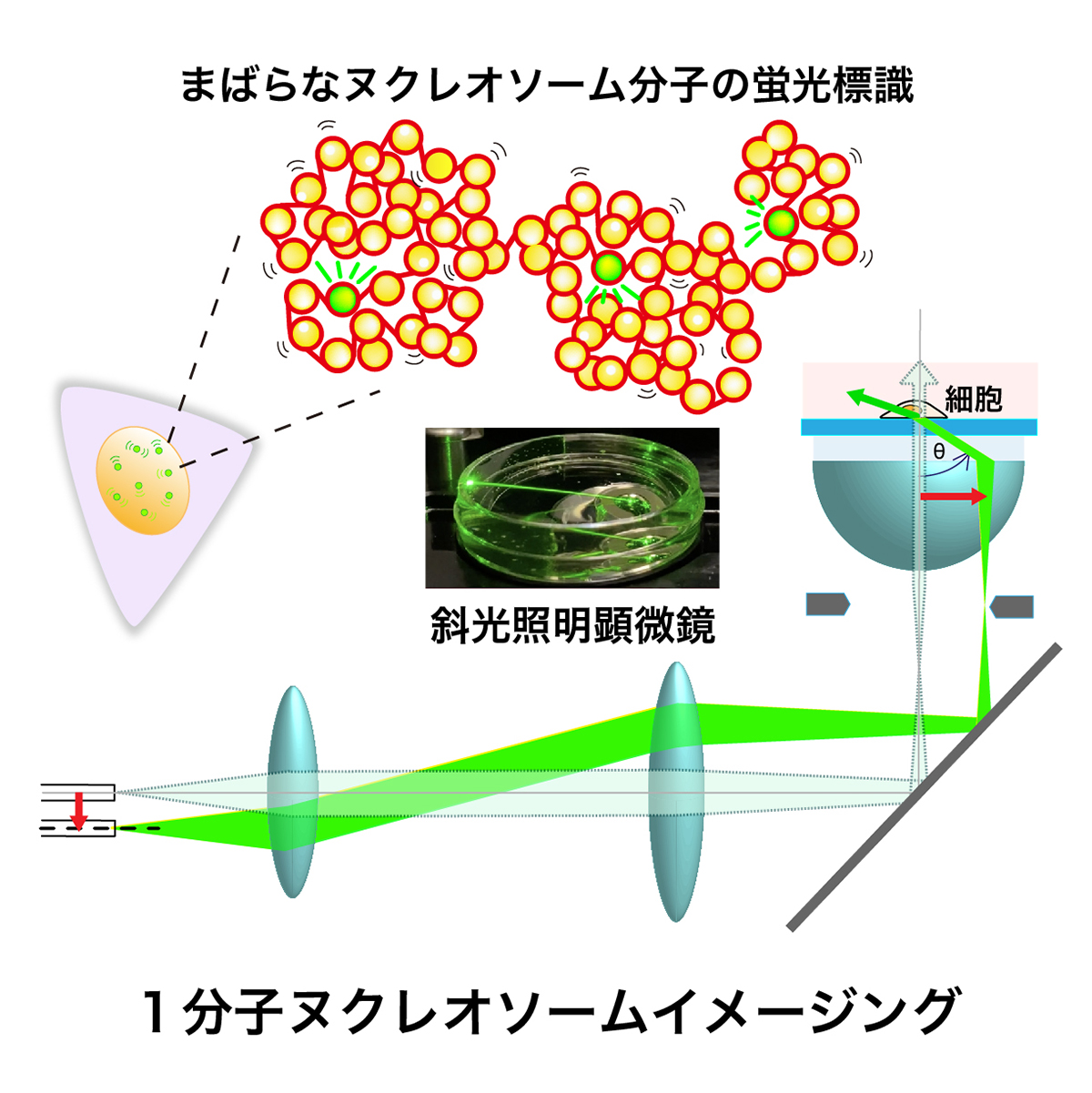
図:1分子ヌクレオソームイメージング。①まばらな分子(ヌクレオソーム)の蛍光標識と②励起光レーザーを斜めに当てること(斜光照明)で、可能な限り焦点面のみを励起し、焦点面以外由来のバックグラウンド蛍光を減少させることによって、生きた細胞で1個1個の分子を観察することができます。われわれが使用しているニコン社製ECLIPSE Ti TIRF蛍光倒立顕微鏡では、レーザー光の入射位置がレンズの中心部の場合、ビームは対物レンズから垂直に出ます(薄緑色の経路)。一方、レーザー光の入射位置をシフトさせると斜めのシート照明が得られます(濃緑色の経路)。
細胞周期の間期におけるクロマチンの定常的な動き
プレスリリース
Single-nucleosome imaging reveals steady-state motion of interphase chromatin in living human cells
Shiori Iida, Soya Shinkai, Yuji Itoh, Sachiko Tamura, Masato T. Kanemaki, Shuichi Onami, Kazuhiro Maeshima
Science Advances (2022) 8, eabn5626 DOI:10.1126/sciadv.abn5626
私たちの体は約40兆個の細胞からできています。それぞれの細胞には全長約2メートルにも及ぶ生命の設計図、ヒトゲノムDNAがクロマチンとして収納されています。クロマチンの収納のされ方については、近年、多くのことが分かってきた一方で、生きた細胞でのクロマチンの局所的なふるまい(ゆらぎ)についてはほとんど分かっていませんでした。
このたび、国立遺伝学研究所 ゲノムダイナミクス研究室 飯田史織 総研大生(SOKENDAI特別研究員)・伊藤優志 学振特別研究員 (現 東北大学助教)・田村佐知子 テクニカルスタッフ・前島一博 教授らのグループは、理化学研究所 新海創也 研究員・大浪修一 チームリーダー、国立遺伝研 分子細胞工学研究室 鐘巻将人 教授と共同で、光学顕微鏡の分解能を超える超解像蛍光顕微鏡を駆使することで、生きた細胞内のクロマチンのゆらぎを観察することに成功しました(動画1)。
一つの細胞が二つの娘細胞に分裂する前、その準備としてDNAの量は二倍になり、DNAを収納する核の大きさも二倍以上になります(細胞周期 間期)。これまで、このような核内の環境の変化は、クロマチンの動きに大きな影響を与えるとされていました。しかし本研究によって、クロマチンのゆらぎの程度は、DNAの量や核の大きさの変化に影響されず、一定であることが示されました(動画2、図)。さらに、DNAの量を変えずに、核だけを大きくしても、クロマチンのゆらぎは変化しませんでした。クロマチンのゆらぎの程度は、DNAへの近づきやすさ(ゲノム情報の読み出しやすさ)に直結します。間期のあいだ、クロマチンのゆらぎの程度が一定に保たれることで、細胞は、DNAに書かれた遺伝情報を、常に同じ環境で読み出し、RNA転写やDNA複製など、必要な仕事を同じように実行できると考えられます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST) (JPMJCR15G2)、JST 次世代研究者挑戦的研究プログラム(JPMJSP2104)、日本学術振興会(JSPS) 科研費(20H05550、21H05763、19K23735、 20J00572、18H05412、19H05273、20H05936)、武田科学振興財団、上原記念生命科学財団の支援を受けました。
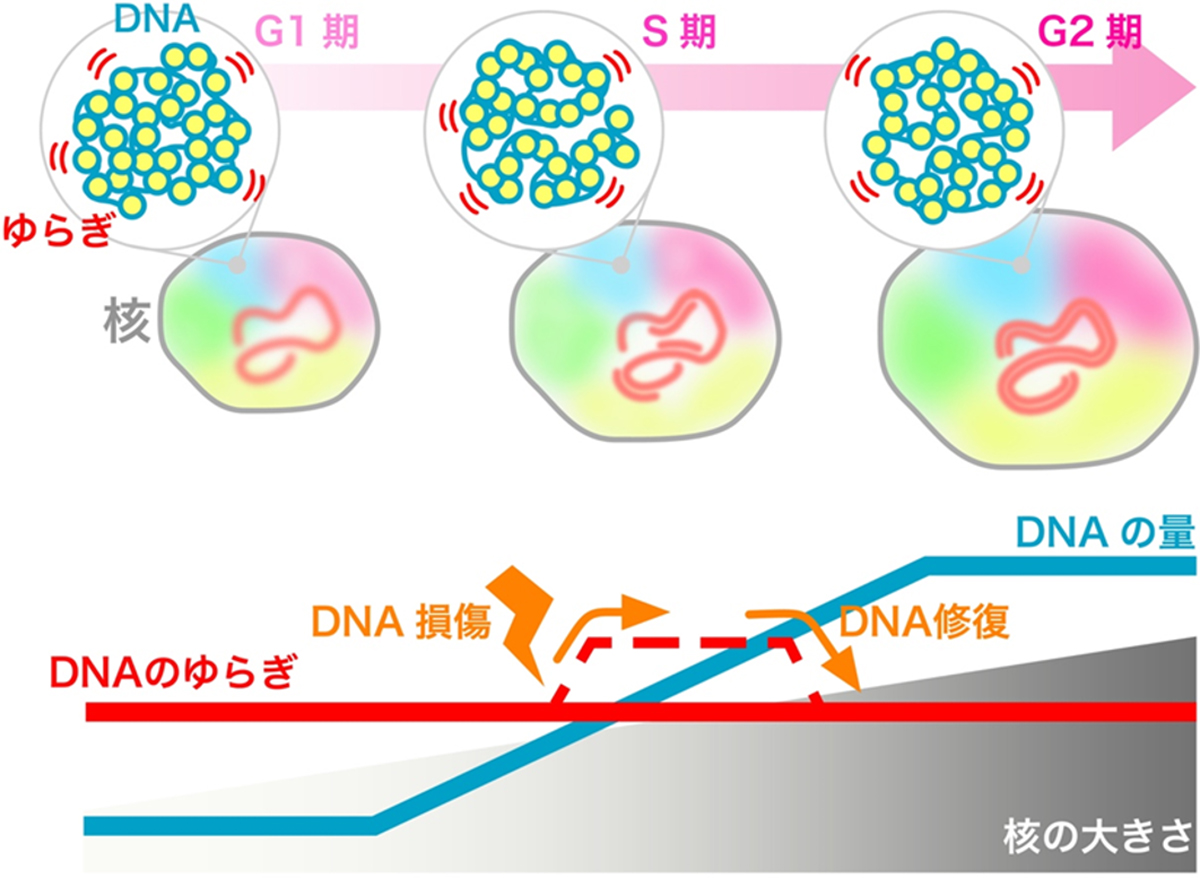
図: 細胞周期の間期(G1期→S期→G2期)において、核の大きさは二倍以上に大きくなり、DNAの量も二倍になる。このような核内の環境の変化にも関わらず、クロマチンのゆらぎは一定であった。間期のあいだ、クロマチンのゆらぎの程度が一定に保たれることで、細胞は、DNAに書かれた遺伝情報を、常に同じ環境で読み出し、RNA転写やDNA複製など、必要な仕事を同じように実行できると考えられる。
動画1: 超解像蛍光顕微鏡により観察された生きた細胞の核内におけるヌクレオソーム(クロマチンの最小ユニット)のゆらぎの動画。1個1個のドットが1個1個のヌクレオソームを示す。 1コマ50ミリ秒。
動画2: G1期(左)、G2期(右)のヌクレオソームのゆらぎの動画。G2期の核(ドットが見える範囲)はG1期の核に比べて大きいが、ヌクレオソームのゆらぎにはあまり違いはない。 1コマ50ミリ秒。
▶ EurekAlert!の記事はこちら
ユーラシアにおけるハツカネズミの遺伝的多様性を解明
~人類の歴史の解明や基礎医学研究への貢献に期待~
プレスリリース
斎藤研究室・集団遺伝研究室
Insights into Mus musculus population structure across Eurasia revealed by whole-genome analysis
Kazumichi Fujiwara, Yosuke Kawai, Toyoyuki Takada, Toshihiko Shiroishi, Naruya Saitou, Hitoshi Suzuki, Naoki Osada
Genome Biology and Evolution (2022) 14, evac068 DOI:10.1093/gbe/evac068
北海道大学大学院情報科学研究院の長田直樹准教授と同大学大学院情報科学院博士後期課程の藤原一道氏らの研究グループは、同大学大学院地球環境科学研究院、国立遺伝学研究所、理化学研究所バイオリソース研究センター、国立国際医療研究センターとの共同研究により、ユーラシア大陸の幅広い地域から集められた野生ハツカネズミの全ゲノム配列を決定し、その遺伝的多様性を明らかにしました。
ハツカネズミは医学研究において用いられる代表的な実験動物ですが、南アジア周辺に生息していた野生の集団が起源となっており、主要な三つの亜種が存在すると考えられています。野生のハツカネズミはその後、アフリカからやってきた人類とともに生息域を広げ、特に1万年ほど前から始まる農耕の発展以降、爆発的に世界中に拡散しました。
本研究では、ハツカネズミの研究に生涯をささげた森脇和郎博士が長年収集してきたサンプルを含む、野生ハツカネズミ98個体の全ゲノム配列を決定し、ユーラシア大陸においてどのように三つの亜種が分布しているのか、また、過去にどのような集団動態を経て野生ハツカネズミ集団が成立してきたのかについて明らかにしました。このような研究は、農耕の発展以降、人類がどのようにユーラシア大陸を移動したのかという疑問に答えるのに役立つだけでなく、医学研究で用いられる実験動物がどのような遺伝的変異をもっているか明らかにすることで、実験結果の解釈や再現性に貢献することが期待されます。
本研究は文部科学省科学研究費補助金新学術領域(複合領域)「ゲノム配列を核としたヤポネシア人の起源と成立の解明」(18H05505)研究費の支援を受けて行われました。
なお、本研究成果は、2022年5月7日公開のGenome Biology and Evolution誌にオンライン掲載されました。
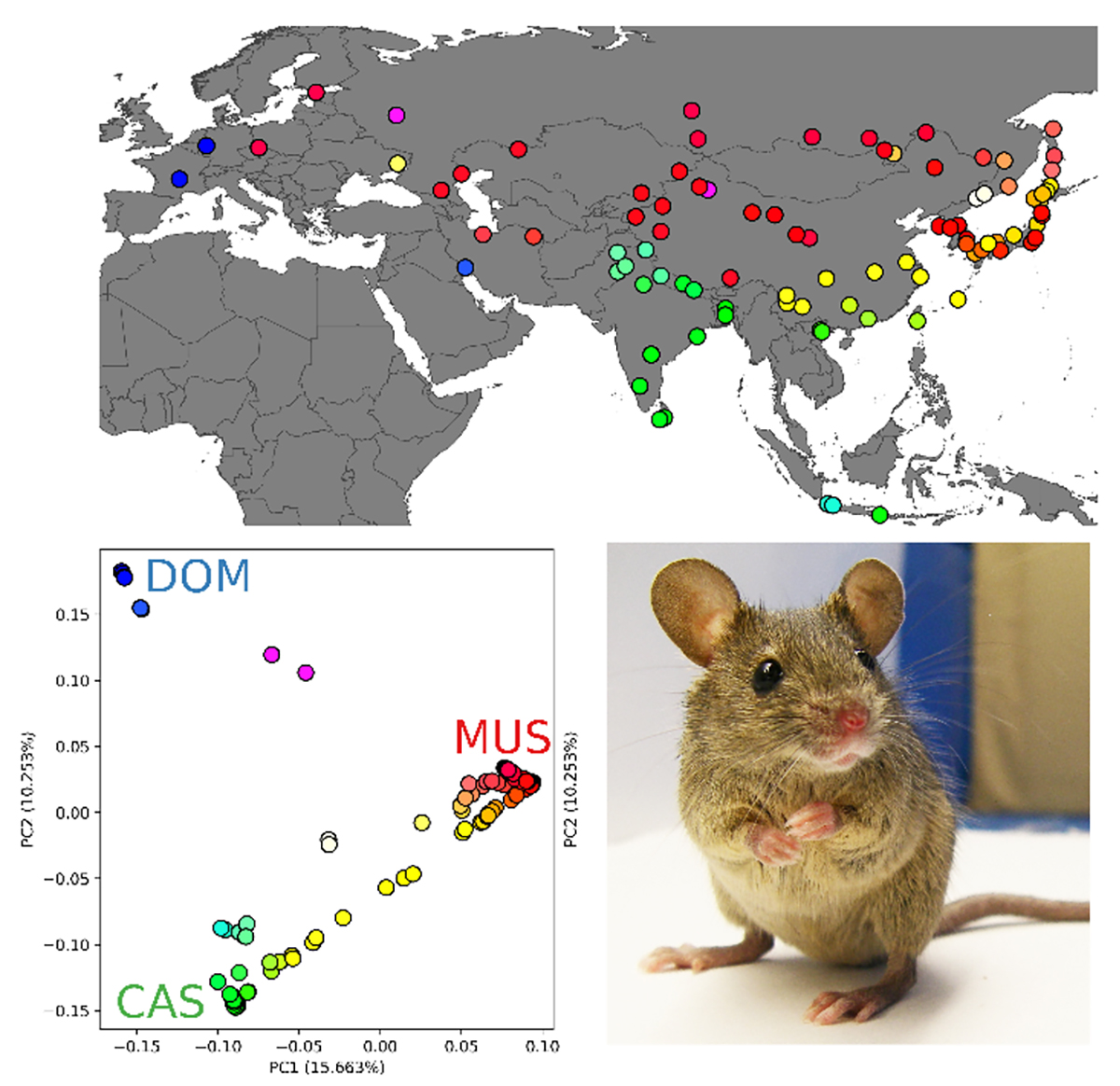
(上)解析に用いられたサンプルの採取地を地図上に示したもの。色は左下のパネルに対応。(左下)主成分分析という手法を用いてゲノムの特徴を可視化したもの。三角形の頂点がそれぞれの亜種がもつ遺伝的特徴に対応。(右下)野生ハツカネズミ由来の実験系統個体(HMI/Ms)
英国王立協会哲学紀要にて特集号を編集
生態遺伝学研究室の北野潤教授は、リードエディターとして英国王立協会哲学紀要(Philosophical Transactions of the Royal Society B)に「Genetic basis of speciation and adaptation: From loci to causative mutations」の特集号を企画・編集し、このたび2022年5月30日に出版されました。英国王立協会哲学紀要は、現存する最古の科学雑誌(1665年より刊行)として知られています。
野生生物の適応進化や種分化の遺伝基盤を研究する分野はこの10年間で大きく進展しました。発展に貢献した一つの技術革新は次世代シークエンサーの開発でした。また、より近年にはゲノム編集技術の発展もその流れを加速化しました。このような生態遺伝学研究の現状を総括し、今後の展望を議論するために、コロナ禍の中、2020年の夏頃から企画を進め、このたび11本の論文・総説をまとめて発表することができました。
本特集号の編集は、生態遺伝学研究室の元助教の石川麻乃博士(現・東京大学・准教授)、元博士研究員のマーク・ラビネイ博士(現・ノッティンガム大学・助教授)、バージニー・コーティアー・オルゴゴーゾ博士(ジャックモノー研究所・グループリーダー)とともに行いました。科研費基盤A、JST CRESTなどの支援を受けて行いました。
特集号では、以下の北野グループの共著論文も発表しました。
1. 特集号全体の序文として、野生生物の適応進化や種分化の遺伝基盤を研究する意義、現状、今後の展望について議論しました。
Genetic basis of speciation and adaptation: From loci to causative mutations.
Kitano, J., Ishikawa, A., Ravinet, M., and Courtier-Orgogozo, V.
Philosophical Transactions of the Royal Society B: Biological Sciences (2022) 377, 20200503 DOI:10.1098/rstb.2020.0503
2. 生態遺伝学研究室では、海と淡水では不飽和脂肪酸のDHAの量が異なるため、海水魚と淡水魚ではDHA合成酵素をコードするFads2遺伝子のコピー数が異なることを見出して2019年にサイエンスに報告していましたが、今回、海水魚と淡水魚の間でコピー数の異なる遺伝子をゲノム配列情報から網羅的に探索し、Fads2以外に、免疫に関与するPSMB81、甲状腺ホルモンシグナルに関与するUGT2などが淡水魚で増幅している傾向を見出しました。本研究は、東京大学の石川麻乃准教授、山内駿さん、岩崎渉教授との共同研究として実施されました。
Convergent copy number increase of genes associated with freshwater colonisation in fishes.
Ishikawa, A., Yamanouchi, S., Iwasaki, W., and Kitano, J.
Philosophical Transactions of the Royal Society B: Biological Sciences (2022) 377, 20200509 DOI:10.1098/rstb.2020.0509
3. ゲノム編集技術を用いることで、野生生物の種分化や適応進化の遺伝研究において何ができるのか、とりわけ、染色体編集や遺伝子置換の最新手法についての総説を、東北大学の安齋賢助教と執筆しました。
Speciation and adaptation research meets genome editing.
Ansai, S., and Kitano, J.
Philosophical Transactions of the Royal Society B: Biological Sciences (2022) 377, 20200516 DOI:10.1098/rstb.2020.0516
製品評価技術基盤機構と国立遺伝学研究所がバイオテクノロジー分野での連携に関する協定の締結式を開催
![]()

独立行政法人 製品評価技術基盤機構(以下、NITE(ナイト))[理事長:長谷川 史彦、所在地:東京都渋谷区西原]と大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所(以下、遺伝研)[所長:花岡 文雄、所在地:静岡県三島市]は、令和4年4月1日にバイオテクノロジー分野における包括的な連携協定を締結し、5月19日に締結式を行いました。
9万株を超える微生物を保有し、微生物の持つ様々な情報を一元化した生物資源データプラットフォーム「DBRP」を提供するNITEと、ゲノム解析の中核拠点としてゲノム研究及びマイクロバイオーム研究の共同利用・共同研究を進める遺伝研が、双方の強みを融合させることにより、微生物を使用したバイオテクノロジーによるものづくりの研究開発とその実用化を支援します。
また、5法人の大学共同利用の機能を強化する取組を通じて、研究教育・共同利用の両面から、大学や研究機関等の活動に貢献し、我が国の学術研究の発展に寄与してまいります。
















