Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
貝を持つ不思議なタコ、アオイガイの全ゲノム解読に成功
~貝殻の起源と進化について新たな知見~
プレスリリース

Gene Recruitments and Dismissals in the Argonaut Genome Provide Insights into Pelagic Lifestyle Adaptation and Shell-like Eggcase Reacquisition
M. Yoshida, K. Hirota, J. Imoto, M. Okuno, H. Tanaka, R. Kajitani, A. Toyoda, T. Itoh, K. Ikeo, T. Sasaki, D. H E Setiamarga
Genome Biology and Evolution 2022 October 26 DOI:10.1093/gbe/evac140
カイダコの殻は冬になると日本海側の各地に打ち上がることが知られており、ビーチでみられる貝殻のなかでも特に珍重されているものです。この貝殻はタコの仲間が作ったものであることが知られています。今回カイダコ類の1種であるアオイガイの全ゲノム配列を世界で初めて解読しました。
アオイガイのゲノム中にある26,433個の遺伝子の中で、44個の遺伝子が貝殻形成に使われていることがわかりました。さらに、カイダコが底生生活から浮遊生活に移行する過程で起こったゲノム中の遺伝子の変化を見つけることができました。これにより、進化の過程で貝を失ったはずのタコが、どのようにして再び貝殻を作れるようになったのか?という進化上の大きな謎を解明することに一歩近づきました。
この研究は、文部科学省科学研究費助成事業(18K06363, 19K21646 , 22K06340)、先進ゲノム支援事業(PAGS)(16H06279)、Human Frontier Science Program grant(RGP0060/2017)、 旭硝子財団(2016年)、および藤原ナチュナルヒストリー財団(2017年)の助成を受けて実施しました。
本共同研究は、2022年10月26日(水)に英文論文誌Genome Biology and Evolutionにオンライン版が掲載されました。
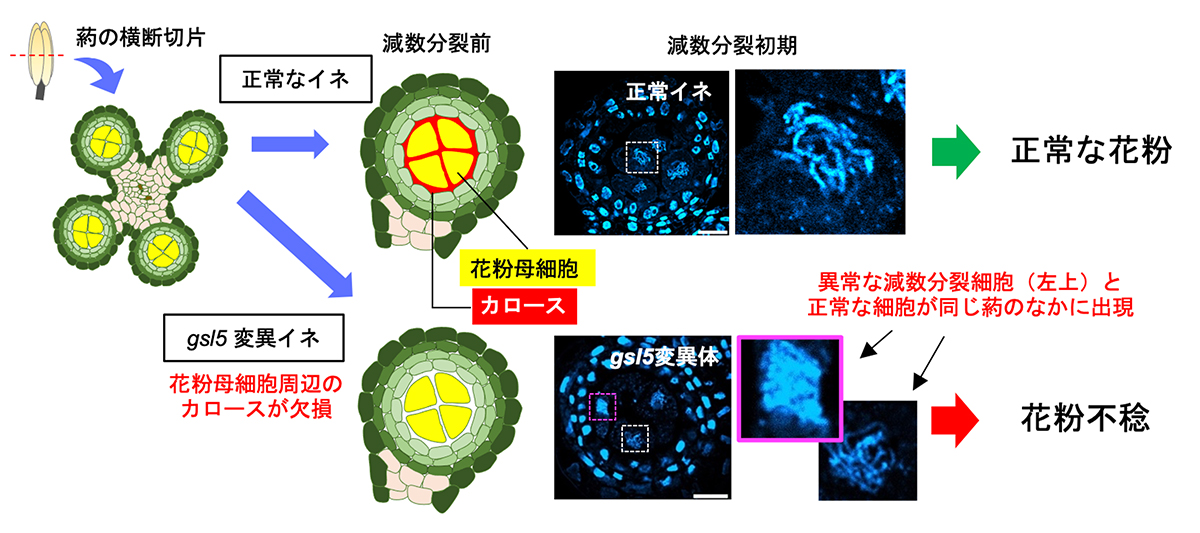
植物生殖研究における長年の謎を解明!
〜 カロースによる減数分裂の開始制御 ~
プレスリリース
Rice GLUCAN SYNTHASE-LIKE5 promotes anther callose deposition to maintain meiosis initiation and progression
H. Somashekar, M. Mimura, K. Tsuda, K. I. Nonomura
Plant Physiology 2022 October 22 DOI:10.1093/plphys/kiac488
植物の花粉は、雄しべ(葯(やく))の中で花粉母細胞が減数分裂をすることで作られます。減数分裂の過程は遺伝的に厳密に制御されていますが、特に花粉の形成に必要な減数分裂の開始に関わる分子メカニズムは未解明でした。本研究のヒントとなったのは、減数分裂開始直前の葯に一時的に蓄積する「カロース」と呼ばれる植物特有の高分子多糖類でした。カロースの葯への蓄積は、減数分裂開始の指標として古くから知られていましたが、減数分裂には関与せず、減数分裂後の花粉形成のみに必要と考えられてきました。
情報・システム研究機構 国立遺伝学研究所 野々村賢一准教授、ソマシェカー ハーシャ総合研究大学院大学 大学院生らの研究グループは、葯で高発現するカロースの合成酵素GSL5の機能が欠損するイネ変異体の解析から、GSL5が減数分裂期の葯におけるカロース合成の主要酵素であり、GSL5によるカロース合成が葯における減数分裂の「適切な開始時期と進行」に必須であることを証明しました。
本研究によって、長年の謎であった葯へのカロースの高蓄積が、減数分裂の開始と進行の制御に必要であることが明らかになりました。今後はGSL5およびGSL5を制御する遺伝機構の解析を進めます。カロースの機能は減数分裂に留まらず、植物の生育過程の全般における環境ストレスへの応答と密接に関係することが知られています。したがって、減数分裂とその後の生殖過程におけるGSL5機能の更なる解析は、地球規模の環境変動で懸念される穀物の収量低下に解決の糸口を与える研究への発展が期待できます。
本研究は、日本学術振興会 科研費21H04729および18H02181(野々村)、二国間交流事業(共同研究)JPJSBP120213510(野々村)の支援を受けて遂行しました。また、文科省 国費外国人留学生制度の支援、および総研大 研究論文掲載費の助成(ソマシェカー)を受けました。本研究で使用した変異体の一部 (mel2変異体) は、日本医療研究開発機構(AMED)ナショナルバイオリソースプロジェクト イネ(NBRP Rice)から分譲いただきました。
本研究成果は、米国科学雑誌「Plant Physiology」に2022年10月23日(日本時間)に掲載されました。
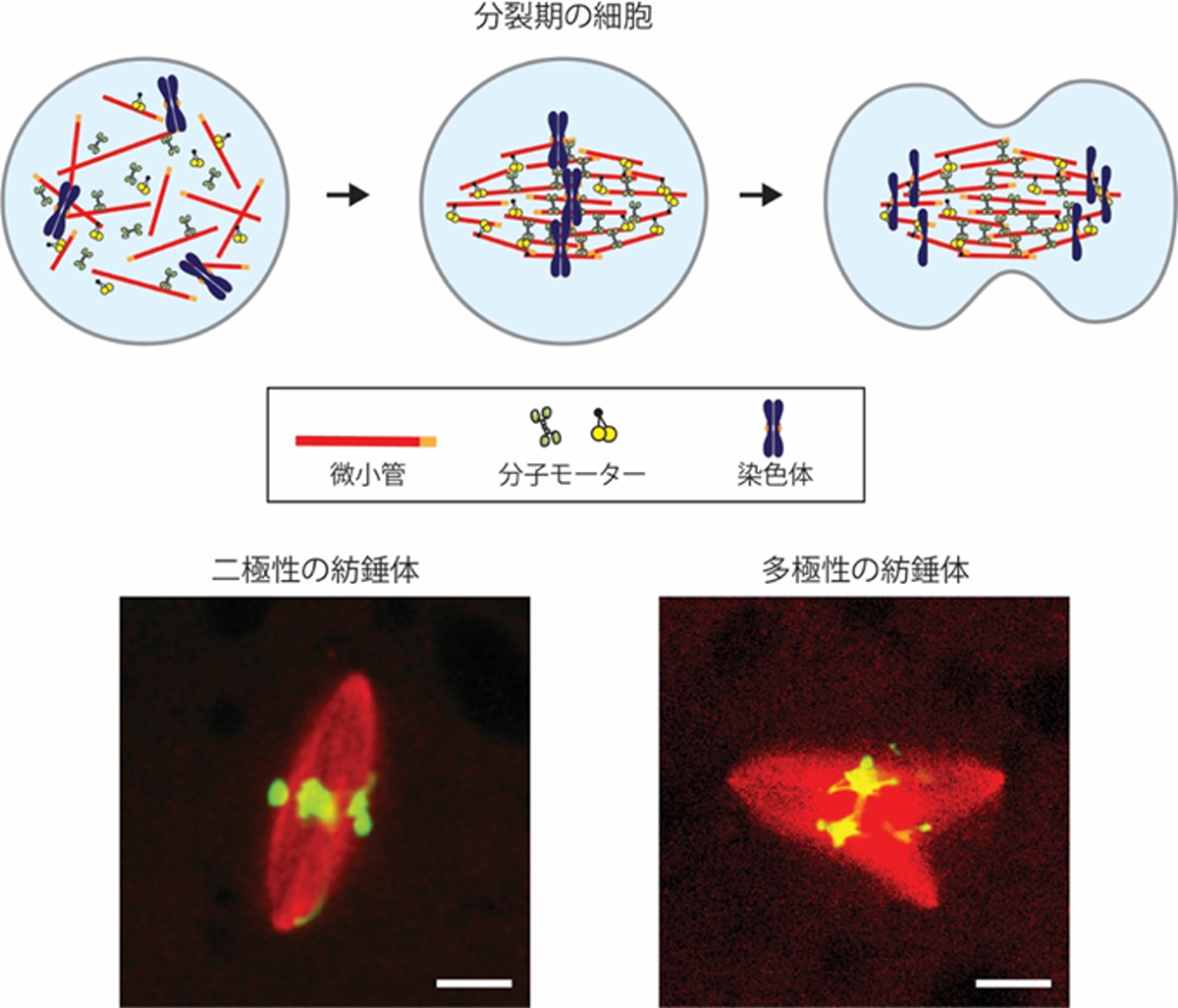
成功にも失敗にもルールがある
―細胞分裂装置の正しい作り方―
プレスリリース
Morphological growth dynamics, mechanical stability, and active microtubule mechanics underlying spindle self-organization
T. Fukuyama, L. Yan, M. Tanaka, M. Yamaoka, K. Saito, SC. Ti, CC. Liao, KC. Hsia, YT. Maeda, Y. Shimamoto
PNAS (2022) 119, e2209053119 DOI:10.1073/pnas.2209053119
我々ヒトを含む真核生物は、紡錘体と呼ばれるミクロンサイズの力発生装置を細胞内に構築して、遺伝情報の実体であるDNAを母細胞から娘細胞へ受け渡します。遺伝情報の正確な受け渡しには紡錘体をラグビーボール状の整ったかたちに作り上げることが大切です。一方で、紡錘体のかたちが崩れると染色体の断片化や異数化の引き金となって娘細胞に異常を引き起こします。
本研究では、この紡錘体のかたち作りの成功と失敗を分けるしくみを明らかにしました。特に、整ったかたちの紡錘体を作るための正しい組み立て順序を明らかにすることに加えて、かたちの崩れた紡錘体は、その組み立て順序を無作為に間違ったせいでなく、ある決まったルールで失敗していることも明らかにしました。また、この成功と失敗を分ける鍵が、紡錘体が自らの形状を記憶するメモリーフォームのような性質にあることも分かりました。
紡錘体のかたちの崩れはガンや不妊症との密接な関連が示唆されています。本研究で得られた知見はそれら疾病の発症メカニズムの理解を進める重要な一歩になります。
本研究成果は、国内2拠点(国立遺伝学研究所、九州大学)の生物物理学研究チームと国外2拠点(香港大学、台湾中央研究院)の生化学研究チームの国際共同研究によって得られたものです。
本研究は、以下の支援を受けて行われました。
科研費補助金(JP19H03201, JP20K21404, JP22H02590, JP18H05427, JP20H01872, JP21K18605, JP22K14014)、Human Frontier Science Program(RGP0037/2015)、国立遺伝学研究所公募型共同研究NIG JOINT(91A2019 and 58A2020)。
本研究成果は、米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」に2022年10月26日(日本時間)に掲載されました。
▶ こちらの実験技術が本研究成果の基盤の一つになっています。
国立遺伝学研究所長の決定について
公開講演会2022「ひろがる遺伝研」
2023年度国立遺伝学研究所 共同研究・研究会「NIG-JOINT」の募集を締切ました
植物進化の解明と微細藻類の高度な産業利用の促進
~温泉微細藻類ガルデリアの性の発見と高度な遺伝的改変技術~
プレスリリース
Life cycle and functional genomics of the unicellular red alga Galdieria for elucidating algal and plant evolution and industrial use
S. Hirooka, T. Itabashi, T. M. Ichinose, R. Onuma, T. Fujiwara, S. Yamashita, L. W. Jong, R. Tomita, A. H. Iwane. S. Miyagishima
PNAS (2022) 119, e2210665119 DOI:10.1073/pnas.2210665119
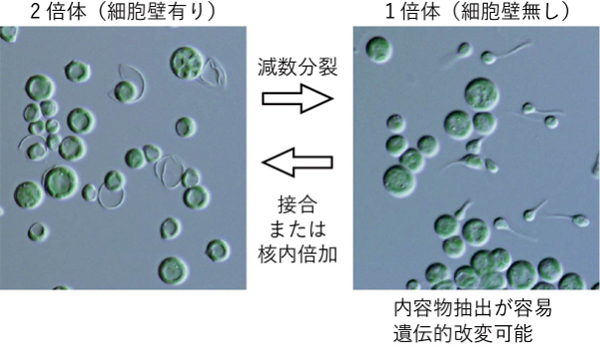
植物には、花を咲かせて受精により種子を生じるという「有性生殖」を伴う生活環が存在します。しかしながら、これまでに、進化の初期に出現した単細胞紅藻などは、無性生殖するとされていて、植物の有性生殖の起源や藻類・植物の進化の過程は不明でした。
情報・システム研究機構 国立遺伝学研究所の廣岡俊亮特任助教、宮城島進也教授、理化学研究所の岩根敦子チームリーダーによる共同研究グループは、単細胞紅藻の一種で国内外の酸性温泉に生息するガルデリアが、有性生殖を行う生物の特徴である2倍体として存在し、特殊な環境に晒すことで減数分裂を行い細胞壁が無い1倍体を生じることを発見しました。ガルデリアには、植物において花を作るための鍵遺伝子群の祖先遺伝子群が存在し、これらの機能を調べた結果1倍体が2倍体化する時にはたらくことがわかりました。さらに、1倍体を1倍体のまま安定的に増殖させることに加え、遺伝的改変技術の開発にも成功しました。
本研究は今後、植物の有性生殖の起源や藻類・植物の進化の過程の解明につながることが期待されます。一方で、ガルデリアは、タンパク質および各種ビタミンの含有量が高く、短期間で超高密度まで増殖するため、新たな産業用藻類として世界各国で活用法の開発が進められています。また本研究グループにより、ガルデリアは、強力な抗酸化作用を持ち、記憶力の向上などの脳機能の促進効果が認められているエルゴチオネインを高濃度に含むことも明らかとなっています。しかしながら、2倍体のガルデリアの活用は、強固な細胞壁が原因で内容物の抽出が困難であり、遺伝的改変による品種改良も不可能という問題がありました。本研究によって発見された細胞壁の無い1倍体は、内容物抽出が容易であり遺伝的改変も可能なため、これらの問題を解決することが期待されます。さらに、これらの特性を活用することによって家畜用の「食べるワクチン」など、微細藻類の高度な利用形態の創出も期待されます。
本研究は、科学技術振興機構(JST)未来社会創造事業 探索加速型 本格研究 「地球規模課題である低炭素社会の実現」領域における研究開発課題「酸性水を用いた微細藻類の培養および利用形態の革新」(研究代表者:宮城島進也)の支援を受けて行われました。
本研究成果は、米国科学雑誌「Proceedings of the National Academy of Sciences (PNAS)」に2022年10月5日(日本時間)に掲載されました。
なお、後日、Ursula Goodenough教授(Washington University in St. Louis)による本論文に関する紹介記事が同誌に掲載される予定です。
▶ EurekAlert!記事はこちら
新生仔マウス三叉神経節のヒゲ投射領域における自発神経活動
Spontaneous Activity in Whisker-Innervating Region of Neonatal Mouse Trigeminal Ganglion.
P. Banerjee, F. Kubo, H. Nakaoka, R. Ajima, T. Sato, T. Hirata, T. Iwasato.
Scientific Reports (2022) 12, 16311 DOI:10.1038/s41598-022-20068-z
脳の神経細胞は外界からの入力がなくても発火します(自発神経活動)が、子供の脳には成体とは異なる特徴的な自発神経活動が見られ、その発生機序や役割が注目されています。子供期特異的な自発活動に関して、視覚系や聴覚系での研究は比較的進んでおり、それぞれ、網膜と内耳で自発活動が発生し、脳に伝達されることが知られています。一方、我々が最近、新生仔マウスの大脳皮質体性感覚野で発見したパッチワーク型の自発活動(2018年1月4日プレスリリース参照)がどこで発生するかについてはわかっていません。我々はこれまでの実験結果から、これらの自発活動の多くはヒゲ(感覚器)と脳を結ぶ三叉神経節(TG)で発生すると考えています。今回の研究では、新生仔マウスから三叉神経節を摘出してex vivoで観察することにより、三叉神経節のヒゲ投射領域の神経細胞が“外部からの刺激なし”に自発的に発火することを発見しました。一方、成体マウスから摘出した三叉神経節はほとんど発火しませんでした。三叉神経節の神経細胞の大部分は痛み伝達に関わる「小さい細胞」ですが、新生仔期の自発活動は触覚を伝達する「大きな神経細胞」で主に発生していました。また、同期して発火する神経細胞は互いに近距離にあることもわかりました。1本のヒゲに投射する神経細胞は互いに近距離に存在することから、新生仔期の三叉神経節では、同じヒゲに投射する神経細胞が同期して発火している可能性が示唆され、こうした自発活動が脳に伝えられ、パッチワーク型の神経活動として体性感覚系神経回路の成熟に重要な役割を担う可能性が考えられます。
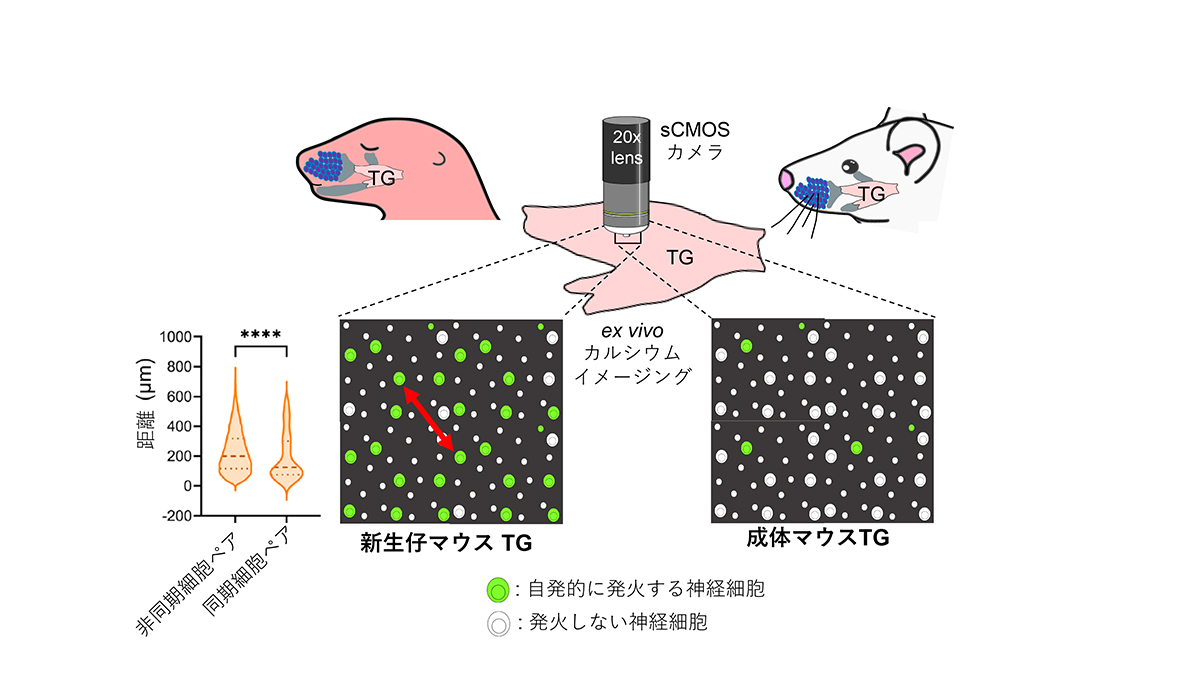
新生仔マウスから三叉神経節(TG)を摘出しex vivo で観察したところ、ヒゲ触覚を担当する「大きな神経細胞」が“外部からの刺激なしに”自発的に発火することが観察された。一方、「小さな細胞(痛みを担当)」や成体ではほとんど発火が見られなかった。同期する細胞は同期しない細胞と比較して互いに近距離(両矢印)にあった。
コンパクトなクロマチン構造とDNAダメージ耐性
Chromatin organization and DNA damage.
K. Minami, S. Iida, K. Maeshima
The Enzymes “DNA Damage and Double Strand Breaks” 2022 September 27 DOI:10.1016/bs.enz.2022.08.003
Free link (2022.11.16まで) :
真核細胞のゲノムDNAは、ヒストンや関連タンパク質とともにクロマチンを構成して核の中に収納されています。近年の研究から、クロマチンは核の中でダイナミックに振る舞うドメインを構成し、様々なゲノム機能の単位として機能していることがわかってきました。
一方、細胞のゲノムは放射線などのDNA損傷源に絶えず曝されています。がん化や細胞死を引き起こしうるDNA損傷から、細胞はどのようにしてゲノムDNAを保護しているのでしょうか。 本総説では、ゲノムダイナミクス研究室からの研究成果 (Takata et al. “Chromatin compaction protects genomic DNA from radiation damage”. PLOS ONE (2013). DOI: 10.1371/journal.pone.0075622) をはじめとする最近の知見をもとに、ドメインの形成などを介したコンパクトなクロマチンの凝縮が、放射線や化学物質による損傷からDNAを保護する仕組みを議論しています。
さらに、生細胞でクロマチンのふるまいを計測する近年の成果をもとに、クロマチンが状況に応じてDNA損傷への耐性とダメージを受けたDNAの効率的な修復を両立している可能性が議論されています。1分子ヌクレオソームイメージングを用いた同研究室の成果 (Iida et al. “Single-nucleosome imaging reveals steady-state motion of interphase chromatin in living human cells” Science Advances (2022). DOI: 10.1126/sciadv.abn5626) から、クロマチンのゆらぎは細胞周期を通じて一定である一方、DNA損傷に応じて一時的に上昇することが明らかになりました。こうした一時的なクロマチン凝縮度の緩和により、損傷を受けたDNAに修復因子が容易にアクセスできる可能性が考察されています。
ゲノムダイナミクス研究室の南克彦・飯田史織 総研大生(共にSOKENDAI特別研究員)、前島一博 教授 の共同成果です。1970年創刊「The Enzymes」シリーズ(Elsevier)のVol. 51「DNA Damage and Double Strand Breaks」(2022年発行)の第3章として出版されます。
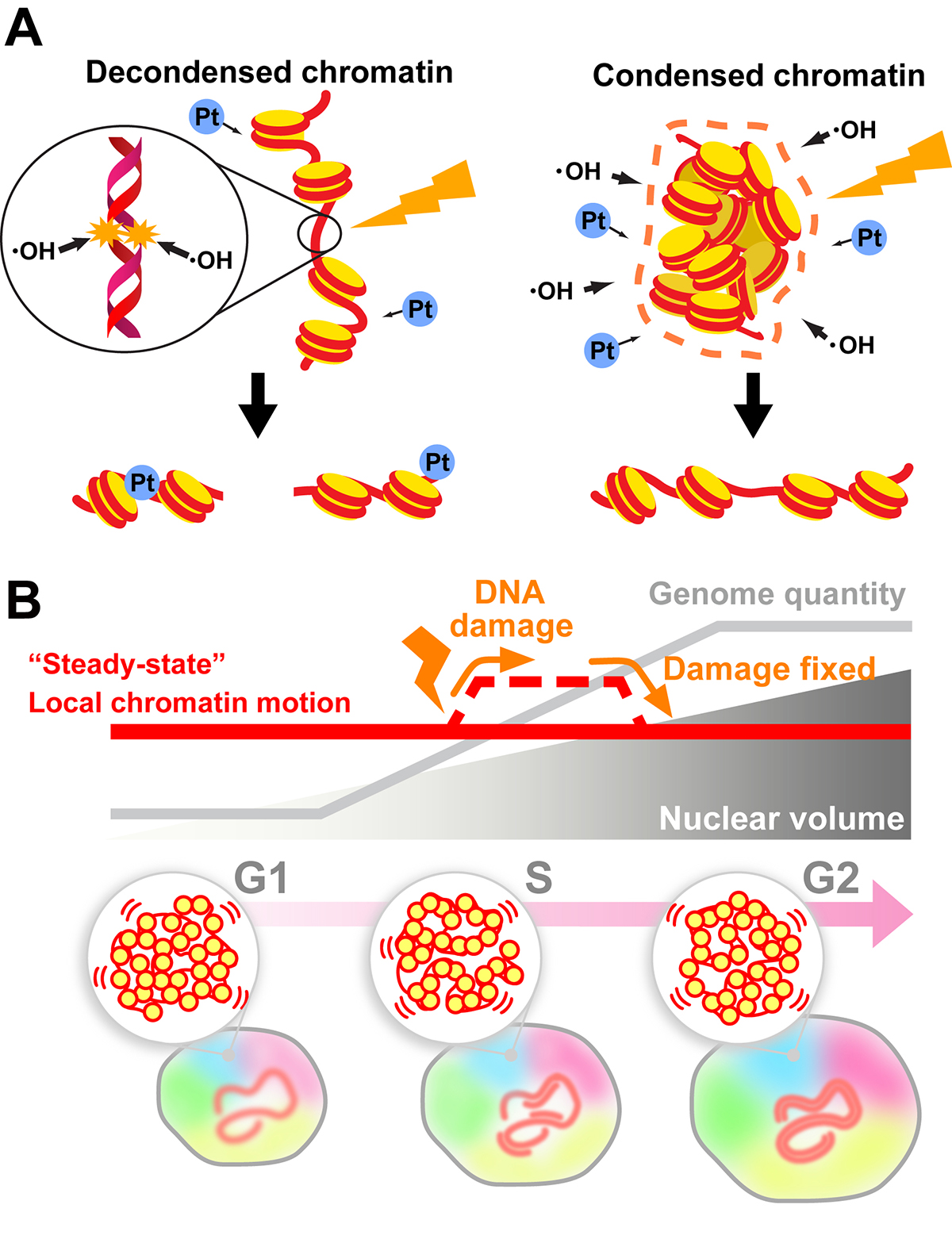
(B) 細胞周期の間期を通じて一定に保たれているクロマチンの局所的ゆらぎ (“定常状態”、赤線) は、DNA修復反応の開始に応じて一時的に上昇する (赤破線)。この一過的なゆらぎの変化は、DNA修復に必要な因子のアクセシビリティ促進に寄与していることが示唆される。
タマネギの品種育成の効率化に役立つ画期的なDNA多型分析手法を開発
プレスリリース
Development of a genome-wide marker design workflow for onions and its application in target amplicon sequencing-based genotyping
D. Sekine, S. Oku, T. Nunome, H. Hirakawa, M. Tsujimura, T. Terachi, A. Toyoda, M. Shigyo, S. Sato, H. Tsukazaki
DNA Research (2022) 29, dsac020 DOI:10.1093/dnares/dsac020
これまで、病気に強い、収量が高いなどの望ましい形質をもつ野菜を選び出すには、たくさんの個体の栽培、形質の調査、有望な個体の選抜を繰り返すことが必要であり、新しい品種の育成には多くの労力と長い時間を費やしてきました。品種育成の効率化には、DNA型の違い(DNA多型)を検出するDNAマーカーを開発し、活用することが有効です。特に、特定の形質と関連したDNAマーカー(選抜マーカー)は、DNA多型によって特定の形質が優れた個体を苗の段階で判別できるため、様々な形質について開発が望まれています。選抜マーカーの開発には、まず染色体全体のDNA多型を調べ、それらと形質データを照らし合わせて、目的の形質と関連するDNA多型の位置を特定する必要があります。近年は次世代シーケンサーの登場により、大量のDNA情報を安価に解読できるようになったため、染色体全体でのDNA多型の効率的な分析が可能になり、多くの野菜品目において選抜マーカーの開発が飛躍的に進んでいます。
しかし、タマネギでは染色体全体でのDNA多型の分析は容易ではありません。生物によって染色体全体のDNA情報であるゲノムサイズは、大きく異なります。タマネギのゲノムサイズは野菜の中でも最大級であり、その大きさはトマトの16倍もあります。そのため、トマトなど他の品目で使われてきた手法を用いて、タマネギの染色体全体でのDNA分析を行う場合、解析に要する費用や時間が大幅に増加することが予想されます。この手法でのタマネギのDNA分析は困難であり、タマネギでは染色体全体でのDNA分析法が確立していないため、選抜マーカーの開発や育種利用が遅れていました。
農研機構をはじめとする共同研究グループは、タマネギにおいて、染色体全体のDNA多型を効率的に分析する方法の開発を目指しました。まず、タマネギにある8本の染色体について、各々に圴一に配置され、染色体全体をカバーしたDNAマーカーセットを作成しました。次に、次世代シーケンサーを利用し、これらのマーカーセットの全てのDNA多型を一度にまとめて分析する手法を試みました。その結果、染色体全体のDNA多型を効率的に分析することに成功しました。この分析手法で得られた個体間のDNA多型と形質を照らし合わせれば、DNAマーカーセットの中から目的の形質と関連したDNAマーカーを特定でき、選抜マーカーとして利用できるようになります。この技術は、タマネギでの選抜マーカーの開発を飛躍的に進め、育種の効率化および新品種の早期育成に貢献することが期待できます。
本研究は、戦略的イノベーション創造プログラム(SIP):スマートバイオ産業・農業基盤技術「データ駆動型育種」推進基盤技術の開発とその活用による新価値農作物品種の開発 2. 農林水産省「戦略的国際共同研究推進委託事業」、JSPS科研費JP26292020、文部科学省 科学研究費助成事業新学術領域研究「学術研究支援基盤形成」先進ゲノム解析研究推進プラットフォーム(16H06279 (PAGS))の支援を受けて行われました。
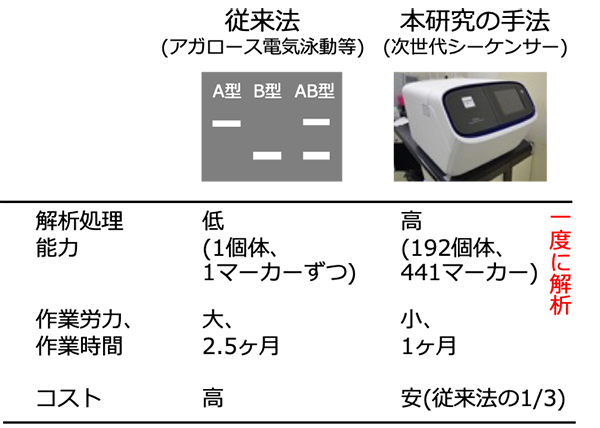
従来法では1個体、1マーカーずつを分析していたため、分析に係る作業時間や労力を多く費やしてきましたが、本研究では次世代シーケンサーの活用により、192個体、441マーカーを一度に分析できるため、分析の作業時間や労力を大幅に省力化できます。また分析に必要な試薬も少なくて済むため、分析にかかる費用も安くなります。
ゲノムダイナミクス研究室 総研大生・飯田さんが第62回生物物理若手の会・夏の学校で現代化学賞を受賞

ゲノムダイナミクス研究室の飯田史織さん(総研大遺伝学専攻D3)が、2022年8月30日〜9月2日に岐阜で開催された、第62回生物物理若手の会・夏の学校でポスター発表をおこない、現代化学賞を受賞しました。
現代化学賞は、株式会社東京化学同人が出版する化学月刊誌『現代化学』の編集者による審査によって決定しました。副賞として、『現代化学』1年分、および、受賞内容に関する記事の『現代化学』への掲載権が与えられます。
▶ 学会HP:第62回生物物理若手の会・夏の学校
▶ 受賞ポスタータイトル:
ヒト生細胞の局所クロマチン動態は細胞周期を通して一定である
共生細胞進化研究室 山下翔大研究員が日本植物形態学会奨励賞を受賞

共生細胞進化研究室の山下翔大さん(遺伝研博士研究員)が2022年度の日本植物形態学会奨励賞を受賞し、2022年9月16日の日本植物形態学会第34回大会にて表彰されました。受賞内容は前所属先での博士課程の研究テーマ「ボルボックス系列緑藻アストレフォメネの発生学的解析とゲノム解読を用いた多細胞形質の平行進化に関する研究」です。山下さんは、ボルボックスとは独立に球状群体や細胞分化を獲得したアストレフォメネという藻類について、新規培養株や新たな実験手法の確立から研究を始め、細胞レベルの形態観察・発生解析からゲノム解読に至るまで幅広いスケールでの進化学的研究を行ない、その独創性や積極性が高く評価されました。
山下翔大研究員より受賞のコメントが届いておりますのでご紹介します。
この度は日本植物形態学会奨励賞を受賞し、大変光栄に思います。これまでご指導、ご鞭撻を賜りました先生方や多くの方々のサポートがあって、伸び伸びと研究をさせていただいた成果が受賞につながりました。支えていただいた皆様に厚く御礼申し上げます。さらに面白い研究へと発展させていけるよう、今後ともより一層精進してまいります。
PAGS・DDBJ合同 初級者情報解析講習会のお知らせ 申込締切:9月26日(月)
今年度第1回目は、初級者向けの講習会として、遺伝研スパコンの概要を解説するとともに、Linuxの基礎から遺伝研スパコンの使い方、さらにはRNA-seq解析などの実践例題も扱う情報解析講習会を以下の要領で開催いたします。
本講習会は、先進ゲノム支援(PAGS)、生命情報・DDBJセンター(DDBJ)が合同で開催いたします。
日時: 2022年10月20日(木)12:40~17:20 (予定)
会場:ハイブリッド開催(Onsite & Online Hybrid) Zoom使用
現地会場:国立遺伝学研究所(DDBJ)静岡県三島市谷田1111
想定スキルレベル: 情報解析初級者(UNIX初心者)
募集人員: 現地会場:若手研究者 20 名程度
・応募者多数の場合は、先進ゲノム支援における支援依頼者を優先します。さらに多数の場合は抽選等で参加者を決定いたします。
・各自のPCを持参ください(Windows、Macいずれも可)
・講習内容をご自身のPCで行うには遺伝研スパコンのログインユーザアカウントが必要となります。お持ちでない方で現地参加の方、およびオンライン参加でご希望の方は当選確定後直ちに取得していただく必要があります。
・抽選に外れた方およびオンラインでの参加希望者にはweb配信でご参加頂けます(講習内容についてのオンライン参加者からの質問には対応致しかねます)。
参加費用: 無料(旅費は参加者でご負担ください。)
申込締切: 2022年9月26日(月)
※ 申込方法・講習スケジュール等、詳細につきましては以下のURLをご覧ください。
https://www.genome-sci.jp/whatsnew/event/news20220914.html
システム神経科学研究室 松田光司研究員が第28回小型魚類研究会口頭発表賞、総研大生 Chung Han Wang さんが ポスター賞を受賞
2022年9月1日~2日、大阪の国立循環器病研究センターにて行われた 第28回 小型魚類研究会に於いてシステム神経科学研究室 松田光司 研究員が口頭発表賞を、大学院生のChung Han Wangさんがポスター賞をそれぞれ受賞しました。
▶ 松田光司研究員 発表のタイトル
Molecular signature of optic flow responsive neurons identified by a technique combining functional labeling and single cell RNA-seq
▶ 大学院生 Chung Han Wangさん 受賞ポスタータイトル
Intersectional genetics for investigating putative pretectal hub neurons in the optic flow processing circuit
▶ 授賞日:2022年9月2日


生態遺伝学研究室 奥出絃太研究員が2022年 成茂動物科学振興賞を受賞

生態遺伝学研究室の奥出絃太さん(日本学術振興会特別研究員PD)が、2022年度の成茂動物科学振興賞を受賞し、2022年9月9日の動物学会にて表彰されました。受賞内容は前所属先での博士課程の研究テーマ「トンボの変態を制御する分子機構の解明」です。
成茂動物科学振興賞は、「動物学の全分野でユニークな研究を展開する研究者」に授与される賞です。
生態遺伝学研究室 元博士研究員 後藤寛貴さんが日本動物学会奨励賞を受賞
生態遺伝学研究室に遺伝研博士研究員として所属していた後藤寛貴さん(現・静岡大学理学部・助教)が、2022年度の日本動物学会奨励賞を受賞し、2022年9月9日の動物学会にて表彰されました。受賞内容は「甲虫類における極端な性的二型発現の分子発生学的研究」です。
日本動物学会奨励賞は、動物学会員で活発な研究活動を行い、将来の進歩、発展を強く期待される若手研究者に贈られる賞です。
大学共同利用機関シンポジウム2022「科学の時代。見えてきた未来」を10月16日に開催
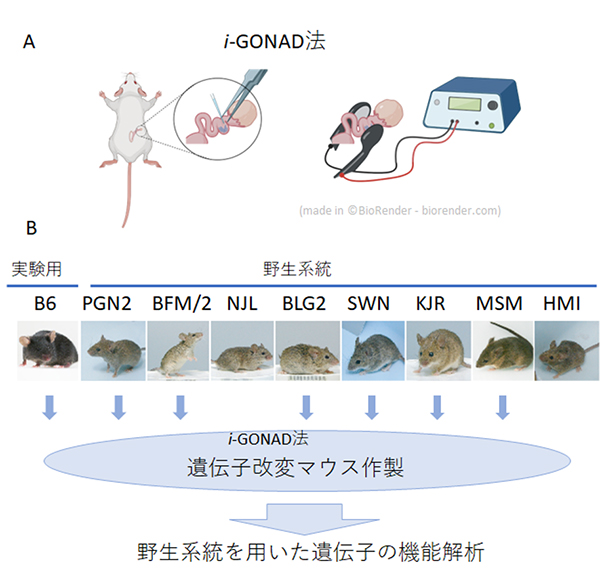
野生マウス系統でゲノム編集が可能になりました!
Efficient genome editing in wild strains of mice using the i-GONAD method
Yuji Imai, Akira Tanave, Makoto Matsuyama, and Tsuyoshi Koide
Scientific Reports (2022) 12, 13821 DOI:10.1038/s41598-022-17776-x
国立遺伝学研究所では、これまでに9種類の野生マウス由来の系統(野生系統)を樹立してきました。これらの系統は、異なる系統間で大きな遺伝的差異があることや野生マウスに特徴的な行動を示すことなど、一般的に用いられている実験用系統にはない特徴を有しています。
これら一連の野生系統は三島バッテリーと名付けられ、当研究所で樹立された独自性の高いリソースとして国内外の研究者に供与され、がん、免疫、発生、行動の分野などさまざまな研究に利用されています。しかし、このような優れた特徴にも関わらず、野生系統では遺伝子改変が難しいという問題がありました。
このたび、マウス開発研究室の今井悠二技術職員と小出剛准教授らは重井医学研究所および理化学研究所との共同研究として、受精卵を体外で扱うことなくゲノム編集を行うi-GONADという手法を用いることで、大半の野生系統で効率よく遺伝子改変を行うことが可能であることを示しました。
まず、実験用系統であるC57BL/6系統(B6系統)と9種類の野生系統で、一般的なゲノム編集作業で必要な体外受精の効率を調べるために、それぞれ体外受精を行いました。その結果、大半の野生系統では体外受精の効率が極端に悪いことが分かりました。そこで、東海大学の大塚正人教授らが開発した、受精卵を体外に取り出すことなくゲノム編集を行うi-GONAD法を野生系統に応用しました。その結果、調べた9系統のうち7系統でゲノム編集を行うことに成功しました。この結果は、今後野性系統を用いて効率よく遺伝子改変を行うことが可能になったことを示しており、今後多くの研究分野における野生系統の活用が期待できます。
本研究は、科学研究費補助金19KK0177および19H03270などの助成により実施されました。