Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
2016年度日本育種学会春季大会で実験圃場の津田勝利助教、 小野聖二郎さんが優秀発表賞を同時受賞
2016年日本育種学会春季大会(第129回講演会)における日本育種学会優秀発表賞が発表されました。
実験圃場・野々村研究室から津田 勝利助教、小野 聖二郎さんの2名が受賞されました。
津田助教の発表は、カリフォルニア大学バークレー校のヘイク研究室および遺伝研城石研究室との共同研究の成果です。
小野さんの発表は、総研大博士論文研究の内容が土台となって得られた成果です。

実験圃場に凱旋 左:津田助教 右:小野研究員
受賞テーマ:
・津田 勝利:トウモロコシKNOTTED1の共役因子 BEL1‒like homeobox転写因子のシュート形成における機能
・小野 聖二郎:イネ減数分裂期タペート組織におけるsmall RNA生合成関連遺伝子の転写制御因子
遺伝研 新分野創造センター 10周年シンポジウム
「データ同化技術」を用いて細胞質流動の原動力を推定
Bayesian Inference of Forces Causing Cytoplasmic Streaming in Caenorhabditis elegans Embryos and Mouse Oocytes.
Niwayama R., Nagao H., Kitajima T. S., Hufnagel L., Shinohara K., Higuchi T., Ishikawa T., Kimura A.
PLoS ONE, Vol 11, e0159917 (2016). DOI:10.1371/journal.pone.0159917
国立遺伝学研究所と統計数理研究所、東北大学、理化学研究所、大阪大学、欧州分子生物学研究所の共同研究チームは、統計数理研究所で研究・開発されてきた「データ同化技術」を遺伝学に適用し、測定が困難な細胞内の力を推定することに成功しました。本研究で庭山律哉博士(総研大遺伝学専攻・日本学術振興会特別研究員、現・欧州分子生物学研究所研究員)らは、細胞内での大規模な物質の流動現象である細胞質流動に着目し、線虫(C. elegans)とマウスの細胞内の流動の方向性や速さを詳細に定量化しました。この計測データと流体力学シミュレーションモデルを統合したデータ同化によって、流動を引き起こす原動力の強さと分布を推定しました。推定された力の分布は、力の発生に重要な分子の分布と一致し、本手法の妥当性が支持されました。マウスと線虫では原動力の分布が異なっていましたが、その違いはそれぞれの細胞での流動の機能と合致していて、機能に適した力の分布をそれぞれの細胞がとっていることが示唆されました。本手法は生体内で生じる様々な流れの解析に適用可能で、今後多くの研究者に活用されることが期待されます。
本研究は情報・システム研究機構の「新領域融合センター」および「データ中心科学リサーチコモンズ」のプロジェクトとして遂行されました。新領域融合センターの合宿型会議である「クロストーク」で異分野の研究者が出会い、同センターの萌芽的研究を促進する「育成融合プロジェクト」の支援を受けて共同研究を開始しました。この間、生命科学および統計数理の両者の観点から魅惑的かつ適切な問題を探索し、取り組んできました。その後、データ中心科学リサーチコモンズ内の「データ同化」プロジェクトのサブ研究テーマとして共同研究を継続し、今回の成果発表につながりました。このプロジェクトの実施により、融合研究を開始するためのノウハウをよく理解し、高度な統計数理技術を習得した生命科学分野の若手研究者を育成し、広範な学術コミュニティに送り出してきました。長い時間はかかりましたが、情報・システム研究機構が推進する新領域創造型研究の好例となりました。この経験は「データサイエンス共同利用基盤施設」のデータ融合計算プロジェクトの運営に引き継がれています。
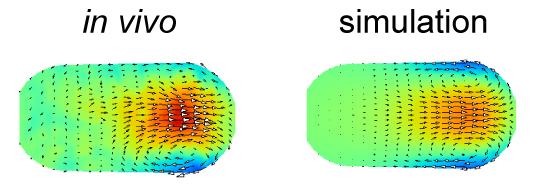
本研究で推定された原動力を用いた流体シミュレーション(右)は、実際の細胞内の流動(左)をよく再現しました。図は線虫胚での結果を示しており、色は流動の速さ、矢印は向きを表します。
細胞分裂の司令塔「中心体」の成熟過程を解明
![]()
Cep295 is a conserved scaffold protein required for generation of a bona fide mother centriole
Yuki Tsuchiya, Satoko Yoshiba, Gupta Akshari, Koki Watanabe, Daiju Kitagawa.
Nature Communications 2016 Aug 26;7:12567 DOI:10.1038/ncomms12567.
細胞が分裂するとき、染色体は糸のような繊維によってそれぞれ引っ張られ、2つの細胞に分配されます。その繊維の伸びる起点となるのが、中心体と呼ばれる細胞内小器官です。通常、1つの細胞に中心体は1つしかありません。しかし、細胞分裂時には中心体が「複製」されて2つになり対極に分かれることで、染色体を引っ張ることができます。もし中心体の複製が失敗すると、染色体を適切に分配できず、細胞分裂に支障が出ることによって、がんなどの病気になりかねません。中心体が適切に複製される仕組みの全容解明が求められています。
中心体は、柱状の部品である「中心小体」が2個組み合わさって形作られています。2個の中心小体のうち、片方が「完成された」母中心小体で、もう一方が「未完成の」娘中心小体です。中心小体の複製では、母中心小体の根元から生み出された娘中心小体が母中心小体へと成熟することが不可欠でした。
今回、国立遺伝学研究所の北川大樹教授、土屋裕樹大学院生らのグループは、娘中心小体の成熟を制御する最上流因子(Cep295)を発見しました。この因子は中心小体の成熟の初期段階で働いていて、Cep295の活性がその後の主な成熟過程に必須であること、Cep295は成熟過程に必要な既知の因子Cep192と結合することで機能することが明らかになりました。
中心体が複製される仕組みの解明は、中心体の異常に起因する様々な病気の原因解明に役立つことが期待されます。今後は、これらの知見をもとにがんの阻害剤となる化合物を探索し、新しい作用機序をもつ抗がん剤の開発を目指します。
本研究は、日本学術振興会 特別研究員奨励費、科学研究費補助金・新学術領域研究(研究領域提案型)、科学研究費補助金・若手研究(A)、JST(生命科学の新分野創造若手育成プログラム)、武田科学振興財団、内藤記念科学振興財団の支援により行われました。
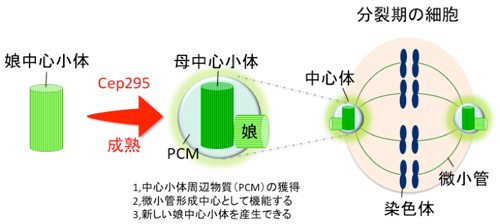
図1. 本研究成果の概略図:中心体は分裂期に対極に分かれて紡錘体と呼ばれる糸状の微小管束を生成し、染色体を引っ張ることで細胞分裂を正しく導きます。本研究では、娘中心小体が成熟し中心体としての機能を獲得する過程を明らかにしました。
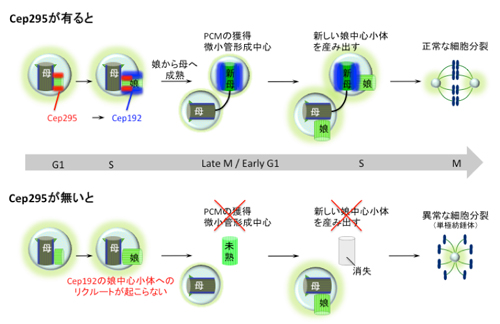
図2. モデル図:Cep295は物理的な相互作用を介してCep192を娘中心小体へとリクルートする。その後、娘中心小体は成熟し、中心体としての機能を獲得する。Cep295がない場合、未熟な中心小体はPCMや微小管形成中心としての機能、さらに新しい中心小体を産み出す能力を獲得できずにやがて消えてしまう。
遺伝研と東京農業大学は連携協定を締結しました
遺伝研から、桂所長、藤山特任教授らが東京農業大学を訪れ、東京農業大学から、髙野学長や夏秋副学長を始めとする関係者の皆様方に迎えられ、締結式を行いました。
桂所長及び髙野学長から、遺伝研と東京農業大学とは、特にゲノム関連において、以前から関係が深かったこと、また、東京農業大学においては、平成29年度に生命科学部が新設されることもあり、研究面のみならずあらゆる面において、今後連携を深めていく取組を検討していきたい旨のお話がありました。



締結式の様子
「夏休み子ども遺伝学講座」を開催
やさしいアリ教室~アリの不思議・アリの知恵~と題して「夏休み子ども遺伝学講座」を開催いたします。身近なアリについて学び、一緒に観察してみましょう。
対象:
三島市内の小学校3年生~6年生 40名
申込者多数の場合は抽選となります。
日時:
平成28年7月27日(水)午前9時30分~午前11時40分(予定)
※広報みしま7月1日号に「7月26日開催」とありますが、正しくは7月27日(水)です。深くお詫び申し上げ訂正させていただきます。
場所:
国立遺伝学研究所(三島市谷田1111)
申込:
三島市政策企画課まで電話か電子メールでお申込みください。
申込時に ①氏名 ②学年 ③住所 ④電話番号 をお伝えください。
申込み締切は平成28年7月20日(水)です。
E-mail: seisaku@city.mishima.shizuoka.jp
染色体の凝縮を司るタンパク質因子のDNA結合特性
In vitro topological loading of bacterial condensin MukB on DNA, preferentially single-stranded DNA rather than double-stranded DNA
Hironori Niki, and Koichi Yano
Scientific Reports 6, Article number: 29469 (2016) DOI:10.1038/srep29469
DNAは細胞の中にぎゅっと凝縮して格納されている。DNAの凝縮には様々な因子が関係している。その中の一つであるコンデンシン複合体は、バクテリアからヒトまで共通している根幹の凝縮因子である。コンデンシン複合体は染色体DNAの特定の位置に形成され、特にバクテリアでは複製の開始点付近に形成される。しかし、それがどのようにして決まるのかは不明である。また、コンデンシン複合体は環状構造をしており、その複合体の輪の中にDNAを閉じ込め結合する、いわゆるトポロジカル結合が可能な構造である。しかし、実際にトポロジカル結合するのかどうかはまだよくわかっていない。これらの問題を解くために、精製したバクテリアのコンデンシンタンパク質でトポロジカル結合の検出を試みたのが本研究である。
大腸菌のコンデンシンタンパク質であるMukBと、複合体の構成因子であるMukE、MukFをそれぞれ精製し、様々なDNAに対しての結合性を測定した。通常のDNA結合能は高塩濃度で阻害されるのであるが、MukBは高塩濃度でも安定なDNA結合性を見せた。この結合能は、基質となるDNAのトポロジーによって異なり直線状DNAでは観察されず環状DNAでのみ検出された。また、二本鎖環状DNAよりも一本鎖環状DNAでより顕著であった。したがって、MukBは一本鎖DNAに対してトポロジカル結合をするものと考えられる。
通常、細胞の内部では染色体DNAは二本鎖状態をとっており、限られた領域でしか一本鎖状態を取らない。そのような領域は転写の活性の高い部分であり、バクテリアではリボソームRNA(rRNA)遺伝子である。実際に、rRNA遺伝子は複製の開始点付近に複数の遺伝子が散在し、rRNA遺伝子のコピー数の低下は染色体の形に悪影響を及ぼすことが知られている。
このようなことから、私たちは、細胞内ではコンデンシンMukBは一本鎖DNAを取りやすいrRNA遺伝子にトポロジカル結合しやすのではないかと考えている。トポロジカル結合した後、MukE、MukFといった他の因子がMukBのこのトポロジカル結合を安定化させ、さらにこのMukBEF複合体同士が集まる。その結果、複製の開始点付近が束ねられるのであろう。今後は細胞内でのトポロジカル結合を調べていくことで、このモデルを検証しコンデンシンの作用の実態をさらに明らかにしていく。
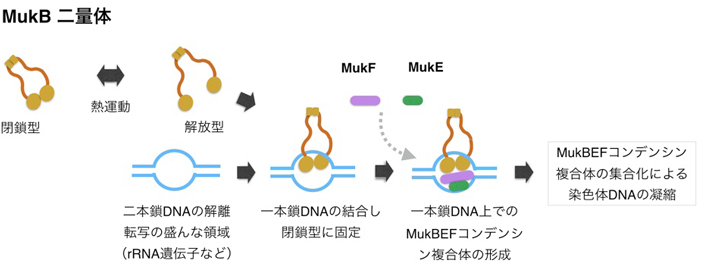
MukBタンパク質は二量体を作り、熱運動により開いたり閉じたりする。そして、染色体のDNAを挟みこみトポロジカルな結合をする。挟み込んだDNAが一本鎖DNAの時は、トポロジカルな結合が安定化する。さらにMukE, MukFが加わりさらに安定な一本鎖DNAとMukBEFタンパク質複合体が形成される。このDNAとMukBEFタンパク質複合体同士が次々と集まることにより、染色体DNAが折りたたまれるようになる。
短時間でがん組織切片の染色体テロメア長を測定できる方法を開発
![]()
Telomere Visualization in Tissue Sections using Pyrrole–Imidazole Polyamide Probes
Asuka Sasaki, Satoru Ide, Yusuke Kawamoto, Toshikazu Bando, Yukinori Murata, Mari Shimura, Kazuhiko Yamada, Akiyoshi Hirata, Kiyoshi Nokihara, Tatsumi Hirata, Hiroshi Sugiyama, Kazuhiro Maeshima
Scientific Reports 6: 29261 (2016) DOI:10.1038/srep29261
国立遺伝学研究所の総研大大学院生 佐々木飛鳥、井手聖助教、前島一博教授、平田たつみ教授、京都大学の杉山弘教授らのグループ、(株)ハイペップ研究所 軒原清史代表らのグループ、国立国際医療センターの志村まり室長らのグループは、細胞老化・がん化に重要な役割を担う染色体テロメア配列を組織切片の細胞において簡便かつ迅速に標識する方法を開発しました。
染色体の末端はテロメアと呼ばれる繰り返し配列により保護されています。ある種のがん細胞では、テロメアの長さが短くなっていることから、テロメア長はがん診断の指標になると考えられています。これまでテロメアの検出にはFISH法が利用されてきましたが、実験に1日以上を要する上に、細胞内の構造を壊すおそれのある熱・有機溶媒処理も必要とすることが課題でした。研究グループらは、これらの問題点を克服する新化合物「ピロール・イミダゾール(PI)ポリアミド化合物」(図1)を開発してきました。本研究では、マウスやヒト凍結組織切片にこの標識法を応用することに成功しました。さらにPIポリアミドは抗体染色と併用できるため、がん組織切片においてがん細胞に焦点を当ててテロメア長を測定することに成功しました(図2)。
本研究の成果により、PIポリアミド化合物は、簡便かつ高精度な1細胞レベルでのテロメア長の測定法として、基礎研究のみならず臨床分野において広く用いられることが期待されます。また本技術は、細胞内の空間情報を保持したままテロメアを標識できるので、超解像顕微鏡技術と組み合わせることにより、細胞が持つテロメア構造の本来の姿を捉えることが期待されます。
本研究の遂行にあたり、JST・CREST 「統合1細胞解析のための革新的技術基盤」および遺伝研共同利用研究費(2015-B)の支援を受けました。
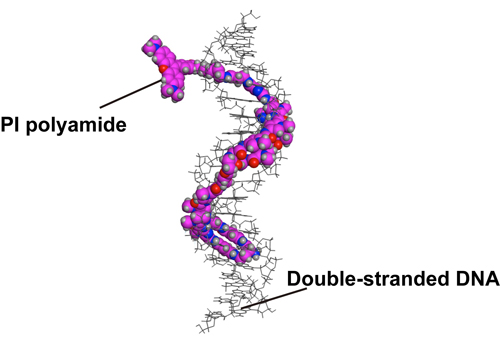
図1. 二本鎖DNAに結合するPIポリアミド。
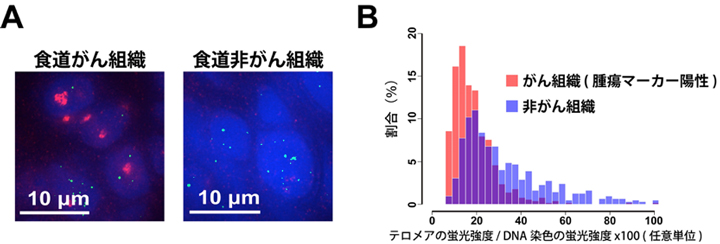
図2. ヒト食道がん・非がん組織切片におけるテロメア標識。(A) がん・非がん組織切片を染色した画像。緑がテロメア(PIポリアミドで染色)、赤色が腫瘍マーカー陽性(抗Ki-67抗体染色)、青色がDNA(DAPI染色)を示す。 (B) がん・非がん組織切片におけるテロメアの蛍光強度を定量した結果。がん組織切片におけるテロメアの蛍光強度は、非がん組織切片よりも小さく、テロメアが短くなっていることが示唆される。
ヒト科特有のコード・非コードゲノム配列の誕生と進化
Emergence and evolution of Hominidae-specific coding and noncoding genomic sequences
Morteza Mahmoudi Saber, Isaac Adeyemi Babarinde, Nilmini Hettiarachchi and Naruya Saitou
Genome Biology and Evolution Volume 8, advance access, 2016 DOI:10.1093/gbe/evw132
ヒト科にはヒトと大型類人猿が含まれる。われわれはこれらの全ゲノム配列を用いて、ヒト科特有の遺伝子および高度に保存された非コード塩基配列 (HCNS)を探索した。遺伝子については、ダウン症重要領域4 (DSCR4) 遺伝子だけが、実験的にタンパク質の存在が確認されているヒト科特有のものだった。DSCR4タンパク質は他のすべてのタンパク質と構造上の相同性がなく、いくつかの段階を経て誕生したと推定された。われわれは1658個のヒト科特有HCNSを発見した。これらのHCNSは純化淘汰を受けており、重要な機能を持っていると考えられる。これらの配列は音の感覚認知や発生過程に関する遺伝子の近傍にあり、またヌクレオソーム存在確率が有意に低い。興味深いことに、ヒト科特有HCNSの祖先配列の多くは、きわめて高い進化速度を有していた。このことは、HCNSの一部の新しい機能がなんらかの正の(ダーウィン流の)自然淘汰によって誕生し、その後純化淘汰によってこれらの機能が保たれるようになったことを示唆している。
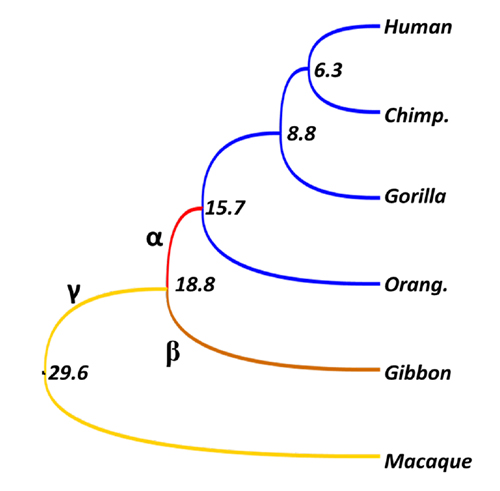
ヒト科とその外群における系統樹の枝ごとの進化速度。数字は分岐年代(単位:百万年)。ヒト科内では進化速度がゼロ(塩基配列が同一)だが、枝α、β、γの進化速度は5.5, 2.0,1.9である。特にヒト科の共通祖先である枝αは、中立進化速度 (1.0)の5倍以上の高さであり、一部の祖先配列は正の自然淘汰を受けていたように思われる。
「遺伝研メソッド」によるプレゼンテーション講習会開催のお知らせ
応募者多数のため募集を締め切らせていただきました
概要
7月1日(金), 2日(土)に科学プレゼンテーション講習会を遺伝研にて開催します。
「遺伝研メソッド」とは,国立遺伝学研究所(総研大・生命科学研究科・遺伝学専攻)で開発された科学プレゼンテーションのカリキュラムです。 英語による研究発表のトレーニングを通じて、研究者としての論理的思考力、英語で質問や議論する能力を培います。 学生だけでなく、若手研究者、教員など多くの研究者のプレゼンテーション能力の向上に成果を上げています。
本講習会は2日間で講義と実践演習(希望者5名の研究発表に対して講師陣や他の参加者が助言を行うセッション)を行います。使用言語は英語です。
参加を希望される方は以下の応募要項をご確認の上、応募方法に従ってお申し込みください。
スケジュール
| 7月1日 | 13:30~16:15 | 講義 |
| 7月2日 | 09:00~12:00 | 実践演習、講義 |
詳しくは以下のサイト(英語)をご参照ください。
http://www.nig.ac.jp/nig/workshop/
開催場所
国立遺伝学研究所
411-8540 静岡県三島市谷田1111
対象者・募集人数
自然科学系の教員、研究者、学生
最大50名(うち実践演習5名)
応募方法
以下の情報をメール ask-ord@nig.ac.jp にてお寄せください。メールの件名は「NIGMethod2016」にしてください。
- 氏名
- 所属機関
- 身分
- 研究室名
- 研究内容(2、3行で)
-
実践演習での研究発表(10分)を希望しますか?(はい/いいえ)
希望される方は、発表題目と要旨ご提出ください。
旅費を支給します。旅費支給を希望される方は、以下の情報を応募メールにてご連絡ください。
- 本ワークショップに参加するにあたって必要な予算(交通費、宿泊費)
- 参加のための経費を支出できる予算(ご自身の研究費、PIの研究費など)がある場合、その金額
- 本ワークショップに参加される理由、期待していることを(2、3行)
申し込み締め切り後、メールにて旅費支給の可否、支給額等をご連絡いたします。
問い合わせ先: ask-ord@nig.ac.jp
「Fission Yeast: A Laboratory Manual」Cold Spring Harbor Laboratory Pressより出版
Cold Spring Harbor Laboratory Pressから実験書「Fission Yeast: A Laboratory Manual」が発行の運びとなりました。単細胞真核生物の分裂酵母は遺伝学、細胞生物学の分野で広く研究され、細胞周期、分化、エピジェネティクスなどの基礎研究で多くの成果を上げています。
分裂酵母の研究で培われてきた実験プロトコールを第一線で研究している研究者が解説し新たに書き下ろしたものです。培養法からイメージジング、また研究に有用なデータベースまでも紹介されています。
分裂酵母といえば Schizosaccharomyces pombeですが、本実験書では最近モデル分裂酵母と利用され始めたS. japonicusの解説と実験プロトコールも収められています。これを国立遺伝学研究所系統生物研究センター、仁木宏典教授、青木敬太助教、京都大学放射線生物研究センター 古谷寛治講師で担当しました。
- タイトル:
- Fission Yeast: A Laboratory Manual
- 編集:
- Iain Hagan, Cancer Research UK Manchester Institute, University of Manchester; Antony M. Carr, University of Sussex; Agnes Grallert, Cancer Research UK Manchester Institute, University of Manchester; Paul Nurse, The Francis Crick Institute
- 価格:
- $150
Cold Spring Harbor Laboratory Press
Schizosaccharomyces japonicus: A Distinct Dimorphic Yeast Among the Fission Yeasts
Keita Aoki, Kanji Furuya, and Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.top082651
Mating, Spore Dissection, and Selection of Diploid Cells in Schizosaccharomyces japonicus
Kanji Furuya and Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.prot091843
Transformation of Schizosaccharomyces japonicus
Keita Aoki and Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.prot091850
Induction of Hyphal Growth in Schizosaccharomyces japonicus
Hironori Niki
Cite this protocol as Cold Spring Harb Protoc; doi:10.1101/pdb.prot091868
蛍光顕微鏡画像の簡便かつ非裁量的な定量解析法を開発
GBIQ: a non-arbitrary, non-biased method for quantification of fluorescent images
Youichirou Ninomiya*, Wei Zhao and Yumiko Saga*
Scientific Reports 6, Article number: 26454 (2016) DOI:10.1038/srep26454
(* corresponding authors)
国立遺伝学研究所の二宮洋一郎融合プロジェクト特任研究員、相賀裕美子教授らは、蛍光顕微鏡画像を簡便かつ非裁量的に定量解析する新しい方法を開発しました。
従来、細胞や組織の蛍光顕微鏡画像を定量解析するには、まず、画像内の細胞を細胞核や細胞膜などの染色像を利用して一つ一つ同定する処理cell segmentationが必要でした。この、同定された個々の細胞の蛍光強度を計測し、定量解析を行います。従って、ノイズやゴミなどの人為産物を取り除き、cell segmentationで適切に個々の細胞を同定することが重要となり、cell segmentationのアルゴリズムやパラメータセットを最適化する必要があります。
これは、画像定量化の最初の過程で多くのパラメータを裁量的に調整しなくてはならず、同じ画像を定量化しても、術者の選ぶパラメータセットやアルゴリズムが変わると異なった解析結果が得られることを意味します。また、現在のcell segmentationの各アルゴリズムには汎用性がなく、個々の解析対象に応じてアルゴリズムとパラメータセットを選択・最適化する必要がありました。
そこで、画像を規則的な碁盤の目状のグリッドで機械的に仕切り、各グリッドの蛍光強度の基本統計量でグリッドの蛍光特性を代表させる、簡便なアルゴリズムGBIQ (Grid Based Image Quantification)を開発しました。ただし、このままでは、一つのグリッドに核と細胞質の両方が含まれるような解析には不適切なグリッドが混在するため、例えば核のみが含まれるグリッドを選択する何らかの方法が必要です。そのため、混合正規分布を個々の正規分布に分離する統計的クラス分類の手法を適用し、特定の要件を満たすグリッドのみを精度良く選択する方法(Median IQR filter)を実装しました。その結果、一つのパラメータ(グリッドの大きさ)を設定するだけで画像の定量化と解析を非裁量的に実行することに成功しました。このことは、どのような蛍光顕微鏡画像でも、GBIQを適用してパラメータを一つ決めれば、術者が誰であるかに関わらず同じ画像からは常に同じ結果が得られることを意味します。
今後、GBIQをハイスループット・スクリーニングなどの大量の顕微鏡画像データの処理に応用することで、表現型の非裁量的な定量化を実現し、データ中心的な生命科学の進展に大きく寄与することが期待されます。
この研究は情報・システム研究機構 新領域融合プロジェクト 統計数理基盤「データ同化」の一環として行われました。
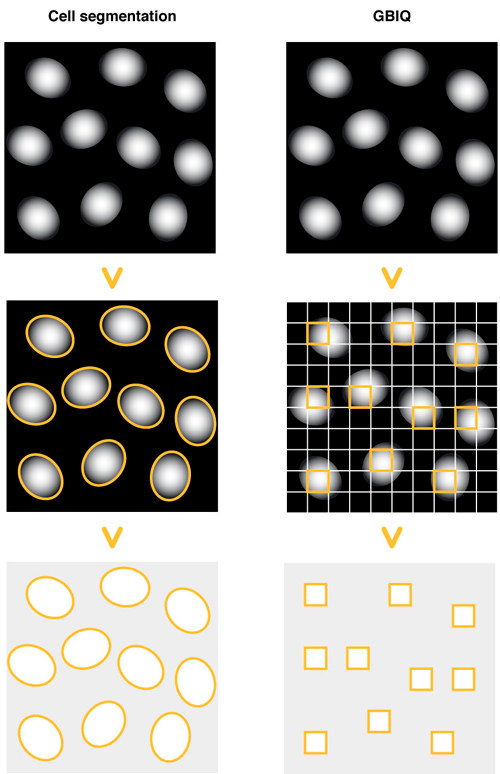
Cell segmentation: 核染色像を指標に、細胞核の輪郭像を描出する。輪郭像を認識・同定し、細胞単位の蛍光特性を計測する。
GBIQ: 画像を一律に同じ大きさのグリッドで区切る。細胞核のみを含むグリッドを選択し、グリッド単位の蛍光特性を計測する。
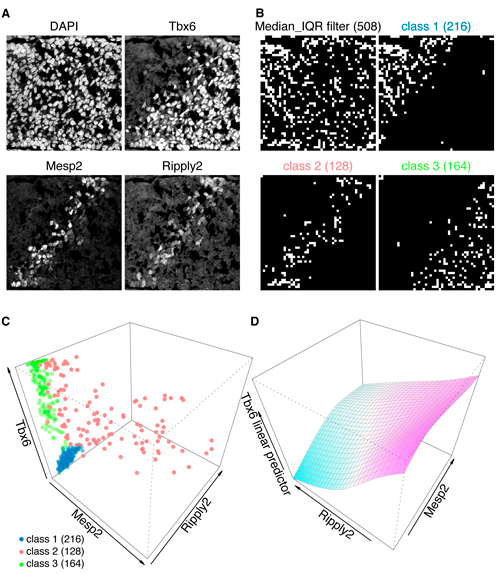
A: マウス胚尾芽の組織切片の三重蛍光染色像。DAPIは核染色。Tbx6の発現境界に一致して、Mesp2/Ripply2の帯状の発現が観察される。
B: Median_IQR filterによって核のみを含む508グリッドを抽出し、Tbx6/Mesp2/Ripply2の染色強度によって3つのクラス(class 1〜3)に分類した。
C: それぞれのクラスの3次元散布図。class 2 (red)のグリッドはMesp2とRipply2の両方を発現する。
D: class 2のグリッドを用いて一般化加法モデルによる解析を行った。Ripply2とTbx6の間には強い負の相関が観察され、Tbx6を実際に分解するのはRipply2であることが強く示唆された。
2016年度以降の入試における英語能力評価に関するお知らせ
遺伝研 大学院説明会2016
熊本地方地震被災地の研究者支援 「緊急共同利用・共同研究」 のお知らせ
新たな抗がんメカニズムをもつ新規白金化合物
Chromatin folding and DNA replication inhibition mediated by a highly antitumor-active tetrazolato-bridged dinuclear platinum(II) complex
Ryosuke Imai, Seiji Komeda, Mari Shimura, Sachiko Tamura, Satoshi Matsuyama, Kohei Nishimura, Ryan Rogge, Akihiro Matsunaga, Ichiro Hiratani, Hideaki Takata, Masako Uemura, Yutaka Iida, Yuko Yoshikawa, Jeffrey C. Hansen, Kazuto Yamauchi, Masato T. Kanemaki, and Kazuhiro Maeshima
Scientific Reports 6, Article number: 24712 (2016) DOI:10.1038/srep24712
ゲノムDNAの正確な複製や分配、転写は、細胞が生きる上で必須の機構です。そのためこれらの機構はしばしば抗がん剤の標的となります。シスプラチンなどの白金製剤は「切れ味鋭い」抗がん作用をもち、現在、最もよく使われる抗がん剤のひとつです。これらの抗がん剤は、DNAに直接共有結合性の架橋を形成することで複製を阻害し、抗がん作用を示すことが知られていました。総研大遺伝学専攻大学院生・今井亮輔、国立遺伝研・前島一博教授らのグループは今回、近年開発された5-H-Yという新たな白金化合物が、シスプラチンなどの既存の白金製剤とは異なるメカニズムによって抗がん作用を示すことを明らかにしました。この5-H-Yはシスプラチンと同様に、DNAの複製やRNAの転写を阻害することによって細胞の増殖を抑制します。しかし、DNAへの架橋はほとんど起こさず、クロマチンを凝集させる作用があることを明らかにしました。実際に、シスプラチン耐性細胞においても5-H-Yは十分な抗がん作用を示すことも確認しています。この5-H-Yの抗がんメカニズムは、今後新たな抗がん剤を開発する上での重要な知見になると考えられます。
本研究成果は、国立遺伝研・今井亮輔総研大生、田村佐知子テクニカルスタッフ、前島一博教授、鈴鹿医療科学大学・米田誠治准教授、国立国際医療研究センター・志村まり室長、大阪大学・山内和人教授、国立遺伝研・鐘巻将人教授、東レリサーチセンター・飯田豊部長、立命館大学・吉川祐子客員教授、米国コロラド州立大・Hansen教授の各グループによる共同研究成果です。また、JST・CREST「コヒーレントX線による走査透過X線顕微鏡システムの構築と分析科学への応用」、および遺伝研・共同研究(A)の支援を受けました。
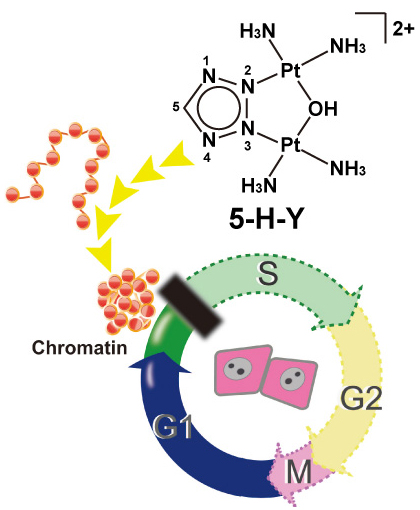
新規白金化合物5-H-YはDNA複製を阻害することで抗がん作用を示す。また、架橋はほとんど形成せず、in vitro およびin vivoでクロマチンを凝集させる。
進化的に保存された非コード塩基配列のゲノム上の位置とその機能との関連
Genomic locations of conserved noncoding sequences and their proximal protein-coding genes in mammalian expression dynamics
Isaac Adeyemi Babarinde and Naruya Saitou
Molecular Biology and Evolution DOI:10.1093/molbev/msw058
哺乳類において進化的に保存された配列 (CNS)を、特にそのゲノム上の位置について調べました。ニワトリと4種の哺乳類(ヒト、マウス、イヌ、ウシ)で保存されているCNSを抽出し、これらがヒトで現在でも淘汰上の制約を受けていることを確認しました。分布パターン、ChIP-SeqとRNA-Seqデータを調べたところ、これらのCNSが制御因子であることが示唆されました。CNSとそのもっとも近傍の遺伝子のあいだの物理距離は、ヒトとマウスのゲノムで高く保存されていました。ChIP-Seqシグナルと遺伝子の発現パターンはCNSが近傍遺伝子の発現を制御していることを示していました。CNSをより多く持つ遺伝子の方がCNSが少ない遺伝子よりも、その発現は進化的により保存的でした。これらの解析結果は、CNSのゲノム上の位置がその遺伝子発現調節機能にとって重要であることを示唆しています。本論文の筆頭著者、ババリンデ博士は総研大遺伝学専攻から博士(理)を授与されたばかりです。彼は森島賞も遺伝研から受賞しています。
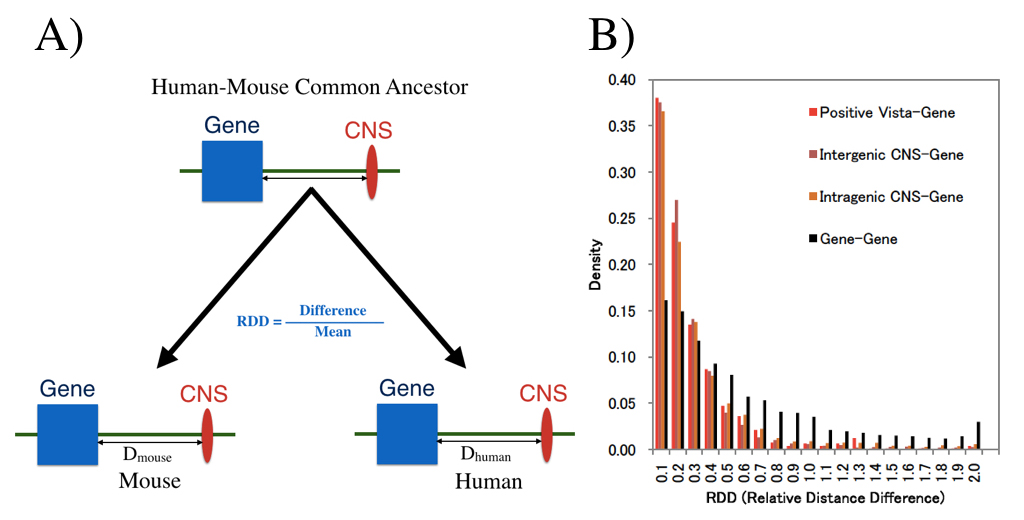
ヒトとマウスの共通祖先で存在していた遺伝子とCNSのあいだのゲノム距離が現在でも保存されているかどうかを調べました。(A)は距離保存の尺度であるRDDの定義を、(B)はRDDの分布を示しています。CNSと遺伝子のあいだの距離が遺伝子間の距離よりもずっと高く保存されています。
生体高分子研究室の前島一博教授が第24回(平成27年)木原記念財団学術賞を受賞

構造遺伝学研究センター 生体高分子研究室の前島一博教授が第24回(平成27年度)木原記念財団学術賞を受賞しました。本賞は、生命科学の分野で特に優れた独創的な研究を行っている50歳未満の研究者に授与されるものです。
受賞課題:細胞内ゲノムDNAの折り畳み構造の解明

















