Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
宮城島進也教授が日本学術振興会賞を受賞

共生細胞進化研究部門の宮城島進也教授が、第13回日本学術振興会賞を受賞することが12/27に発表されました。日本学術振興会賞は、創造性に富み優れた研究能力を有する若手研究者を見い出し、早い段階から顕彰することで、その研究意欲を高め、研究の発展を支援することにより、我が国の学術研究の水準を世界の トップレベルにおいて発展させることを目的として設立された賞で、本年度は人文学、社会科学及び自然科学の全分野の380名の推薦の中から25名が選ばれました。
受賞の対象となったのは「宿主細胞とオルガネラの協調増殖機構を司るタンパク質群の同定」で、宮城島教授は、葉緑体の分裂装置を構成するタンパク質群がシアノバクテリアの分裂装置の一部と宿主真核細胞の細胞質分裂の一部の両方に由来し、協調的に機能することを発見しました。また、光合成真核生物として最小のゲノムを持つ原始紅藻のシゾンに遺伝子破壊、導入遺伝子の発現誘導・抑制系などの分子生物学的手法を導入した独自の実験系を用い、葉緑体分裂装置の構造、分裂時の挙動などを明らかにしました。
これらオルガネラと真核細胞の協調的分裂制御に関する様々な先駆的業績は、細胞内共生の分野に重要な寄与をしたものであることが高く評価されました。
平成29年2月8日(水)に日本学士院において授賞式が行われる予定です。
日本学術振興会HP: 日本学術振興会賞
公募型共同研究・研究会「NIG-JOINT」募集を締め切りました
遺伝子改変マウスの作製支援を開始(マウス研究支援ユニット)
国立遺伝学研究所 マウス研究支援ユニットは、遺伝子改変マウスの作製支援を開始しました。
詳細および申込: https://shigen.nig.ac.jp/mouse/researchSupportingUnit/
近年の遺伝子編集技術の発達により遺伝子ノックアウトマウスの作製が以前よりも容易になりました。そのことを受けて研究コミュニテイではマウスをモデルとした遺伝子機能解析実験の需要が高まっています。しかし、マウスの作製・維持には遺伝子組換実験が認可された動物実験施設と高度な動物作製技術が依然として必要です。
大学共同利用機関法人 国立遺伝学研究所 マウス研究支援ユニットは、大学等の公的研究機関からの需要に応えるため、遺伝子改変マウスの作成を共同研究の一環として支援します。
第34回 DDBJing 講習会 in 三島
集団遺伝研究部門 斎藤成也教授監修の『DNAでわかった日本人のルーツ』宝島社より出版
 宝島社より、集団遺伝研究部門 斎藤成也教授 監修の 『DNAでわかった日本人のルーツ』 が2016年11月29日に出版されました。
宝島社より、集団遺伝研究部門 斎藤成也教授 監修の 『DNAでわかった日本人のルーツ』 が2016年11月29日に出版されました。
詳細は下記および出版社ホームページをご覧ください。
|
||||||
細胞内共生による葉緑体誕生に必須であった細胞と葉緑体の分裂同調化機構の解明
Chloroplast division checkpoint in eukaryotic algae.
Nobuko Sumiya, Takayuki Fujiwara, Atsuko Era, and Shin-ya Miyagishima
Proc. Natl. Acad. Sci. USA. (2016). Published online, DOI:10.1073/pnas.1612872113
真核細胞内で呼吸の場となるミトコンドリアや光合成の場である葉緑体は、バクテリアが真核細胞内に共生することによって誕生しました。
バクテリア細胞が宿主である真核細胞内に永続的に維持され、細胞内小器官へと変遷していくためには、バクテリア細胞の分裂が宿主細胞の分裂に同期される必要があります。この分裂を同調化させるメカニズムの解明は、真核細胞の誕生を理解する上でも重要ですが、その知見は長い間得られていませんでした。
これまでに私たちは、葉緑体は、葉緑体中央に形成される細胞核コードのタンパク質群からなるリングが収縮することによって分裂することを明らかにしてきました。多くの藻類細胞は1ないし数個しか葉緑体をもたず、葉緑体は宿主細胞周期の決まった時期に一度だけ分裂することが知られています。私たちは、このような藻類細胞では、葉緑体分裂リングを構成するタンパク質群が宿主細胞周期のS期のみに発現することにより、葉緑体分裂の開始がS期に限定されることも示してきました。しかし一回の細胞周期に葉緑体分裂が一回に限定される仕組みは不明でした。
今回私たちは、単細胞紅藻シアニディオシゾンにおいて開発した導入遺伝子誘導発現系を用いて葉緑体分裂を停止させたときの宿主細胞周期への影響を調べました。その結果、葉緑体分裂位置の収縮前に分裂を停止させた場合には宿主細胞周期がM期前期で停止すること、収縮開始後に分裂を停止させた場合には宿主細胞周期は停止しないことがわかりました。これらの結果は、葉緑体分裂がひとたび開始すると、細胞周期が葉緑体分裂リング構成タンパク質群の発現を終えるM期中期まで進行し、その結果葉緑体分裂が1回に限定されることを示しています。また、葉緑体分裂と宿主細胞分裂の同調化は、宿主細胞による葉緑体分裂リング形成時期の限定と、葉緑体分裂リングの収縮開始による宿主細胞周期のM期中期以降への進行許可という、宿主細胞と葉緑体双方による制約の掛け合いによって成立していることもわかりました。さらに同様の実験結果が、葉緑体誕生後初期に分岐した灰色藻でも認められたことから、このような葉緑体と細胞の分裂同調化メカニズムは藻類の共通祖先で葉緑体誕生時に獲得されたものであることも示唆されます。
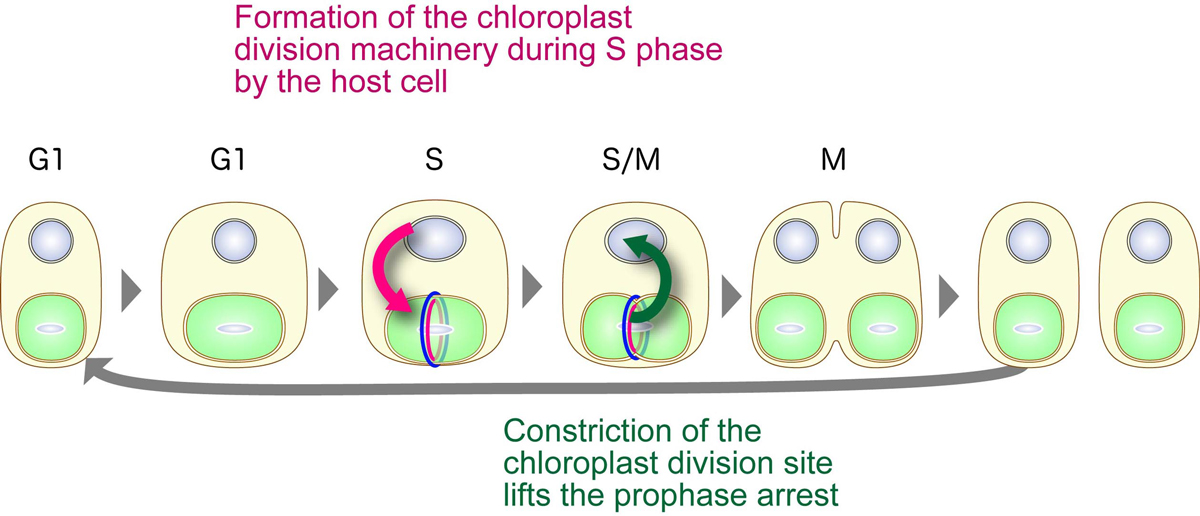
宿主真核細胞と葉緑体の相互作用による分裂同調化機構。葉緑体分裂はその中央に形成されるリング状装置の収縮によっておこる。この装置はそれぞれ核コードの、シアノバクテリア由来のFtsZ(赤)、宿主由来のダイナミン(青)等で構成される。宿主細胞は、葉緑体分裂リング構成タンパク質の発現、葉緑体分裂開始を自身のS期に限定する。一方で葉緑体分裂リング収縮は宿主細胞のM期前期停止を解除する。
アサガオの全ゲノム解読 ― アサガオの学術研究100年目のイノベーション
![]()
Genome sequence and analysis of the Japanese morning glory Ipomoea nil
Atsushi Hoshino, Vasanthan Jayakumar, Eiji Nitasaka, Atsushi Toyoda, Hideki Noguchi, Takehiko Itoh, Tadasu Shin-I, Yohei Minakuchi, Yuki Koda, Atsushi Nagano, Masaki Yasugi, Mie Honjo, Hiroshi Kudoh, Motoaki Seki, Asako Kamiya, Toshiyuki Shiraki, Piero Carninci, Erika Asamizu, Hiroyo Nishide, Sachiko Tanaka, Kyeung-Il Park, Yasumasa Morita, Kohei Yokoyama, Ikuo Uchiyama, Yoshikazu Tanaka, Satoshi Tabata, Kazuo Shinozaki, Yoshihide Hayashizaki, Yuji Kohara, Yutaka Suzuki, Sumio Sugano, Asao Fujiyama, Shigeru Iida, and Yasubumi Sakakibara
Nature Communications. 7, Article number: 13295 (2016) DOI:10.1038/ncomms13295
基礎生物学研究所の星野敦助教、慶應義塾大学理工学部の榊原康文教授、九州大学大学院理学研究院の仁田坂英二講師らは、日本独自の研究資源であるアサガオの全ゲノム配列をほぼ完全に解読することに成功しました。アサガオが約43,000個の遺伝子をもっていることや、その多彩な品種を生み出すもとになった動く遺伝子(トランスポゾン)のゲノム上の分布状況、「渦」と呼ばれる変異の原因遺伝子なども新たに判明しました。アサガオは日本伝統の園芸植物であり、花色や形態形成などの分子遺伝学的な解析材料としての重要性から、活発に研究されています。今回の成果によりゲノム情報基盤が整備されたことで、アサガオがモデル植物として世界中のより多くの研究者に活用されることが期待されます。本研究成果は2016年11月8日に国際学術誌 “Nature Communications”(ネイチャー・コミュニケーションズ)に掲載されます。本研究は文部科学省科学研究費新学術領域研究「ゲノム支援」(代表:小原雄治 国立遺伝学研究所)の一環として実施されました。
国立遺伝学研究所 生命情報研究センター比較ゲノム解析研究室 豊田敦特任教授、先端ゲノミクス推進センター 藤山秋佐夫特任教授、野口英樹特任准教授らのグループは第2世代、第3世代シーケンサーを駆使して全ゲノムデータを提供するとともに、断片化したDNA配列の再構築に関する技術サポート、BACライブラリの両端ならびに全長配列の決定、遺伝子多型解析などに用いられるRad-seqサンプルの配列決定などで本研究に貢献しました。

図1 さまざまな色とかたちのアサガオ

図2 左:全ゲノム解読を行ったアサガオの実験系統、東京古型標準型。 右:変化アサガオ「渦小人」
太田朋子名誉教授が文化勲章を受章
本研究所名誉教授である、太田朋子博士が2016年文化勲章を受章されました。 文化勲章受章者は、原則として前年度までの文化功労者の中から選ばれます。 太田博士は2002年に文化功労者として顕彰されました。 文化勲章親授式は11月3日に皇居で行われました。
<功績>
太田博士の主な業績は、集団遺伝学分野で「ほぼ中立説」という理論を確立したことです。1960年代には、より生存に有利なものが生き残るという自然選択(淘汰)説が広く受け入れられていましたが、当時遺伝研集団遺伝部長であった木村資生 遺伝研名誉教授は、生物集団内に広まる突然変異のほとんどは有利でも不利でもないとする「中立説」を提唱しました。太田博士は木村博士の共同研究者として中立説の確立に貢献しました。さらに太田博士は、中立説だけではつじつまの合わない現象を説明するために、生存に少しだけ不利な弱有害変異という考え方を導入した「ほぼ中立説」を確立しました。この理論は、現在の最先端研究にも大きな影響を与えています。

<参考資料>
クラフォード賞受賞の発表ページ(Royal Swedish Academy of Science)
数理モデルからクロマチンの構造を知る
![]()
Dynamic nucleosome movement provides structural information of topological chromatin domains in living human cells
Soya Shinkai, Tadasu Nozaki, Kazuhiro Maeshima, Yuichi Togashi
PLOS Computational Biology. 12(10), e1005136 DOI:10.1371/journal.pcbi.1005136, 2016
真核生物における長大なゲノムDNAは、ヌクレオソーム、さらにはクロマチンを形成することによって極小な細胞核に収納されています。国立遺伝研の野崎慎(元・特別共同利用研究員/慶応大)、前島一博教授らは、生きている細胞のヌクレオソームを1分子レベルで観測することで、クロマチンの動的な性質の理解に努めてきました(図左)。ヌクレオソームの動きはブラウン運動のように、主に熱ゆらぎによって支配されていますが、実際に観察された動きはブラウン運動から予想される動きよりもはるかに小さく、これまで理論的に説明するモデルがありませんでした。今回、広島大学の新海創也助教、富樫祐一准教授らは、このヌクレオソームの動きを説明するための数理モデルを考案し、その動態を表現する理論式を導出しました。この理論式には、クロマチンの構造を表すパラメータが含まれているため、ヌクレオソームの動きからクロマチンの構造を理解できることが、理論的に明らかになりました。(図右)。そして、これまで観察されていたヌクレオソームの動きの違いは、クロマチン構造による拘束の違いに起因することが分かりました。さらに、実際に理論式と実験データを比較することによって、生細胞のヌクレオソームの動きからクロマチンの構造情報を得ることにも成功しました。
本研究での数理モデルに基づく解析を展開することで、クロマチンの「構造」と「動態」の関係性、さらに両者が支配する遺伝子発現調節機構の解明につながることが期待されます。
本研究は広島大学大学院理学研究科・クロマチン動態数理研究拠点との共同研究です。新学術領域「少数性生物学」のサポートを受けました。
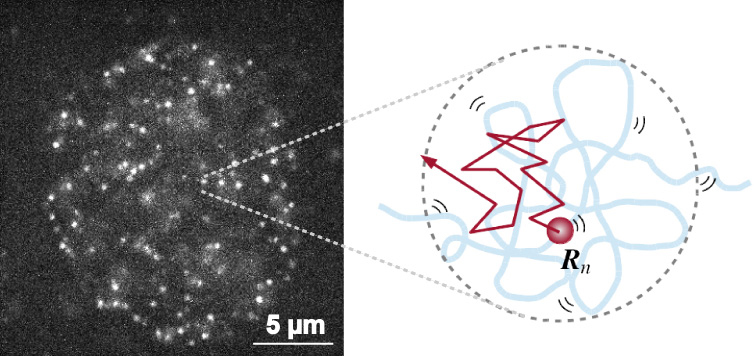
生きた細胞の核内のヌクレオソームを1分子レベルで観察した(左)。ヌクレオソームはクロマチン構造によって制限された中、ゆらいでいる(右)。ヌクレオソームの動きに対して、数理モデルを適用することで、クロマチン構造情報を得ることができる。
どの領域・細胞種の脳細胞でも高輝度標識し、任意の遺伝子を改変する新技術「Supernovaシリーズ」
![]()
Supernova: A Versatile Vector System for Single-Cell Labeling and Gene Function Studies in vivo
Wenshu Luo*, Hidenobu Mizuno*, Ryohei Iwata, Shingo Nakazawa, Kosuke Yasuda, Shigeyoshi Itohara, Takuji Iwasato(*equal contribution) Scientific Reports 24:35747. doi:10.1038/srep35747国立遺伝学研究所 形質遺伝研究部門(岩里研究室)の羅研究員(元総合研究大学院大学大学院生)と水野助教らは、脳の細胞中で遺伝子機能を解析するための、新規ベクターシステム「Supernovaシリーズ」を開発しました。このシステムは簡便かつ高性能で、幅広い用途に適用できます。
哺乳類の脳は、無数の神経細胞(ニューロン)が複雑なネットワーク(神経回路)を作ることで、様々な機能を生み出しています。脳の中に高密度で存在するニューロンから一部だけをランダムに選んで標識し、その細胞のみで目的の遺伝子をノックアウトすることができれば、脳の神経回路が形成され、機能するしくみを細胞レベル、分子レベルで理解することにつながります。しかしながら、これまでにまばらな細胞標識と遺伝子ノックアウトの両方を効率よくできるシステムはありませんでした。
本成果のSupernova法では2種類または3種類のベクターを組み合わせて細胞に導入するだけで、少数の細胞のみを蛍光タンパクで可視化できるとともに、可視化された細胞だけで目的の遺伝子をノックアウトすることが可能となります。遺伝子ノックアウトには、floxマウスとよばれる遺伝子組換マウスを用いる手法に加え、ゲノム編集の手法(TALENとCRISPR/Cas9)も利用できるようになり、Supernova法は広範なモデル生物に使うことができます。また、ベクター導入にウイルスを用いる手法も利用できるので、脳以外の組織にも用いることができます。本手法によって遺伝子改変による細胞の挙動などの変化を追跡することが可能です。
今回開発された手法は神経科学にとどまらない幅広い生命科学分野で、単一細胞における遺伝子機能解析に貢献することが期待されます。
本研究は、情報・システム研究機構 国立遺伝学研究所 形質遺伝研究部門(岩里研究室)にて、羅ブンジュウ研究員(元総合研究大学院大学大学院生)と水野秀信助教が中心となり、岩田亮平博士(同)、中沢信吾氏(総合研究大学院大学大学院生)の協力のもとおこなわれました。AAVを用いたシステムの構築では、理研脳センター 行動遺伝学技術開発チーム[安田光佑博士(元研究員)、糸原重美博士(シニアチームリーダー)]の協力を受けました。この研究は新学術領域研究(「スクラップ&ビルド」、「適応回路シフト」)など科研費の支援を受けて行われました。
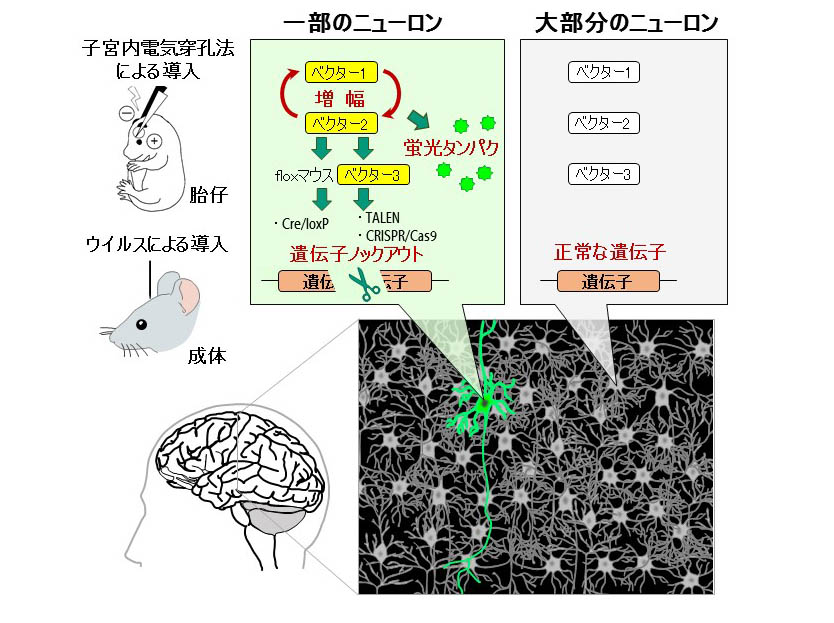
Supernova法のしくみ:2種類のSupernovaベクター(ベクター1、ベクター2)を組み合わせて脳に導入することで、ベクター1とベクター2を取り込んだ細胞のうちの一部でのみ正のフィードバックにより蛍光タンパクの発現の増幅が起こり、強い蛍光を発する。floxマウスと呼ばれる遺伝子組換マウスを用いるとCre/loxP法で目的の遺伝子をノックアウトできる。また、TALENやCRISPR/Cas9法を利用したベクター3を導入すれば、遺伝子組換動物を用いずに目的の遺伝子をノックアウトすることもできる。ベクターは、子宮内電気穿孔法あるいはアデノ随伴ウイルスを用いて導入する。
国立遺伝学研究所長の決定について
大学共同利用機関法人情報・システム研究機構では、平成28年11月30日をもって任期満了となる国立遺伝学研究所長について、同機構教育研究評議会での審議を経て、桂 勲 氏を次期国立遺伝学研究所長とすることを決定しましたので、お知らせします。
なお、研究所長は、平成28年12月1日付けで発令となります。
(任期:平成28年12月1日~平成30年11月30日(2年))
アフリカツメガエルの複雑なゲノムを解読:脊椎動物への進化の原動力「全ゲノム重複」の謎に迫る
![]()

Genome evolution in the allotetraploid frog Xenopus laevis
国際アフリカツメガエル・ゲノムプロジェクト・コンソーシアム
《 代表:平良 眞規(東京大学)、ダニエル・ロクサー & リチャード・ハーランド(カリフォルニア大) 》
Nature. 538, 336–343 (20 October 2016) DOI:10.1038/nature19840
さまざまな生物の全ゲノム解読は、全遺伝子の解明を通じて広く生命科学に寄与するとともに、生物進化の研究に多くの知見をもたらしてきました。多くの動物は父方と母方からの同一のゲノムをもつ「二倍体」ですが、アフリカツメガエルは、異種交配と全ゲノム重複により一つの生物の中に異なる2種類のゲノムをもった「異質四倍体」とされていました。そのため、非常に有用なモデル生物であるにもかかわらず、全ゲノム解読が非常に困難と諦められ、主要モデル生物の中で唯一行われていませんでした。しかし日本とアメリカを中心とする国際コンソーシアムは、アフリカツメガエルの全ゲノム解読に挑み、見事その全貌を明らかにしました。得られた情報は今後生物学から医学に至るさまざまな研究分野に大きく貢献すると期待できます。加えて、アフリカツメガエルのゲノムの中にある2種類のゲノム(サブゲノム)が別々の染色体のセットに分かれて存在するという重要な発見をしました。それにより、このカエルは約1800万年前に、2つの種が異種交配と全ゲノム重複を起こして誕生した異質四倍体であること、その後2つのサブゲノムが一つの生物の中で異なる進化を辿ったことが明確に示されました。今日の地球上には実に多様な種類の脊椎動物が生息し繁栄していますが、その最大の要因と考えられるのが約5億年前の古生代カンブリア紀に起きたとされる「2回の全ゲノム重複」です。その謎を解くための重要な鍵、いわゆるロゼッタストーンとしてアフリカツメガエルのサブゲノムの進化の仕組みが役立つことになります。これは生命科学における画期的な成果です。
国立遺伝学研究所 先端ゲノミクス推進センター・生命情報研究センター比較ゲノム解析研究室の藤山秋佐夫・豊田敦グループは本国際プロジェクトにおいて、当初から共同研究を推進し、BAC、fosmidライブラリの構築と両端および全長配列決定、ゲノムブラウザ構築および提供による国内における情報共有、FISH用BAC、fosmidクローンの調製、RNA-seq解析など多岐にわたる過程で本プロジェクトに貢献しました。また本プロジェクトは主に科研費新学術研究「ゲノム支援」(国立遺伝学研究所、東京大学、国立成育医療研究センター)、科研費・基盤(A、B、C)による支援のもとで進められました。

図1. アフリカツメガエルとネッタイツメガエル。(a)成体メスの比較。外見は良く似ているが、アフリカツメガエルの方がネッタイツメガエルより大きい。(b)頭部の拡大図。アフリカツメガエル(上)とネッタイツメガエル(下)では顔つきが異なる。このアフリカツメガエルは近交系のJ系統である。(c)胚の比較。アフリカツメガエル(上)とネッタイツメガエル(下)の胚。アフリカツメガエルとネッタイツメガエルの卵の直径はそれぞれ1.2 mmと0.7 mmであり、アフリカツメガエルの方が大きく、この時期の胚も大きい。
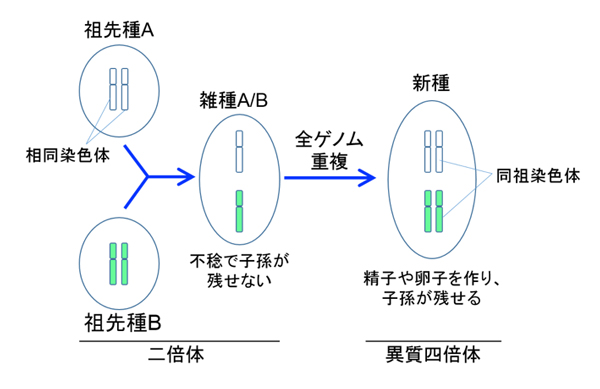
図2. 異質四倍体は雑種の全ゲノム重複によってつくられる。ここでは簡単にするため祖先種の染色体は1対のみを描いてある。実際の染色体数は、祖先種は9対もち、アフリカツメガエルは18対をもつ。
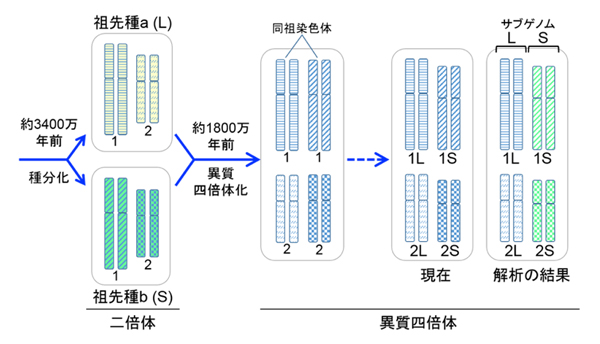
図3. 異質四倍体は祖先種に由来する2つのサブゲノムをもつ。ここでは簡単にするため祖先種aとbの染色体は1番と2番の2対のみを描いた(実際は祖先種は9対でアフリカツメガエルは18対である)。異質四倍体化の直後は、同祖染色体間に区別がないが現在までに一方が短くなったと考えられる。そこで長い方をL(long)、短い方をS(short)と命名した。今回、詳細なゲノム解析を行った結果、染色体LのセットとSのセットが、祖先種由来のゲノム(これをサブゲノムという)にそれぞれ対応することが示された。そこで、二つのサブゲノムをLとSと命名し、さらに祖先種もLとSと命名した。この発見により、倍数化後のサブゲノムの変化を解析することが可能となった。
◇本論文に関わった日本チームの機関と共著者一覧(18機関、23研究室)
東京大学(平良眞規、近藤真理子、道上達男、鈴木穣)、国立遺伝学研究所(藤山秋佐夫、豊田敦)、名古屋大学(松田洋一、宇野好宣)、広島大学(高橋秀治、彦坂暁、鈴木厚)、基礎生物学研究所(上野直人、山本隆正、高木知世)、産業技術総合研究所(浅島誠、原本悦和、伊藤弓弦)、北海道大学(福井彰雅)、長浜バイオ大学(荻野肇)、山形大学(越智陽城)、国立成育医療研究センター(黒木陽子)、東京工業大学(田中利明)、徳島大学(渡部稔)、立教大学(木下勉)、メリーランド大学(太田裕子)、北里大学(回渕修治、伊藤道彦)、バージニア大学(中山卓哉)、新潟大学(井筒ゆみ)、沖縄科学技術大学院大学(安岡有理)
◇主な研究費
科研費新学術研究「ゲノム支援」(国立遺伝学研究所、東京大学、国立成育医療研究センター)、科研費・基盤(A、B、C)
◇その他の主な機関と主な共著者
カリフォルニア大学バークリー校(米国)(アダム・セッション、ダニエル・ロクサー、リチャード・ハーランド)、ウルサン国立科学技術研究所(韓国)(テジュン・クワン)、ラドバウンド分子生命科学研究所(オランダ)(サイモン・ファン・ヘーリンゲン、ガート・ヴィーンストラ)、ソーク研究所(米国)(イアン・キグレイ)、沖縄科学技術大学院大学(日本)(ダニエル・ロクサー、オレグ・シマコフ)
中心体生物学研究部門の北川教授が日本生化学会奨励賞を受賞


第89回日本生化学会大会が、仙台国際センター/東北大学川内北キャンパス にて2016年9月25日(日)~27日(火)に開催されました。
中心体生物学研究部門の北川大樹教授が日本生化学会奨励賞を受賞しました。
受賞名:平成28年 日本生化学会奨励賞
受賞テーマ:中心小体複製の分子機構の研究
ヒト培養細胞の放射線耐性を向上させる新規タンパク質をクマムシのゲノムから発見
![]()
Extremotolerant tardigrade genome and improved radiotolerance of human cultured cells by tardigrade-unique protein
Takuma Hashimoto, Daiki D. Horikawa, Yuki Saito, Hirokazu Kuwahara, Hiroko Kozuka-Hata, Tadasu Shin-I, Yohei Minakuchi, Kazuko Ohishi, Ayuko Motoyama, Tomoyuki Aizu, Atsushi Enomoto, Koyuki Kondo, Sae Tanaka, Yuichiro Hara, Shigeyuki Koshikawa, Hiroshi Sagara, Toru Miura, Shin-ichi Yokobori, Kiyoshi Miyagawa, Yutaka Suzuki, Takeo Kubo, Masaaki Oyama, Yuji Kohara, Asao Fujiyama, Kazuharu Arakawa, Toshiaki Katayama, Atsushi Toyoda, Takekazu Kunieda
Nature Communications 7, Article number: 12808 (2016) DOI:10.1038/ncomms12808
プレスリリース資料(東京大学 大学院 理学系研究科・理学部)
クマムシは、さまざまな極限環境に耐性を示す1mm未満の小さな動物で、ヒトの半致死量の約1000倍(4000 Gy)の放射線照射にも耐えます。しかし、こうした極限的な耐性を支える分子メカニズムはほとんど分かっていませんでした。
東京大学大学院理学系研究科の橋本拓磨特任研究員と國枝武和助教らの研究グループは、慶應義塾大学先端生命科学研究所の堀川大樹特任講師ら、国立遺伝学研究所等と共同で、クマムシの中でも高い耐性を持つヨコヅナクマムシの高精度なゲノム配列を決定し、クマムシに固有な多数の遺伝子を発見しました。これらのうちDsup (Damage suppressor) と名付けた遺伝子をヒト培養細胞に導入すると、放射線などによるDNA傷害が抑制され、放射線耐性が向上することが明らかになりました。これは、極限環境耐性をもつ動物の遺伝子を用いることで、他の動物の細胞に放射線耐性を付与した初めての例であり、これまでまったく知られていなかった放射線耐性の新たな戦略を明らかにしました。本研究グループはDsup以外にも多数のクマムシ固有遺伝子を見出しており、これらはクマムシの持つたぐいまれな耐性能力の基盤解明に貢献するとともに、有用な遺伝子資源として将来的には他の動物にもさまざまな耐性能力を付与する新規技術の開拓につながることが期待されます。
本研究は、東京大学大学院理学研究科 橋本拓磨特任研究員 國枝武和助教、国立遺伝学研究所生命情報研究センター 豊田敦特任教授、ライフサイエンス統合データベースセンター 片山俊明特任助教、慶應義塾大学先端生命科学研究所 堀川大樹特任講師 荒川和晴特任准教授らの共同研究の成果です。科学研究費補助金(特定領域研究「ゲノム」4領域 比較ゲノム 16064101、20017010、新学術領域研究「ゲノム支援」221S0002、基盤研究(B) 25281016, 16H02951、新学術領域研究「宇宙に生きる」16H01632)の支援を受けて実施しました。
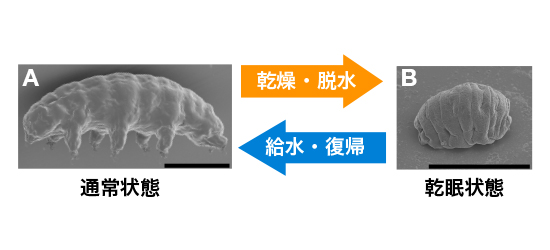
図1:本研究でゲノムを解読したヨコヅナクマムシ。
(A) 通常状態。ヒトの半致死量の約1000倍の放射線(4000Gy)の照射に耐える。
(B) 乾眠状態。外界の乾燥に伴い、ほぼ完全に脱水した乾眠状態に移行する。この状態では、放射線に加え、超低温、高温、真空、有機溶媒曝露などさまざまな極限環境に耐性を示す。給水により通常状態に復帰する。スケールバー、100μm
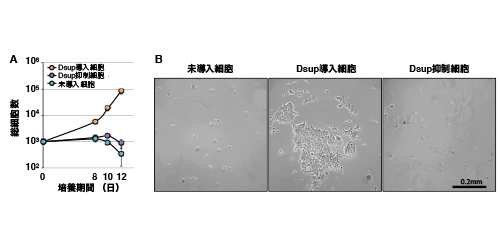
図2:(A)細胞に4GyのX線を照射し細胞数を計数した。Dsupを導入した細胞(オレンジ色)のみ顕著に増殖したのに対し、Dsupの発現を抑制した細胞(紫色)および未導入細胞(青色)では顕著な増殖はみられなくなった。
(B)培養開始後12日目のX線を照射した細胞の位相差顕微鏡像。
遺伝情報分析研究室の学生 飯塚朋代さんが第18回日本進化学会 優秀学生ポスター発表賞を受賞

日本進化学会 第18回年会が、東京工業大学 大岡山キャンパスにて2016年8月25~28日に開催されました。
遺伝情報分析研究室の学生 飯塚朋代さんが日本進化学会 優秀学生ポスター発表賞を受賞しました。
受賞名:第18回 日本進化学会 優秀学生ポスター発表賞
受賞テーマ:担子菌類における隔壁孔キャップの
平行進化の原因遺伝子予測
日本進化学会 学会賞受賞者(2016年)掲載ページ ページの中ほどを御覧ください
遺伝研 公開講演会2016 – 講演の動画を配信中
マウス生殖細胞の雌化因子を同定(卵巣内で精子分化開始)
![]()
Sexual Fate Change of XX Germ Cells Caused by the Deletion of SMAD4 and STRA8 Independent of Somatic Sex Reprogramming
Quan Wu, Kurumi Fukuda, Yuzuru Kato, Zhi Zhou, Chu-Xia Deng, Yumiko Saga
PLOS Biology September 8, 2016 DOI:10.1371/journal.pbio.1002553
ヒトを含め哺乳動物の性は性染色体の構成によって決まります。XX染色体を2本もつ個体は雌になり、卵巣の中には卵子ができます。一方、XY染色体をもつ個体は雄になり、精巣の中で精子が形成されます。精子や卵子の元となる始原生殖細胞は卵巣や精巣とは別の場所でつくられ、胎児期の間に移動して、精巣あるいは卵巣に入るかで、将来精子を作るか卵子を作るかの運命が決まります。すなわち、生殖細胞の性は周りの環境によって決まるのです.しかし、そのメカニズムはよくわかっていませんでした。我々は以前、生殖細胞の雄化にはNANOS2というRNA結合タンパク質が必須であることを示していますが、雌化の仕組みは不明でした。
今回の研究では2つの因子SMAD4とSTR8を卵巣の生殖細胞のみでノックアウトすると周りの環境はメスであるにも関わらず、生殖細胞は雄化してNANOS2などの雄性遺伝子を発現し、精子前駆細胞とよく似た性質を示すことがわかったのです。従って、これらの2つの因子は生殖細胞を雌化する因子であり、これらの因子がないと生殖細胞は雄化することがわかりました。
最近、培養系でES細胞や、iPS細胞から始原生殖細胞を誘導できることが報告されていますが、その後の性分化には体細胞環境が必須です。今回の研究成果は、体細胞なしに、生殖細胞の性分化を操作できる可能性を示唆しています。またこれまで、精子の形成にはY染色体の下流因子が必須であると考えられてきましたが、今回の結果は生殖細胞の雄化には、そのような雄特異的な体細胞因子は必要ではないことを示唆しています。この研究は、「新学術領域研究:生殖細胞のエピゲノムダイナミクスとその制御及」び「基盤研究A」の支援を受けています。また筆頭著者の呉泉は総研大遺伝学専攻出身者で現在は神戸CDBで研究を続けています。
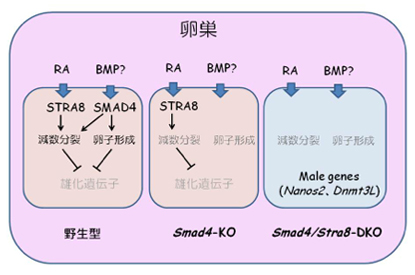
野生型の胎児卵巣の体細胞から分泌されるRAとBMPシグナル(仮説)がそれぞれ生殖細胞のなかでSTRA8とSMAD4を介して、雌化を誘導する。SMAD4単独のノックアウトでは性転換は起こらない。しかしこの2つの遺伝子がKOされると、減数分裂、卵子形成は完全にブロックされて、雄化がおこる。
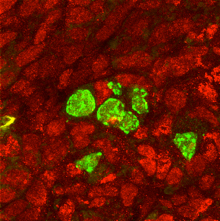
Smad4/Stra8ダブルノックアウト生殖細胞が卵巣の中で雄性因子PLZF(緑)を発現。赤は、卵巣体細胞特異的FOXL2の発現。
がんは腫瘍ホットスポットに生じる〜運命を左右する組織構造〜
![]()
Epithelial tumors originate in tumor hotspots, a tissue-intrinsic microenvironment.
Yoichiro Tamori, Emiko Suzuki, Wu-Min Deng
PLOS Biology Published: September 1, 2016 DOI:10.1371/journal.pbio.1002537
国立遺伝学研究所の田守洋一郎助教とフロリダ州立大学のウーミン デン教授の研究グループは、がん細胞が上皮組織内の特定の場所(腫瘍ホットスポット)で腫瘍形成を始める仕組みを明らかにしました。
過去数十年間にわたるがん研究の積み重ねから、がん遺伝子や、がん抑制遺伝子の変異ががんの原因になること、そして、変異細胞(前がん細胞)が正常な上皮組織に出現して異常に増殖すると腫瘍が生じることなどが明らかにされてきました。しかし、この異常な増殖が始まるがん最初期段階の仕組みはよくわかっていませんでした。
本研究では、モデル生物であるショウジョウバエの上皮組織において、前がん細胞が腫瘍形成を起こす場所(腫瘍ホットスポット)と起こさない場所(腫瘍コールドスポット)があることを発見しました。組織の大部分を占めるコールドスポットでは、前がん細胞は上皮組織から排除されて死んでいくのに対し、ホットスポットに出現した前がん細胞は上皮組織からはみ出て異常な増殖を開始します。また、ホットスポットでは組織構造がもともと少し異なっており、この違いが前がん細胞の運命を左右していることがわかりました。組織構造の少しの違いが前がん細胞の運命を左右するという考えは今までになかったものです。この新しい発見によって、がん発症の仕組みの理解がさらに進むものと期待されます。
本研究は国立遺伝学研究所 構造遺伝学研究センター 遺伝子回路研究室の田守洋一郎助教が中心となり、フロリダ州立大学のウーミン デン教授との共同研究として行われました。本研究の遂行にあたり、国内では、文部科学省科研費 研究活動スタート支援(26891025)、萌芽研究(15K14386)、新学術領域研究「細胞競合」(15H01500)、上原記念生命科学財団による支援を受けました。
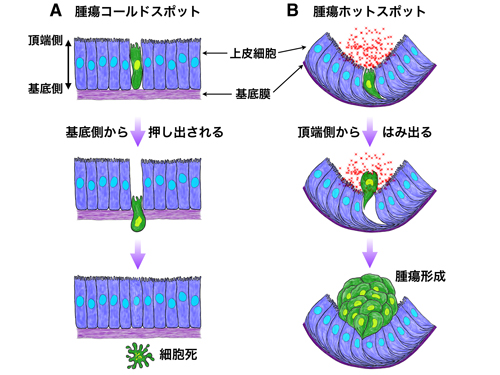
腫瘍ホットスポットで腫瘍が形成される仕組み。
(A)上皮組織の腫瘍コールドスポットに現れた前がん細胞(緑色)は、基底側から押し出されて細胞死を起こして組織から排除される。
(B)腫瘍ホットスポットに現れた前がん細胞は、頂端側からはみ出る。ホットスポットの頂端側には発がんに関与するシグナル(JAK/STAT経路)の活性化因子(Upd:赤)がもともと多く分泌されており、前がん細胞はUpdを取り込むことによって異常な増殖を始める。紫:基底膜。
縄文人の核ゲノム配列をはじめて決定〜東ユーラシア人の中で最初に分岐したのは縄文人だった〜
![]()
A partial nuclear genome of the Jomons who lived 3,000 years ago in Fukushima, Japan
Hideaki Kanzawa-Kiriyama, Kirill Kryukov, Timothy A. Jinam, Kazuyoshi Hosomichi, Aiko Saso, Gen Suwa, Shintaroh Ueda, Minoru Yoneda, Atsushi Tajima, Ken-ichi Shinoda, Ituro Inoue, Naruya Saitou
Journal of Human Genetics 1 September 2016; DOI:10.1038/jhg.2016.110
国立遺伝学研究所集団遺伝研究部門および総合研究大学院大学遺伝学専攻の斎藤成也教授らのグループは、福島県北部にある三貫地貝塚から出土した縄文時代人(縄文人)の歯髄からDNAを抽出して、核ゲノムの一部を解読することに成功しました。
これまで縄文人のDNAについては、ミトコンドリアDNAの情報しか得られていませんでした。今回、ミトコンドリアDNAの数千倍にあたる核ゲノムのDNA配列1億1,500万塩基対を決定しました。このゲノム情報を、現代日本列島人と比較解析したところ、縄文人はアイヌ人にもっとも近く、ついでオキナワ人、そしてヤマト人(アイヌ人とオキナワ人を除く日本列島人)に近縁であることが明らかになりました。さらに、縄文人は、現代人の祖先がアフリカから東ユーラシア(東アジアと東南アジア)に移り住んだ頃、もっとも早く分岐した古い系統であること、そして、現代の本土日本人に伝えられた縄文人ゲノムの割合は15%程度であることが明らかになりました。
今回、縄文人の核ゲノムの一部が解読されたことによって、縄文人が現代の東アジア人と比べて遺伝的に特異な集団であったことが明らかとなりました。今後、縄文人ゲノムデータを充実させ、それらを比較解析することによって、縄文人のたどった進化史が明らかになり、日本列島人の起源と成立を知ることにつながると期待されます。
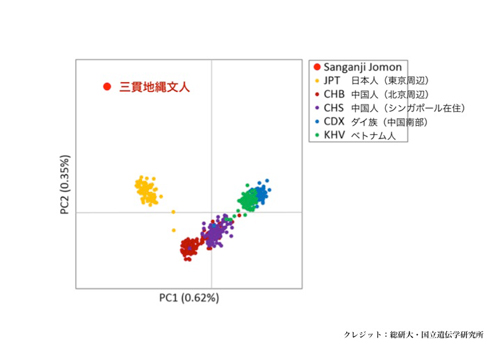
図1:三貫地縄文人(赤点)と他の人類集団ゲノムデータとの遺伝的近縁関係を主成分分析(PCA)
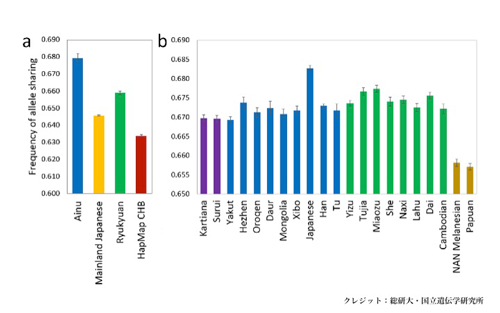
図2:三貫地縄文人と他の人類集団SNPデータとの対立遺伝子共有度
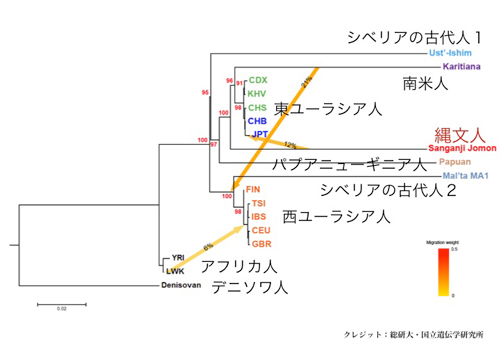
図3:三貫地縄文人と他の人類集団との系統樹
赤色数字は系統樹の枝の信頼性をしめすブーツストラップ確率を、矢印は混血をあらわす
イネ減数分裂染色体のヒストンH3修飾リプログラムに関与するアルゴノート蛋白質
Histone H3 modifications are widely reprogrammed during male meiosis I in rice dependently on MEL1 Argonaute protein
Hua Liu, Ken-Ichi Nonomura
Journal of Cell Science, Published online, 12 August, 2016 DOI:10.1242/jcs.184937
減数分裂は、複製を介さない2回の連続した分裂により、染色体数を半減させる特殊な分裂であり、遺伝情報の次世代への「安定的伝達」に加え、両親から受け継いだ1対の相同染色体の対合・組み換えを通じた「遺伝的多様性の創出」に不可欠の仕組みです。
今回は、染色体の構造や遺伝子発現の制御に重要なヒストン修飾(用語解説)と減数分裂の関係に着目しました。ヒストンH3の9番目のリジン残基のジメチル化(H3K9me2)は植物では一般的に遺伝子発現を抑制し、クロマチン構造を密にするよう働くと考えられています。同じ位置のアセチル化(H3K9ac)は逆に遺伝子発現を活性化します。そこでH3K9me2およびH3K9acに対する抗体を用いて、H3修飾を減数分裂の異なる時期で比較しました。すると減数分裂移行期の前後で、H3K9me2は広範囲で増加し、H3K9acは逆に激減していました。この現象は、減数分裂を支える仕組みの一つと考えられます。
減数分裂におけるヒストンH3修飾のリプログラミング(LMR)は、以前に私たちが同定した生殖細胞特異的Argonaute蛋白質(用語解説)MEL1の突然変異体で欠損していました(図1B)。今回の結果はイネMEL1が、LMRの制御を介して減数分裂の進行を促進している可能性、そして植物の減数分裂におけるRNAサイレンシング機構の重要性を示すものです。
本成果は、学術振興会科学研究費基盤研究 (A) (25252004) および遺伝研博士研究員制度の支援を受けて実施しました。
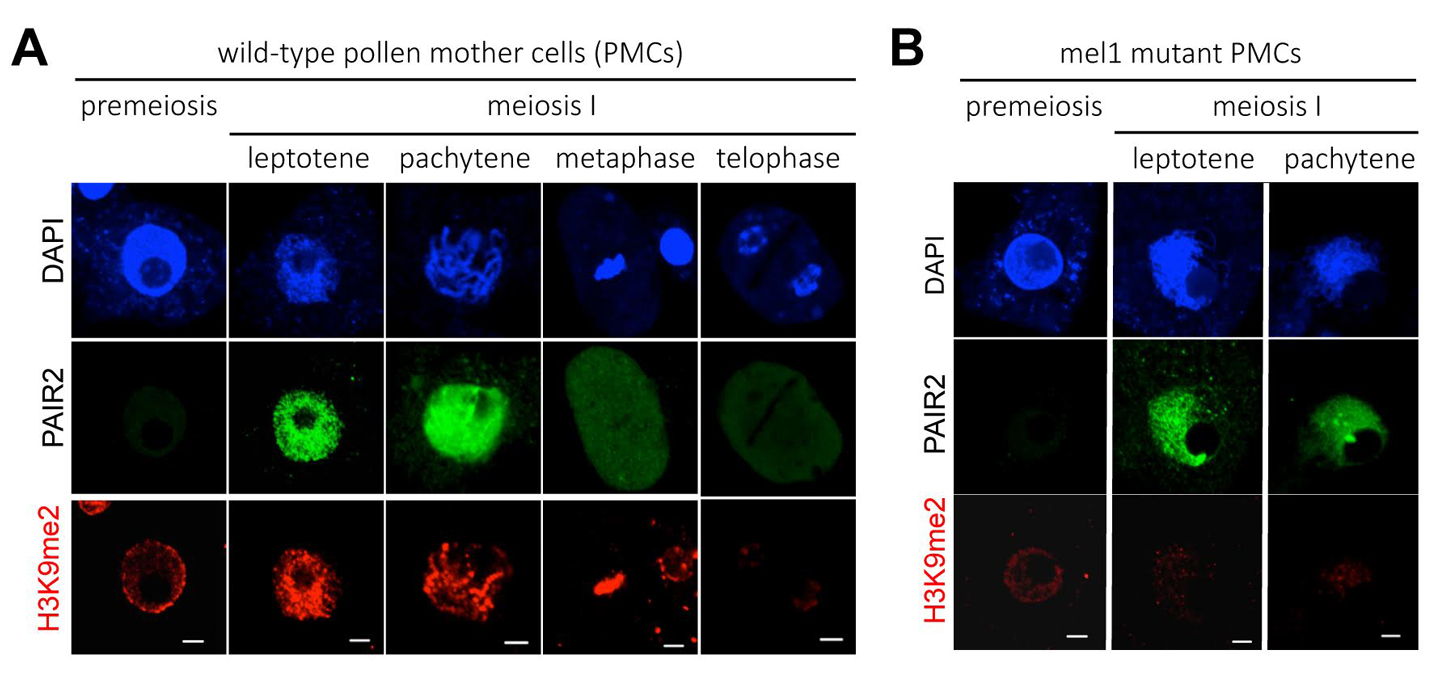
減数分裂におけるヒストンH3K9me2は MEL1依存的にリプログラムされる
(A) 正常なイネの花粉母細胞(減数分裂細胞)では、減数第一分裂に移行する過程で、H3K9me2を示すシグナル(赤)が染色体全域で顕著に増加する。染色体DNAはDAPI(青)で染色。PAIR2(緑)は減数分裂の相同染色体対合に必須のタンパク質であり、この細胞が確かに減数分裂期にあることを示している。スケールバーは5 µm。
(B) mel1突然変異体の花粉母細胞。PAIR2シグナル(緑)から細胞が減数分裂に入っていることがわかるが、H3K9me2の蓄積がほとんど起こっていない。
<用語解説>
- ヒストン修飾:
- 真核生物の染色体を構成するクロマチンは、ヒストンH2A、H2B、H3、H4の8量体にDNAが巻きついたヌクレオソームの繰り返し構造からなる。ヒストンのN末端はヒストンテールと呼ばれ、ヌクレオソームコアから飛び出している。ヒストンテールのアミノ酸が様々な修飾(アセチル化、メチル化、リン酸化など)を受けることで、DNAとヒストンの状態に変化が生じ、遺伝子発現やクロマチン構造などに様々な影響を及ぼすことが知られる。
- Argonaute蛋白質:
- 20-30塩基長程度の小分子RNAをガイド分子として、相補的な配列を持つ標的RNAに結合し、mRNAの分解や翻訳抑制、遺伝子の転写抑制、トランスポゾンの抑制、そしてウィルス防御など、RNAサイレンシングと呼ばれる機構の中で中心的な役割を果たす蛋白質。















