Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
NIGINTERN2014参加者BryanさんがA-IMBN学会で受賞しました
[ROIS]ゲノム編集のためのガイドRNA設計ソフトウェア CRISPRdirect を公開
![]()
CRISPRdirect: soft ware for designing CRISPR/Cas guide RNA with reduced off -target sites.
Yuki Naito, Kimihiro Hino, Hidemasa Bono and Kumiko Ui-Tei. Bioinformatics doi: 10.1093/bioinformatics/btu743ゲノム編集は,生命の設計図であるゲノムDNA の任意の部位を切断することにより,その位置の配列を削除したり,あるいは逆に,任意の配列を挿入したりする手法であり,遺伝子の機能を解析するのに有効な手法としてさまざまな場面で利用され,医療分野への応用も期待されています.近年,新しいゲノム編集の手法として急速に普及しているCRISPR/Cas9 システムは,ゲノム編集を行う部位を見つける役割を担うガイドRNAと,その部位を切断するはさみの役割をもつCas9 ヌクレアーゼとを組み合わせることによりゲノム編集を行います.この方法は,ガイドRNA の塩基配列を変えることによりゲノム編集を行う部位を自在に決めることができるという特徴があります.
ところが,ガイドRNA の塩基配列によっては,ゲノム編集を行いたい部位以外の位置で意図せずゲノム編集が起こってしまうことが知られています.この現象はオフターゲット効果とよばれ,ゲノム編集を行ううえで大きな課題となっています.オフターゲット効果を防ぎ,目的とする部位だけでゲノム編集を行うためには,ガイドRNA の設計が重要な鍵となります.
このたび,情報・システム研究機構 ライフサイエンス統合データベースセンター(DBCLS)の内藤雄樹特任助教,坊農秀雅特任准教授,東京大学大学院理学系研究科の日野公洋助教,程久美子准教授の研究グループは,CRISPR/Cas9 システムのために最適なガイドRNA を効率よく設計することのできるソフトウェア「CRISPRdirect」(http://crispr.dbcls.jp/)を開発しました. このソフトウェアにより,オフターゲット効果の少ない優れたガイドRNA をきわめて容易に設計することが可能となり,ゲノム編集のための強力なツールとして生命科学および医学研究に幅広く貢献することが期待されます.
※DBCLSの内藤雄樹特任助教は、現在遺伝研DDBJ棟の西棟4階にオフィスを構えています。
実験圃場 野々村准教授が科研費審査委員として表彰されました

日本学術振興会では、科研費の適正・公平な配分審査のため、審査終了後、審査の検証を行います。 この検証結果に基づき、第1段審査(書面審査)委員を選考し表彰することとしており、平成26年度は約5,300名の第1段審査(書面審査)委員の中から170名が選考され、本研究所の野々村准教授が対象となりました。
贈呈式は11月18日(火)に行われ、桂勲研究所長より表彰状と記念品が授与されました。
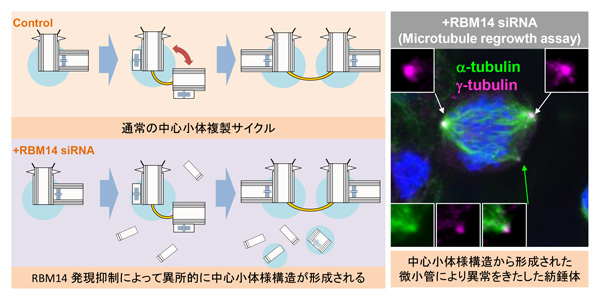
不完全な中心体がかき乱す細胞分裂 〜新しい染色体不安定化機構の提示〜
RBM14 prevents assembly of centriolar protein complexes and maintains mitotic spindle integrity
Shiratsuchi, G., Takaoka, K., Ashikawa, T., Hamada, H., and Kitagawa, D The EMBO Journal (2014) embj.201488979, Published online 10.11.2014; DOI:10.15252/embj.201488979細胞が自らの遺伝情報を子孫に正確に伝えるには、細胞分裂の際に遺伝情報を収めた染色体を均等に分配する必要があります。多くの動物細胞では、微小管という繊維で作られた紡錘体と呼ばれる構造が二つの極にそれぞれ染色体を引っ張っていくのですが、それを可能にするためには、微小管を形成する極として働く細胞小器官、中心体が一回の細胞周期に一回だけ複製されなければなりません。
実は細胞の中には中心体を複数個作るのに十分な材料が存在しているのですが、普通の細胞ではここから余計な中心体が作られることはありません。しかし、ひとたび既存の中心体が外的要因などで失われると、未知の制御機構によって細胞内のあちらこちらで大量に中心体蛋白質の塊が生じ、やがて完全な中心体に置き換わることが知られていました。
今回、私たちはヒトやマウスの細胞において、中心体蛋白質STILと結合するRBM14という蛋白質を減らすことで、既存の中心体が健在であっても、それに似た現象が起こることを発見しました。このとき大量に生み出される中心体蛋白質の塊は構造的に不完全なものですが、微小管を作り出す力は部分的に保持しています。こうした細胞が分裂を始めると異常な紡錘体が形成されて、細胞の癌化などに繋がる危険をはらんだ染色体分配の乱れを生じてしまいます。
一般に癌細胞では中心体の過剰な増加が見られることが知られていますが、一方で完全な活性を持った中心体の増加はむしろ紡錘体の形成に致命的で、多くの場合細胞の死を招くとも考えられています。これまで多くの癌細胞で特に疑いもなく過剰な中心体だとされていたものの中には、もしかするとこのような不完全な中心体が含まれているかもしれません。実際RBM14は以前に癌抑制遺伝子としての可能性が指摘されています。通常の中心体複製機構と異なったこのような制御機構が細胞癌化等に関連があるかどうか、今後の解析が待たれるところです。
本研究は大阪大学生命機能研究科、発生遺伝学研究室の浜田博司教授、高岡勝吉助教との共同研究として行われました。
オーキシンデグロン(AID)法を応用した細胞自死システムの開発
A cell suicide module: Auxin-induced rapid degradation of Inhibitor of Caspase Activated DNase (ICAD) induces apoptotic DNA fragmentation, caspase activation and cell death
Kumiko Samejima, Hiromi Ogawa, Alexander V. Ageichik, Kevin L. Peterson, Scott H. Kaufmann, Masato T. Kanemaki and William C. Earnshaw The Journal of Biological Chemistry, 298, 31617-31623, 2014.; DOI:10.1074/jbc.M114.583542典型的アポトーシスではカスパーゼと総称される蛋白分解酵素がシグナル伝達およびその実行に中心的役割を果たします。そしてそのカスパーゼの基質のひとつであるインヒビター結合因子ICADの切断がCaspase-activated DNase (CAD)を活性化し、アポトーシスの特徴の一つであるゲノムDNAの断片化とゲノムの凝縮を誘導します。しかしながら、正常の細胞内で、アポトーシスの経路の中で下流に位置するICADの分解のみでCADを活性化できるのか、またアポトーシスが誘導できるかどうかは不明でした。この疑問に答えるため、オーキシン誘導デグロン(AID)法を利用して、DT40細胞内でICADの量を自在にコントロールできる細胞株を作製しました。オーキシン添加により細胞内のICADを急速に分解すると、実際にCAD及びカスパーゼが活性化され、アポトーシスが誘導されました。つまり、ICAD分解又はCADの活性化がフィードバックループによりアポトーシスを誘導するのに十分であることを示しました。また、細胞死は出芽酵母においても誘導することが可能でした。作製したICAD分解による人為的細胞死の誘導システムは、様々な真核細胞において機能することが期待され、将来の遺伝子改変生物の拡散を防ぐ手段として利用できる可能性があると考えられます。
本研究は英国エジンバラ大学の鮫島久美子博士、William Earnshaw教授/遺伝研客員教授との共同研究として行われました。
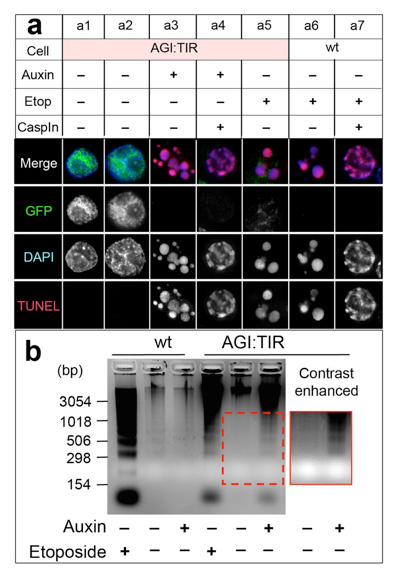
オーキシン添加によるICAD分解により、細胞死を誘導した(a3)。その際にはゲノムDNAの断片化が起こっていることが確認された(b)。
細胞分裂を正しく導く中心体 ─複製が1コピーに限られる仕組みを解明─
![]()
Direct interaction of Plk4 with STIL ensures formation of a single procentriole per parental centriole
Midori Ohta, Tomoko Ashikawa, Yuka Nozaki, Hiroko Kozuka-Hata, Hidemasa Goto, Masaki Inagaki, Masaaki Oyama and Daiju Kitagawa Nature Communications 5, Article number: 5267 DOI:10.1038/ncomms6267細胞分裂時には染色体が分かれ、新たに生じた2つの細胞それぞれに分配されます。均等になるように染色体が移動していくのですが、それにはどのような仕組みが働いているのでしょうか?実は糸のような微小管が伸びてきて、染色体を引っ張り移動させているのです。その微小管が伸びる起点となるのが、中心体と呼ばれる細胞内小器官です。
中心体は100年以上前に発見されていましたが、その構築メカニズムはこれまであまり分かっておらず、近年爆発的に分子的な解明が進んできた小さな細胞内器官です。通常、1つの細胞に中心体は1つしかありません。しかし、細胞分裂時には複製されて2つになり、対極に分かれて染色体を引っ張ることで、細胞分裂は正しく行われます。もし余分に複製されることがあると染色体を適切に分配することができませんから、細胞分裂に支障が出て、がんなどの病気が引き起こされかねません。
今回の研究では、中心体複製の開始段階における分子の働きを、世界に先駆けて明らかにすることができました。そしてその解析を基に、余分な中心体の複製を防ぐ制御機構を、理論的にモデル化しました。
中心体は柱状の部品(中心小体)2個から構成されています。細胞分裂時には、この2個が母中心小体となり、それぞれに娘中心小体を1個作ります。この際の顕微鏡写真を解析したところ、娘中心小体の形成前にはまず、母中心小体の周囲に中心小体形成促進因子が多数集まること、そのうちの1箇所だけに娘中心小体が形成され、他の分子は壊されてしまうことが明らかになりました(図)。娘中心小体の形成が1箇所に限定されることが、中心体の複製を1コピーに限定する、というモデルが得られたのです。
今後は、中心体複製に関与する分子の量的関係性などからこのモデルを実証する計画です。中心体複製の数の異常は、がんや遺伝病、男性不妊に関係し、これらの成果は治療や医薬品開発に役立つと期待されます。2014
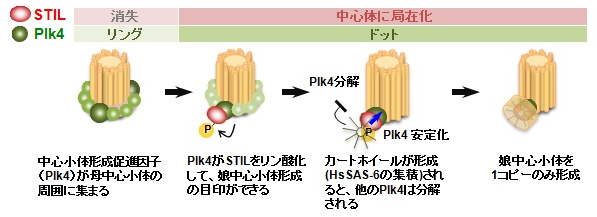
娘中心小体の形成が1個に限定されるモデル
集団遺伝研究部門 斎藤教授がフランス、トゥールーズ大学の名誉博士号を授与されました
トゥールーズ第三大学はヨーロッパの最も古い大学の一つで1229年に設立された伝統ある大学です。1912年にヴィクトル・グリニャールと共にノーベル化学賞を受賞したポール・サバティエの名を冠してPaul Sabatier University ともいいます。
今回は ベルギー、アメリカ、スペインの方が同時に授与されています。

斎藤教授

授与されたDocteur Honoris Causa
初期発生研究部門 博士研究員 LALさんが受賞

写真右:受賞のLAL博士研究員

受賞したBestPosetrAward
日本メダカ雌雄差の地理的変異の遺伝基盤
Ontogenetic stage-specific quantitative trait loci contribute to divergence in developmental trajectories of sexually dimorphic fins between medaka populations
Kawajiri, M., Yoshida, K., Fujimoto, S., Mokodongan, D., Ravinet, M., Kirkpatrick, M., Yamahira, K., and *Kitano, J. Molecular Ecology in press DOI:10.1111/mec.12933雄雌で繁殖に有利な表現型が異なる場合、性差が進化することがあります。雌雄差は集団間によってその程度は大きく異なっていますが、その遺伝基盤はよく分かっていません。このたび、国立遺伝学研究室の北野潤研究室と琉球大学の山平寿智研究室の共同研究により、日本の野生メダカを用いてその遺伝基盤に迫る研究がMolecular Ecology誌にオンライン掲載されました(http://onlinelibrary.wiley.com/doi/10.1111/mec.12933/abstract)。
メダカは、オスの尻ビレがメスよりも発達していることはよく知られており、交配時にオスがメスをつかむために進化したと考えられています。山平研究室では沖縄のメダカの方が、青森のメダカよりも尻ビレの性差が顕著であることを見いだしていました。そこで北野研究室では、性差の度合いの違いを生み出す原因遺伝子座をマッピングし、染色体14番に強い効果のある遺伝子座を同定しました。この際に、テキサス大学のカークパトリック博士と共同で直交ルジャンドル多項式を用いた成長曲線の遺伝解析方法を確立しました。今後は、この遺伝子の実体に迫ることで、野外の生物集団における雌雄差の変異の進化遺伝機構に迫ります。
この研究の一部は、国立遺伝学研究所と琉球大学熱帯生物圏研究センターの共同利用研究の支援のもと行われました。

オス(上)の方が、メス(下)よりも長い尻ビレを持つ
オーキシンデグロン法を利用した簡便な出芽酵母コンディショナル変異体作製法
Rapid Depletion of Budding Yeast Proteins via the Fusion of an Auxin-Inducible Degron (AID)
Kohei Nishimura and Masato T. Kanemaki Current Protocols in Cell Biology, 64, 20.9.1-20.9.16, 2014; DOI:10.1002/0471143030.cb2009s64様々な遺伝学的解析法が確立している出芽酵母は真核生物のモデル生物として長い間重要な役割を果たしてきました。出芽酵母研究においては、コンディショナル変異株として、一般的に温度感受性変異株が作製されてきました。しかしながら、温度変化により標的タンパク質を不活化する特性上、細胞に熱ショック応答が起きること、時としてタンパク質を不活化に時間がかかるなどの問題点がありました。 そこで私たちの研究室では、植物がもつオーキシン分解系を出芽酵母に移植することで、オーキシン添加により標的タンパク質を短時間に分解除去できるオーキシンデグロン法を確立しました(Nishimura et al. Nature Methods, 2009)。その後、改良を加えより効率よく分解誘導するデグロンも報告しました(Kubota et al. Molecular Cell, 2013)。現在、オーキシンデグロン法は出芽酵母コンディショナル変異株作製のための重要な研究ツールになりつつあります。そこで、私たちはオーキシンデグロン変異株を1回のトランスフォーメーションで作製する詳細なプロトコールを出版しました。実験に必要なプラスミドや酵母株は、全てナショナルバイオリソース(http://yeast.lab.nig.ac.jp/nig/)より入手可能です。本プロトコールが出芽酵母研究コミュニティーの発展に役立つことを願っています。
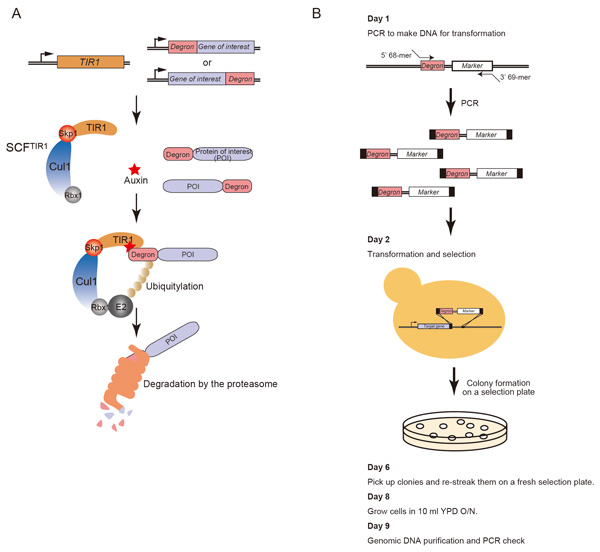
(A) オーキシンデグロン法において、どのようにデグロン融合タンパク質がオーキシン存在下で分解されるかを示した図。 (B) オーキシンデグロン変異株作製のプロトコールを図示した。
セントロメアを構成するクロマチン構造
分子遺伝研究部門・深川研究室
The centromere: chromatin foundation for the kinetochore machinery
Tatsuo Fukagawa, and William C. Earnshaw Dev. Cell 30,496-508,2014; DOI:10.1016/j.devcel.2014.08.016細胞分裂の過程では、紡錘体微小管と染色体上のキネトコア (動原体) 構造が結合することで、正確な染色体分配が遂行される。キネトコアが形成される染色体領域であるセントロメアは、DNAの塩基配列ではなくエピジェネティックな要因で規定される。そして、セントロメアに特異的なヒストンであるCENP-Aが、セントロメアの規定に関わるエピジェネティックな目印として考えられている。分子遺伝研究部門の深川と前遺伝研客員教授の Bill Earnshaw (Edinburgh大学)は、この総説論文においてセントロメアクロマチン研究においての歴史的な論文から最新のセントロメア研究のトピックまでを幅広く解説している。何故セントロメアに反復配列が多いのか、クロマチン因子や修飾はセントロメア形成にどのように関わっているのか、CENP-Aクロマチンの形成機構はどうなっているのか等の疑問をはじめセントロメアのクロマチン構造の理解のためにどのように人工セントロメアや人工染色体が活用されているのかについても詳述している。
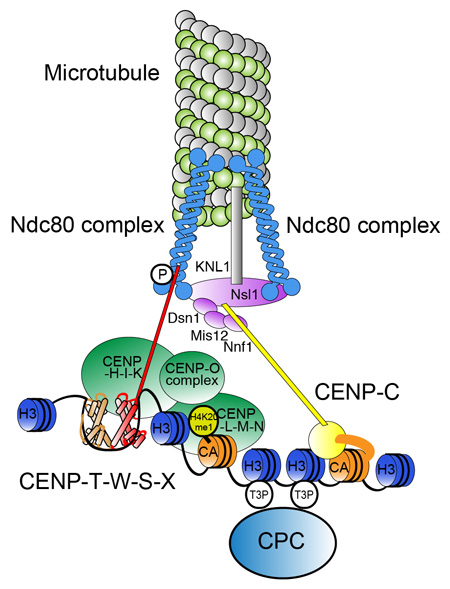
セントロメアの分子構造。CENP-Aから成るヌクレオソームとH3から成るヌクレオソームに加えてCENP-T-W-S-Xがヌクレオソソーム様の構造を形成し、それらが協調してセントロメアに特異的なクロマチン構造が構築される。そのクロマチンを各種タンパク質が認識、集合して機能的な動原体が形成される。
真核細胞の染色体DNA複製開始に不可欠なSld3/Treslin領域の立体構造を解明
超分子構造研究室・白木原研究室 微生物遺伝研究部門・荒木研究室
Crystal structure of the homology domain of the eukaryotic DNA replication proteins Sld3/Treslin
Hiroshi Itou, Sachiko Muramatsu, Yasuo Shirakihara, and Hiroyuki Araki Structure Published: August 7, 2014 DOI:10.1016/j.str.2014.07.001染色体のDNAは、細胞周期の適切な時期に一度だけ過不足なく正確に倍加(複製)します。それは、DNAを複製する際に必要なDNAヘリカーゼの形成が調節されているためです。DNAヘリカーゼは2本鎖DNAを1本鎖にほどく酵素で、ほどかれた1本鎖DNAを鋳型として、初めてDNA合成酵素がDNA鎖の合成を行うことができます。真核生物のDNAヘリカーゼは、Mcm2-7複合体にCdc45とGINSと呼ばれる2つの因子が結合する事で形成されます。酵母のSld3は、Cdc45やGINSと結合し、ヘリカーゼ複合体形成の仲立ちをするタンパク質で、ヒトなどの高等真核生物では同じ働きを持つTreslinタンパク質が知られています。 今回の研究では、出芽酵母のSld3を用いて、Sld3とTreslinに共通して保存された領域がCdc45との結合領域である事を示し、更にその立体構造を明らにしました。この領域は結合相手であるCdc45との結合に適した形をしていて、自由に動く塩基性の領域が結合に重要である事が分かりました。 ヘリカーゼの形成には、Cdc45とSld3/Treslinタンパク質の結合が重要である事がこれまで知られていましたが、そのメカニズムは不明でした。本研究からSld3がCdc45と結合する領域の立体構造が明らかになり、Sld3とCdc45の結合を原子のレベルで考えられる様になりました。今後、この構造に基づく研究により、真核生物の染色体DNA複製開始の詳細なメカニズムの理解が更に進むことが期待されます。
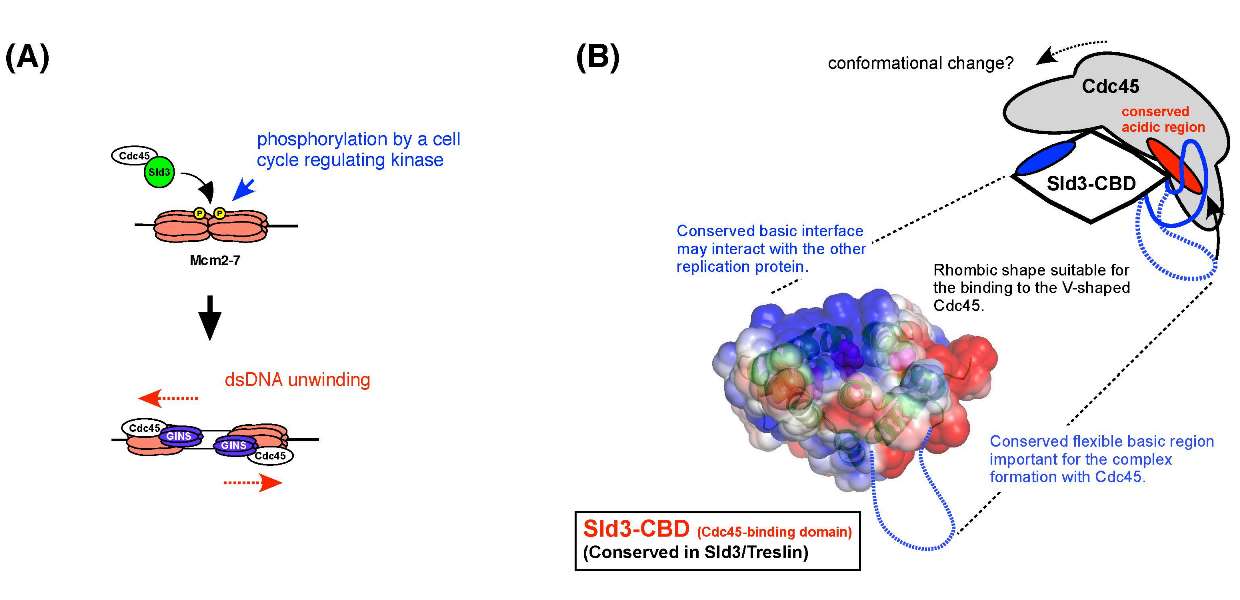
(A) 細胞周期に連動してリン酸化されたMcm2-7複合体に、Cdc45と結合したSld3が結合する。このSld3との結合を介して更にGINSが結合し、ヘリカーゼが形成される。 (B) 今回明らかとなったSld3とTreslinに保存された領域の立体構造と、その立体構造から考えられるCdc45との結合モデル。
学習能力の発達を調節するタンパク質を発見! ~成長期でのはたらきが、おとなの脳機能を左右する~
![]()
RacGAP α2-Chimaerin Function in Development Adjusts Cognitive Ability in Adulthood
Ryohei Iwata, Kazutaka Ohi, Yuki Kobayashi, Akira Masuda, Mizuho Iwama, Yuka Yasuda, Hidenaga Yamamori, Mika Tanaka, Ryota Hashimoto, Shigeyoshi Itohara, Takuji Iwasato Cell Reports Available online 21 August 2014 DOI:10.1016/j.celrep.2014.07.047私たちの脳には、1000億以上の神経細胞(ニューロン)があります。これらは互いに突起(神経突起)を延ばして結びつくことによりネットワーク(神経回路)を作り出し、記憶、学習、思考、判断、言語といった高いレベルの機能(高次機能)を果たしています。このような神経回路は成長期にさかんに作られ、おとなになってからの脳のはたらきを支えていると考えられています。ただし、そこにどのようなしくみが存在し、どのような分子が関与するのかといったことは、よくわかっていません。
今回、国立遺伝学研究所 形質遺伝研究部門(総合研究大学院大学 生命科学研究科教授兼任)の岩里琢治教授、理化学研究所 脳科学総合研究センターの糸原重美シニアチームリーダー、大阪大学大学院 連合小児発達学研究科の橋本亮太准教授らのチームは「αキメリン」というタンパク質に注目し、このタンパク質が脳の機能にどのような影響を与えているかを調べました。αキメリンにはα1型(α1キメリン)とα2型(α2キメリン)がありますが、それらの遺伝子をさまざまに改変したマウスを作り、行動実験を行ったのです。その結果まず、両方のタイプのαキメリンがまったくはたらかないマウスは、正常マウスの20倍も活発に活動することがわかりました。次に、このマウスはおとなになってからの学習能力が高いことが明らかになりました。α1型だけをはたらかなくしたマウスや、おとなになってから両方のタイプがはたらかないマウスの学習は正常であったことから、学習能力には、成長期におけるα2キメリンのはたらきが鍵であることもわかりました(図)。
一方で、健康な人を対象に「αキメリン遺伝子のタイプ(多型:SNPs)」と人格や能力などとの関係を調べました。すると、α2キメリン遺伝子のすぐ近くにある「ある塩基」が「特定の型」の人では、性格や気質に一定の傾向がみられ、計算能力が高いことが明らかになりました。 一連の結果は、αキメリンが「活動量、学習機能といった幅広い脳機能の制御を担っていること」、「成長期でのはたらきが、おとなになってからの学習機能に影響すること」、「ヒトにおいて、脳機能の個人差に関与すること」などを示唆しており、ヒトの学習障害や精神疾患との関連の検証、これらの病気のメカニズム解明などに役立つと期待できます。
今回の研究は、国立遺伝学研究所 形質遺伝研究部門の岩田亮平研究員(元 総研大大学院生)が中心となり、国立遺伝学研究所 形質遺伝研究部門 岩里琢治研究室、理化学研究所脳科学総合研究センター 行動遺伝学技術開発チーム、大阪大学大学院医学系研究科 情報統合医学講座精神医学教室との共同研究で行われました。 また、この研究は、科学研究費補助金(11J03717, 20300118, 22115009)、FIRST、国立遺伝学研究所共同研究(A,B)、三菱財団、上原記念生命科学財団、内藤記念科学振興財団、山田科学振興財団、包括脳ネットワークの支援により行われました。

α2キメリンは子どもの脳で働いて、間接的に、おとなの脳での学習能力を適切なレベルに合わせる。学習能力は神経回路の性能によって左右されるが、α2 キメリンは回路がつくられるときに働いて、その性能を決める過程に関わっていると考えられる。
比較ゲノム法による分裂酵母インターメアの解析
![]()
細胞遺伝研究部門・小林研究室
Population genomics of the fission yeast Schizosaccharomyces pombe
Jeffrey A. Fawcett, Tetsushi Iida, Shohei Takuno, Ryuichi P. Sugino, Tomoyuki Kado, Kazuto Kugou, Sachiko Mura, Takehiko Kobayashi, Kunihiro Ohta, Jun-ichi Nakayama, Hideki Innan PLOS ONE August 11, 2014 DOI:10.1371/journal.pone.0104241生物の設計図であるゲノム(全遺伝子情報)は染色体という「乗りもの」にのって細胞の核に収納されています。さらに、染色体は発生、分化、老化、生殖等の生理機能の制御においても中心的な役割を担っています。我々は、この染色体の機能維持に関わる非コードDNA領域(インターメアと呼んでいます)を同定するために研究チームとして取り組んで参りました。
従来の変異株を用いた遺伝学的な解析法では、インターメアの解析は非常に困難です。というのは、同じ機能のインターメアが複数個存在する可能性があること、またタンパク質をコードする遺伝子とは違い、変異の影響を受けにくいと考えられるからです。そこで今回、染色体研究のモデル生物「分裂酵母」を研究材料とし、多くの個体のゲノムを比較する「比較ゲノム解析法」を行いました。この方法では、ゲノムの比較により変異の入りにくい、つまり保存性の高い領域を探し出すことができます。保存性の高い領域は、染色体機能に重要な配列であり、そのために進化の過程で変化しにくかったと予想できます。我々は、分裂酵母野生株32種のゲノムを決定し、比較ゲノム解析を行い、インターメア候補領域を多数特定しました。
染色体の機能が異常になると、癌をはじめとする多くの疾患を引き起こすことが知られています。インターメアは染色体の機能維持に関わると考えられるので、今回の成果はそのような染色体異常の発症メカニズムの解明につながる重要な基礎研究となります。
本研究は、文部科学省科学研究費補助金新学術領域研究「ゲノムを支える非コードDNA領域の機能」(代表 小林武彦・国立遺伝学研究所)の支援を受け、総合研究大学院大学、名古屋市立大学、東京大学、国立遺伝学研究所の共同研究として行われました。
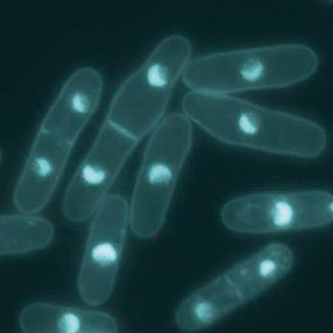
分裂酵母 (Schizosaccharomyces pombe) を、DAPIという試薬で核を染色して蛍光顕微鏡で見た画像 (クレジット:名古屋市立大学)
共生細胞進化研究室の宇塚明洋さんがPoster Award に選ばれました
 共生細胞進化研究室の宇塚明洋さん(総研大遺伝学専攻D2)が 2014年6月21-26日にポーランドのPultuskで行われましたBiology of plastids -towards a blueprint for synthethic organellesで Poster Award に選ばれました。
共生細胞進化研究室の宇塚明洋さん(総研大遺伝学専攻D2)が 2014年6月21-26日にポーランドのPultuskで行われましたBiology of plastids -towards a blueprint for synthethic organellesで Poster Award に選ばれました。 受賞題目
受賞題目Analyses of photosynthetic oxidative stress responses in herbivorous unicellular organisms
 学会HP
学会HPBiology of plastids -towards a blueprint for synthethic organelles
動植物の性決定システムは実に多様
Sex Determination: Why So Many Ways of Doing It?
Bachtrog, D., Mank, J. E., Peichel, C. L., Kirkpatrick, M., Otto, S. P., Ashman, T. L., Hahn, M. W., Kitano, J., Mayrose, I., Ming, R., Perrin, N., Ross, L., Valenzuela, N., and Vamosi, J. C. (2014) PLoS Biology 12(7): e1001899. doi:10.1371/journal.pbio.1001899動植物の性決定システムは実に多様です。例えば、哺乳類では殆どがXYシステム(Y染色体上にオス決定遺伝子がのっている場合)によって性が決定されますが、魚類では、XYに限らずZW(W染色体上にメス決定遺伝子がのっている場合)や性染色体の同定できないような種も多数あります。生態遺伝学研究室の北野特任准教授は、米国進化統合センター(NESCent)のコンソーシアムのメンバーに招かれ、動植物にまたがるデータベースの作成に貢献しました。このデータベースを公開するとともに、それにともなって総説をPLoS Biologyに執筆しました。現在、このデータベースをもとに、性決定システムの進化様式や性決定システムの違いが他の進化過程に与える効果について研究しています。
本研究の一部は、新学術領域研究の助成のもと行われました。
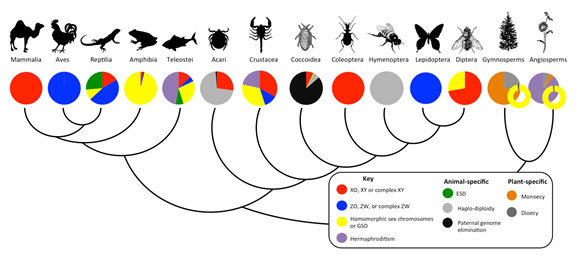
性決定システムが多様であることを示す。Bachtrog et al. (2014) PLOS Biologyより。
染色体のセントロメア形成に関わる分子スイッチを発見
![]()
分子遺伝研究部門・深川研究室
Histone H4 Lys 20 mono-methylation of the CENP-A nucleosome is essential for kinetochore assembly
Tetsuya Hori, Wei-Hao Shang, Atsushi Toyoda, Sadahiko Misu, Norikazu Monma, Kazuho Ikeo, Oscar Molina, Giulia Vargiu, Asao Fujiyama, Hiroshi Kimura, William C. Earnshaw, and Tatsuo Fukagawa Developmental Cell Volume 29, Issue 6, p740–749, 23 June 2014 doi:10.1016/j.devcel.2014.05.001DNAを運ぶ染色体は、細胞分裂のたびに新たな細胞へと正確に分配されていきます。染色体分配に異常がおこると、細胞に様々な問題がおきます。がんを始めとする各種遺伝性疾患の多くは、染色体の分配不全が原因でおきています。したがって、染色体分配についての研究は、基礎生物学の知識探求としてだけでなく、医科学的にも重要な課題です。 この染色体分配に重要な働きを担うのがセントロメアです。セントロメアは染色体の中央部に存在し、染色体が引っ張られるための足場として働いています。正確な染色体分配がおこるためには、染色体のある一カ所にセントロメアが形成されなければなりません。しかしながら、セントロメアはどのように形成されるのかと言うメカニズムは不明であり、世界中の研究者が熱心に探究してきました。 これまでにわかっていたことは、長いひも状のDNAが巻き付くヒストンというタンパク質の特徴が、セントロメア形成に大きく関わっているということです。つまり、DNAは8個のヒストンに巻き付いていますが、そのうちの一部に「CENP-A」というヒストンが含まれていると、そこにセントロメアが形成されます。 しかし、単純にCENP-Aが存在するだけでは、セントロメアは形成できません。そこで、我々は、CENP-Aを活性化する分子スイッチが存在するのではないかと予想しました。 今回の実験で我々が明らかにしたのは、この分子スイッチです。我々は詳細な解析を行った結果、DNAが巻き付くヒストンとしてCENP-Aが取り込まれた後、残りのヒストンのうちのH4という種類のヒストンに特別な修飾が加わると、セントロメア形成が起こることを明らかにしました。この特別な修飾とは、ヒストンH4の20番目のリシン(Lys)残基がメチル化されることです。 セントロメア形成の分子スイッチを発見できたのは、高精度のゲノム解析や染色体工学を活用した技術開発によります。これらの実験により、この分子スイッチがセントロメア形成に必須であることを証明できました。 この分子スイッチを操作することによって、将来的にはがんをはじめとする染色体分配不全が原因でおこる各種遺伝性疾患の解明・治療も可能になると考えています。
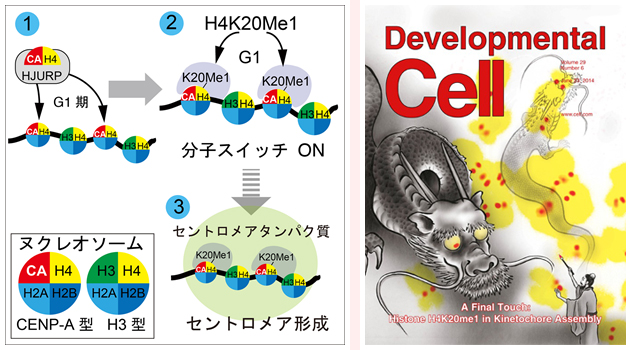
(左)セントロメア形成のモデル。
1.) CENP-AがHJURPという分子の介在でセントロメアへ取り込まれる。2) CENP-A近傍のH4の20番目のリシン残基がメチル化される (H4K20me1修飾: 分子スイッチON)。 3) 分子スイッチを引き金にセントロメア形成がおこる。
(右)今回の掲載誌の表紙。
画家がキャンバスにむけて竜の絵を書いている。目に最後の一筆をいれると竜がキャンバスからとびだす。このコンセプトは、H4K20me1による分子スイッチによりセントロメア形成が達成されるというコンセプトと類似している。
神経軸索の正常な伸長と経路選択を助ける膜タンパク質
Transcallosal Projections Require Glycoprotein M6-Dependent Neurite Growth and Guidance.
Sakura Mita, Patricia de Monasterio-Schrader, Ursula Fünfschilling, Takahiko Kawasaki, Hidenobu Mizuno, Takuji Iwasato, Klaus-Armin Nave, Hauke B. Werner, and Tatsumi Hirata. Cerebral Cortex DOI: 10.1093/cercor/bhu1294回膜貫通タンパク質M6aは軸索の先端に豊富に分布し、軸索伸長に関わる可能性が、古くから培養実験により示唆されてきました。しかし一見矛盾する報告もあり、実際の生理的機能については不明でした。今回我々は、M6a遺伝子とそのホモログであるM6b遺伝子を同時に破壊する事で、これらのタンパク質が実際に生理的に軸索伸長に働くことを明らかにしました。M6aとM6bを欠損したマウスでは、左右の大脳半球をつなぐ軸索束である脳梁が顕著に細くなり、多くの軸索が脳梁に到達する前に伸長を停止してしまいます。さらに一部の軸索は行き先を誤って、大脳皮質外に伸びていることもわかりました。以上の結果は、M6タンパク質が、生体脳において、正常な軸索伸長と経路選択を保障する重要な役割を担うことを示しています。
形質遺伝研究室が開発したSupernovaシステムを用いた共同研究による成果です。
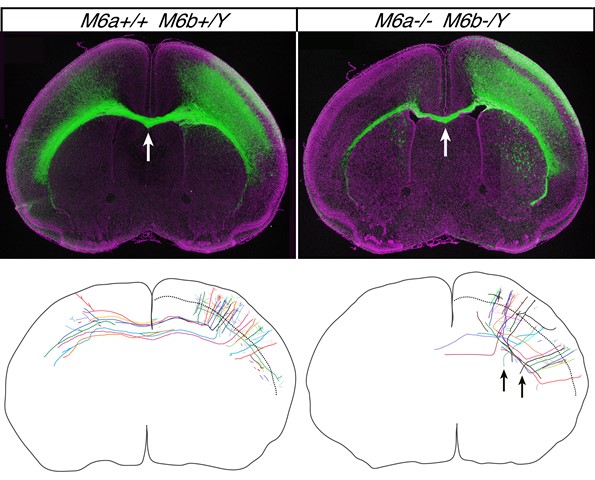
上:M6a/M6b 二重変異マウスの脳(右)では、左右大脳半球をつなぐ脳梁軸索(緑)の本数が著しく減少する(矢印)。下:Supernovaシステムによりトレースした軸索の形態。M6a/M6b 二重変異マウスの脳(右)では、軸索が短いだけでなく、走行方向が乱れ、間違った部位にも投射する(矢印)。
違った性質の攻撃行動には異なる遺伝子が関与する
Genetic mapping of escalated aggression in wild-derived mouse strain MSM/Ms: association with serotonin-related genes
Aki Takahashi, Toshihiko Shiroishi, Tsuyoshi Koide Frontiers in Neuroscience Front. Neurosci., 11 June 2014; doi:10.3389/fnins.2014.00156野生由来マウス系統であるMSMのオスは過剰な攻撃性を示します。マウス開発研究室の高橋阿貴助教らは、その過剰な攻撃行動の調節にかかわる遺伝子が少なくとも2つの染色体に存在し、それぞれの遺伝子は異なった性質の攻撃行動に関与していることを明らかにしました。また、この高い攻撃性にはセロトニン神経系に変化が生じていることを示しました。
マウスのオスは自らのなわばりを守るために、侵入者のオスに対して攻撃行動を示します。これは、相手を追い払うことが目的で、けがを負わせたり殺したりしてしまうことは、実験用マウスではほとんどありません。一方、日本の三島市で捕まえられた野生マウスを系統化したMSM系統のオスは、高い攻撃性を示し、離乳後にオス同士を一緒に飼育していると、性成熟後に激しいけんかが起こり、兄弟や、ときには交配相手であるメスを殺してしまうことがあります。このMSMの高い攻撃性に関わる遺伝子座を明らかにするために、哺乳動物遺伝研究室で作出されたコンソミックマウス系統群を用いて、順遺伝学的な手法を用いて解析を行いました。 コンソミックマウス系統とは、ほとんど全ての遺伝子は実験用マウスのC57BL/6J系統と同じなのですが、1種類の染色体(全部で21種類ある染色体のうちの1つ)のみMSM系統に由来するものを持っている系統です。コンソミック系統群の解析を行うことによって、私たちはMSMの高い攻撃性に関わる遺伝子が、4番染色体と15番染色体上に存在することを明らかにしました。また、それぞれの染色体が行動に及ぼす効果を調べることで、違った性質の攻撃行動にかかわっていることがわかりました。MSM型の4番染色体を持つコンソミック系統は攻撃をひとたび始めてしまうと、異常に高いかみつき行動や追いまわし行動を行い、交配相手のメスに傷を負わせるような個体も存在しました。一方、MSM型の15番染色体を持つコンソミック系統は、多くの個体が攻撃を開始しやすい傾向にあるのですが、攻撃を始めてもその頻度はそれほど高くないという特徴を持ちました。 攻撃行動には脳内のセロトニンが関与することが多くの研究から報告されています。今回、私たちはMSMとコンソミックマウス系統の脳内のセロトニン関連遺伝子の発現を調べ、MSMや高い攻撃行動を示すコンソミック系統において、セロトニンの合成酵素であるTph2遺伝子の発現が増加しており、セロトニン神経系に変化が生じていることも明らかにしました。 今回の研究は、攻撃行動の調節に関わる遺伝子がそれぞれ違った性質の攻撃性に関与しており、その遺伝的基盤の複雑さを示しています。今後、攻撃行動と遺伝子の関係をより深く理解する上で重要な情報をもたらしてくれると考えられます。
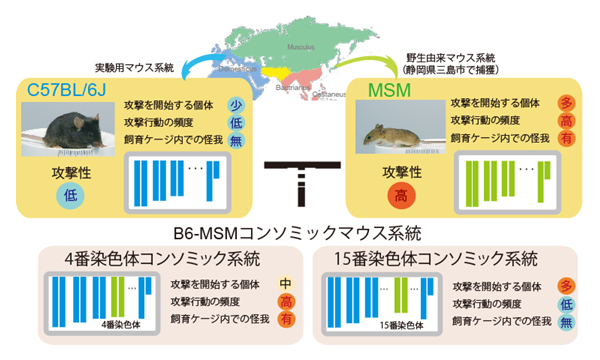
コンソミックマウス系統を用いたMSMの過剰な攻撃行動に関わる遺伝子座の探索
藻類から陸上植物への進化をつなぐ車軸藻植物のゲノム配列を解読
![]()
Klebsormidium flaccidum genome reveals primary factors for plant terrestrial adaptation
Koichi Hori, Fumito Maruyama, Takatomo Fujisawa, Tomoaki Togashi, Nozomi Yamamoto, Mitsunori Seo, Syusei Sato, Takuji Yamada, Hiroshi Mori, Naoyuki Tajima, Takashi Moriyama, Masahiko Ikeuchi, Mai Watanabe, Hajime Wada, Koichi Kobayashi, Masakazu Saito, Tatsuru Masuda, Yuko Sasaki-Sekimoto, Kiyoshi Mashiguchi, Koichiro Awai, Mie Shimojima, Shinji Masuda, Masako Iwai, Takashi Nobusawa, Takafumi Narise, Satoshi Kondo, Hikaru Saito, Ryoichi Sato, Masato Murakawa, Yuta Ihara, Yui Oshima-Yamada, Kinuka Ohtaka, Masanori Satoh, Kohei Sonobe, Midori Ishii, Ryosuke Ohtani, Miyu Kanamori-Sato, Rina Honoki, Daichi Miyazaki, Hitoshi Mochizuki, Jumpei Umetsu, Kouichi Higashi, Daisuke Shibata, Yuji Kamiya, Naoki Sato, Yasukazu Nakamura, Satoshi Tabata, Shigeru Ida, Ken Kurokawa, & Hiroyuki Ohta Nature communications 10.1038/ncomms4978東京工業大学、かずさDNA研究所、理化学研究所、国立遺伝学研究所を含む研究グループは、藻類と陸上植物の中間的な存在である車軸藻植物門「クレブソルミディウム」に着目してゲノム解読を行い、藻類から陸上植物に至る遺伝子の進化過程を解明しました。それを他の藻類や陸上植物と比較して、藻類から陸上植物に至る過程でどのように遺伝子が多様化したのかを明らかにしました。またクレブソルミディウムの祖先が陸上環境に適応するための原始的なストレス応答システムを獲得していたことを突き止めました。
解読したゲノム情報は生命が陸上に進出し発展を遂げた過程を詳細に解明するための重要な基盤となります。また、クレブソルミディウムは藻類と陸上植物の中間的な性質を持つため、両方の架け橋として、その遺伝子情報を藻類の培養技術、物質生産技術に応用することも期待されます。
この研究はかずさDNA研究所、国立遺伝学研究所、理化学研究所、東京大学などと共同で行いました。成果は、平成26年5月28日付で英国科学誌「ネイチャー・コミュニケーションズ」に掲載されました。
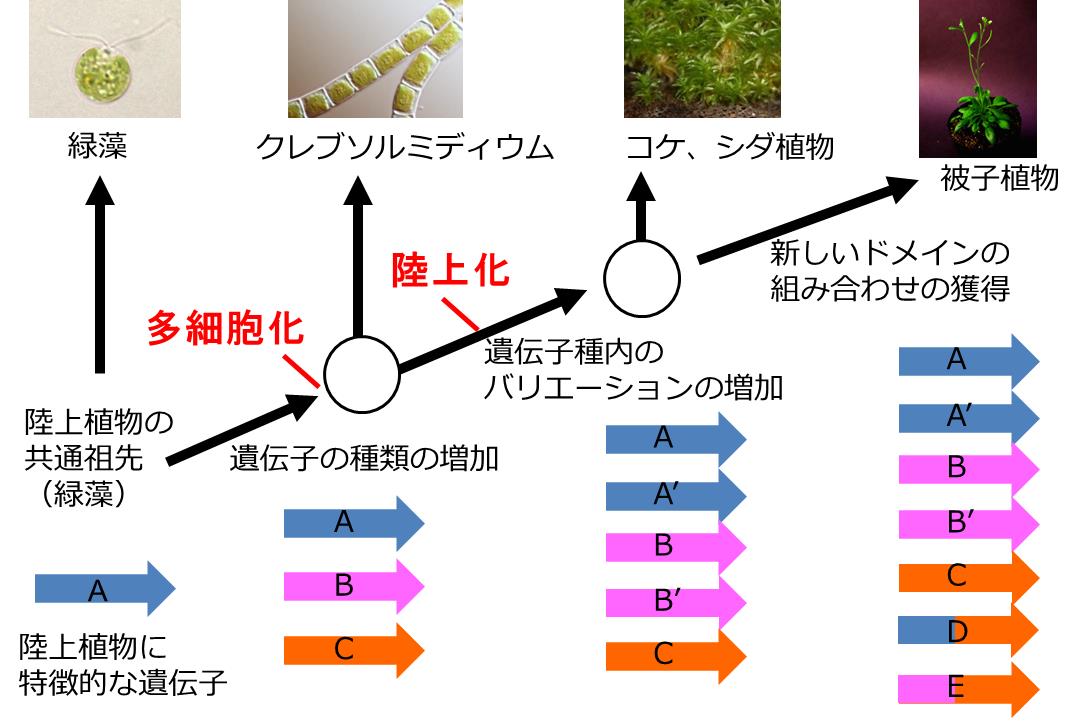
他生物とのゲノム比較から推定される遺伝子の多様性の獲得 植物が陸上化し、遺伝子の多様性が獲得される過程を示しました。クレブソルミディウムの祖先が生まれた段階で、陸上環境に適応するために必要であろう基本的な遺伝子パーツの多くをすでに獲得しており、陸上に進出する原動力となった事が推定されました。















