Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
木村資生博士による「中立進化論」の提唱から50年

1968年、当時国立遺伝学研究所の集団遺伝研究部門部長であった木村資生博士が、Nature誌の217巻624-626頁に “Evolutionary rate at the molecular level”と題した論文を発表しました。
この論文は、現代進化学理論の中核となっている「中立進化論」を提唱したものです。
今年は中立進化論提唱50周年であることを記念して、分子進化学の国際会議 SMBE2018 も横浜にて実施されています。
論文: Kimura, M. (1968). Evolutionary rate at the molecular level. Nature 217: 624-626.
世界初!光で細胞分裂装置の操作に成功 ~体作りに重要な細胞分裂の仕組みの理解促進に期待~
![]()
Dynein-Dynactin-NuMA clusters generate cortical spindle-pulling forces as a multi-arm ensemble
Masako Okumura, Toyoaki Natsume, Masato T Kanemaki, Tomomi Kiyomitsu
eLife Research Article May 31, 2018 DOI:10.7554/eLife.36559
このたび、名古屋大学大学院理学研究科の 清光 智美 助教の研究グループは、情報・システム研究機構国立遺伝学研究所の 鐘巻 将人 教授、夏目 豊彰 助教との共同研究で、光を用いてヒトの内在性タンパク質の局在を自在に操作する技術を開発し、細胞分裂装置(紡錘体1))の配置を光で操作することに世界で初めて成功しました。紡錘体の配置は細胞分裂の方向や娘細胞のサイズを決めるため、母細胞が2つの同じ娘細胞に分裂するのか、それとも2つの異なる娘細胞に分裂するのかを決める重要な役割を担います。従って、紡錘体を適切に配置する仕組みは、私たちの体を作る基礎となりますが、どのようにして紡錘体を動かす力が生み出されるのかは、理解されていませんでした。私たちは、今回新たに開発した技術を用いて複数の候補因子の局在を操作したところ、紡錘体牽引力の生成に十分なヒト遺伝子を同定することに成功しました。この発見は、細胞分裂の対称性・非対称性制御の仕組みを理解する上で極めて重要な手がかりとなり、細胞分裂が私たちの体作りに果たす役割や、その破綻と疾患との関連について理解が進むことが期待されます。
この研究成果は、平成30年5月31日(日本時間)に英国科学雑誌「eLife」オンライン版に掲載されました。
なお、この研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ、ヒューマン・フロンティア・サイエンス・プログラム(HFSP)、文部科学省科学研究費助成事業等の支援のもとで行われたものです。
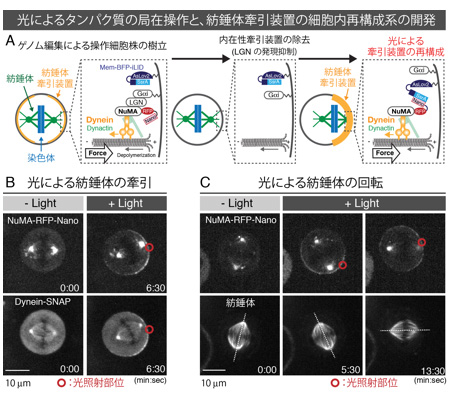
図1: 光によるタンパク質の局在操作と紡錘体配置の光操作
(A) 光によるヒト内在性タンパク質の局在操作の模式図。まず膜局在型のiLID(Mem-BFP-iLID)、RFP-Nanoを融合したNuMA(NuMA-RFP-Nano)の2つを発現する細胞株を樹立した。RNA干渉法(RNAi)7)をもちいてNuMAの上流因子LGNを発現抑制した後、赤丸領域を光照射することによって、NuMA-RFP-Nanoを細胞膜へと局在操作した。光照射によってiLIDは構造を変え、Nanoと結合するため、NuMA-RFP-Nanoを膜上へと局在化できる。(B) 光による紡錘体の牽引の様子。上段;NuMA-RFP-Nano像。下段; SNAPタグを融合したDynein-SNAP像。赤丸で記した領域に光を照射すると、NuMAおよびダイニンはその領域近くの細胞膜に局在化し、その後、その方向に紡錘体が引き寄せられていく。(C) 光による紡錘体の回転操作の様子。光照射部位を回転させると、NuMA局在の回転に伴い、紡錘体が回転する様子が観察された。上段:NuMA-RFP-Nano像。下段:紡錘体像。点線は紡錘体の長軸を表す。
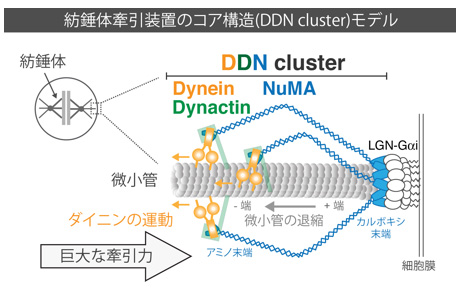
図2:紡錘体牽引装置の構造モデル
NuMAは尾部(カルボキシル末端)の自己集合ドメインを介して環状構造を形成し、かつ微小管結合ドメインを用いて、微小管の先端に結合することで、微小管の退縮エネルギーを牽引力に変換する。またNuMAの頭部(アミノ末端)領域によって局在化された複数のダイニン、ダイナクチン分子は微小管の側面に結合し、ダイニンのマイナス端への運動エネルギー用いて大きな微小管牽引力を生み出す。このようにダイニン, ダイナクチン, NuMAがcluster構造(Dynein-Dynactin-NuMA (DDN) clusterと命名)をとることによって、まるで人の手のような形をつくり、より効率的に微小管を捕らえ、紡錘体牽引力を生成できると考えられる。
日本列島で生じたトゲウオの種分化の様子を全ゲノム配列から解明
The genomic landscape at a late stage of stickleback speciation: High genomic divergence interspersed by small localized regions of introgression
Ravinet, M., Yoshida, K., Shigenobu, S., Toyoda, A., Fujiyama, A., and Kitano, J.
Plos Genetics Published: May 23, 2018 DOI:10.1371/journal.pgen.1007358
種とは、お互いに交配して一つに混合してしまわないような集合体と定義されます(生物学的種概念による)。もともとは連続的であった集団から、どのようにして異なる種が生じるのか(種分化)は、進化生物学における重要な課題です。
遺伝子流動(2集団の間で遺伝子が交流すること)がある場合、種分化の初期の段階では、ゲノム(個体に存在するDNAの集合体)全体ではなく、限られた一部の配列のみが分化していくことが、近年のゲノム解析によって多くの分類群で示されてきました。その一方で、種分化の後期にどのようにして種分化が完成していくかについては多くが不明でした。特に、地理的に完全に分断されるなどの大きな出来事がない場合にどのように種形成が完成に向かうのかは大きな謎でした。
本研究では、日本に生息するトゲウオ2種(図参照)、太平洋岸を中心に生息するイトヨ(Gasterosteus aculeatus)と日本海を中心に生息するニホンイトヨ(G. nipponicus)について全ゲノム配列を利用してこの課題に取り組みました。この2種は、北海道の道東地域などでは、繁殖地を共有しており、頻度は低いものの交雑を続けていることから、種分化の後期に位置すると考えれています。我々はニホンイトヨの全ゲノム配列を既に決定の上、報告しています(Yoshida et al. 2014 PLoS Genetics 10: e1004223)。本研究では、まず、この2種が約68万年前に分岐を始めたこと、分岐後も程度は低いものの遺伝子の交流をほぼ連続的に続けながら分化してきたことを明らかにしました。次に、2種間のゲノム配列を比較すると、殆どのゲノム領域では分化が進行しているにも関わらず、一部のゲノム領域では遺伝子配列が似通っており(図参照)、このような分化の低い領域は遺伝子流動によることが明らかになりました。遺伝子流動は、組換え率の低い領域、特にネオX染色体(ニホンイトヨのみに存在するX染色体)で低いことも明らかになりました。遺伝子流動は、免疫関連遺伝子に多く、何らかの機能的な意義があるのではないかと推測されましたが、機能的意義に関してはさらに詳しい研究が必要です。
遺伝子流動を保持しながら種分化が後半まで到達した事例において、種間でのゲノム分化のパターンが解析された研究例が少ないことから、貴重な成果と言えます。今後、類似の研究が他の分類群で実施されることによって、本成果の普遍性が検証されることが望まれます。
本研究は、学術振興会の助成を得て生態学研究部門・北野研究室(https://www.nig.ac.jp/labs/EcoGene/)に滞在中のMark Ravinet博士(現・オスロ大学)が中心となって、国立遺伝学研究所・比較ゲノム解析研究室、基礎生物学研究所・生物機能情報分析室との共同研究として実施したものです。科研費(23113007, 23113001, 221S0002, 15H02418)及び、国立遺伝学研究所共同利用-I (98I2017)などの支援を受けました。
本成果は、PLoS Geneticsに掲載されました。
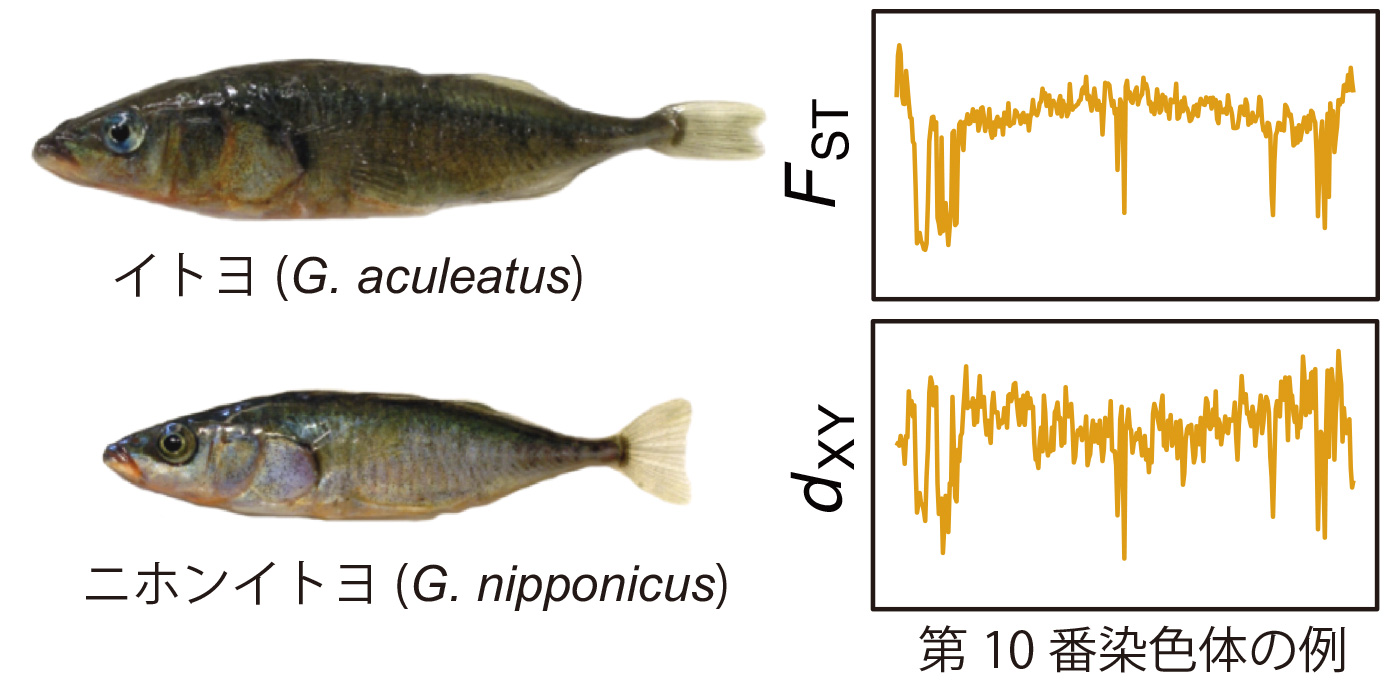
図:左は、イトヨとニホンイトヨのオス。右は、ある染色体(ここでは第10番染色体)に観察されたゲノムの分化のパターン。
第9回国際トゲウオ会議[Stickleback2018]を開催:7月3日-7日
2018年7月3日から7月7日にかけて,京都大学吉田キャンパスにて第9回・国際トゲウオ会議 Stickleback2018 (https://sites.google.com/view/stickleback2018/)を開催します。
本国際会議は、国際ネットワーク形成・MOU推進プロジェクトの一環として、情報・システム研究機構(ROIS)の支援を受けて開催します。他にアメリカ遺伝学会、福井県大野市、京都大学教育研究振興財団の支援を受けています。
プレナリー講演会を公開と致しますので、興味のある方は是非お越しください。いずれの講演者も、進化生態学、進化遺伝学、進化発生学の分野で大きな成果を挙げられている方々です。
会場: 京都大学吉田キャンパス 北部構内 北部総合教育研究棟 益川ホール
http://www.kyoto-u.ac.jp/ja/access/campus/yoshida/map6r_n.html
7/4(水)9:30-10:15
David Kingsley (HHMI and Stanford University School of Medicine)
The arrival of the fittest: sources of molecular variation underlying repeated evolution in vertebrates
7/5(木)9:30-10:15
Dolph Schluter (University of British Columbia)
Fitness maps to a large-effect locus in an experimental stickleback population
7/6(金)9:30-10:15
Andrew Hendry (McGill University)
Eco-evolutionary dynamics
7/7(土)9:30-10:15
Ole Seehausen (Eawag and University of Bern)
The genomic basis of quantum speciation in Lake Victoria cichlids
「夏休み子ども遺伝学講座」を開催
スマホ顕微鏡で見る、遺伝学で活躍する小さな生き物
対象:
三島市内の小学校4年生~6年生 30名
(申込者多数の場合は抽選)
日時:
平成30年7月31日(火)
午前9時30分~午前12時00分(予定)
場所:
国立遺伝学研究所(三島市谷田1111)本館3FA316
持ち物:
筆記用具(※使用する端末、顕微鏡は主催で用意)
申込:
三島市政策企画課まで電話か電子メールでお申込みください。
申込時に ①氏名 ②学年 ③住所 ④電話番号 をお伝えください。
申込み締切は平成30年 7月17日(火)です。
E-mail: seisaku@city.mishima.shizuoka.jp
環境と微生物をビッグデータでつなぐ ~「環境」から微生物を検索し、微生物から「環境」を予測するウェブツール「LEA」を開発~
![]()
Latent environment allocation of microbial community data
Koichi Higashi, Shinya Suzuki, Shin Kurosawa, Hiroshi Mori and Ken Kurokawa
PLOS Computational Biology Published: June 6, 2018 DOI:10.1371/journal.pcbi.1006143
微生物は様々な環境に存在し、物質循環や宿主の健康などに影響しています。したがって「どのような微生物がどのような環境に生息するのか?」という問いは、環境問題や健康問題の解決の糸口となり得るので世界中で探求されました。その結果、特定の「環境」に生息する微生物の群集についてのデータが大量に蓄積される一方で、その「環境」を弁別する記述が研究者間でまちまちとなっていました。この問題によって、研究者間のデータを横断的に解析することが困難となり、微生物の群集と相互作用する環境因子を包括的に理解することができませんでした。
情報・システム研究機構 国立遺伝学研究所の東光一特任研究員および黒川顕教授らのグループは、微生物群集構造の大規模データから様々な環境と微生物とのつながりを明らかにし、その結果を利用して環境と微生物のつながりを可視化するウェブツール「LEA」(http://leamicrobe.jp)を開発しました。
本研究では、数万サンプルの微生物群集データと各サンプルの由来環境について研究者が記述した文書(自然言語)を確率モデルで表現し、微生物群集の形成に影響を及ぼす環境を機械学習技術によって抽出しました。抽出された「環境」はそれぞれ固有の「微生物」群集構造と結びついています。この結果をもとに、「環境」に対応する「微生物」を検索する、あるいは逆に「微生物」から「環境」を予測するウェブツール「LEA」を開発しました。LEAは、ヒト共生微生物による疾患の診断や、環境汚染の検出などへの応用が期待できます。
本研究成果は、「PLOS Computational Biology」に平成30年6月6日午後2時(米国東部標準時間)に掲載されました。
本研究は、文部科学省科研費「新学術領域研究『学術研究支援基盤形成』」先進ゲノム解析研究推進プラットフォームの助成を受けて行われました。
本研究成果は、国立研究開発法人科学技術振興機構バイオサイエンスデータベースセンター(JST-NBDC)のライフサイエンスデータベース統合推進事業(統合化推進プログラム)における研究開発課題「データサイエンスを加速させる微生物統合データベースの高度実用化開発」の一環として開発されました。
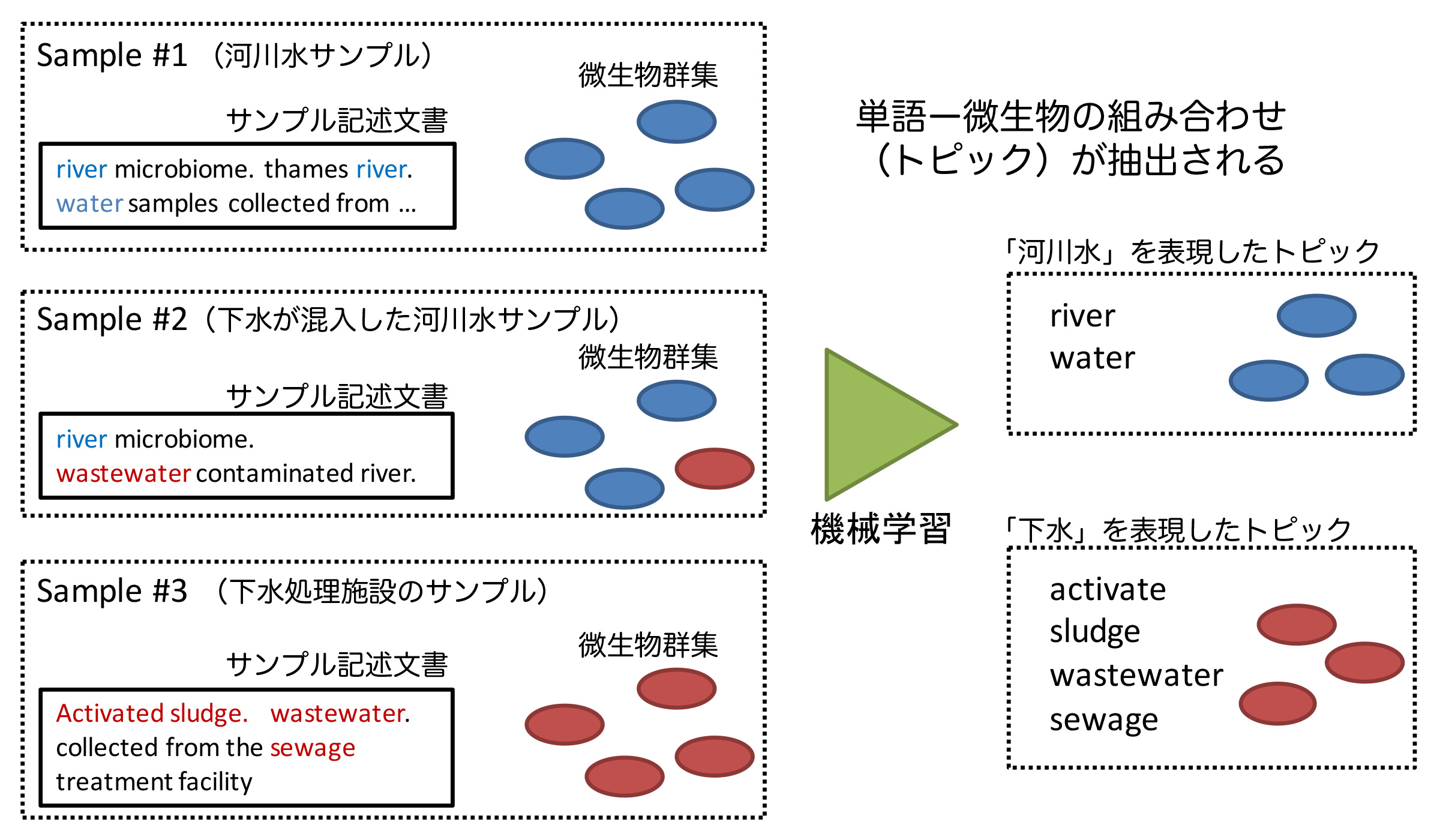
図1: 微生物と自然言語の対応関係を学習
DDBJなどの公共データベース中のすべてのメタゲノムデータには、「サンプルについて研究者が記述した文書(自然言語)」が付随する。
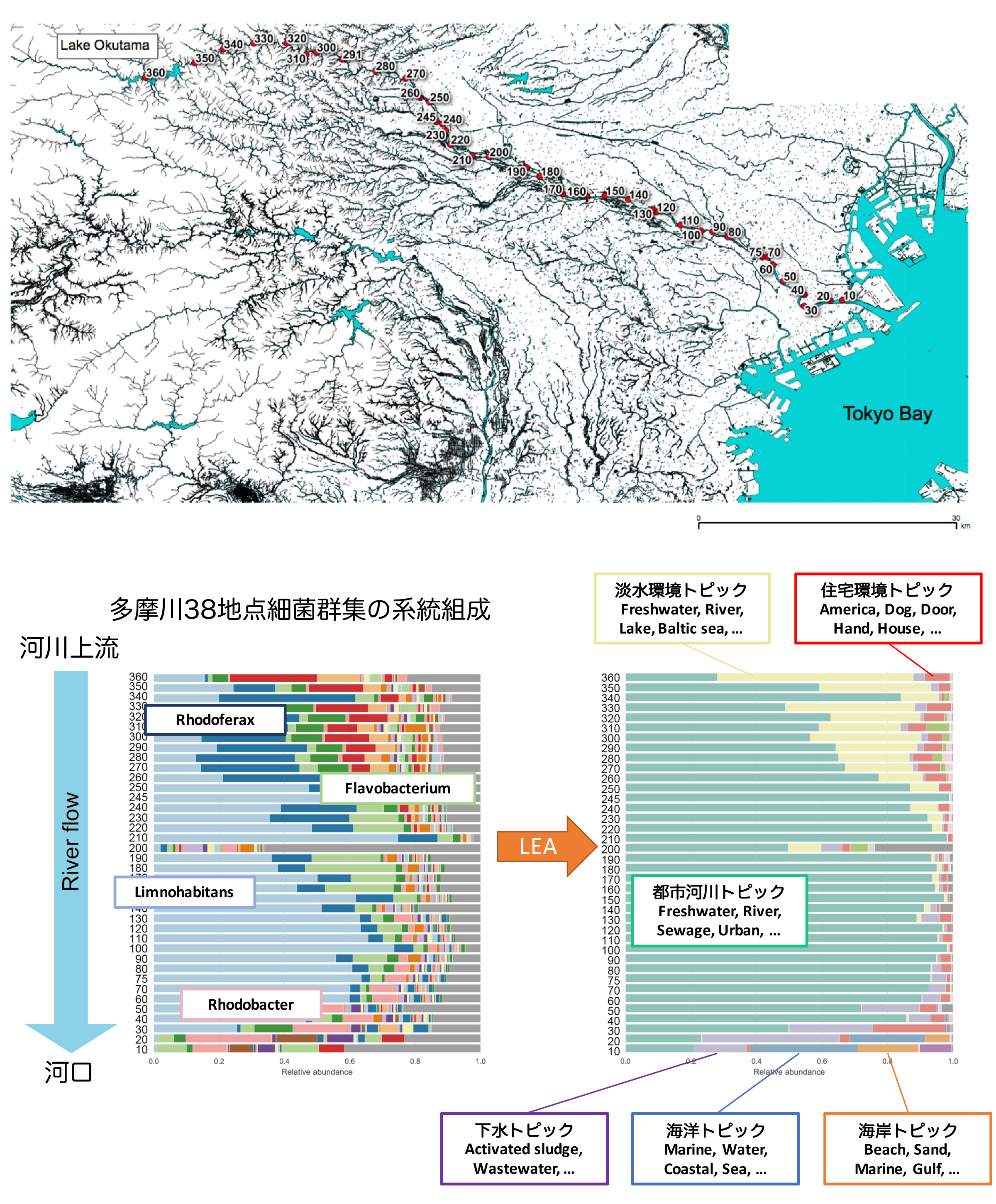
図2:微生物群集構造データからの環境予測
テスト対象:多摩川細菌群集
上流(奥多摩湖)から河口(羽田空港付近)まで38サンプルを解析
国立台湾大学・生命科学院と学術交流協定を締結
今後、共同研究などによって益々の組織間交流が期待されます。
 |
 |
| 国立台湾大学・生命科学院 (JENG, Shih-Tong 学部長とTING, Chau-Ti 助教授) |
国立遺伝学研究所(桂勲 所長と川上浩一 教授) |
卵の品質はDazl遺伝子の適切なONとOFFで制御される
Requirement of the 3′-UTR-dependent suppression of DAZL in oocytes for pre-implantation mouse development
Kurumi Fukuda, Aki Masuda, Takuma Naka, Atsushi Suzuki, Yuzuru Kato, and Yumiko Saga
Plos Genetics Published: June 8, 2018 DOI:10.1371/journal.pgen.1007436
卵子形成は様々な遺伝子の適切な発現によって進行します。マウスの卵子形成に重要な遺伝子の一つ、Dazlはノックアウトすると不妊になり、胎児期も生後もRNAの発現があること等から、卵子形成過程を通じて必要な遺伝子と考えられてきました。
本研究ではこれまでの通説に反し、胎児期の雌性生殖細胞の発生にDazlは必須であるが、生後の卵胞形成においては、むしろDazlは抑制されることが受精後の胚発生の正常な進行に必要であることを明らかにしました。Dazlの発現抑制が破綻すると一部の受精卵は胚発生を停止し、その結果、産子数が減少すること、また、この抑制は3’UTRを介した翻訳抑制によって行われることが新たに分かりました。以上の結果は、卵母細胞におけるDazlの必要性について再考を迫るものです。
本研究は情報・システム研究機構国立遺伝学研究所の福田胡桃(学振特別研究員)、加藤譲(助教)、相賀裕美子(教授)と、横浜国立大学の鈴木敦(准教授)らにより、以下のサポートを受けて行われました。
日本学術振興会(16J11687(福田胡桃)、25840091(加藤譲)、26251025(相賀裕美子))
文部科学省新学術領域(16H01252(鈴木敦)、16H01259(加藤譲)、25112002(相賀裕美子))
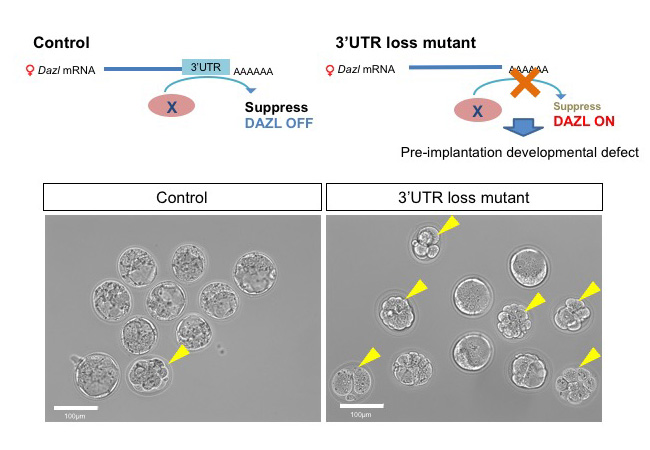
図:通常、生後の卵子形成過程においてDAZL蛋白質の発現は3’UTRを介して翻訳抑制される(図左上)。一方、Dazlの3’UTRが欠損した卵子では生後もDAZLが発現し続け、一部の胚発生が停止する(図右上)。コントロールでは着床後3.5日目で殆どの胚がブラストシストになっているが(図左下)、変異体では約半数が途中で発生を停止している(図右下)。黄色の矢印は発生が停止した異常胚。
高速かつ高精度に細菌群集の系統組成を推定するツールVITCOMIC2を開発
VITCOMIC2: visualization tool for the phylogenetic composition of microbial communities based on 16S rRNA gene amplicons and metagenomic shotgun sequencing.
Mori H, Maruyama T, Yano M, Yamada T, Kurokawa K. BMC Syst Biol
BMC Systems Biology 12 (Suppl 2), 30, 2018. DOI:10.1186/s12918-018-0545-2
情報・システム研究機構国立遺伝学研究所 生命情報研究センター ゲノム進化研究室 森宙史助教および黒川顕教授らは、細菌群集由来のDNAを丸ごとシーケンスすることで、個々の細菌を培養することなく解析可能な手法であるメタゲノム解析、および16S rRNA遺伝子のみをPCR増幅してシーケンスするメタ16S解析により得られる膨大なDNA配列データから、高速かつ高精度に細菌群集の系統組成を推定するウェブアプリケーション、VITCOMIC2を開発し公開しました。VITCOMIC2では、DNA配列間の配列類似性をGraphics Processing Unit (GPU)を用いて高速に検索するツールCLASTを用いることで、各配列の高速な系統推定を実現しています。また、VITCOMIC2ではメタ16S解析等で一般的に用いられている配列クラスタリングを行わずに、全配列を配列類似性検索することによって、配列をクラスタリングで生じる系統推定結果の曖昧性を回避でき、高精度な系統推定を実現しています。VITCOMIC2は、http://vitcomic.orgから利用できます。
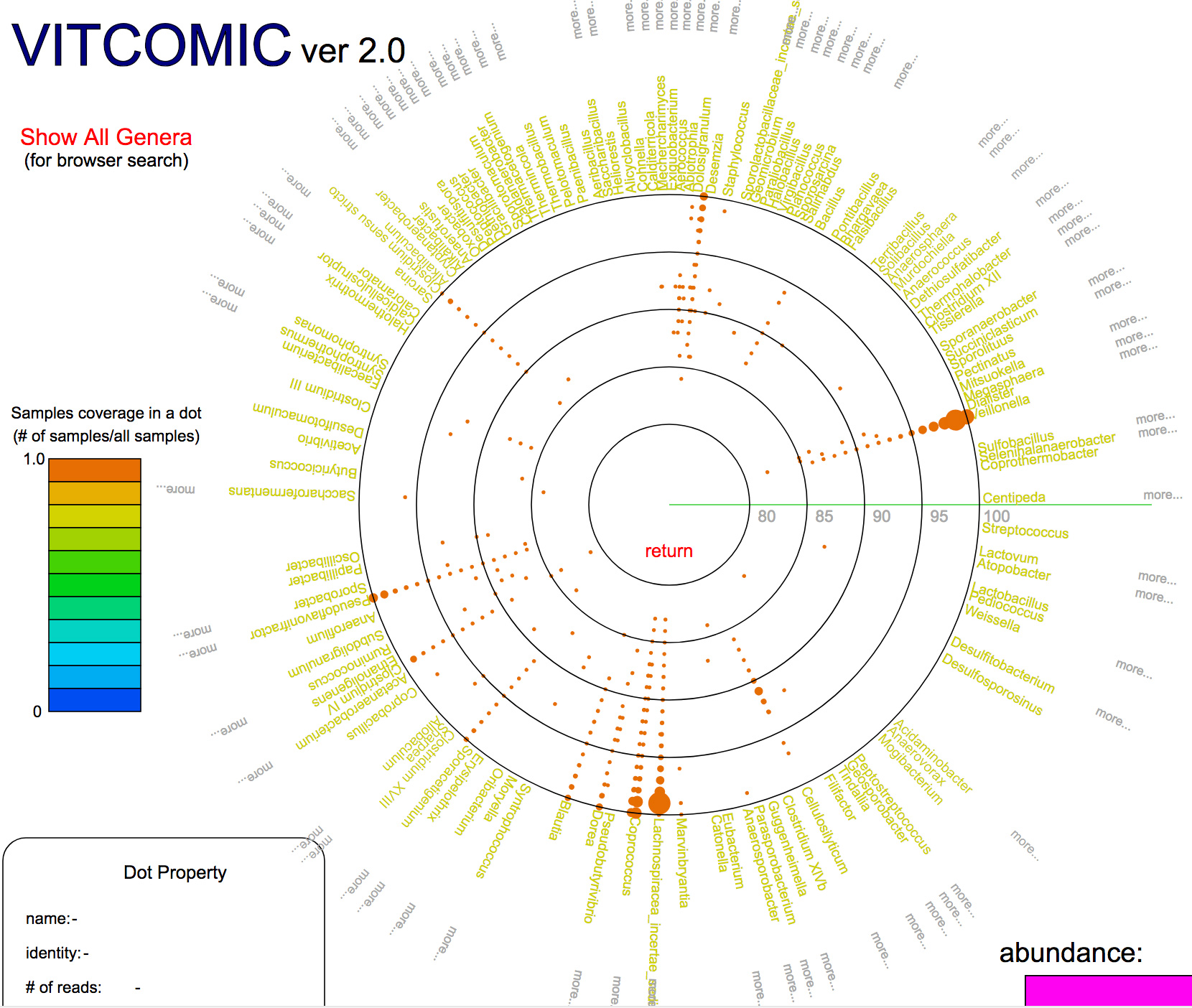
図:VITCOMIC2の結果の表示の例
海水のメタゲノム解析をテーマとする「臨海ハッカソン」を開催:6月10-13日
RinkaiHackathon 2018 受講生募集のお知らせ
臨海実験所を主たる活動の場とし、動植物学と情報学の垣根を超えた研究教育と人材交流を進めることを目的として、数名の有志による研究会”RinkaiHack”を企画しています。
https://sites.google.com/view/rinkaihack/
第2回の公開イベントを、平成30年6月10-13日に広島で開催します。6月10日の午後に福山城内の福寿園にてシンポジウムを、翌11日から3日間を広島大学 向島臨海実験所にて海洋メタゲノムに関するハンズオンセミナーを、それぞれ開講します。
本年は環境DNA/メタゲノムをテーマに、臨海実験所で海水を採集し、DNA抽出から配列解読・解析を行うための講義と実習を計画しています。最近、しばしば話題になる海水のメタゲノム解析の実情を専門家に学び(前日シンポジウム)、3日間の実習でそのエッセンスを実際に一緒に体験しましょう。これらシーケンス解析実習を行うと同時に、実習期間中には、技術の進展によっては変わらない古典的な生物学の知識や思考体系とは何であるかを参加者で議論します。
また、今年から、イベント中の基本言語を英語に変更します。これは、国内の留学生にも積極的に参加してもらいたいと考えたこと、また同時に学外での交流の機会に利用して欲しいと考えたからです。同時に、英語に自信のある日本人学生はもちろん、英語に自信のない学生さんにも参加してほしいと思います。もし英語でのコミュニケーションに自身のない方にも運営スタッフがサポートいたします。
実習の詳細についてはWebsite(https://sites.google.com/view/rinkaihack/registration)を参照してください。また、参加登録、実習に関連する質問等も、Website(Home => Contact タブ)から受け付けています。
実習内容、スケジュール:
ホームページを参照してください。募集締切: 2018年5月11日
* 実習施設・実習内容から定員を20名とし、応募多数の場合は選考を行います。* Hands-onのスケジュールや講演者の日程には変更の可能性があります
招待講師:
川口慎介 かわぐち しんすけ (JAMSTEC) 6月10日(日)ブランマチュー ローマン (京都大学) 6月10日(日)
山本哲史 (京都大学) 6月11日(月)
内山雄介 (神戸大学) 6月12日(火)
ライマー ジェームス (琉球大学) 講演日未定
平岡聡史 ひらおか さとし (JAMSTEC) 6月10日(日)
西村陽介 にしむら ようすけ (東京大学 大気海洋研究所)
Rinkaihackathon2018 運営委員
吉田真明(島根大学隠岐臨海実験所)
川島武士 (国立遺伝学研究所)
濱田麻友子(岡山大学牛窓臨海実験所)
宮本教生 (JAMSTEC)
守野孔明 (筑波大学)
スティアマルガ デフィン (和歌山工専)
大森紹仁 (新潟大学)
田川訓史 (広島大学 向島臨海実験所)
共催
広島大学
DDBJ: DNA Data Bank of Japan
JSBi (日本バイオインフォマティクス学会)
協力
ROIS 未来投資FS
推薦
全国国立大学臨海・臨湖実験所所長会議・議長推薦
魚の鱗が同じ方向に伸びる仕組み:shhシグナリングの乱れで鱗は「渦」を巻く
Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale.
Iwasaki M., Kuroda J., Kawakami K., Wada H.
Developmental Biology 437, 105-119, 2018. DOI:10.1016/j.ydbio.2018.03.005
魚の鱗は、透明な表皮の下に埋もれた平たい骨(皮骨)でできています。すべての鱗は同じ方向に伸び、体表を覆っています(図A)。本研究では、ゼブラフィッシュを用いて、骨を作る細胞(骨芽細胞)が、どのように鱗のパターンを生み出すのか調べました。まず、はじめに、初期発生研究部門で作成したゼブラフィッシュ・エンハンサートラップ系統をスクリーニングして、鱗で蛍光タンパク質を発現する系統を複数得ました(図A)。これらの系統の解析から、鱗には2種類の骨芽細胞があることがわかりました。(i)鱗の裏面に存在する1層の扁平な骨芽細胞と、(ii)鱗の成長端を縁取る骨芽細胞です(図A)。鱗の骨の成長様式は他の骨とは大きく異なり、骨芽細胞は増殖せず、細胞が仮足を伸ばしながら大きくなっていました。さらに、鱗の成長端にある骨芽細胞の分化と鱗の成長には、表皮細胞から分泌されるshh遺伝子が必要であることを示しました。Wnt/PCPシグナル遺伝子の阻害によってshh遺伝子の発現パターンを乱すと、鱗の成長方向が乱れ「渦」を巻くことが分かりました(図B)。これは、私たちの頭髪が「つむじ」を巻くのと同じ現象です。魚の鱗が骨芽細胞でできているのに対し、哺乳類の毛はケラチンを合成する表皮細胞でできています。毛と鱗では、同じ遺伝子群が異なる細胞を制御して、パターンを生み出しているのです。
本研究は、NIG-JOINT (89B2017)の支援の下、北里大学和田博士との共同研究として行われました。
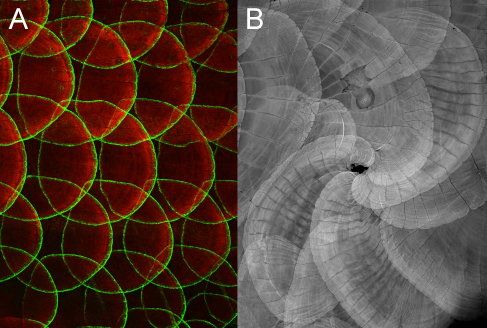
図:(図A)鱗に蛍光タンパク質(GFP、緑)を発現するエンハンサートラップ系統(hspGFFDMC13F;UAS:GFP)の成魚を、カルシウム染色(赤)したもの。鱗の縁(成長端)の骨芽細胞のみがGFPを発現する。(図B)表皮細胞においてWnt/PCPシグナル遺伝子を阻害した魚を、カルシウム染色したもの。鱗のパターンが乱れ「渦」を巻く。
ゼブラフィッシュを用いて腸の腫瘍が肝臓に作用するメカニズムを解明
A novel zebrafish intestinal tumor model reveals a role for cyp7a1-dependent tumor-liver crosstalk in tumor’s adverse effects on host
Sora Enya, Koichi Kawakami, Yutaka Suzuki, Shinpei Kawaoka
Disease Models & Mechanisms (2018) DOI:10.1242/dmm.032383
癌(悪性腫瘍)が個体の全身に悪影響を与える仕組みを明らかにするため、後腸特異的にGal4を発現しているトランスジェニックゼブラフィッシュを用いて、後腸に発癌性RAS遺伝子(krasG12D変異)を発現させ、後腸腫瘍モデルの作製に成功しました。この後腸腫瘍モデルゼブラフィッシュは、肝臓の肥大や炎症、全身の成長阻害、個体の死など様々な異常を示しました。これはマウス癌モデルやヒト癌患者でも観察されるものです。この後腸腫瘍モデルフィッシュを解析し、後腸の腫瘍が肝臓のコレステロール−胆汁代謝の異常を介して肝臓に炎症を引き起こすことを明らかにしました。さらにコレステロール代謝酵素遺伝子cyp7a1の過剰発現による炎症の抑制が観察されました。このように本ゼブラフィッシュモデルは、癌が肝臓に悪影響を与えるメカニズムの理解や、生体・臓器への影響を制御しながら癌と共存できる治療法の開発につながることが期待されます。本研究は、国際電気通信基礎技術研究所(ATR)河岡慎平グループリーダー、東京大学鈴木穣教授との共同研究として行われました。
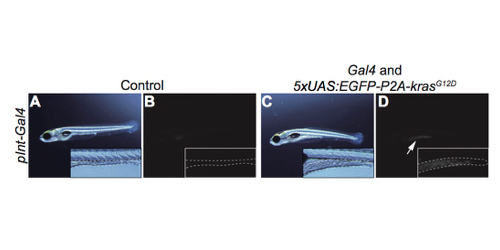
図:変異型kras(G12D)遺伝子をGal4-UAS法により後腸特異的に発現させ作製したゼブラフィッシュ後腸腫瘍モデル。
A, B(蛍光画像):コントロール。点線は正常な後腸。C, D(蛍光画像): 後腸腫瘍モデル。点線は異常な後腸。矢印は、EGFPの発現を示す。
ゼブラフィッシュを用いた脊索損傷修復にはたらく新しい細胞集団の同定
Wilms Tumor 1b defines a wound-specific sheath cell subpopulation associated with notochord repair
Lopez-Baez, J.C., Simpson, D.J., Forero, L.L., Zeng, Z., Brunsdon, H., Salzano, A., Brombin, A., Wyatt, C., Rybski, W., Huitema, L.FA., Dale, R.M., Kawakami, K., Englert, C., Chandra, T., Schulte-Merker, S., Hastie, N.D., and Patton, E.E.
eLife 2018;7:e30657 DOI:10.7554/eLife.30657
加齢等による脊椎の変性の再生治療のためには、変性のプロセスを遅らせたり、元に戻したりする可能性のある細胞の同定が重要です。本研究では、ゼブラフィッシュの脊索傷害後に、脊索鞘細胞(sheath cell)の一部にWilms Tumor(WT)1bを発現する細胞群が出現し、それらが損傷部位に移動してストッパーのような構造を形成し、脊索構造の完全性を維持する可能性があることを明らかにしました。驚くべきことに、wt1b発現細胞は非典型的な軟骨中間体を経て、損傷部位において成人期の脊椎にまで維持されていました。このことは発生期の脊索細胞が成人の椎間板に保持されうることを示してます。本研究により同定された新規細胞集団は、脊椎疾患再生治療に重要な可能性を拓くものです。
本研究は、国立遺伝学研究所、University of Edinburgh (英国), Hubrecht Institute (オランダ)Institute for Cardiovascular Organogenesis and Regeneration (ドイツ)Loyola University Chicago (米国)Lipmann Institute (ドイツ), Friedrich-Schiller-University (ドイツ)の共同研究として行われました。
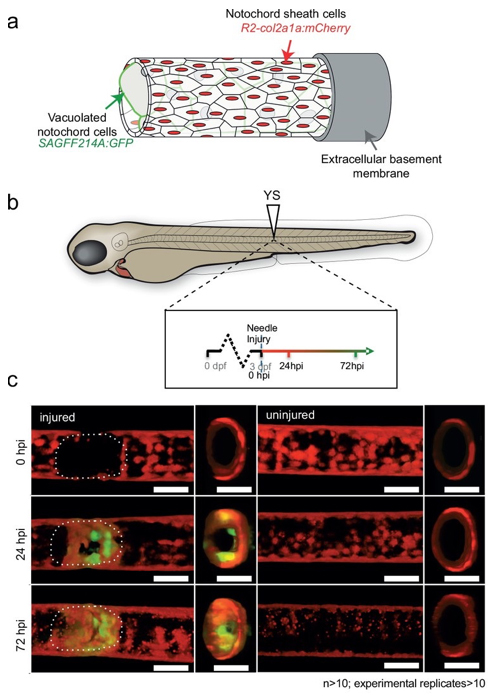
図:脊索の液胞細胞特異的にGFPを発現するトランスジェニックフィッシュにおいて、脊索損傷後に脊索が修復される様子を表す(24-72時間後のGFP発現細胞の出現)。
育種遺伝研究部門 齋藤 絡さんがCold Spring Harbor Asia Conference 2018ポスター発表で1位を受賞

育種遺伝研究部門 齋藤 絡(総研大遺伝学専攻D4)さんが、先日、中国 蘇州市で行われた Cold Spring Harbor Asia Conference 2018 “Chromatin, Epigenetics & Transcription” においてポスター発表を行い、”1st prize of the CSH Asia fellowship” を受賞しました。
この学会でポスター発表された107の演題の中から見事 1位となったものです。
▶ 学会HP:CSH Asia 2018 Conference Chromatin, Epigenetics & Transcription ▶ 演題:Evolution of sequence-specific DNA demethylation systems by transposon-encoded anti-silencing factor
▶ 育種遺伝研究部門 角谷研究室
動物はどうやって危険を察知することができるようになるのか? ~魚類の恐怖条件付け学習の神経回路を発見~
![]()
Identification of a neuronal population in the telencephalon essential for fear conditioning in zebrafish
Pradeep Lal, Hideyuki Tanabe, Maximiliano L. Suster, Deepak Ailani, Yuri Kotani, Akira Muto, Mari Itoh, Miki Iwasaki, Hironori Wada, Emre Yaksi , and Koichi Kawakami
BMC Biology Published: 25 April 2018 DOI:10.1186/s12915-018-0502-y
恐怖を感じるような危険な出来事をその予兆(刺激)と関連付けること(恐怖条件付け学習)は、動物が危険を回避し、生存するためにとても大事なことです。哺乳動物では、脳の構造のひとつである扁桃体がこの学習に重要な役割を果たしています。けれども、より原始的な魚類の脳で恐怖条件付け学習に重要な神経回路はわかっていませんでした。
総合研究大学院大学院生(当時)のPradeep Lal博士と情報・システム研究機構 国立遺伝学研究所 川上浩一教授らの研究グループは、モデル生物のゼブラフィッシュにおいて特定の脳神経細胞を可視化したり、操作したりする技術の開発に成功してきました。今回、これらの技術を駆使して、終脳(4)のDmとよばれる領域の特定の神経細胞が恐怖条件付け学習に重要であることを突き止めました。すなわち、この神経細胞が哺乳動物の扁桃体と同じ役割を果たしているのです。
本成果は、恐怖条件付け学習に必須な脳神経回路の構造や進化を明らかにしていく手掛かりになります。また恐怖や不安が関わる疾病やPTSDなどの原因解明や治療の基盤になることが期待されます。
本研究は、情報・システム研究機構国立遺伝学研究所 川上浩一教授と総合研究大学院(総研大)大学院生(当時)のPradeep Lal博士らの研究グループによっておこなわれました。
本研究は文部科学省科学研究補助金JP15H02370とJP16H01651の支援を受けておこなわれました。
本研究成果は、英国電子ジャーナルBMC Biologyに平成30年4月25日午前2時(グリニッジ標準時)に掲載されました。
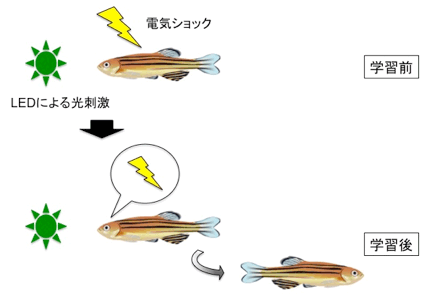
図:ゼブラフィッシュの恐怖条件付け学習に重要な神経回路を発見
ゼブラフィッシュの恐怖条件付け学習。ゼブラフィッシュが2つの区画をもつプラスチックボックス中にはいっている。 LED点灯後10秒に電気ショックを与える(1日目)。これを1日10回行い、5日間連続して繰り返した。5日目には、 LEDが点灯するとゼブラフィッシュは別の区画に逃亡する。
恐怖条件付けに不可欠な神経細胞の3D画像。透明なゼブラフィッシュ脳を作製し、ライトシート顕微鏡による解析を行った。
※EurekAlert!で本成果を紹介した記事を配信しています
NGS解析プラットフォーム「Maser」の開発
Maser: one-stop platform for NGS big data from analysis to visualization
Sonoko Kinjo, Norikazu Monma, Sadahiko Misu, Norikazu Kitamura, Junichi Imoto, Kazutoshi Yoshitake, Takashi Gojobori, Kazuho Ikeo
Database (2018) Vol. 2018: article ID bay027; DOI:10.1093/database/bay027
情報・システム研究機構国立遺伝学研究所 遺伝情報分析研究室 池尾一穂准教授、金城その子研究員、北村徳一研究員、井元順一研究員らは、次世代シークエンサーからの膨大なデータを分析するためのデータ解析プラットフォーム、Maser(Management and Analysis System for Enormous Reads)およびゲノムブラウザ、GE (Genome Explorer)を紹介する論文を雑誌DATABASEに出版しました。
Maserは、グラフィカル表示を改善し、複数の解析ツールを組合せた分析パイプラインを提供することにより、特に解析に不慣れな初心者にとって使いやすい分析プラットフォームを実現しました。Maserの機能に関する詳細は下記のURLをご覧下さい。
Maserは現在、国立研究開発法人 日本医療研究開発機構の資金提供を受けて運営しています。
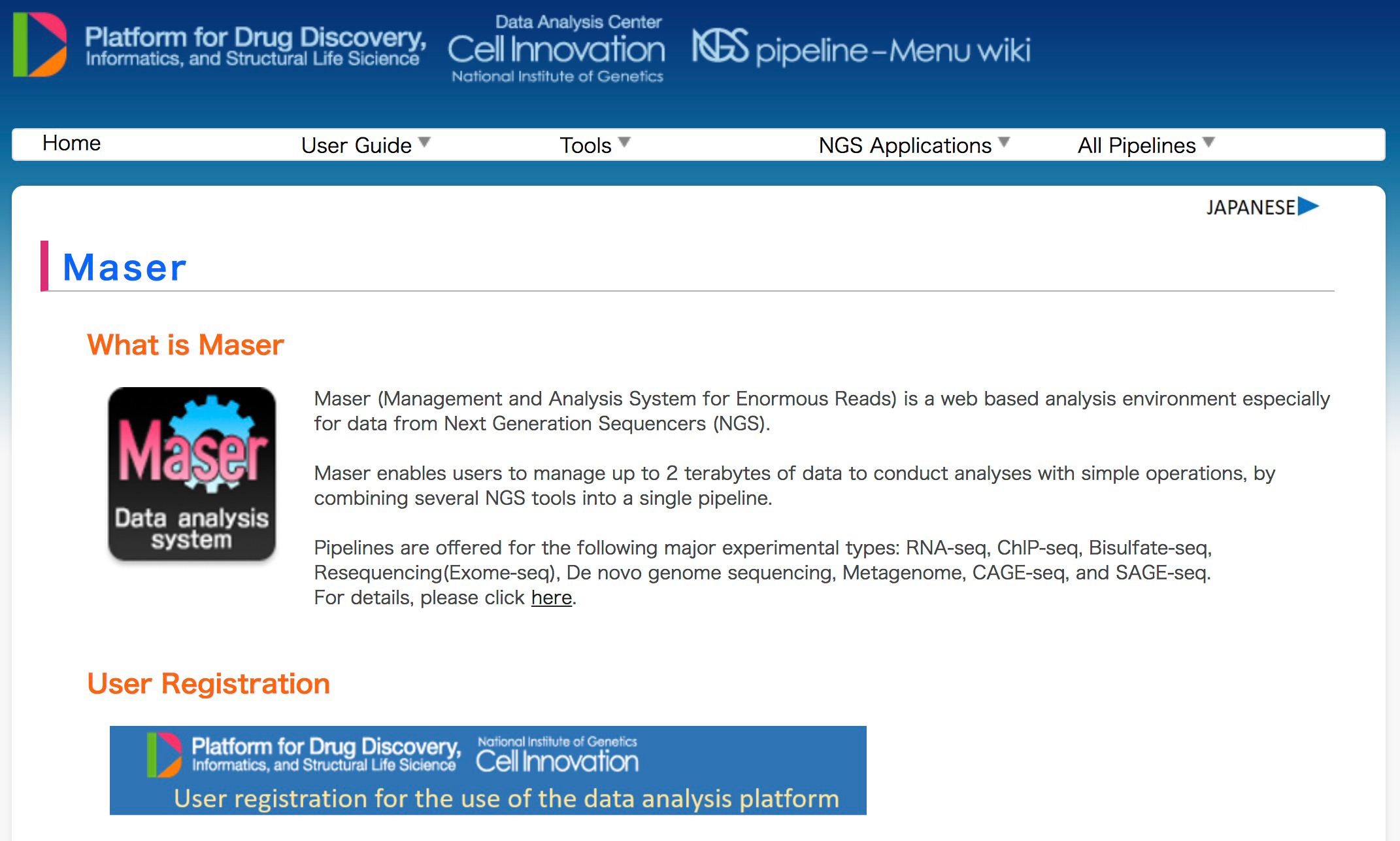
図1:Maserの機能説明およびユーザー登録サイト
図2:Maserのトップページ(ユーザーのみアクセス可能)
















