Archive
- Home
- 2026/3
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
トミヨ隠蔽種間における生態的分化とその遺伝基盤の一端を解明
Ishikawa, A., Takeuchi, N., Kusakabe, M., Kume, M., Mori, S., Takahashi, H., and Kitano, J.
Journal of Evolutionary Biology, 2013 Jul;26(7):1417-1430. DOI: 10.1111/jeb.12146
トゲウオ科魚類は、生息場所によって外見や行動が種間や集団間で大きく異なっていることから、現在、このトゲウオの持つ「多様性」が大きく注目されており、生態学や進化生物学の最前線のモデル生物として世界中で活発に研究されています。今回、生態遺伝学研究室の石川麻乃研究員(学術振興会)や北野潤特任准教授らの研究グループは、北海道東部に生息するトミヨ隠蔽種(外見が似ていて容易に区分できない種)について、隠蔽種間の生殖的隔離、生態的分化、生理的分化等について体系的に解析を行いました。
エゾトミヨ、淡水トミヨ、汽水トミヨの隠蔽3種は遺伝的に明らかに異なっており、同所生息域でも淡水トミヨと汽水トミヨ間の雑種のみがごく稀に採集される程度でした。これら3種は河川の上流から下流にかけて生息域をうまく住み分けて共存しており、摂餌器官や浸透圧耐性能も大きく異ななっていました。一方で、鱗板(体の側面の骨化組織)の変異は、単純な上流-下流勾配にそった変異はみられず、また、その遺伝基盤は近縁のイトヨ属とは異なる遺伝子で決定されていることが明らかになりました。イトヨ属では、Eda遺伝子が鱗板をコントロールしていることが既に知られていますが、トミヨ属ではEda遺伝型と鱗板表現型に相関は見られませんでした。
これらの成果は、トミヨ属とイトヨ属の表現型進化の遺伝基盤が異なっていることを示しており、トミヨ属は、表現型進化の遺伝基盤の一般性を理解するためにイトヨと並び貴重な研究材料となることが示されました。
この研究は、新学術領域「ゲノム遺伝子相関」、JSTさきがけ、国立遺伝学研究所共同利用、日本学術振興会等の助成のもと行われました。

これら三種のトミヨは外見が似ていますが別種であり、うまく生息場所を住み分けて共存していることが分かりました。
脱分化と分化を制御する転写因子
Takafusa Hikichi, Ryo Matoba, Takashi Ikeda, Akira Watanabe, Takuya Yamamoto, Satoko Yoshitake, Miwa Tamura-Nakano, Takayuki Kimura, Masayoshi Kamon, Mari Shimura, Koichi Kawakami, Akihiko Okuda, Hitoshi Okochi, Takafumi Inoue, Atsushi Suzuki, and Shinji Masui
PNAS, 2013 Apr 16;110(16):6412-6417. DOI: 10.1073/pnas.1220200110
分化した細胞を転写因子Oct3/4、Sox2、Klf4、Myc(OSKM)の導入により脱分化させ、iPS化することはできるが、その効率は決して良いものではない。我々はこれが脱分化を阻害する転写因子の発現によるものと考え、ES細胞から分化した神経前駆細胞株において発現している転写因子遺伝子群の中から、ひとつひとつの遺伝子を過剰発現させることにより、iPS化の効率を減少させる少数の転写因子セットを同定した。これらはいずれも発生制御関連転写因子であり、それらをマウス胎児繊維芽細胞や肝芽細胞に導入したところ、直接神経前駆細胞の遺伝子発現プロファイルを誘導することがわかった。このように、本研究により、細胞の分化・脱分化状態が少数の転写因子の発現により制御されており、それらが発現誘導する遺伝子ネットワークのせめぎあいによって細胞の状態が決定していることが明らかとなった。
本研究成果は、京都大学iPS細胞研究所(CiRA)升井伸治博士との共同研究によるものである。
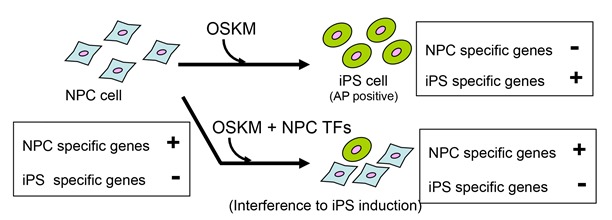
神経前駆細胞(NPC)は、OSKMの導入により脱分化しiPS細胞となる。この脱分化は、NPC特異的転写因子の発現により阻害された。
植物遺伝研究室の久保貴彦助教が第123回日本育種学会講演会・総会において日本育種学会奨励賞を受賞
 系統生物研究センター 植物遺伝研究室の久保貴彦助教が日本育種学会 日本育種学会第123回講演会および第63回総会において日本育種学会奨励賞を受賞しました。
系統生物研究センター 植物遺伝研究室の久保貴彦助教が日本育種学会 日本育種学会第123回講演会および第63回総会において日本育種学会奨励賞を受賞しました。- 表彰式日時:平成25年3月27日(水) 日本育種学会第123回講演会・第63回総会
- 表彰式場所:東京農業大学世田谷キャンパス
- 受賞題目:栽培イネにおける生殖的隔離遺伝子群の遺伝的解析
日本育種学会サイト http://www.nacos.com/jsb/index.html
植物遺伝研究室 倉田研究室
中心体生物学研究室の北川大樹特任准教授が平成25年度文部科学大臣表彰 若手科学者賞を受賞
 中心体生物学研究室の北川大樹特任准教授が平成25年度文部科学大臣表彰 若手科学者賞を受賞しました。
中心体生物学研究室の北川大樹特任准教授が平成25年度文部科学大臣表彰 若手科学者賞を受賞しました。本賞は、萌芽的な研究、独創的視点に立った研究等、高度な研究開発能力を示す顕著な研究業績をあげた40歳未満の若手研究者に授与されるものです。
 授賞式日時: 平成25年4月16日(火)
授賞式日時: 平成25年4月16日(火) 授賞式場所: 文部科学省3階 講堂
授賞式場所: 文部科学省3階 講堂 受賞名: 平成25年度文部科学大臣表彰 若手科学者賞
受賞名: 平成25年度文部科学大臣表彰 若手科学者賞 受賞テーマ: 中心小体複製の分子機構の研究
受賞テーマ: 中心小体複製の分子機構の研究
平成25年度科学技術分野の文部科学大臣表彰受賞者等の決定について
遺伝子の爆発的増加は「輪転がし」で
Satoru Ide, Kimiko Saka, and Takehiko Kobayashi
PLOS Genetics, 2013 Apr;9(4):e1003410. DOI: 10.1371/journal.pgen.1003410
細胞にはたくさんの種類の遺伝子があり、通常その数は生涯を通じて変化しませんが、時として爆発的に増加(遺伝子増幅)することが知られています。例えばカエルの卵が出来るときリボソームRNA遺伝子というリボソームを作る遺伝子が数万〜数十万コピーに増加します。また進化においては、現在ファミリー遺伝子やクラスター遺伝子として存在する相同性の高い反復遺伝子群は、かつて1つの遺伝子からの大規模な遺伝子増幅により発生したと考えられています。以前よりこの爆発的な遺伝子増幅はローリングサークル(輪転がし)型DNA複製と呼ばれる環状DNAを鋳型にした複製の連続反応によると考えられていましたが、そのメカニズムについては判っていませんでした。今回我々はその誘導にはRTT109 というクロマチン構造の変化に関わる遺伝子が重要な役割をはたしていることを発見しました。
RTT109 遺伝子はヒストンをアセチル化修飾しクロマチン構造を変化させる働きがあります。この遺伝子の発現が低下すると、リボソームRNA遺伝子が突如としてローリングサークル型DNA複製を開始し、コピー数が450コピー以上に増加しました。その分子機構としては、RTT109 がなくなるとDNAにできた傷を修復する過程に変化が生じ、本来起こらないローリングサークル型DNA複製中間体が形成され、輪っか状の鋳型がコロコロ転がりながら複製されてコピー数が増加します(図参照)。
生物はこのヒストン修飾を利用した遺伝子増幅スイッチのON/OFFにより、時に遺伝子数を爆発的に増やして、環境変化への適応や発生、分化の制御を行っていると考えられます。
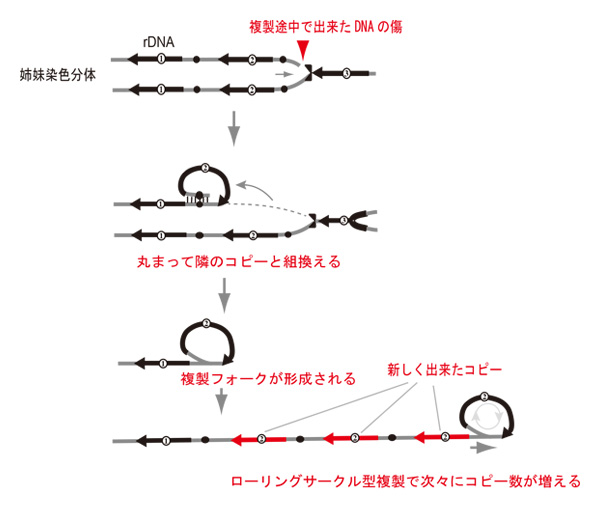
複製の途中でできた傷はリボソームRNA 遺伝子のような反復遺伝子では丸まって隣のコピーと組換えて修復されることがあります。通常は輪っかが生成され修復が終了し元に戻されますが、RTT109 遺伝子の機能が低下すると組換えが 解消されずそのまま複製フォークとなり「輪転がし」の要領でコピー数がどんどん増加していきます。
原核生物遺伝研究室の研究員、中井亮佑さんが受賞

南極湖底に広がる「コケ坊主」の共在生物相の網羅的解析
染色体工学の新たな幕開け!高等動物のセントロメア作製に成功
![]()
Chromosome engineering allows the efficient isolation of vertebrate neocentromeres
Wei-Hao Shang, Tetsuya Hori, Nuno M.C. Martins, Atsushi Toyoda, Sadahiko Misu, Norikazu Monma, Ichiro Hiratani, Kazuhiro Maeshima, Kazuho Ikeo, Asao Fujiyama, Hiroshi Kimura, William C. Earnshaw, and Tatsuo FukagawaDevelopmental Cell, 24(6), 635-648, 14 March 2013. DOI: doi:10.1016/j.devcel.2013.02.009
生物学の教科書を書き換えるような根本的な発見が、染色体研究の分野で起こっています。長い間謎に包まれていた染色体のセントロメア ──その正体を明らかにしてきた国立遺伝学研究所の深川竜郎教授らのグループは、今回、セントロメアを人工的に作成する画期的な染色体改変技術を考案しました。 分子生物学の基本的な技術として、医学や農学などの分野で今後大いに活用されると期待されます。
生命の設計図である遺伝子は、細胞分裂のたびに新たな細胞にきちんと受け継がれていきます。遺伝子を安全に次世代に「運ぶ」ことは、細胞の大切な仕事であり、細胞にはそのための精巧な仕組みが備わっています。 その1つが、遺伝子を積み込む「乗り物」としての染色体と、染色体の中央部で、染色体の「運転手」としての役割を果たすセントロメアです。
ヒトの病気の研究から、運転手であるセントロメアが何らかの理由で働けなくなったときに、「控えの運転手」(ネオセントロメア)が現れるという珍しい現象が知られていました。そこで深川教授らは、ネオセントロメアを自在に作成する技術を開発し、それが染色体のどこに現れ、どのような性質を持つかを調べました。 その結果、ネオセントロメアは、CENP-A(センプA)というヒストンタンパク質が含まれる染色体上の位置に作られること、今回作成したネオセントロメアが本来のセントロメアと遜色ない働きを果たすことがわかってきました。
今回の研究では、染色体が運ばれる機構(染色体分配)の基本的な仕組みが明らかになったことに加えて、染色体を改変する新しい技術をも考案しています。 すなわち、既存のセントロメアを壊し、染色体の任意の位置に新しいセントロメアを作る技術です。今回は、ニワトリの培養細胞を実験に用いていますが、この原理は他の高等動物にも応用でき、 例えば遺伝子デリバリーシステムなどに使用可能なヒト人工染色体の開発に利用されていくことでしょう。
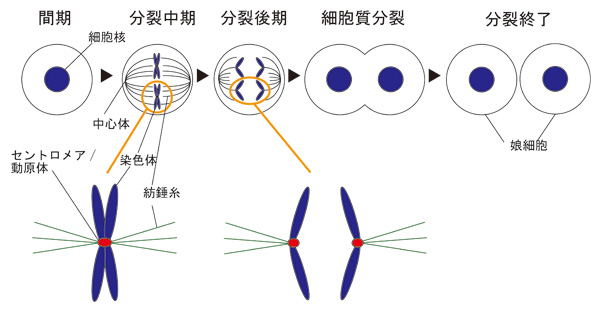
細胞分裂と染色体のセントロメア
細胞分裂の分裂期には、染色体の中央部分にあるセントロメアに向かって線維(紡錘糸)が伸びてきて、染色体は両極に運ばれ、その結果、染色体の均等な分配が達成されます。 この仕組みが障害されると、がんなどの病気が引き起こされます。セントロメア上で紡錘体と結合する構造体は、動原体ともよぶ。
神経軸索投射が、感覚器官の細胞増殖に必要
Hironori Wada, Christine Dambly-Chaudiere, Koichi Kawakami, and Alain Ghysen
PNAS, 2013 Apr 2;110(14):5659-5664. DOI: 10.1073/pnas.1214004110
感覚器官には必ず感覚神経軸索が分布し、外界からの情報を脳に伝えています。感覚器官からはさまざまな因子が分泌され、神経軸索を増殖・誘引することが知られていますが、神経軸索の働きについてはよくわかっていません。我々は、ゼブラフィッシュの側線器官(感丘)の細胞増殖が、神経軸索によって制御されることを示しました。
ゼブラフィッシュの側線器官(感丘)では、出芽によって新たな器官を形成し、クラスターを形成します。出芽して増殖する感丘において「Wntシグナル」が細胞増殖を制御しています。Wntシグナル活性が高い増殖細胞は、分岐した神経軸索が隣接して存在します(図A,矢頭)。感覚神経細胞をレーザー照射装置により除去すると、感丘は出芽するにもかかわらず、細胞増殖が起きないことを示しました(図B)。さらに、神経軸索が、Wnt活性を亢進することを示しました。つまり、神経軸索はWntシグナルを亢進することによって、感丘の細胞増殖を制御していることが分かりました。神経軸索と感覚器官には密接な相互作用があることを示しています。
本研究は、モンペリエ大学、アラン・ギーセン博士との共同研究であり、科学技術振興機構さきがけの助成のもと行われました。
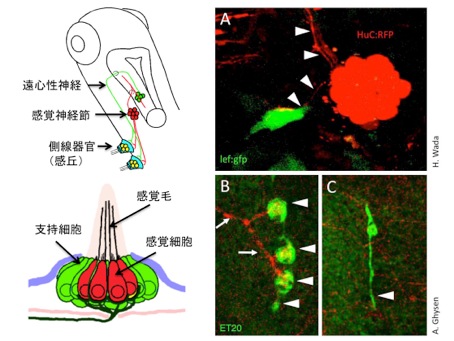
(A) ゼブラフィッシュ側線器官において、出芽する増殖細胞はWntシグナル活性が高い(緑)。また、増殖細胞は、神経軸索(矢頭)によって投射を受ける。
(B, C)神経軸索を除去すると、側線器官は出芽するにもかかわらず、細胞増殖が起きなくなる。
インターシップ(NIGINTERN)留学生が日本の淡水イトヨの起源を確認
Cassidy, L. M., Ravinet, M., Mori, S., and Kitano, J.
Evolutionary Ecology Research, 15: 295-311 (2013).
昨年度のNIGINTERN制度にて、国立遺伝学研究所の北野研究室において数ヶ月間滞在して研究を行いました Lara M. Cassidyさんの研究成果が、米科学誌Evolutionary Ecology Researchに出版されました。
トゲウオ科魚類のイトヨは、淡水侵出によって適応放散し多様性を獲得したことが知られています。昔のアロザイムを用いた系統研究などによって、日本の淡水イトヨは、日本海ではなく、太平洋のイトヨが淡水域に侵出したことで進化したと考えられていました。今回は、マイクロサテライトという、さらに感度の良い手法を用いてその成果を確認したものであり、米科学誌Evolutionary Ecology Research に出版されました。今後の生態遺伝学研究室では「なぜ日本海イトヨは淡水に侵出できなかったのか」という問いに遺伝的手法で迫ることを目指しており、その基盤情報となる貴重な成果です。
Cassidyさんは、NIGINTERN制度を利用して数ヶ月間遺伝研に滞在してこの実験を行い、アイルランドに帰国後も、我々とメール会議を通してデータの共同解析や論文の共同執筆を行い、このたび、その成果が米科学誌に出版されました。
本成果は岐阜経済大学との共同研究であり、環境省、文部科学省、科学技術振興機構、国立遺伝学研究所共同利用の助成のもとで行われました。
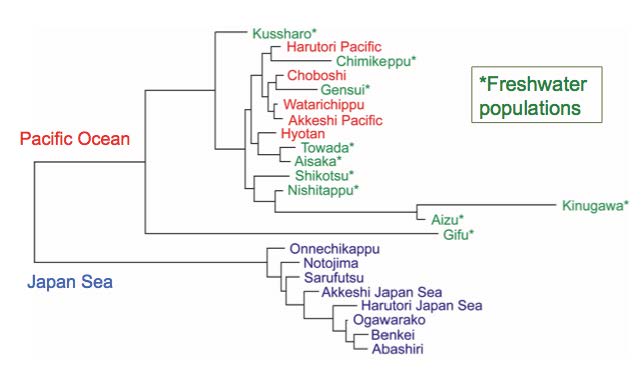
日本産イトヨのマイクロサテライト系統図
淡水集団(緑)は全て太平洋系統(赤)由来で、日本海由来(青)の淡水集団は見つかっていない。
世界初!無菌化ノリのゲノム情報解読に成功
![]()
The First Symbiont-Free Genome Sequence of Marine Red Alga, Susabi-nori (Pyropia yezoensis)
Yoji Nakamura, Naobumi Sasaki, Masahiro Kobayashi, Nobuhiko Ojima, Motoshige Yasuike, Yuya Shigenobu, Masataka Satomi, Yoshiya Fukuma, Koji Shiwaku, Atsumi Tsujimoto, Takanori Kobayashi, Ichiro Nakayama, Fuminari Ito, Kazuhiro Nakajima, Motohiko Sano, Tokio Wada, Satoru Kuhara, Kiyoshi Inouye, Takashi Gojobori, and Kazuho IkeoPLOS ONE, 2013;8(3):e57122. DOI: 10.1371/journal.pone.0057122
私たちの目に見える世界は、網膜に映った後さらに脳へとその情報が伝えられます。視覚を司る脳の領域では、視野全体に対応するように神経細胞が並んでおり、これは「視覚地図」と呼ばれます。このような脳の構築様式はヒトや魚など視覚を持つ全ての動物に共通する特徴です。しかしながら、視野全体が脳の視野地図へと写されている様子を、神経活動としてリアルタイムに自然な条件下で捉えた例はこれまでありませんでした。私たちは、改良を加えて非常に高感度にしたカルシウムセンサーGCaMPを用いることにより、ゼブラフィッシュ稚魚の餌となるゾウリムシが、稚魚の視界の中で泳ぎ回るときの視覚地図上の神経活動を画像可視化することに成功しました。今回の研究は、視覚から入る情報に基づいて動物が行動するとき、脳内の認知プロセスでどのような神経活動が生じているのかを明らかにしていくための端緒になります。
本研究成果は、埼玉大学中井淳一教授らのグループと遺伝学研究所川上浩一教授らのグループとの共同研究によるものです。
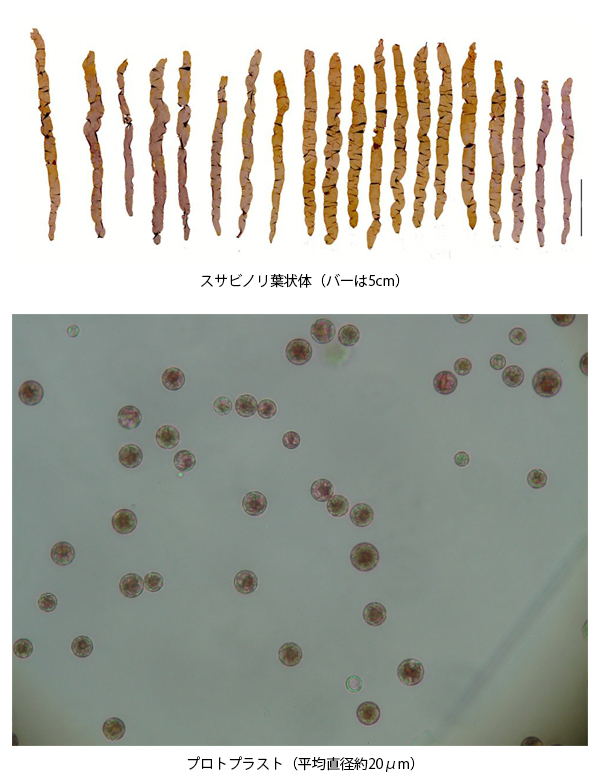
スサビノリ葉状体(バーは5cm)
プロトプラスト(平均直径約20μm)
脳に写される視覚世界をカルシウムセンサーGCaMPでリアルタイム可視化
![]()
Real-Time Visualization of Neuronal Activity during Perception
Akira Muto, Masamichi Ohkura, Gembu Abe, Junichi Nakai and Koichi Kawakami Current Biology, 23(4), Feb 18, 2013. DOI: 10.1016/j.cub.2012.12.040私たちの目に見える世界は、網膜に映った後さらに脳へとその情報が伝えられます。視覚を司る脳の領域では、視野全体に対応するように神経細胞が並んでおり、これは「視覚地図」と呼ばれます。このような脳の構築様式はヒトや魚など視覚を持つ全ての動物に共通する特徴です。しかしながら、視野全体が脳の視野地図へと写されている様子を、神経活動としてリアルタイムに自然な条件下で捉えた例はこれまでありませんでした。私たちは、改良を加えて非常に高感度にしたカルシウムセンサーGCaMPを用いることにより、ゼブラフィッシュ稚魚の餌となるゾウリムシが、稚魚の視界の中で泳ぎ回るときの視覚地図上の神経活動を画像可視化することに成功しました。今回の研究は、視覚から入る情報に基づいて動物が行動するとき、脳内の認知プロセスでどのような神経活動が生じているのかを明らかにしていくための端緒になります。
本研究成果は、埼玉大学中井淳一教授らのグループと遺伝学研究所川上浩一教授らのグループとの共同研究によるものです。
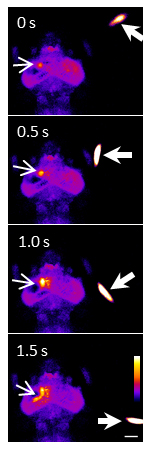
ゼブラフィッシュ稚魚の周囲を餌であるゾウリムシ(太矢印)が泳ぎまわると、その動きは眼球の網膜上に投影され、さらに視神経の興奮を経て脳内に伝達され、脳(中脳視蓋)の神経細胞を興奮させます。その様子が、カルシウム蛍光指示薬GCaMPを用いたイメージングによりリアルタイムで蛍光シグナルとして観察されました。スケールバーは100ミクロン。
▶本技術は以下の研究成果の基盤の一つになっています。 仮想現実世界を「遊泳する」ゼブラフィッシュ 満腹と空腹が食欲をコントロールするメカニズム 魚で見つかったレム睡眠とノンレム睡眠 ゼブラフィッシュ研究からわかった「てんかん発作」の新しい仕組み ―てんかん発作へのグリア細胞ネットワークの関与― 見たらつい食べたくなるのは本能だった~視覚情報を摂食行動に結びつける神経回路の発見~
バクテリアの形を決める仕組み:全ゲノムシークエンスによる解析
大腸菌は通常は桿菌(かんきん)と呼ばれる形態をしています(図A左)。このような形態を作るためには、細胞壁、特にペプチドグリカンという堅い構造が正しく合成されなければなりません。抗生物質には、この合成を阻害し、バクテリアを殺すものがあります。しかし、これに対して抵抗性を示すバクテリアが近年増加しており、そのためもペプチドグリカンの合成をもっと理解する必要があります。
私たちは大腸菌の桿菌形態の維持に必要なRodZタンパク質を発見し、これまでその機能を研究してきました。rodZ遺伝子を破壊した株は生きられるものの生育が遅くなります。また、その形態は球形になってしまいます(図A中央)。私たちは、生育の遅いこのrodZ欠損株から、元の生育に回復した株を29株単離しました。これらは、生育が回復しただけではなく、形態も元の桿菌に戻っていました(図A右)。rodZ遺伝子は完全に破壊されているので、その機能を補うような突然変異が二次的に自然に起こったものと考えられます。これは、抑圧変異とよばれ、rodZ遺伝子の機能と関連する遺伝子を知る手がかりとなります。そこで、次世代シークエンサーを用いて、これら抑制変異株すべての全ゲノムの配列を解読しました。その結果、簡単に29株の抑制変異部位を決定することができました。
抑制変異は、<i”>mreB遺伝子、mrdA遺伝子、mrdB遺伝子にありました。これらはバクテリアの伸長に必要な遺伝子です。特に、抑圧変異株のうち20株はmreB遺伝子に変異が起っていました。さらに、それら突然変異はMreBタンパク質の一つの領域に集中していました(図B)。これら変異により、MreBタンパク質は性質を変え、RodZタンパク質がなくても、大腸菌は伸長できるようになったのでしょう。また、mrdA遺伝子、mrdB遺伝子の変異によってもMreBタンパク質の性質が変えられていることが分かりました。通常では、RodZはこれら遺伝子産物、とくにMreBタンパク質に働きかけ、大腸菌の形態を正しく保つように指令を伝えているものと思われます。
本研究は、遺伝学研究所の比較ゲノム解析研究室、生物遺伝資源情報研究室(現、先端ゲノミクス推進センター)による最新のゲノム解読の支援を受け、共同研究として行われました。
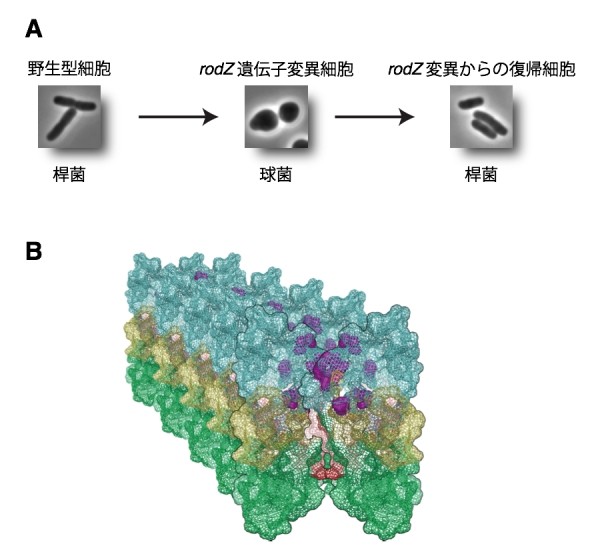
(A) 野生型の大腸菌は桿菌(左)、rodZ遺伝子変異株は球菌(中央)になります。rodZ変異からの復帰株は、元の桿菌に戻りました(右)。 (B) MreBタンパク質に見出された変異(紫色のボールでで示した)は、MreBフィラメント間の領域に見出されました。これらの変異により、MreBフィラメントの特性を変化させていると考えられます。
動原体の形成基盤となるCENP-T構造の解明
動原体(キネトコア)は、紡錘体微小管と結合する染色体上の重要構造体である。動原体タンパク質であるNdc80複合体は、微小管と直接結合することが知られている。しかしながら、このNdc80複合体が他の動原体タンパク質とどのように結合しているのかについては、不明な点も多い。本研究では、高解像度の構造解析によって、CENP-TのN末端側が、Ndc80複合体を構成するSpc24/25部分と直接に結合していることを明らかにした。特に、この結合はCENP-TのCDK(サイクリン依存的カイネース)によるリン酸化に依存しておこることも明らかになった。また、構造解析によって、リン酸化されたCENP-Tの72番目のT残基(T72)が直接にSpc24/25と結合するのではなく、リン酸化されたT72が近傍のリジン残基(R74)と水素結合をつくり、CENP-Tのαヘリックス構造とSpc24/25との安定な疎水結合を保証しているという分子基盤が明らかになった。さらに、生化学的な解析によって、CENP-TはNdc80複合体と結合するMis12複合体とは排他的に、Ndc80複合体と結合することも明らかになった。今回の研究により、動原体の分子構成の実体の理解が深まった。
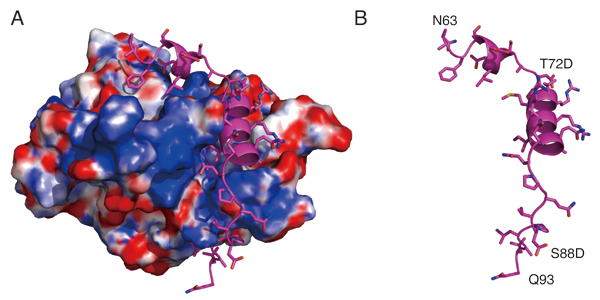
(A)Spc24/25複合体に結合したCENP-T構造(シアン) (B)Aの図からCENP-Tのみ取り出した構造リボン図
細胞遺伝研究部門の小林武彦教授が第29回井上学術賞を受賞
 細胞遺伝研究部門の小林武彦教授が第29回井上学術賞を受賞しました。
細胞遺伝研究部門の小林武彦教授が第29回井上学術賞を受賞しました。本賞は自然科学の基礎的研究で特に顕著な業績を挙げた50歳未満の研究者に対して与えられる賞です。過去に当研究所の石浜明元教授、堀田凱樹元所長、荒木弘之教授、2007年にはiPS細胞の山中伸弥教授が受賞しています。
 受賞題目
受賞題目遺伝子増幅の分子機構の全容解明と癌化や老化との関係性の発見
小林教授は、高度に反復したリボソームRNA遺伝子(rDNA)が如何にコピー数を安定に維持しているのか、単離した多数の変異株を用いて詳細に解 析し、rDNA遺伝子増幅の分子機構の全容を解明しました。またリボソームRNA遺伝子の安定性やコピー数の変化が、細胞の老化速度や発ガン物質に対する 感受性に影響を与えることを発見し「細胞老化のrDNA 仮説」を提唱するに至っています。
遺伝子のコピー数の変化は一卵性双生児間でも多数起こっていることが近年のゲノム解析から明らかになってきています。今後、医学領域においても遺伝子増幅と老化・発ガンとの関係が解明されることが期待され、小林教授の発見はきわめて重要です。
井上科学振興財団
マウス生殖細胞の雄性分化誘導因子を同定
哺乳類において精巣を作るか卵巣を作るかという性の決定機構は比較的よく理解されています。Y染色体にのっているSRY遺伝子が発現すると精巣が、発現しないと卵巣ができます。また生殖細胞が精子になるか卵子になるかという決定は、生殖細胞の前駆体である始原生殖細胞が精巣に入るかあるいは卵巣に入るかによって決まります。しかし、実際に生殖細胞の性分化誘導機構は理解されていませんでした。今回総研大(D5)の呉泉君が雄性生殖細胞の誘導因子を同定しました。彼はNodalシグナル系が雄性生殖細胞特異的に活性化していることを見いだし、特異的な阻害剤及びNodalシグナル系の条件付きノックアウトマウスを用いた解析を行いました。その結果、体細胞から分泌されるFGF9により生殖細胞でNodalが活性化し、その下流で雄性特異的遺伝子Nanos2が誘導されることを明らかにしました。またこの時同時に、FGFシグナルは体細胞にも機能し、主にActivinの活性化を介して体細胞の雌化を抑制することも示しました。
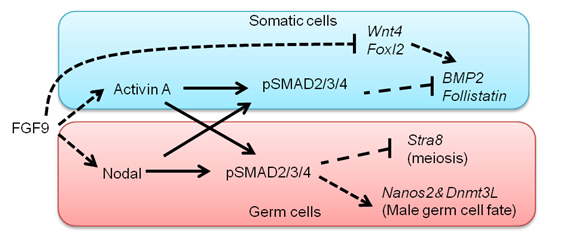
雄の性分化にTGFbシグナルであるNodal/Activinが重要な機能を果たす。FGF9の下流で体細胞ではActivinが誘導され雌化因子(BMP2、Follistain)を抑制し、体細胞の雌化を抑制する。一方、生殖細胞で特異的に活性化するnodalシグナルは生殖細胞が雌化することを抑制し、雄化遺伝子(Nanos2, Dnmt3L)の発現を誘導する。















