Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
ヒストンアセチル化による細胞運命維持機構
細胞運命の維持は、発生及び生物の恒常性に不可欠であり、その異常は必要な細胞の欠損や癌化を引き起こすと考えられる。以前に私達はC. elegansを用いヒストンのアセチル化が細胞運命の維持に関与する事を示している。運命維持には、MYSTファミリーヒストンアセチル化酵素MYS-1, MYS-2とアセチル化ヒストン結合蛋白質BET-1が必要だが、詳細な分子機構は不明であった。
BET-1の酵母相同分子BDF1はクロマチンリモデリング因子SWR1と複合体を形成し、ヒストンH2AバリアントHTZ1/H2A.zのゲノム上の配置を制御する事が知られている。私達はC. elegansにおいて、BET−1に加え、SSL-1/SWR1とHTZ-1/H2A.zが運命維持に必要である事を明らかにした。これらの因子は生殖巣の体細胞で細胞運命を維持する事で、生殖幹細胞のニッチ細胞であるDTCの過剰形成を抑制する。私達はDTCの誘導に必要な転写因子をコードするceh-22がHTZ-1の直接の標的遺伝子であり、BET-1, MYS-1, HTZ-1がその転写を抑制している事を示した。ヒストンアセチル化は転写の活性化に関与する事が広く知られているが、この結果はヒストンアセチル化が転写抑制も行う事を示唆している。
また、細胞運命の維持にはH3K27のメチル化が関与する事が以前から知られていた。私たちは、ceh-22遺伝子へのHTZ-1の局在はH3K27脱メチル化酵素UTX-1の阻害で減少すること、HTZ-1とH3K27メチル化のゲノム上の局在には負の相関があることを示し、HTZ-1はUTX-1によってメチル化が除かれた場合に、転写抑制を行うことで細胞運命を維持している事を示唆した。H3K27のメチル化による安定した転写抑制と異なり、BET-1やHTZ-1は、分化を促すシグナルによって転写が簡単に誘導されるような遺伝子の、シグナルに依存しない転写を抑制していると考えられる。
この研究は関西学院大学・柴田博士、西脇博士との共同研究として行なわれました。
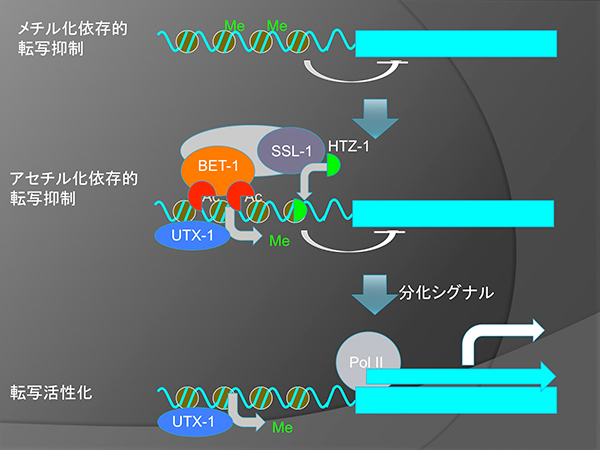
転写活性化の二段階モデル。H3K27のメチル化による安定な転写抑制がUTX-1によって解除されると、遺伝子は転写活性化可能となるが、分化シグナルを受けない場合は、BET-1とHTZ-1によって抑制されている。
生態遺伝学研究室の研究員、吉田恒太さんが受賞
 |
| 受賞を聞いて喜ぶ吉田研究員(左)と 北野特任准教授(右) |
第85回日本遺伝学会
人類遺伝研究部門の細道一善助教が日本人類遺伝学会 第58回大会にて大会最優秀ポスター賞を受賞
 人類遺伝研究部門の細道一善助教が2013年11月20日から23日まで江陽グランドホテル(宮城県仙台市)で行われた日本人類遺伝学会第58回大会において大会最優秀ポスター賞を受賞しました。
人類遺伝研究部門の細道一善助教が2013年11月20日から23日まで江陽グランドホテル(宮城県仙台市)で行われた日本人類遺伝学会第58回大会において大会最優秀ポスター賞を受賞しました。
表彰式日時: 平成25年11月22日(金) 日本人類遺伝学会 第58回大会
受賞題目: 「Phase-definedシーケンシングによるHLA遺伝子配列完全決定とパイプライン」
日本人類遺伝学会 第58回大会
セントロメア内のクロマチン構造
分子遺伝研究部門・深川研究室
The centromeric nucleosome-like CENP–T–W–S–X complex induces positive supercoils into DNA
Kozo Takeuchi, Tatsuya Nishino, Kouta Mayanagi, Naoki Horikoshi,, Akihisa Osakabe, Hiroaki Tachiwana, Tetsuya Hori, Hitoshi Kurumizaka and Tatsuo Fukagawa
Nucleic Acids Research, (2013), doi:10.1093/nar/gkt1124
染色体の分配に必須なセントロメア領域は、DNA配列によってその場所が規定されるのではなく、エピジェネティックな情報により規定されると考えられています。セントロメアに特異的なヒストンバリアントであるCENP-Aは、その中心的な役割を果たすと考えられていますが、分子遺伝研究部門では、CENP-T-W-S-Xという新規の複合体もセントロメア形成に重要な働きを担うことを報告しています (Nishino et al., Cell, 2012)。今回、大学院生および特任研究員として分子遺伝研究部門に所属していた竹内康造らは、CENP-T-W-S-XがDNAに正の超らせんを導入することを発見しました。通常のヌクレオソームを構成するヒストン8量体は、DNAへ負の超らせんを導入することが知られているので、CENP-T-W-S-XがDNAに結合する際に導入されるユニークな構造的な性質は、セントロメアに特異的なエピジェネティック情報を与えていると予想されます。竹内らは、正の超らせん構造の導入に関わるCENP-TやCENP-W内のアミノ酸部位も特定しており、今回の発見は、セントロメアのクロマチン構造の理解を前進させる重要な発見と言えます。
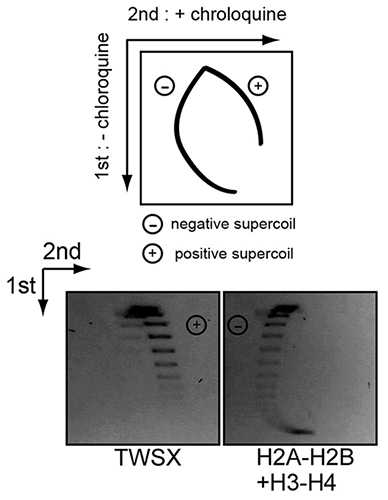
正と負の超らせんを区別する実験系(上)。負の超らせんは、クロロキンの存在下で早く流れるのでその特性をいかしている。下は、ヒストン8量体とCENP-T-W-S-Xの実験データ。CENP-T-W-S-XはDNAへ正の超らせんを導入している。
集団遺伝研究部門大学院生の神澤秀明さんが第67回日本人類学会大会にて若手会員大会発表賞を受賞
 集団遺伝研究部門斎藤研究室に所属する、総研大遺伝学専攻博士課程の大学院生、神澤秀明さんが、2013年11月1日から4日まで国立科学博物 館で行われた第67回日本人類学会大会にて、「古代日本列島人の核ゲノム解析」というタイトルで発表を行い、学生の部で若手会員大会発表賞を受賞しまし た。
集団遺伝研究部門斎藤研究室に所属する、総研大遺伝学専攻博士課程の大学院生、神澤秀明さんが、2013年11月1日から4日まで国立科学博物 館で行われた第67回日本人類学会大会にて、「古代日本列島人の核ゲノム解析」というタイトルで発表を行い、学生の部で若手会員大会発表賞を受賞しまし た。
第67回 日本人類学会大会
遺伝研公開講演会2013を11月2日(土)に開催します
遺伝研公開講演会2013を11月2日(土)に開催します
ヒトのテロメア配列を認識するポリアミド化合物の新しい合成法の開発
Development of a New Method for Synthesis of Tandem Hairpin Pyrrole–Imidazole Polyamide Probes Targeting Human Telomeres
Kawamoto, Y., Bando, T. *, Kamada, F., Li, Y., Hashiya, K., Maeshima, K. *, and Sugiyama, H. *
*co-corresponding authors
Journal of the American Chemical Society (JACS) October 1, 2013 DOI:10.1021/ja406737n
ピロール・イミダゾール(PI)ポリアミド化合物はDNAの二重らせんの副溝を通して、塩基配列を特異的に認識することができます。この方法による塩基認識は、FISHなど、DNAの二重らせんを激しい条件で解離させ、塩基対で認識させる方法に比べて温和な条件であるため、クロマチン構造を維持できる利点を持ちます。ヒトのテロメア配列を認識するPIポリアミド化合物はこれまでも存在しましたが (Maeshima et al., EMBO J. 2001)、合成するのが困難で広く使用されることはありませんでした。今回、私たちはテロメアを認識するPIポリアミド(TH59)をいくつかのパーツに分けて合成する新しい合成法を開発し、大量に合成することに成功しました。この新しい合成法を用いて蛍光色素をもつTH59を合成し、ヒトとマウス細胞のテロメア配列[(TTAGGG)n]を、テロメア構造が維持できるような温和な条件で標識させることができました。そして、蛍光強度でテロメア長を定量し、1個1個のテロメアで、shelterin複合体の構成蛋白質である TRF1の量とテロメア長に相関があることを明らかにしました。今後、簡便なテロメア長の定量法として広く用いられることが期待されます。
本研究は京都大・杉山教授グループと遺伝研・共同研究Bのサポートを得ておこなわれました。
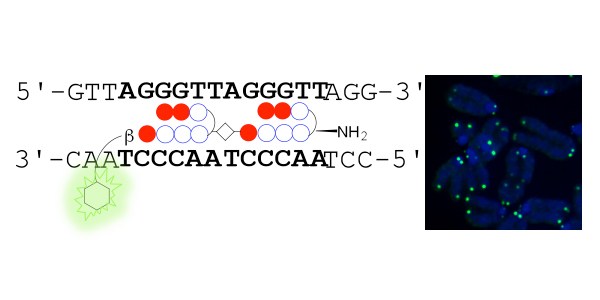
左、蛍光色素をもつPIポリアミドTH59がDNAのテロメア配列を認識する模式図 右、染色体スプレッドをPIポリアミドTH59で標識したイメージ。青色(DNA染色)の染色体末端がドット状に緑色に標識されている。
五條堀特任教授がTWASのAssociate Fellowに選出されました
 生命情報研究センター 遺伝情報分析研究室の五條堀特任教授が、TWAS(The World Academy of Science for the advancement of science in developing countries)のAssociate Fellowに選出されました。
TWASは、トリエステ(イタリア)に拠点を置き、発展途上国で持続可能な繁栄のために、科学とエンジニアリングの発展に取り組んでいる、世界的な 科学アカデミーです。発展途上国・先進国より選ばれた国際的に有名な科学者がメンバーとなり、TWAS Fellowsは発展途上国から選ばれ、TWAS Associate Fellowsは先進諸国から選ばれます。TWAS Fellows に比べてTWAS Associate Fellowsは非常に少なく、選出されることが難しいと言われています。
生命情報研究センター 遺伝情報分析研究室の五條堀特任教授が、TWAS(The World Academy of Science for the advancement of science in developing countries)のAssociate Fellowに選出されました。
TWASは、トリエステ(イタリア)に拠点を置き、発展途上国で持続可能な繁栄のために、科学とエンジニアリングの発展に取り組んでいる、世界的な 科学アカデミーです。発展途上国・先進国より選ばれた国際的に有名な科学者がメンバーとなり、TWAS Fellowsは発展途上国から選ばれ、TWAS Associate Fellowsは先進諸国から選ばれます。TWAS Fellows に比べてTWAS Associate Fellowsは非常に少なく、選出されることが難しいと言われています。
生命情報研究センター 遺伝情報分析研究室
DNAを有害な放射線から守る新しい仕組み 〜放射線の影響の理解や、がん治療への応用につながる可能性
![]()
Chromatin compaction protects genomic DNA from radiation damage
Takata, H., Hanafusa, T., Mori T., Shimura, M., Iida, Y., Ishikawa, K., Yoshikawa, K., Yoshikawa, Y., Maeshima, K.
PLOS ONE 8(10): e75622. doi:10.1371/journal.pone.0075622
放射線は生物にとって大きな脅威。放射線にさらされると細胞内のDNAが切断され、遺伝子が正しく機能しなくなったり、がん化や細胞死が引き起こされたりするからです。しかし、自然界にはもともと自然放射線が存在しています。
本研究では、生物が放射線からDNAを守る新たな仕組みを突き止めました。それは、DNAが密に集まる、ということでした。DNAは特殊な構造をした長い線維で、細胞の核の中に折りたたまれています。そうしたDNAが、密に集まって存在(凝縮)するか、散らばって存在するかが、放射線による損傷の程度に大きく影響していたのです。DNAの凝縮と放射線耐性の関係を、定量的に測定し、さらにコンピュータシミュレーションを行うことで、放射線がDNAを切断するメカニズムも詳しく明らかにすることができました。
その結果、自然界から浴びる放射線を、生物は細胞中のゲノムDNAを凝縮させることで、日々防御しようとしていることがわかりました。生物がDNAを放射線から守ろうとする新たな仕組みを明らかにした今回の研究成果は、がん治療など医療応用の面でも、重要な基礎知識を提供するものです。
生物にとって有害な放射線ですが、がん治療においては、がん細胞を死滅させるために有効に利用されています。今回の成果から、DNAの凝縮を弱める薬を使えば、放射線治療、重粒子線治療、化学療法の飛躍的な効率向上が期待できます。
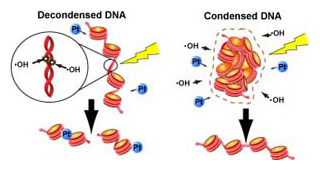
DNAが凝縮していない状態のときは、DNA(赤線)は放射線によって発生するヒドロキシルラジカル(活性酸素、・OH)や抗がん剤(青丸、Pt)による損傷を受けやすいが、凝縮しているときには、DNAはこれらから保護される。
ヒトに関する研究データ共有のためのデータベース(NBDCヒトデータベース)運用を開始
![]()
JST(理事長 中村 道治)と国立遺伝学研究所(所長 桂 勲)は、国内で初めてヒトの塩基配列や画像データなどの研究データを共有するためのデータベース(NBDCヒトデータベース)の運用を10月1日より開始します。
NBDCとDDBJは、NBDCが2013年4月に公開した「NBDCヒトデータ共有ガイドライン」に基づき、ヒトに関する研究データの提供・利用に当たって、倫理面で適切に対応がなされているかなどの点について審査を行ない、研究で得られた個人レベルの塩基配列データなどを保管し、ほかの研究者などが利用できる仕組みの構築について協力することとし、ヒトに関するさまざまな研究データを共有するNBDCヒトデータベースのサービスを開始します。NBDCヒトデータベースでは、個人レベルの塩基配列データ以外に、ヒトの画像データや疫学データなど種々の研究データを受け入れ、セキュリティ上安全な環境で保管し利用者に提供して行く予定です。
このデータベースが整備されることにより、今後は日本人のゲノム情報などが蓄積され、医学や創薬の研究を日本人に適した形で推進できるようになることが期待されます。
NBDCヒトデータベース http://humandbs.biosciencedbc.jp/
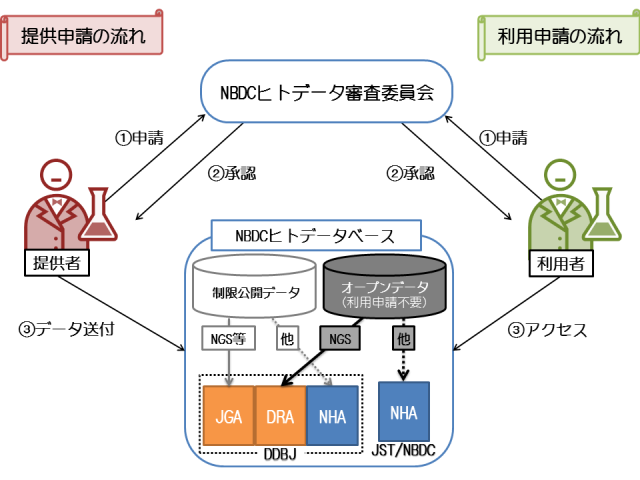
NBDCヒトデータベースへのデータ提供およびデータ利用の手続きの概要
RNAヘリカーゼによるグリシン作動性シナプス制御と行動制御
運動神経回路研究室(平田研究室)
J. Neurosci. 33: 14638-14644 (2013). doi: 10.1523/JNEUROSCI.1157-13.2013
RNAヘリカーゼと言えば、からまったRNA鎖をときほぐすための酵素と思われがちです。しかし実際のRNAヘリカーゼの機能はRNA合成、pre-RNAスプライシング、翻訳、リボソーム生合成、RNA分解など多岐に渡り、RNAが関わるあらゆる細胞内イベントに関わる酵素であると言えます。RNAヘリカーゼは6種類のサブグループ(DEAD box型やDEAH box型など)に大別され、ヒトでは計70以上のRNAヘリカーゼが同定されており、それらで全てのRNAイベントをカバーすると考えられています。いくつかのRNAヘリカーゼについては基質が報告されていますが、そもそも各RNAヘリカーゼに(E3ユビキチンリガーゼのような)基質特異性があるのか、各RNAヘリカーゼに固有の生理的機能があるのかなど不明な点が多く、RNAヘリカーゼの世界は謎に満ちています。
私たちはゼブラフィッシュの運動・行動異常を指標にして、グリシン作動性シナプス伝達に異常のある変異体をスクリーニングし、DEAH box型RNAヘリカーゼDhx37のゼブラフィッシュ変異体を得ました。電気生理学的解析から、Dhx37変異体ではグリシン作動性シナプス伝達が顕著に低下していることが分かりました。さらに詳細な解析から、Dhx37は特定のグリシン受容体αサブユニットのRNAに結合し、スプライシングを制御することで、グリシン受容体タンパク量、グリシン作動性シナプス伝達量を規定することが解明されました。この研究により、RNAヘリカーゼに明確な基質特異性・生理機能があることも確認されました。ヒトでグリシン作動性シナプス伝達の低下はhyperekplexia(通称:ビックリ病)という、突然の刺激による過剰な驚愕応答を特徴とする行動異常疾患を引き起こすことが知られています。家族性hyperekplexiaの原因遺伝子としてグリシン受容体遺伝子の変異が知られていますが、家族性で原因遺伝子が不明なものも依然多く、その解明が待たれます。今回の発見はDhx37がhyperekplexiaの新しい原因遺伝子であることを提唱するものでもあります。
また、細胞運命の維持にはH3K27のメチル化が関与する事が以前から知られていた。私たちは、ceh-22遺伝子へのHTZ-1の局在はH3K27脱メチル化酵素UTX-1の阻害で減少すること、HTZ-1とH3K27メチル化のゲノム上の局在には負の相関があることを示し、HTZ-1はUTX-1によってメチル化が除かれた場合に、転写抑制を行うことで細胞運命を維持している事を示唆した。H3K27のメチル化による安定した転写抑制と異なり、BET-1やHTZ-1は、分化を促すシグナルによって転写が簡単に誘導されるような遺伝子の、シグナルに依存しない転写を抑制していると考えられる。
この研究は関西学院大学・柴田博士、西脇博士との共同研究として行なわれました。
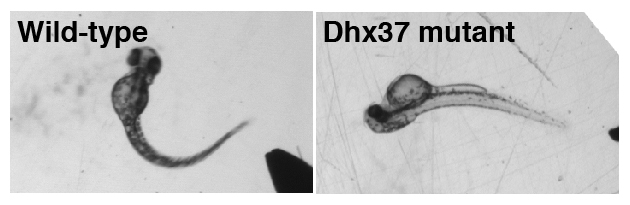
図:ゼブラフィッシュ稚魚をピンセットでつつくと逃避行動が見られ、正常な個体(Wild-type)の場合、体を側方に大きく曲げます。Dhx37に変異のある稚魚(Dhx37 mutant)の場合、体を側方ではなく背側に曲げます。これはグリシン作動性シナプス伝達に異常のある稚魚で特徴的に見られる左右同時の筋収縮によるもので、hyperekplexiaで見られる驚愕応答のサカナ版であるといえます。
野生マウスはどのようにして愛玩化されたのか
Tatsuhiko Goto, Akira Tanave, Kazuo Moriwaki, Toshihiko Shiroishi, Tsuyoshi Koide
Genes Brain and Behavior 2013. DOI: 10.1111/gbb.12088
人類はこれまでに様々な動物種を選択により家畜化してきました。その家畜化の過程で野生原種から変化する行動が愛玩化と呼ばれる行動形質です。しかし、この愛玩化とはどのような行動の変化であるのか、これまであまり明確にされてきていませんでした。私たちは、米国の動物学者であるEdward O. Priceが、その著書の中で、「愛玩化とは動物個体が人を避ける傾向が弱くなるか、あるいは積極的に人に近づく傾向が強くなること」と述べていることに着目しました。そこで、この二つの性質を区別するための3種類の行動テストを考案し、野生由来の10系統と実験用の6系統および愛玩用の1系統について、この新規行動テストを行いました。その結果、愛玩および実験用マウスは「愛玩化」の過程で、ヒトからの接触を避けないような行動特性が選抜されてきたものの、人に積極的に接近する性質については選択されてこなかったことが示されました。この結果は、今後の研究において、野生マウスがどのような遺伝的変化によって愛玩化されるか解明するための糸口になるものと期待されます。
なお、筆頭著者の後藤達彦博士は情報・システム研究機構、新領域融合プロジェクト特任研究員として研究に従事しました。
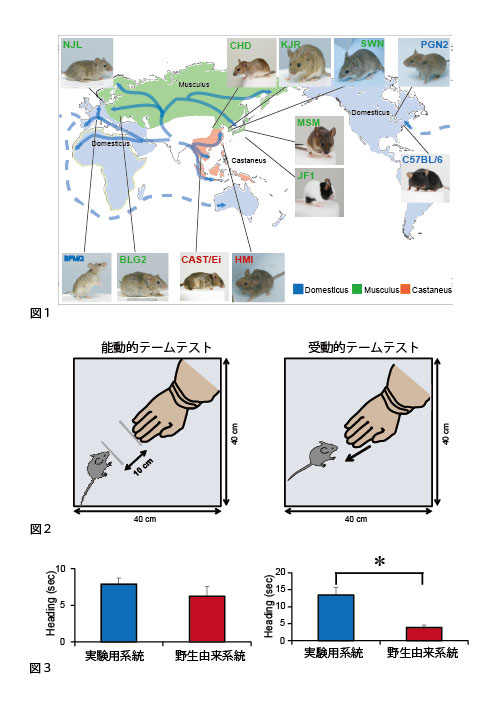
図1. 国立遺伝学研究所には、森脇和郎名誉教授を中心に世界各地で捕獲して収集し、それらから樹立された10種類の野生由来系統が維持されています。これらはいまだに野生マウスに特徴的な臆病な行動形質を保っており、世界的にも有数の貴重な遺伝資源です。一方、研究に一般的に使われる実験用系統は愛玩化されたマウスの集団から樹立されてきました。このように、野生系統と実験用系統はその由来も行動も顕著に異なるのです。
図2. マウスの愛玩化を調べるために新たに考案したテームテスト
図3. 実験用系統と野生系統は能動的テームテストでは有意な差を示さないのに対し、受動的テームテストでは野生由来系統がより人の手からの逃避を示します。
集団遺伝研究部門の斎藤教授が木村資生記念学術賞・日本進化学会学会賞を受賞
 表彰式日時:平成25年8月29日(木) 日本進化学会第15回つくば大会
表彰式日時:平成25年8月29日(木) 日本進化学会第15回つくば大会
 受賞題目:「近隣結合法などの分子系統進化学の方法論の開発とその応用研究」
受賞題目:「近隣結合法などの分子系統進化学の方法論の開発とその応用研究」
 日本進化学会サイト http://sesj.kenkyuukai.jp/special/index.asp?id=11632
日本進化学会サイト http://sesj.kenkyuukai.jp/special/index.asp?id=11632


集団遺伝研究系 集団遺伝研究部門 斎藤研究室
生態遺伝学研究室の石川麻乃研究員が日本進化学会第15回大会にて若手口頭発表最優秀賞を受賞

生態遺伝学研究室 北野研究室
酵母の日輪
Sho Okamoto, Kanji Furuya, Shingo Nozaki, Keita Aoki, and Hironori Niki
Eukaryotic Cell 2013 12:1235-1243. doi:10.1128/EC.00109-13
生物は太陽の光による昼夜の明暗サイクルから様々な影響を受けています。それは動植物のみならず、真菌や細菌においても同様です。私達は、真菌であるジャポニカス分裂酵母が、明暗のサイクルに応答すること発見しました。ジャポニカス分裂酵母は名前のとおり、日本で分離された酵母です。この分裂酵母は、栄養条件の悪化といったストレスやDNA損傷させるようなストレスを受けると、酵母から菌糸に生育の仕方が変化します。ペトリ皿の寒天培地の中心にこの分裂酵母を植えると、数日で酵母のコロニーが現れます(図a)。さらにこれを培養つづけると、コロニーの周囲から菌糸が放射状に伸長します(図b)。増殖中の菌糸に光を日周期的に照射させると、菌糸の部分に黒白の縞が形成されます (図c)。これは、ジャポニカス分裂酵母が、光の変化に反応したためです。この黒い縞の部分では、細胞分裂が一斉に活性していることがわかりました。真菌類では、WC-1とWC-2の2つのタンパク質からなる光受容体がよく知られています。確かに、これと類似したタンパク質の遺伝子がジャポニカス分裂酵母にもありました。それらの遺伝子を破壊すると光に応答しなくなるので、ジャポニカス分裂酵母でもWC光受容体が縞模様の形成時に働いていることがわかりました。さらに光だけなく、温度を上下すると光の刺激がなくても、同様の縞模様を作りだしました。この時には、WC光受容体は必要ありません。おそらく、別に温度の受容体があるのでしょう。以上のように、酵母も日周的に変わる温度や光といった環境要因を感知して、細胞の活動を周期的に調整することがわかりました。今後は、細胞分裂の活性化の仕組みや、熱受容体が何であるのかといった問題を解き明かしていきます。
なお筆頭著者の岡本尚 博士は、2012年度国立遺伝学研究所博士研究員制度の援助を受け、本研究を行いました。
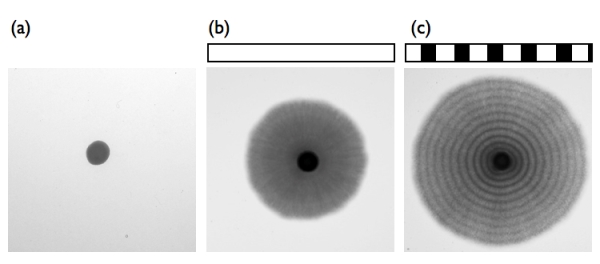
ジャポニカス分裂酵母は栄養ストレスのかかる培地で培養すると、数日間は酵母型の細胞で増殖し(a)のようなコロニーを発達させますが、さらに培養を続けると(b)のように菌糸型の細胞に転換し菌糸を伸長させるようになります。このときに明暗の刺激があると菌糸に(c)のような縞が形成されます(12時間の明条件、12時間の暗条件)。
サーチュイン遺伝子は、本当に長寿遺伝子だった -ゲノムを安定化することで老化を防ぐ作用機序を解明-
![]()
Cellular senescence in yeast is regulated by rDNA noncoding transcription.
Kimiko Saka, Satoru Ide, Austen R.D. Ganley, and Takehiko Kobayashi
Current Biology, 29 August 2013 doi:10.1016/j.cub.2013.07.048
寿命を延ばす働きをすると信じられているサーチュイン遺伝子(SIR2)。社会的な注目度も高く、関連した健康補助食品が販売されているくらいです。サーチュイン遺伝子の作用を解き明かそうと世界中の研究者が挑戦し、いろいろな仮説は得られてきましたが、詳しい作用メカニズムが明らかになっていませんでした。サーチュインはどんな仕組みで働くのでしょうか。そもそも、サーチュインの長生き効果は本当なのでしょうか。
今回、国立遺伝学研究所の小林武彦教授らは、その質問に答える決定的な発見をしました。さまざまな仮説を一掃する発見です。サーチュイン遺伝子の作用する反応経路を明らかにすることに成功したのです。それによると、サーチュイン遺伝子には、ある遺伝子の数を一定に保つという作用があり、それがゲノムの安定性へ通じ、確かに寿命を延ばすことにつながっていたのでした。そしてこれこそが、長生き効果における唯一の反応経路であることを実証しました。
ある遺伝子とは、リボソームRNA遺伝子です。この遺伝子は、ゲノム中にたくさんのコピーが含まれていますが、そのコピー数が変動しやすい、つまり不安定な性質をもつ遺伝子なのです。小林教授は、ヒト老化研究のモデル生物である酵母による研究を長年続け、データを積み上げてきました。そうした研究がジグソーパズルのピースの1片、1片を明らかにすることとしたら、今回の小林教授の研究は、そのジグソーパズル全体を完成させたようなものです。つまり、全体像が見えるようになり、そのことで、サーチュイン遺伝子が寿命を延長する効果を発揮するには、何が真に必要なのかが見えるようになったのです。決定的に必要なのはリボソームRNA遺伝子のコピー数の維持であること。具体的には、E-proというプロモーターを制御することだということです。実験では、サーチュイン遺伝子のノックアウト酵母株において、リボソームRNA遺伝子のコピー数を制御することにより、酵母菌の寿命を自由に操作することさえ可能でした。今後、このリボソームRNA遺伝子のコピー数の維持、つまりゲノムの安定性の維持が、老化や寿命の制御にどのように具体的にかかわっているか、さらに突き止めていくことが望まれています。それはヒトの老化機構の解明や、健康寿命の延長につながっていくでしょう。
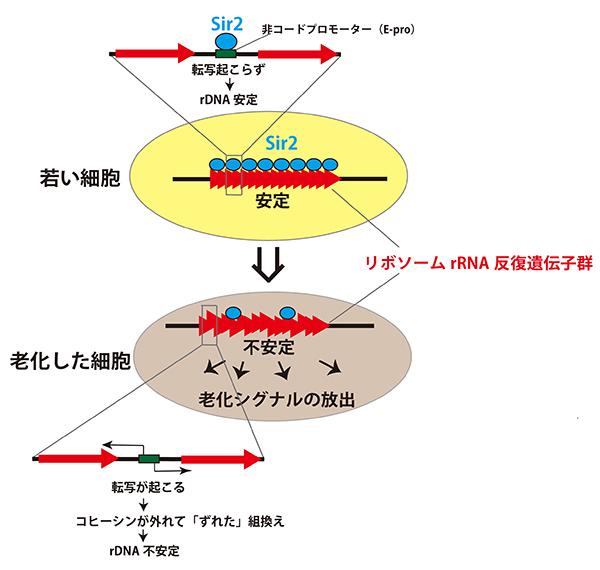
若い細胞ではSir2タンパク質が非コードプロモーター(E-pro)の発現を抑えているが、細胞が分裂を繰り返すとその抑えが徐々に弱くなり、E-proからの転写が起こり、リボソームRNA遺伝子の安定性が低下する。その結果何らかの老化シグナルがリボソームRNA遺伝子から発せられ、細胞が老化する。今回E-proからの転写を人為的にON、OFFできるようにしたところ、SIR2の有る無しに関わらず、ON時は酵母が短寿命で、OFFでは長寿命になることを見つけた。
遺伝性筋疾患の新たな原因遺伝子Stac3
運動神経回路研究室・平田研究室
Horstick, E. J., Linsley, J. W., Dowling, J. J., Hauser, M. A., McDonald, K. K., Ashley-Koch, A., Saint-Amant, L., Satish, A., Cui, W. W., Zhou, W., Sprague, S. M., Stamm, D. S., Powell, C. M., Speer, M. C., Franzini-Armstrong, C., Hirata, H.* and Kuwada, J. Y.* (*Corresponding authors)
Nature Communications 4: 1952 (2013). doi:10.1038/ncomms2952
私たちはゼブラフィッシュ稚魚の動きを指標に運動・行動に関わる遺伝子のスクリーニングを行い、Stac3 (SH3 and cysteine rich domain 3)という遺伝子の変異が運動障害を引き起こすことを見出しました。Stac3はSH3ドメインとシステインリッチドメインを有すること以外に何も知られていない機能不明遺伝子でしたが、私たちの解析からStac3が骨格筋に発現し、Stac3タンパクがT管(transverse tubule)という部位で電位センサー分子とカルシウム放出チャネルに結合し、筋収縮時の小胞体カルシウム放出を制御することを明らかにしました。
Stac3遺伝子は脊椎動物で保存されており、ヒトのSTAC3遺伝子は12番染色体上12q13.3部位にありますが、近年この領域にアメリカ先住民ミオパチー(Native American myopathy)という遺伝性疾患の責任領域がマップされました。この疾患はアメリカ先住民ラムビー族で報告された、筋力低下、筋痙攣、呼吸困難の症状を伴う筋疾患で、ラムビー族では5,000人に1人の高頻度で罹患すると推察されています。しかし、その原因はこれまで不明で、治療法も確立されていませんでした。私たちはアメリカ先住民ミオパチーの原因遺伝子がSTAC3であるという仮説のもと、患者のSTAC3遺伝子を解析しました。予想通り、患者のSTAC3遺伝子には変異があり、STAC3がアメリカ先住民ミオパチーの原因遺伝子であることが証明されました。さらに、その変異により運動時のカルシウム放出量が少なくなること、骨格筋の収縮力が低下することも分かりました。
本研究でアメリカ先住民ミオパチーの原因が明らかになりましたので、今後は効果的な治療法の開発が期待されます。本研究で開発されたゼブラフィッシュStac3変異体はアメリカ先住民ミオパチーの病態モデルとして有用で、症状を軽減する治療薬の開発にも使われています。
本研究はミシガン大学のジョン・クワダ教授らとの共同研究で行われました。
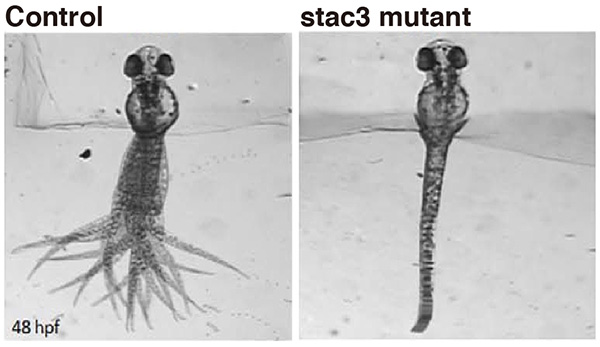
正常なゼブラフィッシュ(Control)は尾を大きく左右に振り泳ぐことができますが、アメリカ先住民ミオパチーの病態モデルのゼブラフィッシュ(stac3 mutant)は筋力が弱く、ほとんど尾を振れません。 尾の動きを見やすくするため、ゼブラフィッシュの前半身は動かないように固定してあります。
多発性関節拘縮と知的障害の原因遺伝子
運動神経回路研究室・平田研究室
Hirata, H.*, Nanda, I.*, van Riesen, A.*, McMichael, G.*, Hu, H.*, Hambrock, M., Papon, M.-A., Fischer, U., Marouillat, S., Ding, C., Alirol, S., Bienek, M., Preisler-Adams, S., Grimme, A., Seelow, D., Webster, R., Haan, E., MacLennan, A., Stenzel, W., Yap, T. Y., Gardner, A., Nguyen, L. S., Shaw, M., Lebrun, N., Haas, S. A., Kress, W., Haaf, T., Schellenberger, E., Chelly, J., Viot, G., Shaffer, L. G., Rosenfeld, J. A., Kramer, N., Falk, R., El-Khechen, D., Escobar, L. F., Hennekam, R., Wieacker, P., Hübner, C., Ropers, H.-H., Gecz, J., Schuelke, M., Laumonnier, F. and Kalscheuer, V. M. (*Equal contribution)
American Journal of Human Genetics 92: 681-695 (2013). doi: 10.1016/j.bbr.2011.03.031
私たちはゼブラフィッシュ稚魚の動きを指標に運動・行動に関わる遺伝子の研究を行い、ジンク・フィンガー型転写因子Zc4h2の発現を阻害した個体では泳動が遅くなることを見出しました。Zc4h2遺伝子は脊椎動物で高度に保存されており、ヒトのZC4H2遺伝子はX染色体上Xq11.2部位にあります。私たちはヒトのZC4H2遺伝子がヒトの運動・行動疾患にかかわる可能性を視野に、ヒトのZC4H2遺伝子の研究も行いました。
多発性関節拘縮は上肢や頸部などの関節周りの組織が固まり、運動が制限される難病で、先天性・遺伝性のものと、後天性のものがあります。私たちは次世代シーケンサーを用いた患者ゲノムの解析から、ZC4H2遺伝子が知的障害を併発する遺伝性多発性関節拘縮の原因遺伝子であることを突き止めました。さらにゼブラフィッシュを用いた多発性関節拘縮の病態モデルの解析から、Zc4h2が神経系に広く発現すること、Zc4h2を欠く個体では運動ニューロンの筋投射に異常が見られることも明らかになりました。これらの発見は多発性関節拘縮の原因を解明するとともに、その生前診断を可能にし、さらに治療法確立に貢献するものであります。
本研究はマックスプランク分子遺伝学研究所のVera M. Kalscheuer博士、ベルリン大学附属シャリテ病院のMarkus Schuelke博士らとの共同研究で、遺伝研共同研究の支援を受けて行われました。
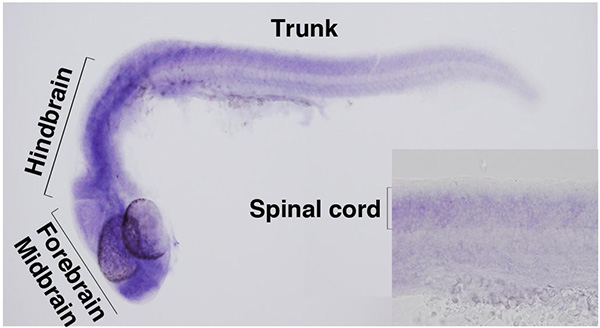
ZC4H2遺伝子は前脳、中脳、後脳、脊髄など神経系に広く発現する。
遺伝子内ヘテロクロマチンへの対処
Hidetoshi Saze, Junko Kitayama, Kazuya Takashima, Saori Miura, Yoshiko Harukawa, Tasuku Ito and Tetsuji Kakutani
Nature Communications, 4, Article number:2301 doi:10.1038/ncomms3301
動物や植物のゲノムにはトランスポゾンが多数存在します。これらの生物は、エピジェネティックな機構を用いてトランスポゾンを不活性なヘテロクロマチン状態にすることで、その増殖を抑制しています。 一方、トランスポゾンは活発に転写されている遺伝子の内部にも見つかりますが、遺伝子内のトランスポゾンの制御機構についてはほとんど理解されていませんでした。
他の多くの生物と同様に、モデル植物であるシロイヌナズナやイネのゲノムにはヘテロクロマチンを内包した遺伝子が数多く存在します。こうした遺伝子内ヘテロクロマチンは多くがトランスポゾンの挿入により形成されたものでした。今回、ヘテロクロマチンをもつ遺伝子を適切に転写するのに必要な新しい因子IBM2(Increase in Bonsai Methylation 2)を発見し、その働きを調べました(図)。この研究により、生物がトランスポゾンの抑制を保ちつつ適切な遺伝子発現を保障する仕組みを進化させてきたことが明らかになりました。これは生物の集団中の遺伝的多様性とその影響を理解する上で重要な知見になると考えます。(この研究はOIST佐瀬研究室との共同研究です。)
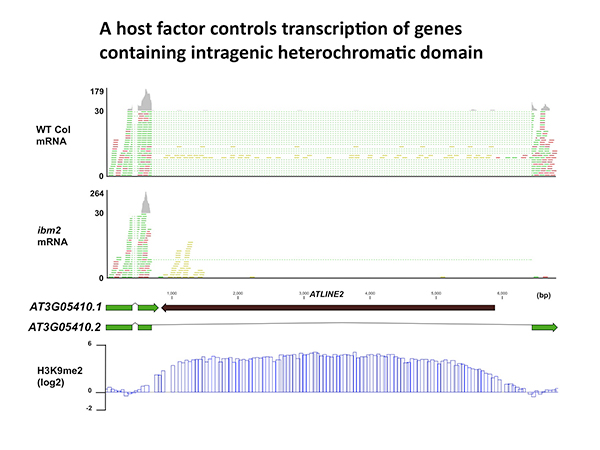
テロクロマチンをもつ遺伝子(AT3G05410.2)の転写がibm2変異体では阻害される。緑と赤が転写されたmRNAを、点線がスプライシングされている領域を示す。 遺伝子内にはトランスポゾン(ATLINE2)の挿入があり、H3K9メチル化を受けてヘテロクロマチン化されている(再下段)。















