Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
国立遺伝学研究所 一般公開 2025:4月5日(土)開催 講演の動画を配信中
TEDC1遺伝子の変異はヒトとゼブラフィッシュで重度成長障害を引き起こす
酒井研究室・小型魚類遺伝研究室
技術課 / 細胞建築研究室
Biallelic TEDC1 variants cause a new syndrome with severe growth impairment and endocrine complications
Noriko Miyake, Kentaro Shiga, Yuya Hasegawa, Chisato Iwabuchi, Kohei Shiroshita, Hiroshi Kobayashi, Keiyo Takubo, Fabien Velilla, Akiteru Maeno, Toshihiro Kawasaki, Yukiko Imai, Noriyoshi Sakai, Tomonori Hirose, Atsushi Fujita, Hidehisa Takahashi, Nobuhiko Okamoto, Mikako Enokizono, Shiho Iwasaki, Syuichi Ito, Naomichi Matsumoto
European Journal of Human Genetics 2025 Feb 20. DOI:10.1038/s41431-025-01802-3
出生前発症の重度成長障害、原発性小頭症、発達遅延、副腎機能不全、先天性緑内障、骨老化遅延、頭蓋骨癒合症、先天性気管狭窄症、および原発性性腺機能低下症を持つ希少疾患の患者のexome解析からTEDC1遺伝子が機能欠失していることが見つかりました。ゼブラフィッシュでtedc1変異体を作出したところ、患者と共通する表現型が認められ、cilia異常をもつ他のゼブラフィッシュ変異体と類似していました。そこで、ciliaマーカーのアセチル化チューブリンを調べた結果、変異ゼブラフィッシュと患者の細胞ともに形成異常が認められ、この疾患が繊毛病(ciliopathy)であることが示唆されました。
本研究は、J-RDMM(国立研究開発法人日本医療研究開発機構の未診断疾患イニシアチブ・IRUD(Initiative on Rare and Undiagnosed Diseases) の中で、モデル生物により疾患原因を究明するためのプロジェクト、遺伝研井ノ上教授代表)の一環として、国立国際医療研究センター研究所の三宅部長、横浜市大の松本教授と遺伝研の酒井准教授(小型魚類遺伝研究室)によって進められたものです。
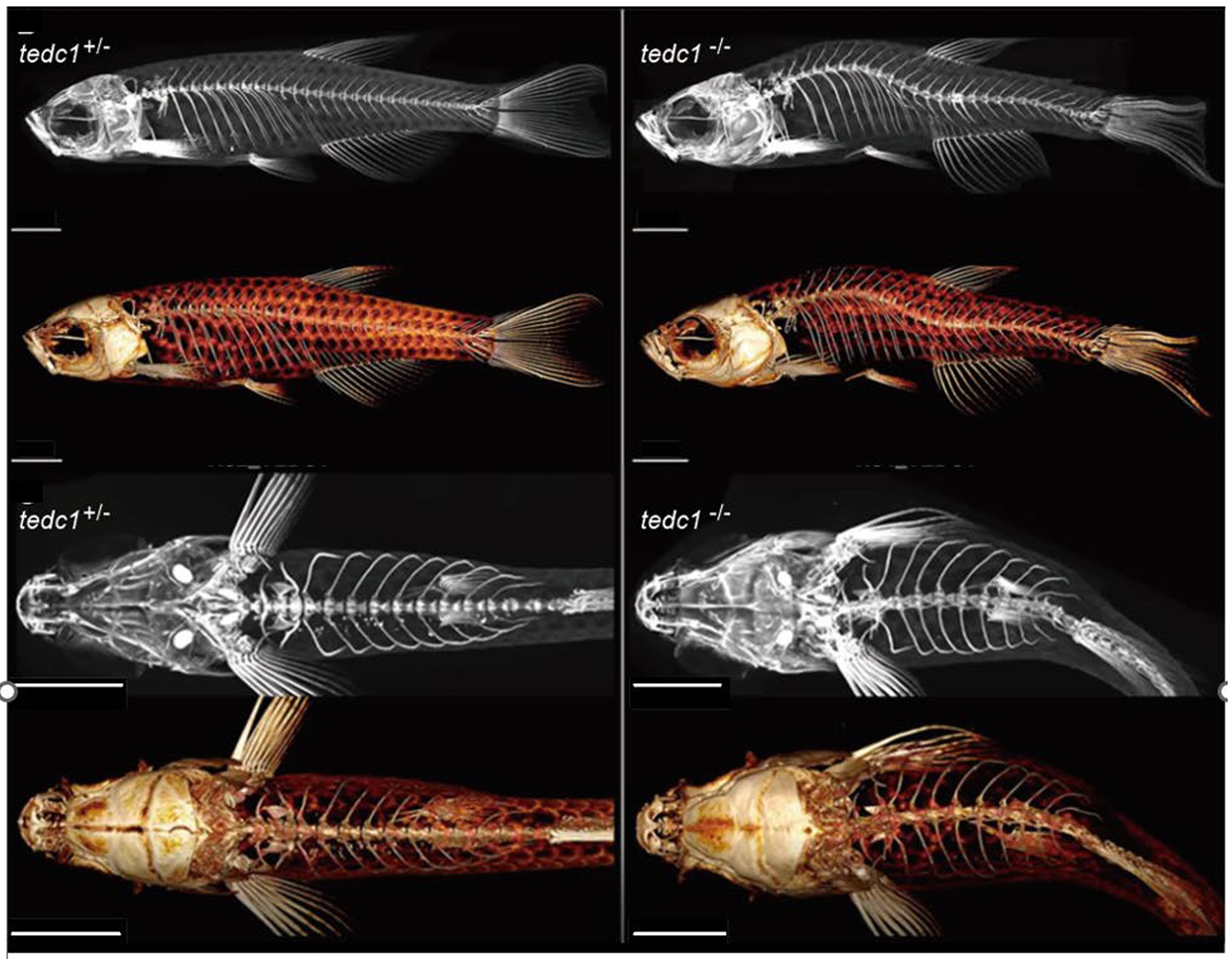
図:tedc1+/− および tedc1−/− ゼブラフィッシュの側面および上面の µCT 画像
分子生命史研究室 技術補佐員募集
分子生命史研究室では以下の業務を担当していただける短時間雇用職員(技術補佐員)を募集いたします。同時に募集している特任研究員とのどちらかを1名採用の予定です。
| 【業務内容】 | 研究室で進める生物種横断的な生命科学研究の補助 |
| 【募集人員】 | 1名 |
| 【勤務地】 | 静岡県三島市谷田1111 国立遺伝学研究所 分子生命史研究室(変更の予定なし) |
| 【応募資格】 | 大卒以上。DNA・タンパク質の配列を用いた生命情報学的解析の経験があることが望ましい。 |
| 【採用時期】 | 2025年4月以降(応相談) |
| 【勤務時間】 | 月〜金 9:00-16:00(昼休憩1時間)の範囲(週30時間以下)で応相談。 |
| 【給与・待遇】 | 所内規定に準じます。詳細については、「情報・システム研究機構 短時間雇用職員就業規則」をご参照ください。 |
| 【雇用期間】 | 年度契約、評価に基づき更新可。 |
| 【応募方法】 | メール件名に「分子生命史研究室 技術補佐員応募」と明記の上、履歴書(写真添付・メールアドレス記載)、職務経歴書を下記宛先までメールにて送信下さい。 書類審査後、書類選考通過者のみ面接を行い、採用を決定いたします。 面接についてはメールでご連絡いたします。 |
| 【応募期間】 | 適任者が見つかり次第締め切ります。 |
| 【備考】 | 提出して頂いた書類は、情報・システム研究機構個人情報保護規程に則り厳重に管理し、採用審査の用途に限り使用されます。これらの個人情報は正当な理由なく第三者への開示、譲渡及び貸与することは一切ありません。 また、お送りいただきました履歴書等の応募書類は返却せず責任をもって廃棄致しますこと、ご承知おき下さい。 |
〒411-8540 三島市谷田1111
大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所
分子生命史研究室 工樂 樹洋
分子生命史研究室 特任研究員募集
分子生命史研究室では以下の業務を担当していただける特任研究員を募集いたします。
同時に募集している技術補佐員とのどちらかを1名採用の予定です。
| 【仕事内容】 | 研究室で進める生物種横断的な生命科学研究 |
| 【募集人員】 | 1名 |
| 【勤務地】 | 静岡県三島市谷田1111 国立遺伝学研究所 分子生命史研究室(変更の予定なし) |
| 【採用時期】 | 2025年4月以降(応相談) |
| 【雇用期間】 | 年度契約で最長2030年3月まで審査の上更新の可能性あり。 |
| 【応募資格】 | 分子生物学や生命情報科学、または関連する分野において博士号を取得した者。トランスポゾンの機能、ゲノム構成の進化的変遷、脊椎動物の表現型の進化、分子系統学的アプローチにもとづく生命情報解析、の少なくともひとつについての主体的なプロジェクト遂行の実績に加えて国際学会での口頭発表経験があることが望ましいが必須とはしない。 |
| 【給与・待遇】 | 相談のうえ研究所の規定に準じて決定 |
| 【勤務時間】 | 特任研究員(特定有期雇用職員)の場合 月~金 8:30-17:15 1日7時間45分の裁量労働適用(昼休憩1時間、週38時間45分) |
| 【応募方法】 | メール件名を「分子生命史研究室 特任研究員応募」として、下記を揃えて所定の宛先までメールにて送信下さい。 1)履歴書 2)これまでの研究の概要と志望の動機 3)研究業績リスト 4)照会先となる研究者2名の氏名及び連絡先 |
| 【応募期間】 | 適任者が見つかり次第締め切ります。 |
| 【備考】 | 提出して頂いた書類は、情報・システム研究機構個人情報保護規程に則り厳重に管理し、採用審査の用途に限り使用されます。これらの個人情報は正当な理由なく第三者への開示、譲渡及び貸与することは一切ありません。 また、お送りいただきました履歴書等の応募書類は返却せず責任をもって廃棄致しますこと、ご承知おき下さい。 |
〒411-8540 三島市谷田1111
大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所
分子生命史研究室 工樂 樹洋
細胞の中のクロマチンドメイン
Chromatin domains in the cell: phase separation and condensation
Shin Fujishiro*, Masaki Sasai*, and Kazuhiro Maeshima*
*Corresponding author
Current Opinion in Structural Biology Volume 91, April 2025, 103006 DOI:10.1016/j.sbi.2025.103006
Free download link for 50 days [Available online 20 February 2025]
負に帯電したゲノムDNAは、正に帯電したコアヒストン八量体に巻きつくことでヌクレオソームを形成します。これらのヌクレオソームは、タンパク質やRNAとともに細胞核内で自己組織化し、クロマチンを構築します。高等真核細胞では、クロマチンはループを形成し、それがさらに折りたたまれてクロマチンドメインとなり、ゲノムの機能単位として働きます。クロマチンの構造には、クロマチン結合タンパク質、ヒストン修飾、転写状態、高分子混雑、陽イオンなどのさまざまな要因が大きく影響するため、クロマチンドメインが細胞内でどのように形成されるのかは、いまだ明らかになっていません。京都大学・福井記念研究センターの藤城新 研究フェローと笹井理生 研究員、国立遺伝学研究所の前島一博 教授らは、本総説において、クロマチンドメインの形成メカニズムについて、相分離や凝縮の観点を含め、物理的な視点から考察しています。
本研究は、JSPSおよびMEXT KAKENHIの助成金(JP20H05936、JP22H00406、JP23K17398、JP24H00061)および武田科学振興財団の助成を受けて実施されました。
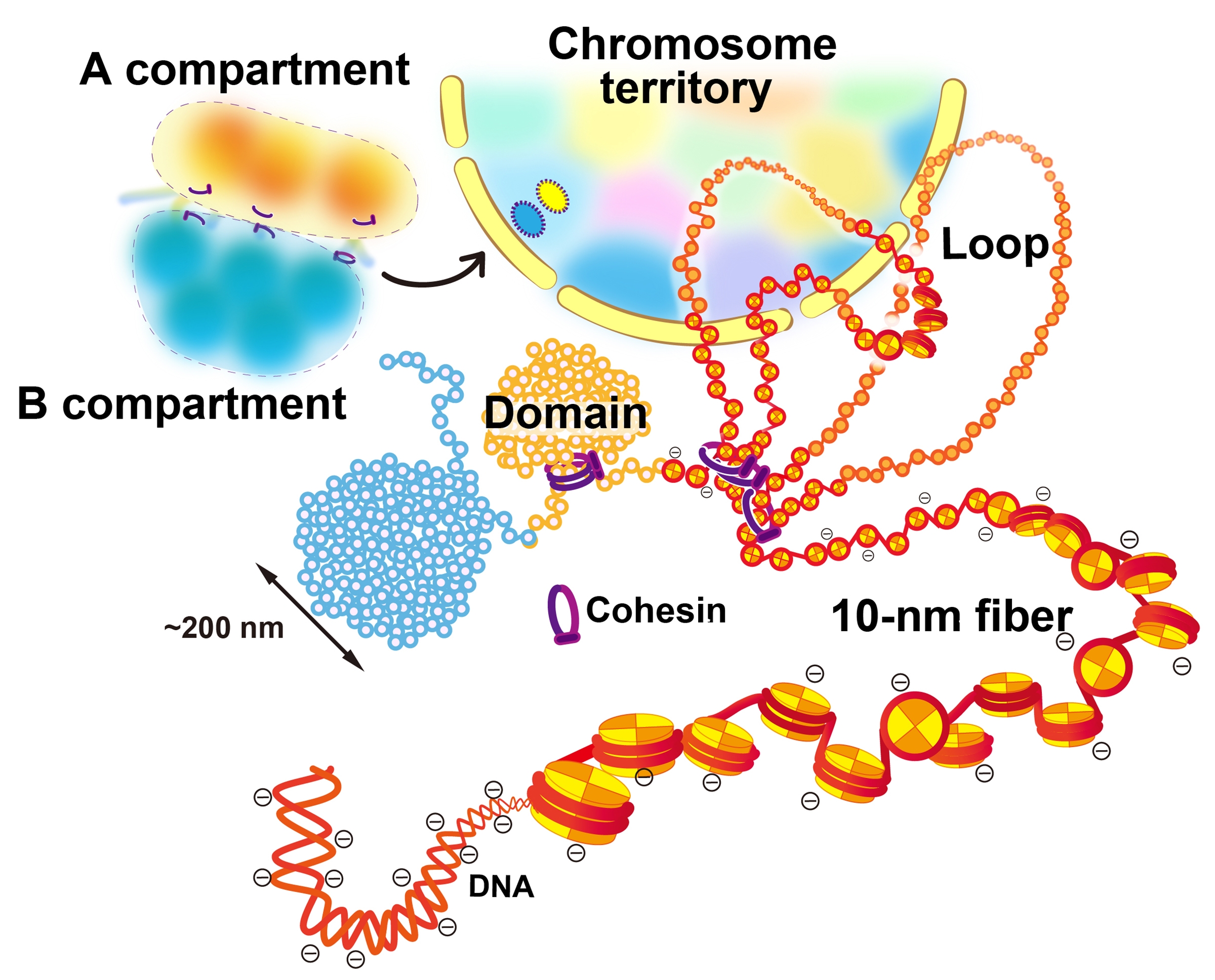
図:細胞核内のクロマチン階層構造の模式図
DNAはヒストン八量体に巻き付き、ヌクレオソームを形成している。ヌクレオソームの鎖はコンパクトなクロマチンの塊 (ドメイン) を形成し、ドメイン同士が相互作用することでコンパートメントができる。コンパートメントAとBはそれぞれ、転写がアクティブなクロマチンと、転写が不活性なクロマチンを表すと考えられている。間期の染色体は、染色体領域を形成する複数のコンパートメントからなる。この模式図は、現在考えられているモデルを単純化して示したものであり、実際はもっと複雑な階層構造を形成していると考えられる。
生命のゆりかごで渦が踊る
〜受精卵の細胞質流動の反転現象を解明〜
プレスリリース
Swirling Instability mediated by Elastic and Hydrodynamic Couplings in Cytoplasmic Streaming
Takuji Ishikawa*, Takayuki Torisawa, Hirofumi Wada, Akatsuki Kimura*.
*corresponding authors
PRX Life (2025) 3, 013008 DOI:10.1103/PRXLife.3.013008
細胞の中には無数の分子が存在し、それぞれが機能することで細胞全体が調和して働いています。その一例が「細胞質流動」と呼ばれる現象です。細胞内の分子が互いに影響しながら動くことで、まとまった流れが生じますが、なぜ個々の分子の動きが秩序ある流れにつながるのかは謎でした。2017年に木村教授(細胞建築研究室)らの研究チームは線虫の受精卵を用いた研究で、細胞内の「微小管」という繊維状のタンパク質が、「ER(小胞体)」を介してつながることで、流れの方向が整うことを明らかにしました。この研究では、Joanny教授(仏・キュリー研究所)らが1次元の数理モデルを作成し、流動の発生や方向の逆転を説明しました。
この1次元モデルは流動のエッセンスを理解するには有効でしたが、3次元である実際の細胞と比較するには限界もありました。そこで、東北大学の石川教授が3次元シミュレーションを開発し、立命館大学の和田教授の協力で3次元の流動のリアルなモデルが完成しました。これにより、ERが有する「弾性」という性質が流動の発生と逆転に重要であることが判明しました。すなわち、ERの弾性が弱すぎると流動が起こらず、強すぎると逆転が生じないことがシミュレーションにおいて示されたのです。シミュレーションで逆転が生じるERの弾性は、鳥澤助教(細胞建築研究室)が実験的に測定したERの弾性と一致しました。この研究により、細胞質流動がERの弾性を活用して発生し、特定の方向に流れ、逆転する理由が定量的に説明されました。この成果は、動物や植物を問わず多くの細胞で見られる細胞質流動の解明に貢献し、私たちの細胞の理解の基盤となることが期待されます。

図: 本研究で構築された細胞質流動のシミュレーション。受精卵が楕円球で表され、細胞表面付近の流動の方向が矢印で、速さが色(赤=速い、青=遅い)で表されている。実際の細胞の流動同様、細胞長軸に垂直な方向に流動が見られた。図は論文の図2Bより転載。
ダムは在来エビの最後の砦!?外来エビの分布拡大過程の一端を解明
River dam prevents the invasion of non-native species of Neocaridina Kubo, 1938 (Decapoda: Caridea: Atyidae) into native habitats: A case study in the Yumesaki River system, Japan
Ryosuke Ishii and Yusuke Fuke *
* Corresponding author
Journal of Crustacean Biology (2025) 45, ruaf009 DOI:10.1093/jcbiol/ruaf009
外来種の分布域の拡大は、人為的な導入とそれに続く分散の繰り返しによって生じます。分散は人為的な介入がなくても生じ、そのパターンは種によって異なります。そのため、外来種のさらなる分散の防止や効率的な管理のためには、個々の種について、分散の様式に関する知見を蓄積していくことが重要です。
この度、国立遺伝学研究所の福家悠介(日本学術振興会特別研究員PD)と香川大学大学院農学研究科の石井良典氏(修士課程学生)は、世界的に問題となっている淡水性甲殻類の侵略的外来種シナヌマエビ(以下、外来エビ)について、水系内における分布拡大に関する知見を遺伝解析と形態解析に基づいて報告しました。調査地とした兵庫県夢前川水系では、約30年前にも十脚甲殻類の分布調査が行われており、当時は外来エビと同属の在来種ミナミヌマエビ(以下、在来エビ)が水系全域に生息していたことが分かっています。しかしながら、今回の調査では、在来エビは主にダムの上流側の地点でのみ出現し、ダムより下流のほとんどすべての地点は外来エビに置換されていることが示唆されました。外来エビはダムの下流側に導入されたことが過去に報告されています。本研究は外来エビの強い侵略性とそのパターンの一端を浮き彫りにすることができました。すなわち、外来エビが一度導入されると在来エビと完全に置き換わってしまうこと、そして、本水系では、一般的に生息地の分断などによって生態系に負の影響を与えるダムが上流側に残る在来エビの生息地への外来種の分布拡大を防いでいることを明らかにしました。

図:在来種ミナミヌマエビNeocaridina denticulata。本研究で調査した水系では、近縁の外来種に追いやられ、ダムの上流側のみで確認された。
サクラ研究の新時代到来
〜オオシマザクラの完全ゲノム配列を公開〜
プレスリリース
A Near Complete Genome Assembly of the Oshima Cherry Cerasus speciosa
Kazumichi Fujiwara, Atsushi Toyoda, Bhim B. Biswa, Takushi Kishida, Momi Tsuruta, Yasukazu Nakamura, Noriko Kimura, Shoko Kawamoto, Yutaka Sato, Toshio Katsuki, Sakura 100 Genome Consortium, and Tsuyoshi Koide*
Sakura 100 Genome Consortium (full list): Kazumichi Fujiwara, Atsushi Toyoda, Bhim B. Biswa, Takushi Kishida, Momi Tsuruta, Yasukazu Nakamura, Noriko Kimura, Shoko Kawamoto, Yutaka Sato, Toshio Katsuki, Tsuyoshi Koide*, Akatsuki Kimura, Ken-Ichi Nonomura, Hironori Niki, Hiroyuki Yano, Kinji Umehara, Tazro Ohta, Chikahiko Suzuki.
*責任著者
Scientific Data volume 12, Article number: 162 (2025) DOI:10.1038/s41597-025-04388-z
日本の春を彩るサクラの中で、ひときわ存在感を放つオオシマザクラ。その完全なゲノム配列を国立遺伝学研究所(遺伝研)と森林総合研究所(森林総研)を中心とする「サクラ100ゲノムコンソーシアム」が解読に成功しました。研究チームは、伊豆大島にある樹齢800年以上といわれる国の特別天然記念物「大島のサクラ株」をサンプルとして使用し、高度なゲノム解析技術によりオオシマザクラの全染色体構造を明らかにしました。
オオシマザクラは、日本のサクラ品種の多様化に重要な役割を果たしてきました。特に注目すべきは、日本中で親しまれている‘染井吉野’の親の一つであるという点です。1960年代に遺伝研の竹中要博士が、染井吉野がオオシマザクラとエドヒガンの雑種であることを実験データに基づき示しましたが、今回の研究はその知見をさらに深化させるものです。オオシマザクラのゲノム解析は、単にこの種の理解を深めるだけではなく、今後はオオシマザクラが関与したと考えられる多くのサクラ栽培品種の由来や花の色、開花時期、形態などに関わる遺伝子の解明に活用できると期待されます。また、この「大島のサクラ株」は接ぎ木により増殖して遺伝研構内に植樹を行いました。
本研究を遂行した「サクラ100ゲノムコンソーシアム」は、遺伝研の藤原一道特任研究員、豊田敦特任教授、川本祥子准教授、佐藤豊教授、小出剛准教授、及び、森林総研の勝木俊雄博士をはじめ、サクラゲノム研究を目的として遺伝研や森林総研などの研究者が集まり作られました。
本研究は、情報・システム研究機構戦略的研究プロジェクトにより支援されました。
本研究は、2025年2月4日に「Scientific Data」にオープンアクセスとしてオンライン出版されました。
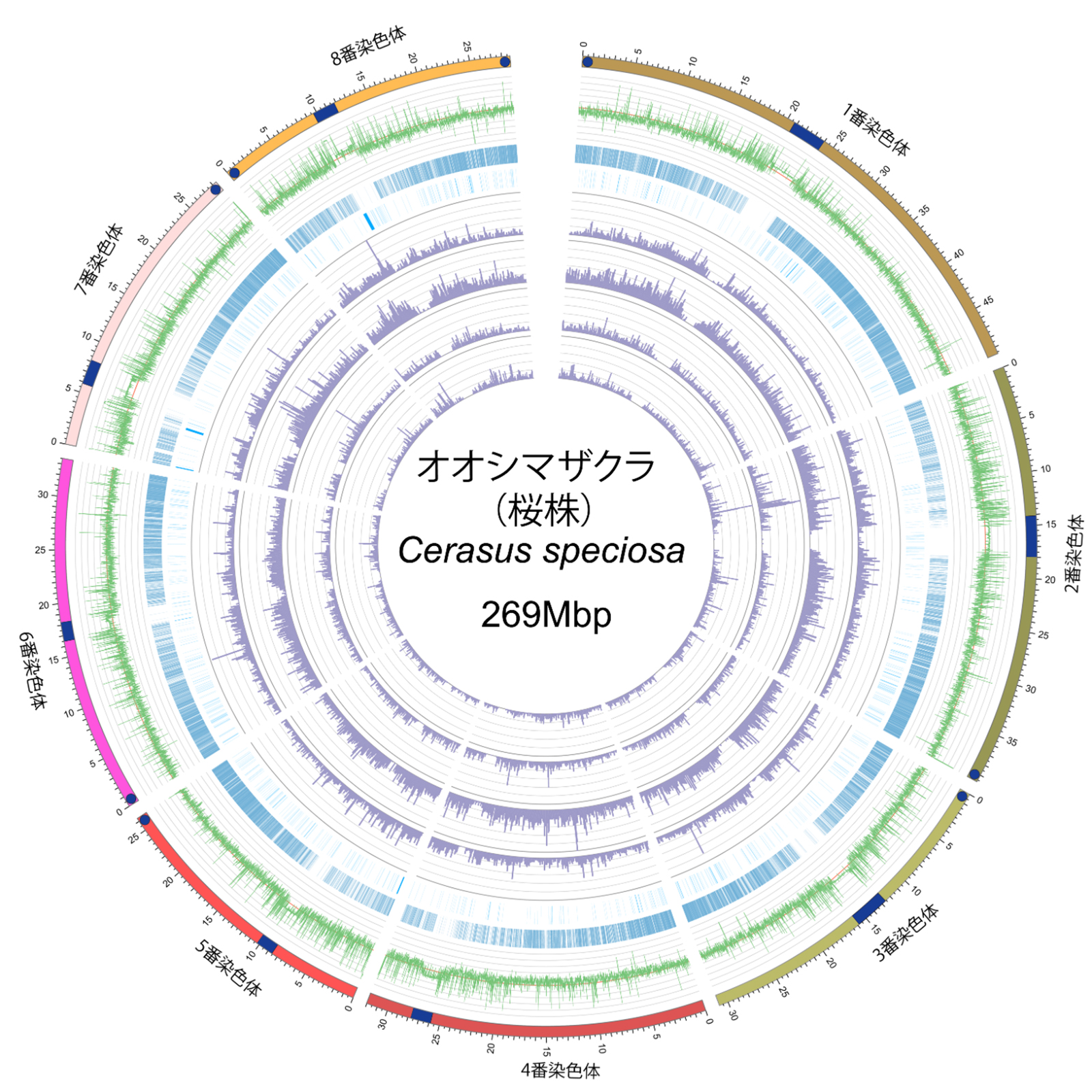
図: オオシマザクラ(桜株)の完全ゲノムの模式図。8本の染色体すべてについて、染色体の構造が明らかになった。外側のサークルは各染色体をあらわし、青いボックスはセントロメア、青い丸はテロメアを示している。多重の線は以下のゲノム配列を示している(外側から2番目:GC塩基の比率、3番目:遺伝子分布、4番目:ノンコーディングRNA遺伝子、5番目:LTR配列、6番目:TIR配列、7番目:LINEおよびSINE配列、8番目:Helitron配列。

写真: 「大島のサクラ株(さくらっかぶ)」 伊豆大島に自生するオオシマザクラの巨木。樹齢は800年以上と推定され、1952年に国の特別天然記念物に指定される。折れた主幹から大枝が横に張り出している。















