Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
攻撃行動の強度を制御する脳領域の神経伝達物質を特定 ~背側縫線核のグルタミン酸入力が攻撃行動のレベルを決定している~
![]()
Glutamate input in the dorsal raphe nucleus as a determinant of escalated aggression in male mice
Aki Takahashi, Ray X. Lee, Takuji Iwasato, Shigeyoshi Itohara, Hiroshi Arima, Bernhard Bettler, Klaus A. Miczek, Tsuyoshi Koide Journal of Neuroscience, 22 April 2015, 35(16): 6452-6463; DOI: 10.1523/JNEUROSCI.2450-14.2015国立大学法人筑波大学人間系の高橋阿貴助教と国立遺伝学研究所マウス開発研究室の小出剛准教授らは、雄マウスの攻撃行動のレベルを決めている脳内メカニズムの一端を明らかにしました。脳内セロトニン系が攻撃行動に重要な役割を果たしていることはすでに多くの研究から分かっていましたが、動物が攻撃行動を示している最中に、セロトニン系がどのような活性を示し、それがどのような伝達物質で制御されているかについては明らかになっていませんでした。本研究により、セロトニン神経系が存在する背側縫線核において興奮性神経伝達物質であるグルタミン酸の入力が増加することで、雄マウスの攻撃行動が高ぶることが分かりました。本研究は、攻撃行動のレベルを決めている脳内の制御機構を初めて明らかにしたものです。
本研究の成果は、米国神経科学学会誌「The Journal of Neuroscience」に発表されました。本研究は科学研究費補助金(23683021, 25116527)の支援を受けて行われ、NIGINTERNで来日した大学院生も貢献しています。
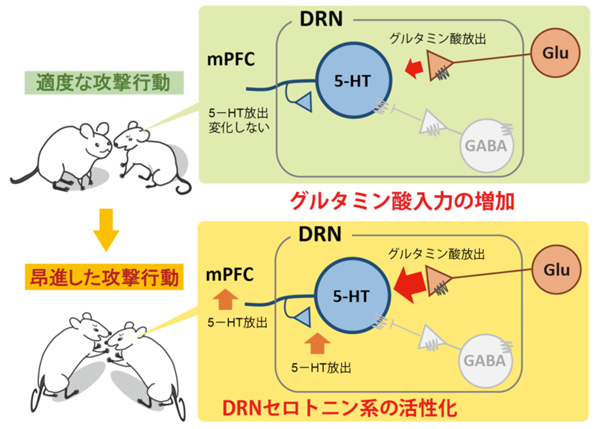
日雄マウスが攻撃行動を示している最中に、背側縫線核(DRN)へのグルタミン酸(Glu)入力が増加する。しかし、攻撃行動が適度なレベルのときには、内側前頭前野(mPFC)でのセロトニン(5-HT)の放出量は変化しない。一方、雄マウスの攻撃行動が高ぶる(昂進した攻撃行動を示す)と、DRNのグルタミン酸入力が更に増加し、それに応じてセロトニンの放出も増加する。
定量メカノバイオロジー研究室の島本勇太准教授が平成27年度文部科学大臣表彰 若手科学者賞を受賞

新分野創造センター・定量メカノバイオロジー研究室の島本勇太准教授が平成27年度文部科学大臣表彰 若手科学者賞を受賞しました。
本賞は、萌芽的な研究、独創的視点に立った研究等、高度な研究開発能力を示す顕著な研究業績をあげた40歳未満の若手研究者に授与されるものです。
授賞式日時
平成27年4月15日(水)
授賞式会場
文部科学省3階 講堂
受賞名
平成27年度文部科学大臣表彰 若手科学者賞
受賞テーマ
有糸分裂紡錘体の集合と機能を制御する細胞内物理化学の研究
形質遺伝研究部門 中沢信吾さんが総研大未来科学者賞を受賞

総研大は平成26年度から、科学者として活躍している修了生の研究を顕彰することを目的とした「総研大科学者賞」と、科学者を志す在学生の研究の奨励を目的とした「総研大未来科学者賞」を新設しました。 形質遺伝研究部門 岩里研究室所属の中沢信吾さん(総研大遺伝学専攻D3)がそのうちの「総研大未来科学者賞」を受賞しました。
研究テーマ
新生仔大脳皮質における入力依存的なバレル神経回路発達機構の解析
孤島におけるカニクイザルの遺伝的多様性
Whole-genome sequencing of six Mauritian cynomolgus macaques (Macaca fascicularis) reveals a genome-wide pattern of polymorphisms under extreme population bottleneck
Naoki Osada, Nilmini Hettiarachchi, Isaac Adeyemi Babarinde, Naruya Saitou, Antoine Blancher
Genome Biology and Evolution, 7(3):821–830 (2015) DOI: 10.1093/gbe/evv033
カニクイザル(Macaca fascicularis)は医学・薬学実験で広く用いられている霊長類で,多様な遺伝的背景を持っていると考えられています.これら実験用霊長類の遺伝的背景を明らかにすることは医学・薬学研究の発展にとって重要な課題です.
カニクイザルは東南アジアに広く分布していますが,それに加えモーリシャス島に生息する特徴的な集団が知られています.これらのサルは16世紀に船乗りによって少数の個体が持ち込まれ,その後急速な速度で島全体に広がったと考えられています.今回の研究目的のひとつは,モーリシャス産カニクイザルの全ゲノムレベルでの遺伝的多様性がどのようになっているかを明らかにすることです.また本件は,哺乳類のような生物種で,少数の個体から爆発的に集団内の個体数が増えたときにどのような影響がゲノムに起こるのかを調べるよいモデルになります.
今回,我々はトゥールーズ第三大学との共同研究により,モーリシャス産カニクイザル6個体のゲノム配列を決定し解析を行いました.これらのゲノム配列を比較解析することにより,モーリシャス産のカニクイザルは,これまで考えられていたようにインドネシア・マレーシア集団に由来し,母集団よりも2割程度低い遺伝的多様性を持っていることが確認できました.それだけでなく,急激な個体数の減少が集団の中の遺伝子多型頻度に強く影響影を与えることが観察されました.これらの全ゲノム情報は新規遺伝子の同定や効率的な遺伝子発現解析など,今後モーリシャス産カニクイザルを医学・薬学実験で用いる際の重要な情報になるでしょう.

左)赤い円で囲まれた島がモーリシャス島 右)カニクイザルの写真
プロテオミクスによるクロマチンコード情報の解読
End-targeting proteomics of isolated chromatin segments of a mammalian ribosomal RNA gene promoter
Ide, S. and Dejardin, J.Nature Communications, 6, Article number: 6674, DOI: 10.1038/ncomms7674
ゲノムが記憶する遺伝情報をどのように使うのか、その役割を担っているのはクロマチンです。その実体はDNAがヒストンに巻き付いてできるヌクレオソームとそこに相互作用する転写因子などの結合タンパクです。各塩基配列上のクロマチンコード情報の解読は、個体の発生や疾患の原因解明のための大きな手がかりとなります。
Proteomics of isolated chromatin segments (PICh) 法は、質量分析法を用いて、特定のDNA配列に相互作用する因子を網羅的に同定する方法です。人工核酸プローブを核抽出液に混ぜ、プローブと相補鎖である配列に複合体を形成させることで、その領域をクロマチンごと特異的に回収します。この方法により、単純な塩基配列の繰り返し[(TTAGGG)n]からなるテロメア領域のタンパクを精製し、質量分析装置で網羅的に同定することが可能でした。しかしながら、複雑な塩基配列からなる遺伝子やその制御配列に適用できませんでした。
今回、人工核酸プローブのデザインの至適化とクロマチン調製の改良により、遺伝子領域に適用可能なPICh法のグレードアップに成功しました。連続した2つのプローブがDNAの切断末端に結合してはじめて安定に維持されることから、クロマチン断片を制限酵素で切断することで、末端配列を人為的にコントロールし、目的の領域の制限部位の周辺に結合するプローブを作成する工夫をしました(DNA断片の末端を狙う戦略に因んでEnd targeting PICh: ePICh法と命名)。ePICh法を哺乳細胞のガン化や老化に関連するリボソームRNA遺伝子のプロモーター配列に応用したところ、転写開始前複合体や新規機能性タンパクも含めた多数の分子群を同定できました。ePICh法を応用すれば、あらゆる生物から、多くの塩基配列上のクロマチンコード情報を包括的に抽出することが可能になり、今後、エピジェネティクス研究を加速させることが期待されます。
本研究は、本研究所とフランス国立科学研究センター人類遺伝学研究所で行われました。
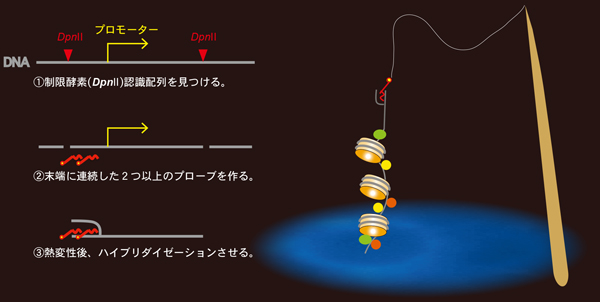
ePICh法のための人工核酸プローブデザインの秘訣。ターゲット配列近くの制限酵素認識部位周辺に、連続した二つ以上のプローブを作成する。プローブ結合部位がDNA断片の末端に位置する場合、ハイブリダイゼーション後に、解離したもう一方の鎖の再アニリーングする力が弱くなるため、プローブが二本鎖DNA内に安定にとどまる。
石川麻乃研究員が日本生態学会奨励賞を受賞

インドネシアムナ島の調査地で現地の人たちと。 後方左から3番目が石川研究員。
3月20日の日本生態学会において、生態遺伝学研究室の石川麻乃研究員が「表現型可塑性の進化とその分子遺伝機構」の研究に関して、日本生態学会奨励賞(鈴木賞)を受賞しました。鈴木賞は、学位取得後4年くらいまでの今後の優れた研究展開が期待できる若手研究者に授与される賞です。 石川研究員は、大学院時代にはアブラムシの表現型多型の運命決定機構について、学位取得後はトゲウオ科魚類に材料を移し季節性回遊を示す生態型と示さない生態型の日長応答性の違いの遺伝基盤について研究してきました。双方のシステムにおいて、表現型可塑性の進化の背景に存在する多機能性ホルモンの環境応答性の進化過程を解明し、さらに、トゲウオではこのホルモン応答の獲得や喪失を引き起こす具体的な遺伝的変化を明らかにしつつあります。これらの一連の研究成果と将来性が高く評価されました。
温度センサーができるまで -感覚受容神経の運命決定メカニズムの一端を解明-
Co-expression of the transcription factors CEH-14 and TTX-1 regulates AFD neuron-specific genes gcy-8 and gcy-18 in C. elegans.
Hiroshi KAGOSHIMA and Yuji KOHARADevelopmental Biology, 2015, 399(2): 325-336. DOI: 10.1016/j.ydbio.2015.01.010
動物の体は、それぞれに異なる機能を持つ多様な細胞から成り立っています。中でも感覚神経には様々な種類があり、一つ一つがある特定の刺激(味、匂い、温度など)だけを受容するように特殊化しています。このように特殊化した機能を持つためには、それぞれの神経は自身に必要な遺伝子だけを選んで発現(*注1)しなくてはなりません。我々は、この過程で行われる遺伝子の発現制御のしくみを明らかにするため、実験モデル生物:線虫C. elegans (シー・エレガンス)を材料に研究を進めています。C. elegans の体は約1,000個の細胞からなる非常にシンプルな動物ですが、人間と同様に味覚、嗅覚、温度などを感じる感覚神経、記憶や学習を司る中枢神経、筋肉を制御する運動神経を持っており、これら全ての神経細胞の形態や、これらが作る神経接続のネットワークが完全に明らかになっています。
今回の研究で、我々はC. elegans の温度センサーであるAFD温度感受神経細胞に着目しました。この細胞では、温度感受遺伝子の一つ、グアニル酸環状化酵素(*注2) gcy-8とgcy-18が発現しています。我々はgcy-8とgcy-18の発現調節領域で、一組のホメオボックス転写制御因子CEH-14とTTX-1が一緒に遺伝子発現の調節スイッチとして働くことを示しました。次いで、これら二つの転写因子が結合するDNAの配列を明らかにし、これらの配列がAFDでのgcy-8とgcy-18の発現に必須であることを示しました。さらに、嗅覚受容細胞であるAWBに、この一組の転写因子を両方、同時に強制発現させることで、この細胞にgcy-8とgcy-18を発現させることにも成功しました。これは、転写因子CEH-14とTTX-1が、本来AWBになるはずだった細胞の運命をAFDに変更し得ることを示しています。
本研究では、CEH-14とTTX-1が中心となって、AFD神経の分化と機能に必要な温度感受遺伝子の発現を調節している可能性を示しました。我々は、今後この研究が、未熟な神経細胞が温度感受神経に特殊化する運命決定のメカニズムや、生物が温度を感じる機構の解明に繋がるのではないかと考えています。
(*注1) 発現:遺伝情報がmRNAを経て、タンパク質が合成され、細胞内で機能すること。染色体(DNA)上にある遺伝子はそのままでは働けません。細胞は自身に必要な遺伝子を選んで、遺伝情報のコピーであるmRNAを作ります。mRNAを元にタンパク質が合成され、細胞は異なる機能を持つようになります。この一連の流れが遺伝子の「発現」です。この論文では、特に「発現」の一番最初の段階の遺伝情報の選択のメカニズムについて得られた成果を報告しています。
(*注2) グアニル酸環状化酵素:細胞外からのシグナルを細胞核に伝達する過程を仲介する機能タンパク質。
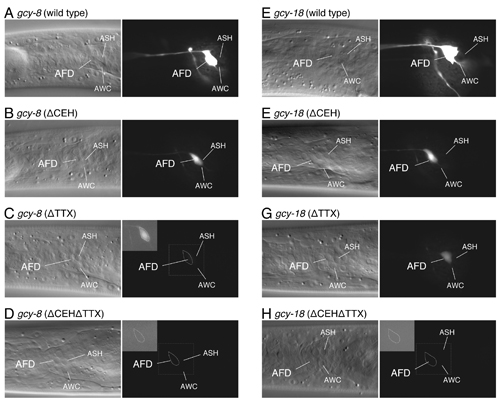
gcy-8、gcy-18プロモーターの中にある、CEH-14とTTX-1の結合配列を破壊すると、GFPレポーターはAFDでの発現を失う。
gcy-8プロモーターとgcy-18プロモーターにある、CEH-14とTTX-1の結合配列を一方(ΔCEH: CEH-14結合配列を破壊、ΔTTX: TTX-1結合配列を破壊)、または両方破壊(ΔCEHΔTTX)して、GFPレポーターの発現の変化を観察した。写真の露光時間は、野生型(A, D)は0.2秒、変異型(B-D, E-H)は2秒。発現が弱い・無いものについては、デジタル増幅を行い、左上の灰色部に示した。
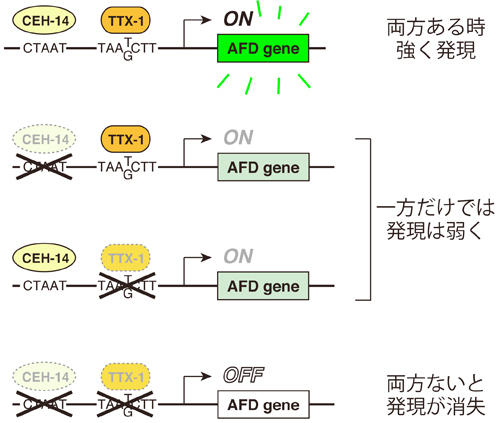
AFD遺伝子の発現には、CEH-14とTTX-1の両方の結合配列が必須である。
転写因子CEH-14とTTX-1は、温度感受神経AFDで働く遺伝子群の調節領域(CEH-14: CTAAT, TTX-1: TAA(T/G)CTT)に結合し、その遺伝子の発現を制御している。一方の転写因子の結合配列が破壊されても、ある程度の遺伝子発現は保たれるが、その両方の結合配列が破壊された場合、遺伝子発現は完全に喪失する。
電位依存性ナトリウムチャネルの品質管理と動物の運動能力
RING finger protein 121 facilitates the degradation and membrane localization of voltage-gated sodium channels
Ogino, K., Low, S. E., Yamada, K., Saint-Amant, L., Zhou, W., Muto, A., Asakawa, K., Nakai, J., Kawakami, K., Kuwada, J. Y., and Hirata, H.PNAS, 112: 2859-2864. DOI: 10.1073/pnas.1414002112
私たちは動物の運動能力を規定する遺伝的要因(氏)と環境要因(育ち=後天的変化=神経可塑性)の実体解明を目指しています。
動物が運動するためには神経細胞が活動電位を発生させることが必要です。そのためには電位依存性ナトリウムチャネル(NaV)が神経細胞の中でも軸索起始部とよばれる軸索の根元部分に輸送され、そこでNa電流を発生させなければなりません。これまでNaVがNa電流を発生させ活動電位を生み出す機構についてはよく研究されてきましたが、NaVが合成されて軸索起始部まで輸送される過程は分かっていませんでした。私たちはゼブラフィッシュ個体やヒト細胞を用いた解析から、小胞体に存在するユキチンリガーゼRNF121がNaVの品質管理を行い、これが軸索起始部へのNaVの輸送、ひいては活動電位の発生や動物の運動に必須であることを明らかにしました。
NaVは小胞体で合成され、適切に折りたたまれることで正しい立体構造をとります。その後、ゴルジ体で補助サブユニットNaVβと会合することで安定化し、軸索起始部へ輸送されます。NaVは膜貫通ドメインが24個ある、折りたたみの難しいタンパク質で、合成されたNaVは一定の割合で折りたたみ異常による不良品になると考えられます。RNF121は小胞体でこれらNaVをユビキチン化し、プロテアソームによる分解へ仕向けることで、NaVの品質管理を行うことが分かりました。RNF121を欠く神経細胞では、折りたたみ異常の不良品NaVが小胞体やゴルジ体に蓄積してNaVβを差し押さえるため、正常に折りたたまれたNaVと会合できるNaVβが不足し、NaVがゴルジ体から先へ輸送されなくなります。その結果、RNF121を欠く個体では神経細胞が活動電位を作れず、運動能力がなくなり、逃避行動が見られなくなります。
本研究から、運動能力を規定する遺伝的要因として、RNF121による電位依存性ナトリウムチャネルNaVの品質管理と局在制御が重要であることが分かりました。これは活動電位の発生とその異常に関する新しい動作原理を提唱するものです。膜貫通ドメインを多くもつイオンチャネルやトランスポーターは神経細胞に多く、他のチャネルやトランスポーターでも同様の品質管理機構が存在し、それが神経活動を支え、動物の運動・行動・情動を規定すると考えられます。
本研究はロックフェラー大学、ミシガン大学、埼玉大学との共同研究で行われました。
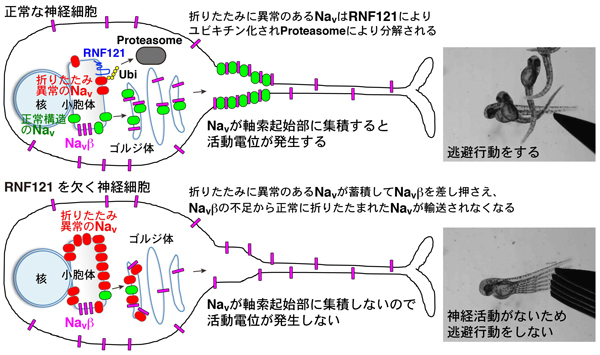
小胞体で合成されるNaVは一定の確率で折りたたみ異常による不良品(赤色)となりますが、これらはRNF121によりユビキチン化され、プロテアソームにより分解されます。一方、正常に折りたたまれたNaV(緑色)はゴルジ体でNaVβ(紫色)と会合して軸索起始部へ輸送されます。また、NaVβは単独でも一定量は細胞膜へ運ばれ、これは細胞接着に寄与します。RNF121を欠く神経細胞では、折りたたみ異常のNaVが小胞体やゴルジ体に蓄積し、これらがNaVβと会合してNaVβを差し押さえるため、正常に折りたたまれたNaVと会合できるNaVβが枯渇し、NaVはゴルジ体から先へ輸送されなくなります。その結果、RNF121を欠く個体では神経細胞で活動電位が作られず、運動能力がなくなります。
遺伝研 一般公開 : 4月4日(土)開催
痛風の発症に関わる新たな遺伝子領域を発見 —どの病型になりやすいかの予測も可能に—
![]()
Genome-wide association study of clinically-defined gout identifies multiple risk loci and its association with clinical subtypes
Hirotaka Matsuo, Ken Yamamoto, Hirofumi Nakaoka, Akiyoshi Nakayama, Masayuki Sakiyama, Toshinori Chiba, Atsushi Takahashi, Takahiro Nakamura, Hiroshi Nakashima, Yuzo Takada, Inaho Danjoh, Seiko Shimizu, Junko Abe, Yusuke Kawamura, Sho Terashige, Hiraku Ogata, Seishiro Tatsukawa, Guang Yin, Rieko Okada, Emi Morita, Mariko Naito, Atsumi Tokumasu, Hiroyuki Onoue, Keiichi Iwaya, Toshimitsu Ito, Tappei Takada, Katsuhisa Inoue, Yukio Kato, Yukio Nakamura, Yutaka Sakurai, Hiroshi Suzuki, Yoshikatsu Kanai, Tatsuo Hosoya, Nobuyuki Hamajima, Ituro Inoue, Michiaki Kubo, Kimiyoshi Ichida, Hiroshi Ooyama, Toru Shimizu, and Nariyoshi ShinomiyaAnnals of the Rheumatic Diseases, 2015 Feb 2. pii: annrheumdis-2014-206191. DOI: 10.1136/annrheumdis-2014-206191
生活習慣病の一つである痛風は、激しい関節痛を引き起こすのみならず、高血圧、脳卒中などのリスクとなることが知られています。近年の遺伝子研究により、痛風の発症には遺伝的要因が関与していると考えられていましたが、その全容はまだ明らかとなっておりません。
この度、松尾洋孝(防衛医科大学校講師)、山本健(久留米大学教授)、中岡博史(国立遺伝学研究所特任研究員)、中山昌喜(防衛医科大学校医官)、崎山真幸(同)らの研究グループは、ヒトゲノム全体を調べるゲノムワイド関連解析(GWAS)を行い、新規のものも含め、痛風の発症に関わる5つの遺伝子領域を発見しました。今回の研究は、アンケート用紙などによる自己申告の痛風症例は対象とせず、医師により確実に診断された痛風症例のみを対象とした世界で初めてのGWAS です。このため、痛風の病型ごとの違いを見るような詳細な解析が可能であり、病型ごとに異なる遺伝子領域が関連していることも発見しました。
本研究は、近年増えつつある痛風患者の遺伝的リスクを評価する有用な手段となりうる成果です。この発見により、痛風を発症するリスクの高いヒトを早期に見つけ出し、さらにどの病型になりやすいかを予測でき、個人差に応じた治療薬の選択につながることが期待されます。痛風に対する新たな視点からの予防法や治療薬の選択に有用であり、医療費の削減につながることが多いに期待されます。
本研究は、文部科学省新学術領域研究「ゲノム支援」のサポートを受けて進められました。
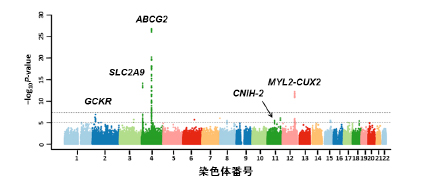
日本人男性の痛風患者におけるゲノムワイド関連解析(GWAS)の結果
日本人の痛風患者945人と対照者1,213人についてのGWASの結果(一次解析)で、第1~22番染色体までの約70万か所の一塩基多型(横軸)における痛風との関連の強さ(縦軸)をグラフ化したもので、プロットが上に行くほど痛風との関連が強い一塩基多型であることを表しています。図に示す5か所の遺伝子領域で痛風との強い関連性を認め、別の集団でも関連性が再現(二次解析)されました。
線虫C. elegans 初期胚における、細胞周期時間と細胞サイズにはベキ則の関係がある
Power law relationship between cell cycle duration and cell volume in the early embryonic development of Caenorhabditis elegans
Yukinobu Arata, Hiroaki Takagi, Yasushi Sako, and Hitoshi SawaFrontiers in Physiology, 2015 Jan 28;5:529. DOI: 10.3389/fphys.2014.00529
細胞サイズは細胞周期時間を決定する要因の一つである。トロント大学の増井禎夫教授らは、アフリカツメガエル初期胚における細胞周期時間は、細胞半径の2乗に比例して伸長することを見つけた。この結果を基に、彼らは細胞周期時間が細胞表面の活性によって決定すると言うモデルを提唱した。しかし、この“2乗ベキ則”は脊椎動物であるツメガエル以外の動物胚では検証されていなかった。我々は、無脊椎動物である線虫C. elegans 初期胚でも細胞周期時間と細胞サイズの関係がベキ則に従うことを見つけた。ただし、細胞系譜ごとのベキの値は3つのグループに分類され、いずれの系譜のベキ値もツメガエル胚の値よりも小さかった。興味深いことに、細胞サイズと細胞核サイズの間にもベキ則が成立していた。細胞質と核の相互作用を想定して細胞と核サイズの比のベキ値を求めると、そのベキ値が「最もサイズ—時間の相関が強い細胞系譜」におけるサイズ-時間のベキ値にほぼ一致することを見つけた。この「サイズ—時間」と「細胞体積—核体積」の間のベキ値の一致から、我々は、「C. elegans 初期胚におけるサイズ—時間の関係が、細胞と核サイズの比という幾何的な制約により決定している」という新たなモデルを提案した。他の動物種でも同様の制約により、細胞周期時間が決定している可能性がある。
本研究は理化学研究所および奈良県立医科大学との共同研究で行われました。
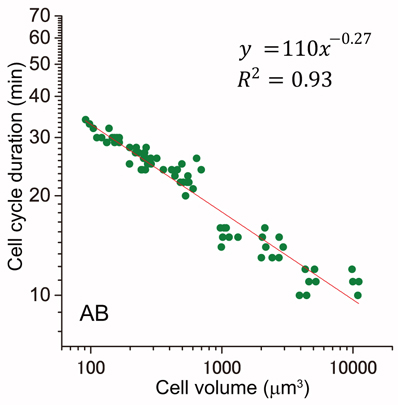
細胞周期時間と細胞体積は、両対数グラフ上で直線的な関係(ベキ則)にある。分類された3種のベキ値を示す細胞系譜の内、AB細胞系譜における結果を表示した。
ヒトテロメア配列を認識するポリアミド化合物の特異性の向上
(i) Structural Evaluation of Tandem Hairpin Pyrrole–Imidazole Polyam-ides Recognizing Human Telomeres
Hirata, A., Nokihara, K., Kawamoto, Y., Bando, T., Sasaki, A., Ide, S., Maeshima, K., Kasama, T., and Sugiyama, H. Journal of the American Chemical Society (JACS), July 18, 2014. DOI: 10.1021/ja506058e
(ii) Tandem Trimer Pyrrole-Imidazole Polyamide Probes Targeting 18 Base Pairs in Human Telomere Sequences
Kawamoto, Y., Sasaki, A., Hashiya, K., Ide, S., Bando, T. *, Maeshima, K. *, and Sugiyama, H.**co-corresponding authors
Chemical Science, January 20, 2015. DOI: 10.1039/C4SC03755C
ピロール・イミダゾール(PI)ポリアミド化合物は、DNAの二重らせんの副溝を通して、塩基配列を特異的に認識することができます。この方法は、これまで行われていた、FISHなどの塩基対を認識させる方法に比べ、迅速、簡便、そしてクロマチン構造が維持できるような温和な条件で塩基対認識を行える利点を持ちます。これまでに私たちは、哺乳類のテロメアDNA [(TTAGGG)n]を認識するPIポリアミド(TH59)の合成(Maeshima et al., EMBO J. 2001)および、その大量合成法を開発してきました (Kawamoto et al., JACS. 2013)。
今回、従来のTH59を改良し、テロメア配列への結合特異性を上げることに成功しました。TH59はヘアピン構造が二つヒンジを介して連結し、テロメアリピートに結合します。本論文では、ヒンジの長さを至適化したポリアミド (HPTH59-b, 図A)、ヘアピン構造を三つ連結させ、より長い18bpテロメアリピートを認識するポリアミド (TT59, 図B)を合成しました。これらの改良により、ポリアミドが非特異的配列に結合する頻度を減少させ、テロメア領域以外からのシグナルを飛躍的に減少させることができました。今後、簡便かつ高精度なテロメア長の定量法として、基礎研究のみならず臨床分野において広く用いられることが期待されます。
本研究は、京都大・理学研究科・杉山教授グループおよび株式会社ハイペップ研究所 (京都府)との共同研究です。遺伝研・共同研究Bのサポートを得ておこなわれました。
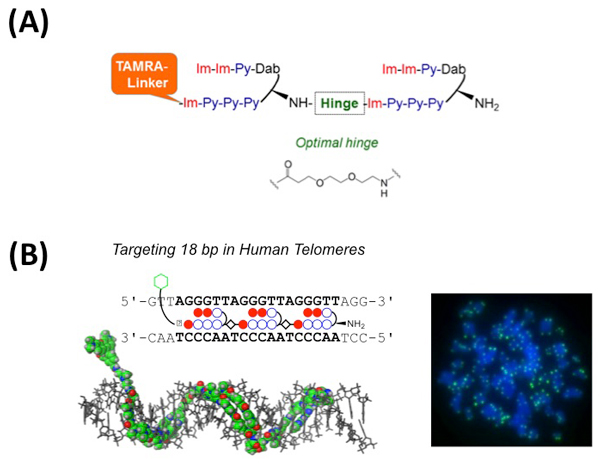
(A)ヒンジが改良されたHPTH59-bの模式図。改良型ヒンジ領域の化学構造が示されている。
(B)左、ヘアピン構造を三つ連結させたTT59ポリアミドの模式図、および結合様式。右、染色体スプレッドをTT59で標識した画像。青色 (DNA染色)の染色体末端が緑色のドット状に標識されている。
太田朋子名誉教授がクラフォード賞を受賞
スウェーデン王立科学アカデミーは、2015年のクラフォード賞を太田朋子名誉教授とリチャード・レウォティン米ハーバード大学名誉教授へ贈呈することを発表しました。今回の賞は、両教授による遺伝的変異および進化への理解を促す先駆的研究に対して贈られます。授賞式は5月5〜7日にスウェーデンのストックホルムで行われます。
クラフォード賞は、天文学、数学、生物科学、関節炎の各分野の研究に対して年ごとに順次与えられるものであり、ノーベル賞が扱わない専門分野を補完しています。
今回の受賞は、太田先生が遺伝研で行った遺伝的多型の理解に関する基礎的貢献が認められたものです。太田先生は1973年、集団内における変異および同種間における違いを理解する重要な要素としての「ほぼ中立説」をNature誌に発表しました。現在では弱い淘汰はゲノム進化を理解する上での中核となる考えであるとされており、太田先生の考え方は生体医学、システム生物学、比較ゲノム解析の研究に大きな影響を与えています。
転写因子の物理的サイズはクロマチンドメイン内の転写制御にとって重要である
The physical size of transcription factors is key to transcriptional regulation in chromatin domains
Kazuhiro Maeshima, Kazunari Kaizu, Sachiko Tamura, Tadasu Nozaki, Tetsuro Kokubo, and Koichi TakahashiJournal of Physics: Condensed Matter, 27, 064116 (10 pp), 2015. DOI: 10.1088/0953-8984/27/6/064116
真核生物には、大小様々な大きさの転写因子があります。そして、これらの転写因子は、微小な空間に折り畳まれている長いDNAから、必要な遺伝情報を読み出すのに必要です。一般的に、遺伝子特異的な働きをする転写因子のサイズは小さく (~50 kDa)、これらはゲノムDNA中の標的となる調節領域を探して結合します。そして、この小さい転写因子が、基本転写因子、メディエーター、RNAポリメラーゼ、ヌクレオソームリモデラー、ヒストン修飾因子など、巨大タンパク複合体 (1-3 MDa以上) の標的配列への結合を誘導すると考えられています。最近、細胞核内では、ヌクレオソーム線維が凝集することによってできるクロマチンドメイン(topologically associating domains, 図の青ボール集団) が多数形成されていることが分かってきました。私たちは、この凝集したクロマチンドメインにおける転写制御に、転写因子やその複合体の物理的なサイズが重要であるという新しいモデルを提唱しました。
私たちは、まずモンテカルロ・シミュレーションによって、凝集したクロマチンドメイン内部に入ることができる転写因子の物理的なサイズを決定しました。その結果、遺伝子特異的な転写因子群(小さいサイズ)は、ドメイン内部に入り込むことができる一方(図の黄ボール)、サイズが大きな転写複合体群は、ドメイン内部に入ることはできないことが分かりました(図の緑ボール)。
この結果、サイズの小さな転写因子がクロマチンドメイン内の標的配列を探索して結合し(図a)、その転写因子-標的配列複合体がドメイン表面に出てきた際、この転写因子を「目印」として、サイズの大きい転写因子複合体が標的配列に結合すると考えました (図b)。標的配列に結合した巨大な転写因子複合体は、ドメイン内部へと動くことが難しいため、標的配列をドメインの表面に維持する「ブイ(浮き袋)」のような働きができます(図b)。そして、ヌクレオソームリモデラー、ヒストン修飾因子など、他の巨大複合体と共に安定的な転写を可能にするという新しいモデルを提唱しました (図c)。
これらの転写因子の物理的サイズに依存した、標的探索の方法や、標的配列をドメイン表面につなぎ止める性質は、DNA複製や修復、組換えを含む様々なDNA機能に共通するメカニズムと考えられます。
本研究は理研・生命システム研究センター高橋恒一・海津一成、横浜市立大学・古久保哲朗らとの共同研究としておこなわれ、英国Journal of Physics: Condensed matter誌の「Physics of chromatin」特集号に掲載されました。
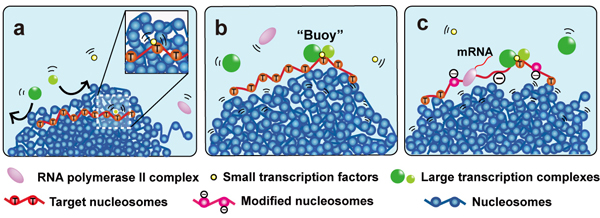
転写制御における「ブイ(浮き袋)」モデル
凝集したクロマチンドメインは青いボール集団で示している。
(a) 黄色い小さな転写因子は凝集したクロマチンドメイン内部を動くことができるが、緑の大きい転写因子複合体はドメインに入ることができない。 (b) 大きな転写因子複合体がブイ(浮き袋)となって、標的配列がドメイン表面で維持される。(c) ヌクレオソームリモデラー、ヒストン修飾因子など、他の巨大複合体と共に、安定的な転写がおこる。
1分子のタンパク質でDNAの2本鎖をほどく新しい仕組み
超分子構造研究室・白木原研究室
Structural basis for replication origin unwinding by an initiator-primase of plasmid ColE2-P9: Duplex DNA unwinding by a single protein
Hiroshi Itou, Masaru Yagura, Yasuo Shirakihara, and Tateo ItohJournal of Biological Chemistry, 2015 Feb 6;290(6):3601-3611. DOI: 10.1074/jbc.M114.595645
DNAを複製する際、2本鎖構造が一時的に解かれます。この2本鎖構造を壊すためには、複数のタンパク質が集まって出来る複合体が必要です。1本鎖が露出した部分に、ヘリカーゼ、プライマー合成酵素、DNA合成酵素等が結合し、DNAの複製が始まります。大腸菌を宿主とするColE2プラスミドの複製開始因子Repは、プラスミド上の複製開始点に特異的に結合し、DNAの2本鎖構造を解き、更にRNAプライマーの合成を行う多機能なタンパク質です。
今回の研究では、Repが持つDNA結合領域と複製開始点との複合体の立体構造を解明しました。RepのDNA結合領域は3つのモジュールで構成され、1分子内の各モジュールが連携して複製開始点へ特異的に結合し、その2本鎖構造を巧みに解く仕組みが明らかになりました。さらに、立体構造および機能が未知であったPriCTと呼ばれる領域が、2本鎖の解裂に重要な役割を果たす事も今回初めて明らかになりました。このドメインは様々なバクテリアを宿主とするプラスミドだけでなく、バクテリアや真核生物のウィルス等でも保存されていることから、今後これらのタンパク質が担う分子機構に対する理解がより深まると期待されます。
本研究は信州大学理学部等との共同研究で行われました。
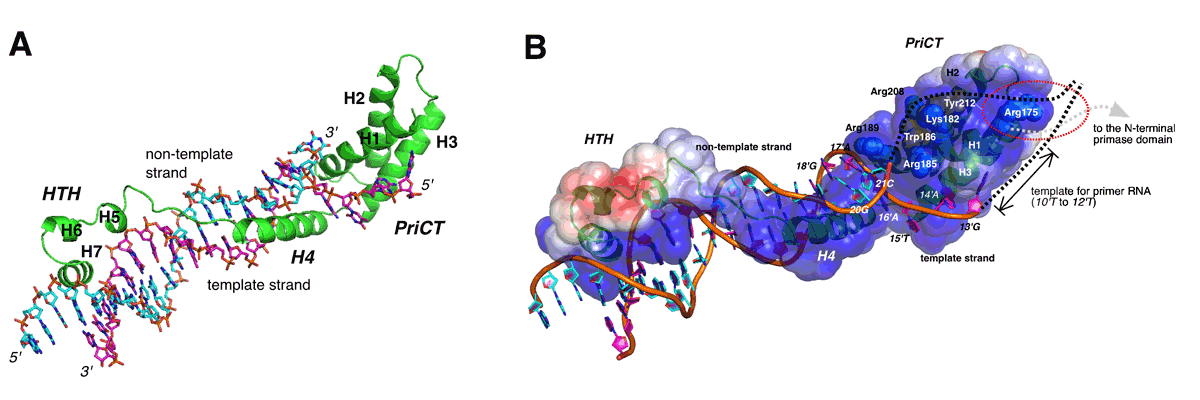
(A) ColE2 RepのDNA結合領域と複製開始点との複合体の立体構造。DNA分子に沿って細長く巻き付くような形を持つ事で、DNAの構造を壊すに足りる結合力を確保している。
(B) 本研究から提案された複製開始点解裂のモデル。 PriCT領域は2本鎖の解裂と解けた構造の安定化に中心的な役割を持つ。















