Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
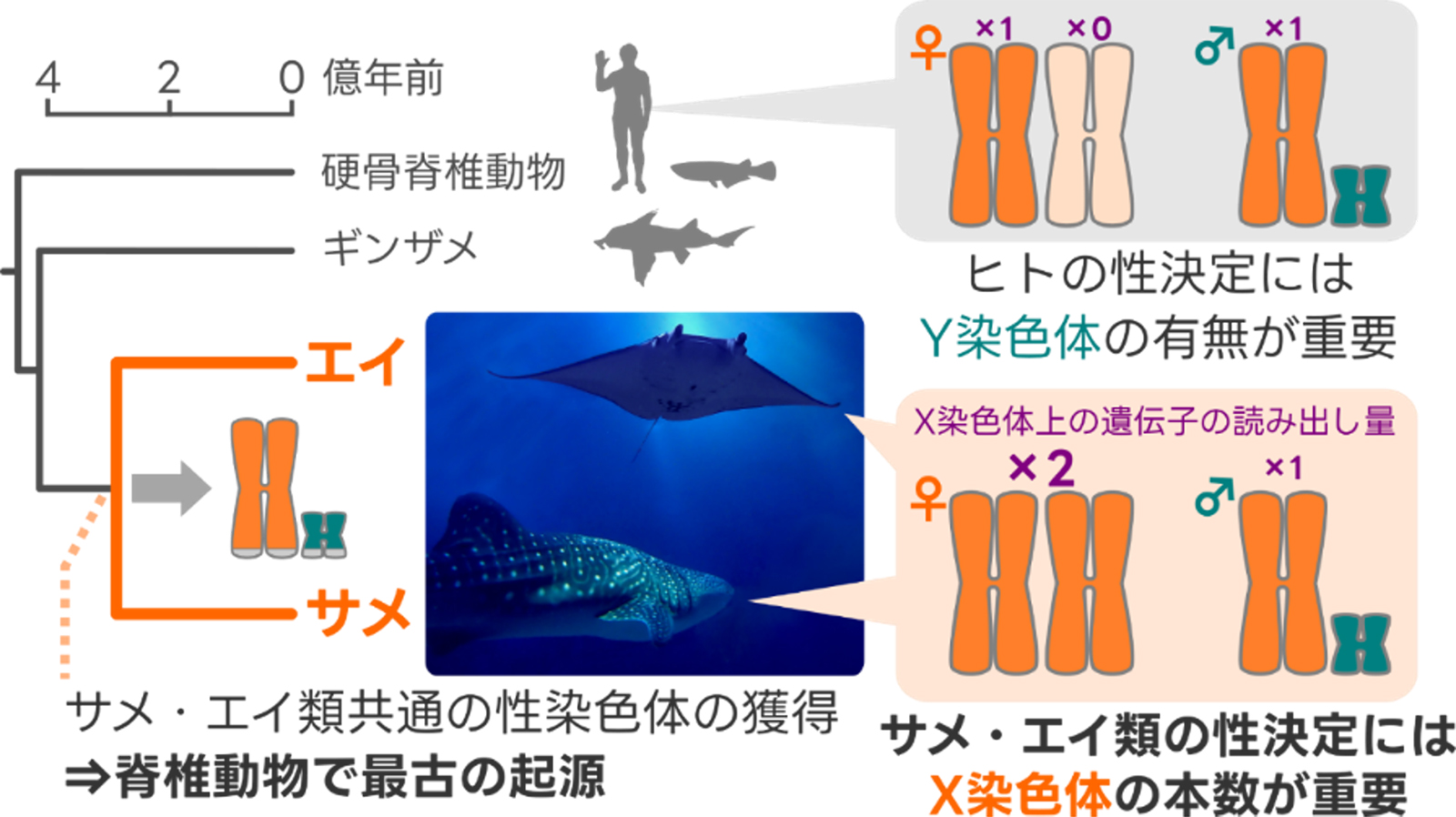
脊椎動物最古の性染色体の発見
~ゲノム情報から迫るサメ・エイ類のユニークな性決定~
プレスリリース
Sharks and rays have the oldest vertebrate sex chromosome with unique sex determination mechanisms
Taiki Niwa, Yoshinobu Uno, Yuta Ohishi, Mitsutaka Kadota, Naotaka Aburatani, Itsuki Kiyatake, Daiki Katooka, Michikazu Yorozu, Nobutaka Tsuzuki, Atsushi Toyoda, Wataru Takagi, Masaru Nakamura, Shigehiro Kuraku*
*責任著者
Proceedings of the National Academy of Sciences USA (2025) DOI:10.1073/pnas.2513676122
性は多くの生物が持っていますが、それを決める仕組みは同じではありません。私たちヒトを含む脊椎動物は遺伝的要因や胚発生時の温度など環境要因に頼った多様な性決定の仕組みを持っていますが、それがどのように進化してきたのかは大きな謎の一つです。サメやエイを含む軟骨魚類は、脊椎動物の他の系統とは深く隔たれ独自の進化を遂げてきた仲間ですが、他の系統とは対照的に軟骨魚類の性を決める仕組みはほとんど調べられていませんでした。総合研究大学院大学 大学院生の丹羽大樹、国立遺伝学研究所 分子生命史研究室の工樂樹洋教授(理化学研究所生命機能科学研究センター 客員研究員)、徳島大学大学院社会産業理工学研究部の宇野好宣准教授、(一財)沖縄美ら島財団総合研究所の中村將参与、東京大学大気海洋研究所の髙木亙助教、および複数の水族館から成る研究グループは、軟骨魚類のゲノム配列の比較により、サメ・エイ類のX染色体が共通の遺伝子セットを保持し、Y染色体が大半の遺伝子を失っていること、そして、それらの性染色体が約3億年もの長い間保持されてきた可能性が高いことを明らかにしました。X染色体には雌雄での本数の差を埋め合わせる遺伝子量補償の仕組みが働いておらず、それこそがサメ・エイ類の性の決定に重要である可能性が示されました。本研究は、サメ・エイ類では他の脊椎動物とは異なる仕組みで性が決まっていることを示すものであり、性の成り立ちについてのこれまでの研究に一石を投じる成果です。
本研究は、情報・システム研究機構 国立遺伝学研究所 分子生命史研究室(丹羽大樹 大学院生(総合研究大学院大学所属)、工樂樹洋 教授)、同研究所 比較ゲノム解析研究室(豊田敦 特任教授)、理化学研究所 生命機能科学研究センター 分子配列比較解析チーム(宇野好宣 研究員(研究当時)、大石雄太 大学院生リサーチ・アソシエイト(研究当時;神戸大学大学院理学研究科所属)、門田満隆 技師(研究当時)、工樂樹洋 チームリーダー(研究当時))、一般財団法人 沖縄美ら島財団 総合研究所(中村將 参与(研究当時))、徳島大学 大学院社会産業理工学研究部(宇野好宣 准教授)、東京大学 大気海洋研究所(油谷直孝 大学院生(研究当時)、髙木亙 助教)、および、海遊館(喜屋武樹)、新江ノ島水族館(加登岡大希)、アクアパーク品川(萬倫一(研究当時))、下田海中水族館(都築信隆)から構成される研究グループにより遂行されました。
本研究は、日本学術振興会(JSPS)科学研究費補助金(課題番号:20H03269, 16H06279 (先進ゲノム支援), 21K06286, 23KJ1002)の支援、および理化学研究所 大学院生リサーチ・アソシエイトの支援を受けて行われました。
本研究成果は、国際科学雑誌 「Proceedings of the National Academy of Sciences USA (PNAS)」 に2025年7月23日(日本時間)にオンライン掲載されました。
総研大生 島添將誠さんが「Poster prize: 1st Place」を受賞
ゲノムダイナミクス研究室(前島研究室)の島添將誠さん(総研大遺伝学コースD4・学振特別研究員DC1)が、2025年7月15日-18日にドイツEMBL Heidelbergで開催された「EMBL Conference: Gene regulation: one molecule at a time」でポスター発表をおこない、「Poster Prize: 1st Place」を受賞しました。さらに、「EMBL Advanced Training Centre Corporate Partnership Programme fellowship」にも選出されました。
本出張はSOKENDAI研究派遣プログラムの支援を受けました。
▶ 受賞発表タイトル:Linker histone H1 functions as a liquid-like glue to organize chromatin in living human cells
▶ EMBL Conference: Gene regulation: one molecule at a time

島添將誠さん
総研大生 Samal Tazhibayevaさんがポスター賞を受賞

多細胞構築研究室の Samal Tazhibayeva さん(総研大遺伝学コースD4)が、名古屋市で、2025年7月16日-18日に開催された発生生物学会細胞生物学会合同大会においてポスター賞を受賞しました。
・ 受賞発表タイトル:CWN-2/Wnt localization in C. elegans challenges gradient-dependent polarity regulation by Wnt
学振特別研究員 八尾晃史さんがBest Poster Presentation Awardを受賞

分子生命史研究室の八尾晃史研究員(学振特別研究員PD)が2025年7月8〜12日に仙台国際センターで開催されたThe 19th International Congress of Comparative Endocrinologyにおいて、Best Poster Presentation Awardを受賞しました。
・学会名:The 19th International Congress of Comparative Endocrinology
・ 受賞発表タイトル:Follicle-stimulating hormone regulates female-to-male sex
change in a teleost fish, harlequin sandsmelt
トマトの雄性不稔を回復させる遺伝子座を特定しました

Multiple fertility restorer loci for cytoplasmic male sterility caused by orf137 in tomato
Yurie Iki, Issei Harada, Kentaro Ezura, Seira Mashita, Kosuke Kuwabara, Hitomi Takei, Atsushi Toyoda, Kenta Shirasawa, Tohru Ariizumi
Journal Of Experimental Botany (2025) DOI:10.1093/jxb/eraf309
かずさDNA研究所は、筑波大学、国立遺伝学研究所、先進ゲノム支援と共同で、トマトの雄性不稔を回復させる遺伝子座を特定しました。
キャベツやダイコン(アブラナ科)、トマトやピーマン(ナス科)など消費の多い野菜は、異なる2系統を両親としてかけあわせること(交雑)で得られる一代雑種(F1)が一般的です。F1品種は、両親の優れた性質を引き継ぎ、同時期に同じ品質の野菜が大量に収穫できることから、現代の農業には欠かせない存在です。
トマトなどのナス科作物では、F1品種を作る際に、同じ花の花粉が受粉(自家受粉)しないように、開花前の花から雄しべを取り除く「除雄(じょゆう)」という作業が必要ですが、種苗会社にとって大変手間のかかる作業です。
以前の研究により、トマトで花粉をつくらない性質(雄性不稔)に関わる orf137 遺伝子が特定されており、これを従来品種に導入することで、除雄作業なしにF1種子を採ることができるようになりました。
しかしこの方法では、得られたF1個体も雄性不稔となるため、果実を実らせることができないという問題が残っていました。
一方で、トマトの祖先種の中には、この雄性不稔を回復させる遺伝子(RF遺伝子)を持つものが存在することが知られていましたが、その遺伝子がどこにあるのか(遺伝子座)はこれまで明らかになっていませんでした。
そこで本研究では、以前にゲノムを解読した祖先種2種(Solanum pimpinellifoliumとSolanum lycopersicum var. cerasiforme)と、今回新しくゲノムを解読した祖先種(Solanum cheesmaniae)を利用して、F1での雄性不稔を回復させるRF遺伝子座を解析しました。その結果、祖先種は複数のRF遺伝子座を持つことが明らかになり、RF遺伝子座を識別するためのDNAマーカーを開発することができました。
本研究の成果により、雄性不稔を利用した効率的なF1種子の生産と、F1個体が正常に果実をつけることの両立が可能となり、トマトの品種改良に大きく貢献することが期待されます。
特任研究員 飯田史織さんが「若手女性科学者海外研修助成事業」に採択
ゲノムダイナミクス研究室の飯田史織さん(特任研究員)が、大学女性協会の「2025年度(第3回)若手女性科学者海外研修助成事業」に採択されました。こちらの事業は、同協会の守田科学研究奨励賞受賞者による推薦を受けて応募する若手女性研究者向けの支援制度です。
・ 飯田史織(国立遺伝学研究所ゲノムダイナミクス研究室 特任研究員)
・ 推薦者:川口茜 国立遺伝学研究所/総合研究大学院大学 分子生命史研究室助教(第27回守田科学研究奨励賞受賞者)
・ 分野(テーマ):生物学(初期発生)
・ 研修先:Prof. Sara Wickström, Department of Cell and Tissue Dynamics, Max Planck Institute for Molecular Biomedicine [ドイツ]
夏季休業のお知らせ(8/14-15)
本研究所は、下記のとおり夏季一斉休業を実施します。
ご不便をおかけいたしますが、ご理解とご協力のほどお願いいたします。
令和7年(2025年) 8月14日(木)~15日(金)
総研大生 Samal Tazhibayevaさんがポスター賞(Honorable Mention)を受賞
多細胞構築研究室の Samal Tazhibayeva さん(総研大遺伝学コースD4)が、2025年6月28日-7月2日にアメリカカリフォルニア大学デービス校で開催された 第25回International Worm Meeting で ポスター賞(Honorable Mention)を受賞しました。また、同会議で行われたArt Showにおいて、彼女の作品がgrand prizeを受賞しました。
・ 受賞発表タイトル:CWN-2/Wnt localization on seam cells challenges gradient-dependent polarity regulation by Wnt
総研大生 岡田薫さんが最優秀口頭発表賞を受賞

共生細胞進化研究室の岡田薫さん(総合研究大学院大学 遺伝学専攻 D4、日本学術振興会特別研究員DC1)が、2025年6月22日から27日に韓国・ソウルで開催されたICOP/ISOP 2025にて口頭発表を行い、最優秀口頭発表賞(Best Oral Presentation Award)を受賞しました。また、今回の学会参加にあたりHolz-Conner Awardも受賞しました。
ICOP(International Congress of Protozoology)は、ISOP(International Society of Protistologists)が主催する、原生生物に関する国際的な会議で、4年に1度開催され、幅広いトピックを扱う研究者が世界中から集まる学会です。
・ 受賞発表タイトル:The closed nutrient recycling system in the photosymbiosis between Paramecium bursaria and Chlorella variabilis contributes to survival under oligotrophic conditions
分解タグを付加しなくても標的タンパク質を分解できる新技術
A Single-Chain Antibody-Based AID2 System for Conditional Degradation of GFP-Tagged and Untagged Proteins
Moutushi Islam, Takefumi Negishi, Naomi Kitamoto, Yuki Hatoyama, Kanae Gamo, Ken-ichiro Hayashi, and Masato T. Kanemaki*
*corresponding author
Journal of Cell Science (2025) jcs.263961 DOI:10.1242/jcs.263961
生細胞内において、標的とするタンパク質を短時間で分解除去することにより、そのタンパク質機能の欠損が引き起こす影響を観察することができます。鐘巻研究室が開発したオーキシンデグロン(auxin-inducible degron, AID)技術は、これまで様々なタンパク質の機能解析研究において広く利用されてきました。最新の改良版AID2は、高精度な標的タンパク質の分解制御を可能にします。しかし、ゲノム編集を利用して分解タグを標的タンパク質に付加する必要があり、これまでAID2法を非モデル生物や臨床応用へ展開することを困難にしていました。この問題を克服するため、鐘巻研究室は単鎖抗体を利用することで、標的タンパク質に分解タグを付加しなくても分解誘導できる、単鎖抗体AID2(single-chain antibody AID2, scAb-AID2)法の開発に成功しました。
まず実証実験として、GFPを認識する単鎖抗体であるGFPナノボディを用いました。GFPナノボディと分解タグを融合したアダプターと分解に必要なユビキチンリガーゼOsTIR1(F74G)を、様々なGFP融合タンパク質を発現するヒト培養細胞および線虫に導入し、分解誘導リガンド5-Ph-IAAの添加により、これらGFP融合タンパク質がに分解されることを確認しました。
さらに、がん抑制因子p53および増殖誘導因子H/K-RASに対する単鎖抗体を用いて分解タグと融合したアダプターを設計し、アダプターとOsTIR1(F74G)をヒト培養細胞に導入しました。これら細胞を分解誘導リガンド5-Ph-IAAで処理したところ、p53およびH/K-RASの分解が確認されました。さらに、p53を分解した際には複製ストレス誘導剤に感受性が増し、H/K-RASを分解した細胞で作成した腫瘍では、その腫瘍形成が抑制されました。
この単鎖抗体AID2システムは、従来のAID2 におけるタグ付加の必要性を克服し、標的タンパク質分解を利用した生命科学研究および医療応用への道を拓くものです。
本論文に関連して、筆頭著者の総研大生Moutushi Islamさんが、Journal of Cell Science誌のFirst Personとして取り上げられました。また、本論文が同誌のResearch Highlightとして取り上げられました。
本研究は科研費(23K05836, 21H04719, 23H04925, 25H00979)およびJST CREST(MJCR21E6)のサポートによりおこなわれました。
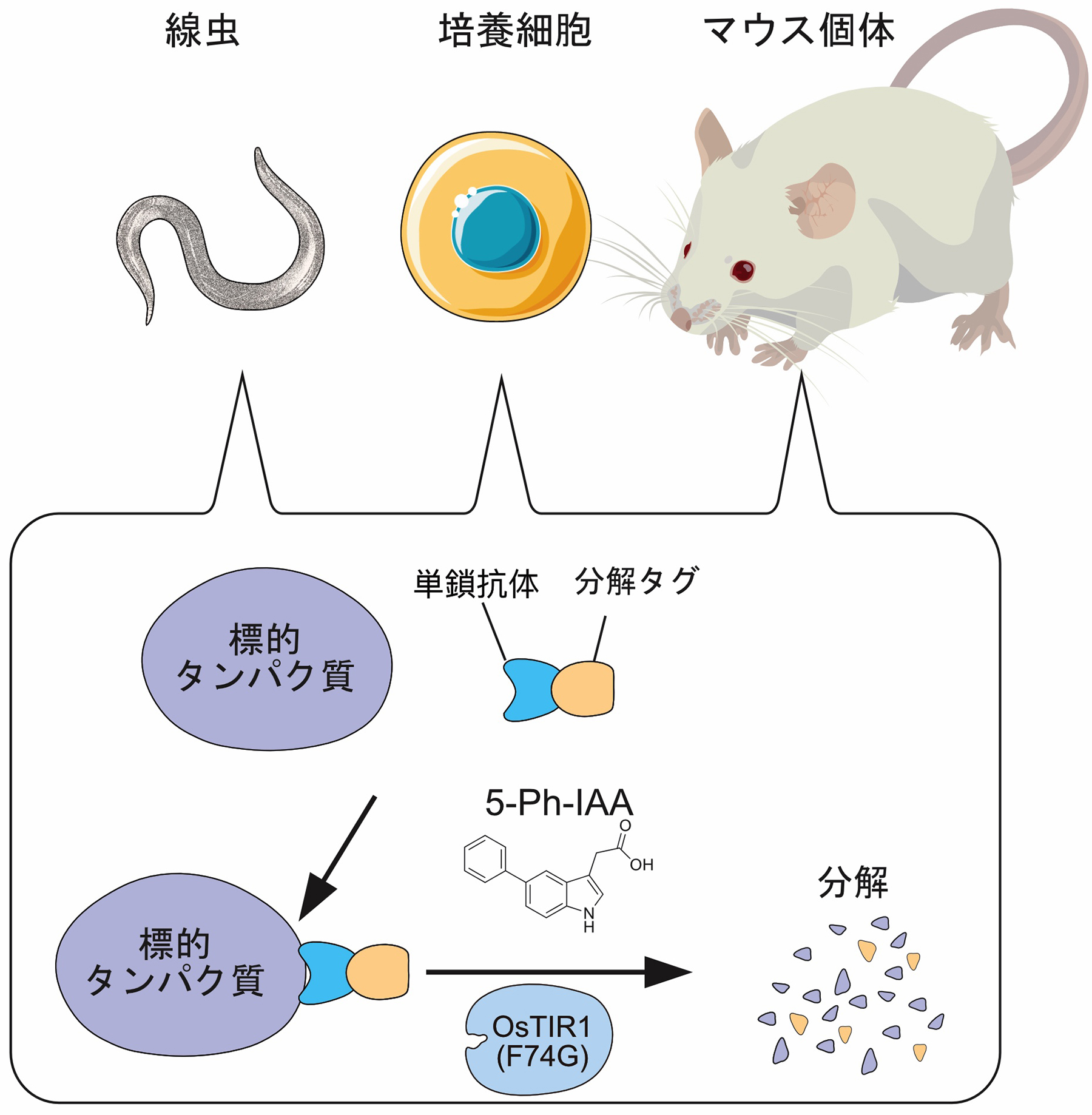
図:単鎖抗体AID2法により、分解タグを付加していないタンパク質が認識されて、5-Ph-IAA存在下で分解される。















