Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
ギンカクラゲの群体がいかにして個体のように振る舞うのか?
技術課 / フェノタイプ研究推進センター / 細胞建築研究室
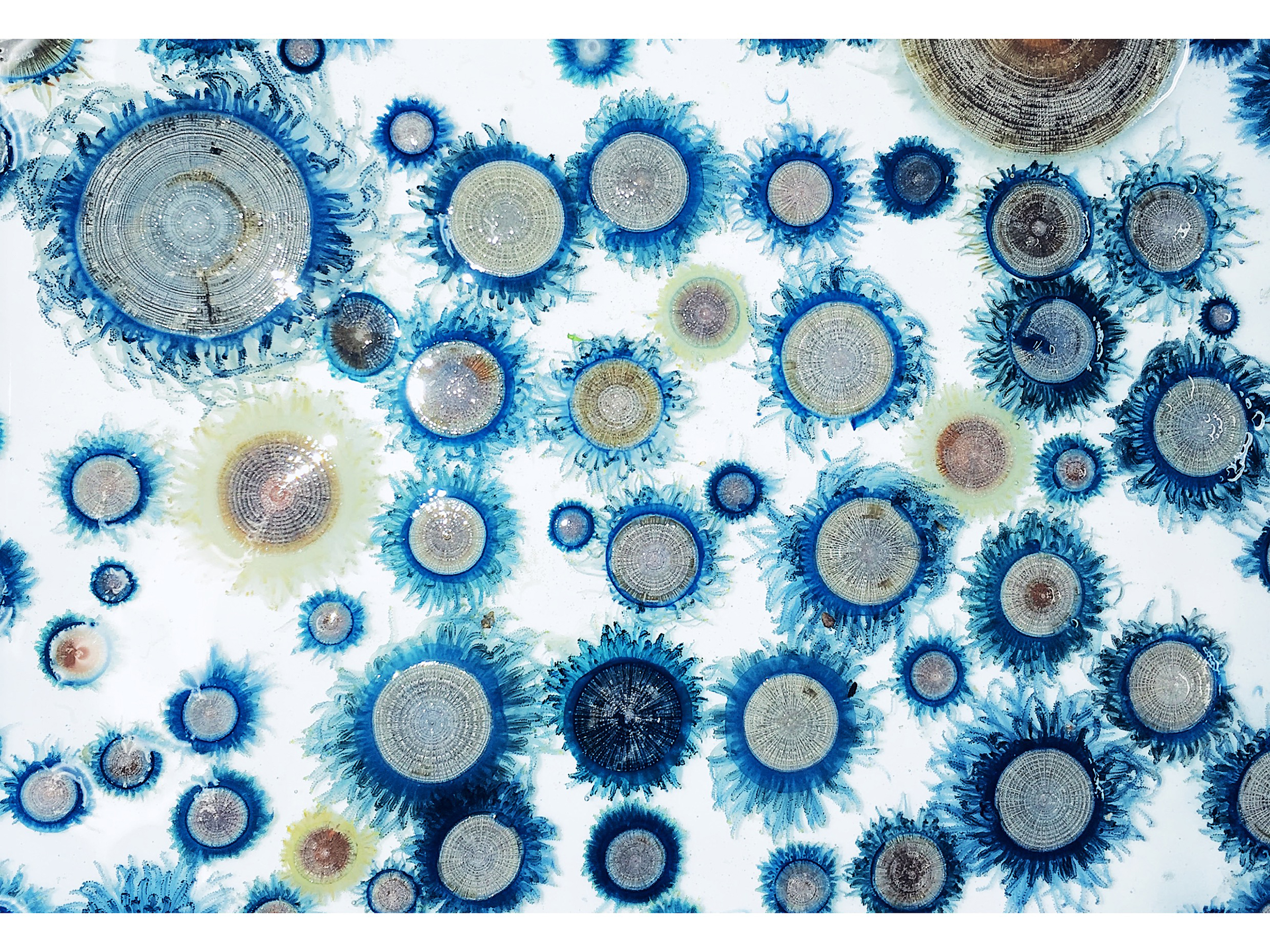
Zooid arrangement and colony growth in Porpita porpita
Kohei Oguchi, Akiteru Maeno, Keita Yoshida, Gaku Yamamoto, Hisanori Kohtsuka and Casey W. Dunn
Frontiers in Zoology (2025) 22, 11 1-12 DOI:10.1186/s12983-025-00565-3
海表面に暮らす不思議な生物のひとつに、青色の触手に囲まれた銀白色の円盤、ギンカクラゲ Porpita porpita がいる。「クラゲ」と呼ばれてはいるが、ギンカクラゲはまったく異なる生物である――複数の機能分化した個虫からなる群体動物なのだ。ギンカクラゲのように海面に浮かんで生活する生物は「プリューストン」と呼ばれ、海洋表層において特有の生態系を形成している。しかし、風や海流の影響を強く受けるこれらの生物は、漂着や発生の時期を予測することが難しく研究が困難であり、生活史の多くが未解明のままである。特にギンカクラゲは構造が脆弱で、長期的な飼育も困難なため、これまで群体の発達様式は不明であった。
そこで本研究では、神奈川県の相模湾沿岸で採集された、さまざまな大きさのギンカクラゲ群体を対象に、組織切片およびマイクロCTによる組織形態学的観察を行った。観察の結果、群体の大きさに関わらず中央に必ず1つの栄養個虫が存在し、群体の成長に伴い生殖個虫や触手個虫の数と大きさが増加することが明らかとなった。また、触手個虫は外套直下に、生殖個虫は栄養個虫と触手個虫の間の上皮全体において新たに出芽することが確認された。得られた標本の中には歪んだ形の群体も見られたが、触手個虫が辺縁部に分布していたことから、群体は再生能力を持つことが示唆された。これらの知見は、一つの個体のように振る舞う群体がどのように形成されるのか、個虫の配置と分化の仕組みを解明する手がかりとなる。
本研究は、国立遺伝学研究所のNIG-JOINT(25A2020、70A2021)、日本学術振興会科研費 研究活動スタート支援(課題番号22K20662)、および海産無脊椎動物研究所からの助成金による支援で実施されました。
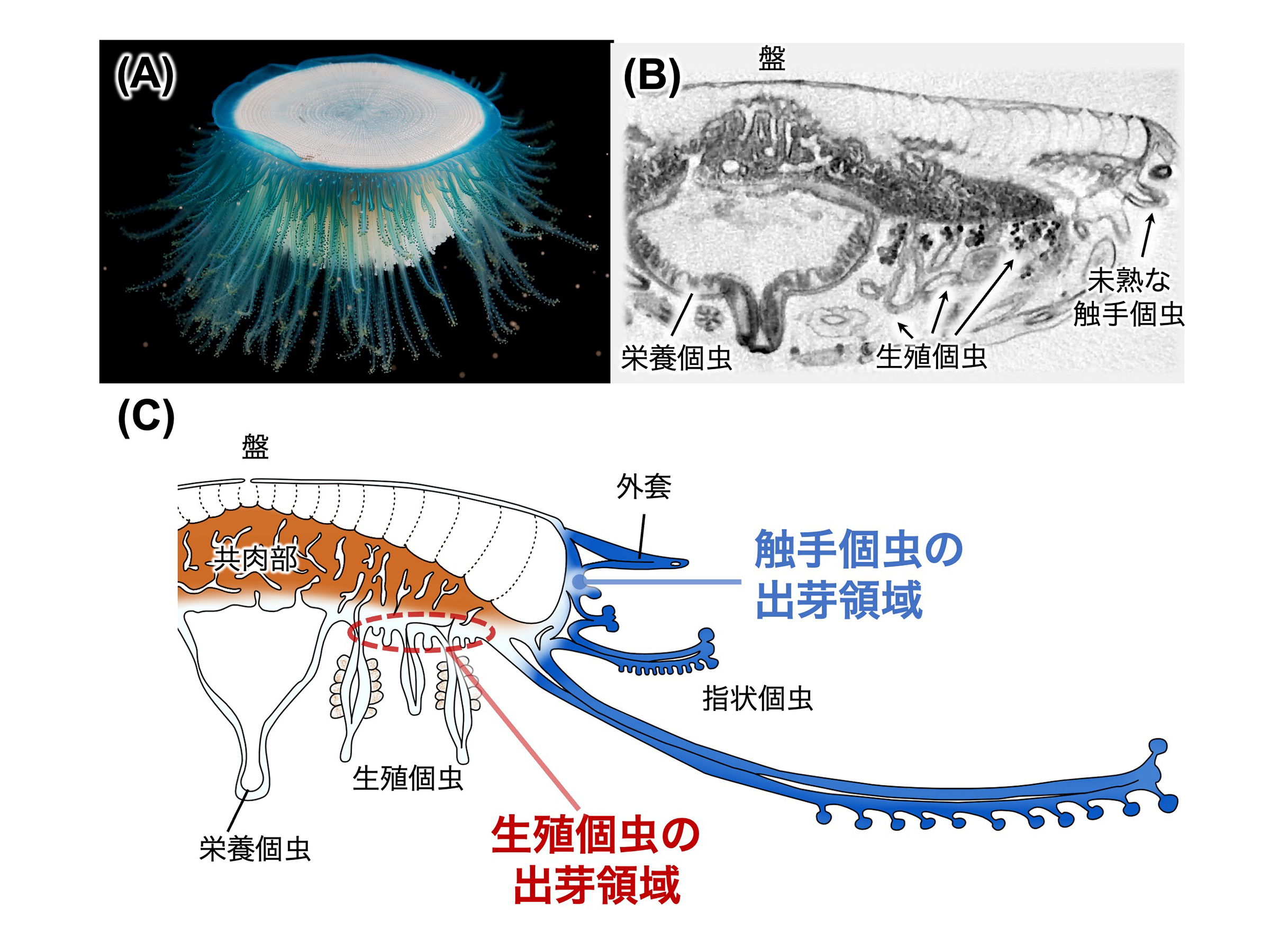
図:(A)ギンカクラゲの群体。(B)マイクロCTによる群体の断面構造。(C)本研究により明らかとなったギンカクラゲ群体の内部構造の模式図。触手個虫の成長領域は群体の縁沿い、特に外套の基部に位置し、生殖個虫の成長領域は共肉部の上皮に広く分布している。
NBRPオンラインWS2025「バイオリソースをみがく最新技術」を開催
「夏休み子ども遺伝学講座」を開催
「生物が『変身』する方法」
●日時:令和7年7月23日(水曜日) 9:30~12:00
●場所:国立遺伝学研究所 講堂
●講師:近藤 滋 先生(国立遺伝学研究所 所長)
●対象:市内小学校4~6年生
●定員:40名(応募者多数の場合、抽選)
●持ち物:筆記用具
●申し込み先:三島市教育委員会 生涯学習課
申込用紙・はがき・電子申請で7/13(日)までにお申込みください。
①氏名 ②フリガナ ③通学する小学校 ④学年 ⑤郵便番号 ⑥住所 ⑦電話番号
「夏休みこども遺伝学講座」と記入し、生涯学習センター4階生涯学習課へ。
〒411-0035 三島市大宮町1-8-38
電話:055-983-0881
物理的性質から考えるクロマチンやDNAのアクセシビリティ
Euchromatin and heterochromatin: implications for DNA accessibility and transcription
Katsuhiko Minami#, Adilgazy Semeigazin#, Kako Nakazato, and Kazuhiro Maeshima*
# co-first authors; * corresponding author
Journal of Molecular Biology (2025) DOI:10.1016/j.jmb.2025.169270
ヒトなどの高等真核細胞では、ゲノムDNAはヒストンに巻きついてヌクレオソームを形成し、これがさらに、転写が活発な「ユークロマチン」から、不活化された「ヘテロクロマチン」まで、さまざまな折りたたまれ方をした凝縮クロマチンドメインを構築しています。過去15年間の研究で、これらのクロマチンドメインが「液体のようにふるまう」ことが明らかになってきました。本論文において、ゲノムダイナミクス研究室の南克彦特任研究員(元・総研大生/学振特別研究員DC2)、Semeigazin Adilgazy総研大生(文科省国費外国人留学生)、仲里佳子総研大生、前島一博 教授は生きた細胞におけるクロマチンの動きや物理的性質について議論しました。さらに、こうした振る舞いが遺伝子転写やDNA複製の制御にどのように関与しているかについて、「DNAアクセシビリティ」の観点から論じました。
1分子ヌクレオソームイメージングに基づく南らの最近の成果(論文及び遺伝研プレスリリース)により、凝縮したクロマチンドメインの中で、ユークロマチンはより液体のように、ヘテロクロマチンはよりゲルのように振る舞うことが明らかになりました。この物理的性質は、大きなタンパク質がどの程度クロマチン内部にアクセスできるか(アクセシビリティ)に直結し、遺伝子の転写やDNA複製・修復といったゲノム機能の制御に深く関与していると考えられています(図)。本論文はJournal of Molecular Biology誌の”Imaging of the central dogma” 特集号に掲載されます。
本研究は、日本学術振興会 科研費 (JP23K17398, JP24H00061, JP23KJ0998)、先進ゲノム支援 (PAGS・JP22H04925)、JST次世代研究者挑戦的研究プログラム (JPMJSP2104)、日本学術振興会特別研究員プログラム (23KJ0998)、および武田科学振興財団の助成を受けて実施されました。
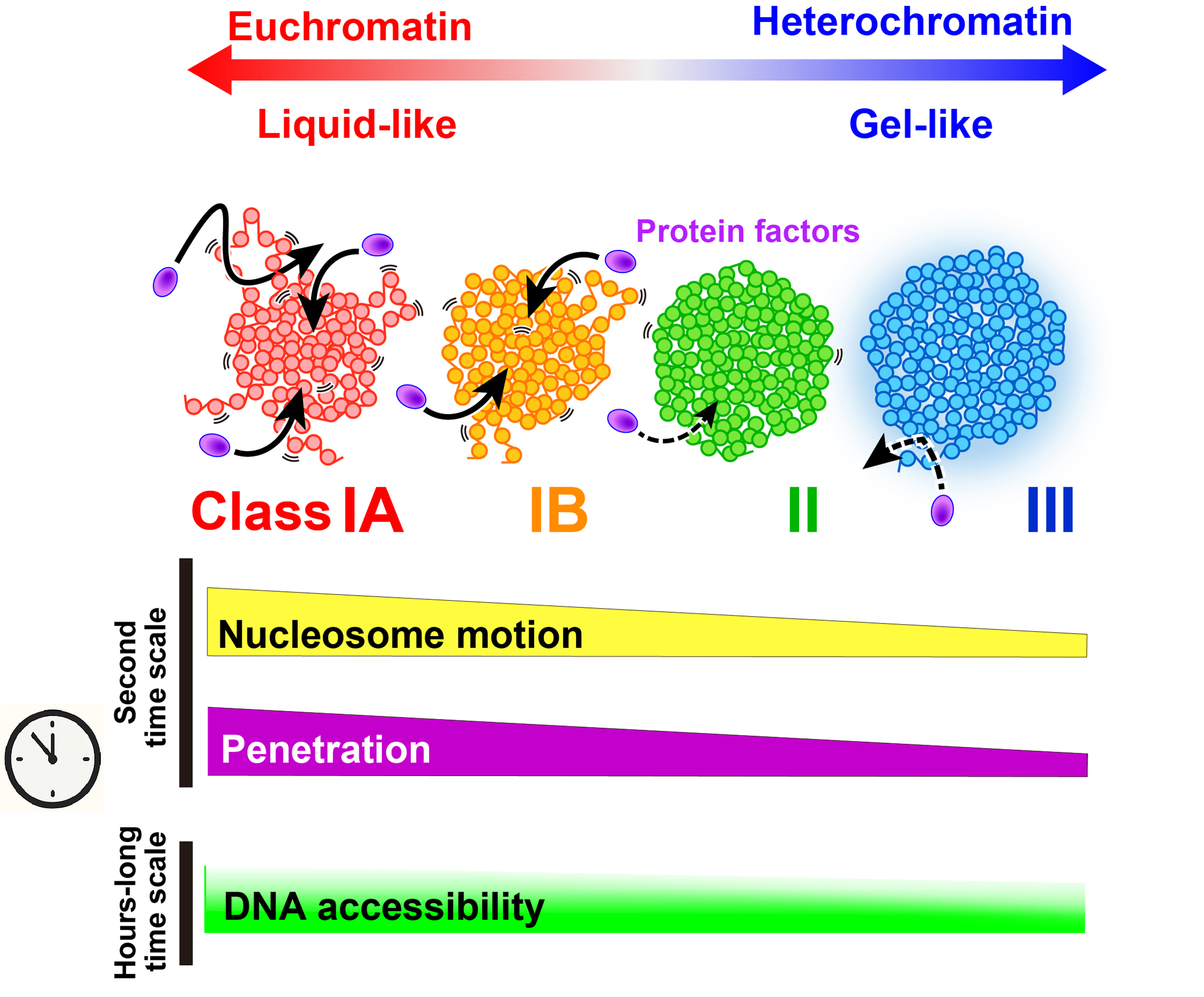
図:ユークロマチン・ヘテロクロマチンの物理的性質とアクセシビリティ
生きた細胞内で、遺伝子の転写が活発に行われるユークロマチン領域(IA, IB)はより「液体様」に、転写の抑制されたヘテロクロマチン(II, III)はより「ゲル様」に振る舞う。この性質は、転写因子(紫)などが短い時間にどれほどクロマチン内部へ「アクセス」しやすいかと直結している。
守田科学研究奨励賞 川口助教が受賞講演
受賞テーマ「三次元組織の再生能力を可能にするクロマチン制御機構の解明と器官再生研究への応用」
自然科学を専門とする若手女性研究者に贈られる「第27回守田科学研究奨励賞」(主催・大学女性協会)の授賞式が2025年6月8日、東京都内で行われ、国立遺伝学研究所(ゲノム・進化研究系)の川口茜助教が受賞講演した。両生類が失われた自らの組織を再生する仕組みの解明に挑んだ川口氏は「私たち生き物は体の中に器官の地図、つまり位置情報を持っている。組織の再生能力が高い両生類などの分子メカニズムを調べ、将来的には応用研究につなげたい」と語った。
同賞は1998年、化学教育者の故・守田純子氏から寄贈された資金をもとに設立。自然科学を専門とする40歳以下の女性研究者を対象に選考し、研究の奨励と科学の発展に貢献する人材育成を目指している。今回は物理、化学、生物、医学分野などの応募者から、川口氏とともに宇宙のブラックホール撮影に取り組む新潟大学の小山翔子助教(同大大学院自然科学研究科数理物質科学系列・同大学創生学部)が選ばれた。

<選考理由>
川口氏の受賞研究テーマは「三次元組織の再生能力を可能にするクロマチン制御機構の解明と器官再生研究への応用」。イモリなどの有尾両生類は、手足などが切断されてもその部分を正しい位置から再生する能力を持っている。川口氏は謎に包まれていた仕組みの解明に挑み、優れた再生能力を持つサンショウウオの仲間のアホロートル(通称・ウーパールーパー)の遺伝子の発現制御状態を調べた。その結果、アホロートルには、切断された組織の再生に伴い活性化される転写因子のネットワークがあり、その転写ネットワークが再生過程に限定的に応答するゲノム領域(エンハンサー)を活性化することを示唆するデータを得た。細胞の位置記憶と再生制御、発生生物学の基礎研究から将来の医療分野にも発展性が高く、国内外で高く評価された。

<川口助教 受賞講演の要旨>
アホロートルはどうして器官を再生できるのか。脊椎動物はそれぞれ異なる再生能力を持っている。例えば、トカゲは「トカゲのしっぽ切り」で知られているように自身に危険が迫ると尾部の一部を切断し本体は逃げ去る訳だが、時間が経てば失われた尻尾は元通りの構造を再構築しているかのように“見える”。しかし、その再生においては、主要な神経系、筋肉、脊椎などを元通り作ることはできず、不完全な再生能力を持つ。
また、無尾両生類である、ツメガエルのオタマジャクシは失った尾部を再生することができるほど、再生能力が高いと考えられる。しかしながら、変態後のカエルにおいて四肢を失った場合は、スパイクと呼ばれる指(極性)のない、四肢とは似ても似つかない構造を作る。つまりツメガエルの再生能力は限定的なものである。
一方、アホロートルでは、四肢を失った場合でも、三次元的に元通り、過不足のない構造を再生することができる。これは切断面の細胞が、発生過程で得た位置情報を記憶しており、それが切断後に活性化されることで、失った位置だけを再構築するのではないかと考えられてきた。そこで私は、遺伝子の発現を制御するメカニズムが鍵であると考え、転写制御機構が腕の節ごとに異なるという可能性についてアプローチし、実験をおこなった。
その結果、アホロートルの四肢は、発生後も、腕の位置情報は位置依存的に維持されていること、それが四肢の切断の刺激と再生の過程を経ることで、位置依存的な転写の活性化が起こることを示した。また、扁形動物のプラナリア、ゼブラフィッシュのような魚類、アホロートルに至るまで再生能力の高い生物では再生を活性化する遺伝子制御ネットワークが共通して作用しているのではないかということを明らかにした。これらの生き物の再生過程を調べることで、三次元構造を再構築する転写制御メカニズムを、より詳細に明らかにしていきたい。
トランスポゾンを用いた効率的な多サブユニット蛋白質の生産
川上研究室・発生遺伝学研究室
Production of multi-subunit proteins in CHO cells by transposase-mediated integration of subunit-splitting vectors.
Keina Yamaguchi, Risa Ogawa, Masayoshi Tsukahara and Koichi Kawakami
Scientific reports (2025) 15, 18512 DOI:10.1038/s41598-025-03301-3
CHO細胞(チャイニーズハムスター卵巣細胞)は、抗体医薬などのタンパク質生産に広く用いられています。私たちは以前、Tol2トランスポゾンシステムを用い、効率的にタンパク質生産細胞株を樹立する方法を確立しました。これは、転移により目的の遺伝子がCHO細胞ゲノムの様々な領域に複数組み込まれることによるものです。
今回、私たちは、モノクローナル抗体遺伝子を発現させる際、L鎖とH鎖遺伝子を両方もつ単一のベクターではなく、各サブユニットを別々にもつふたつのベクターを作製し、CHO細胞に導入しました。
その結果は、最長12週間にわたり安定的にタンパク質を生産し、フェッドバッチ培養(流加培養)において高い生産性を示す細胞株が得られました。これらの細胞株では、異なる種類のモノクローナル抗体ごとに、ゲノムに組み込まれたL鎖とH鎖ベクターのそれぞれのコピー数にばらつきが見られました。抗体高生産細胞株において、これらのベクターが最適なコピー数の比率で組み込まれていることが示唆されました。また、この際に薬剤耐性遺伝子は、H鎖のベクターにしか組み込まれておらず、そのような条件下でも組み込まれたコピー数の最適化が起こることがわかりました。
この研究は、モノクローナル抗体や複数サブユニットからなるタンパク質の生産において、Tol2トランスポゾンシステムが有用である可能性を示し、バイオ医薬品の生産技術の進展に貢献するものです。
本研究は、国立遺伝学研究所と協和キリン株式会社の共同研究として行われました。
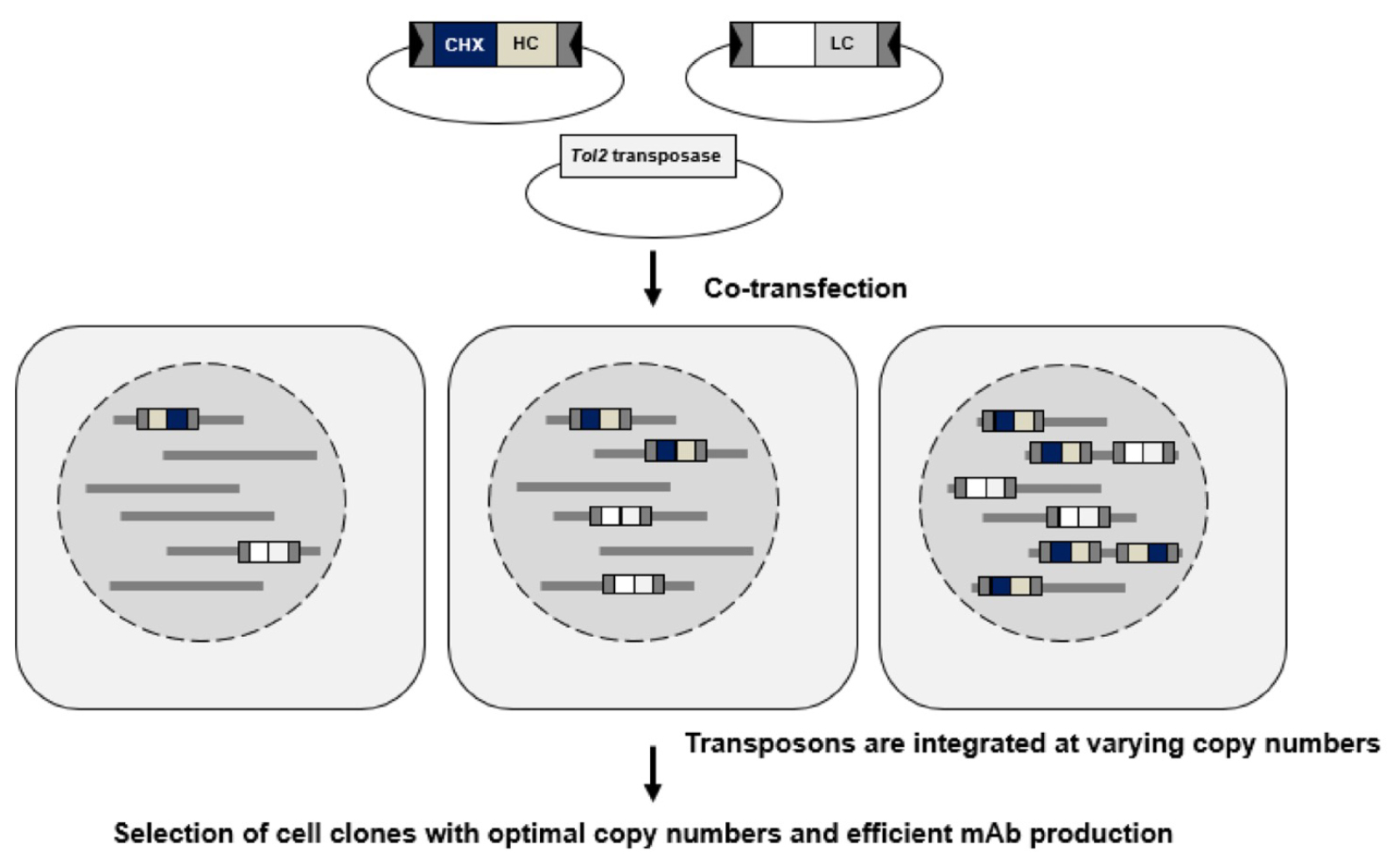
図:本手法の概略図。
H鎖およびL鎖遺伝子をもつ別々のトランスポゾンベクターを、CHO細胞に同時にトランスフェクションする。薬剤耐性(シクロヘキシミド)遺伝子はL鎖ベクターのみがもつ。トランスフェクションされた細胞内では、H鎖およびL鎖ベクターが、さまざまなコピー数で宿主ゲノムに組み込まれる。最適なH鎖およびL鎖ベクターのコピー数をもつ細胞が、モノクローナル抗体を効率的に生産する細胞株として選択可能である。
DNAの核内3次元構造が種分化に影響することを発見
北野研究室・生態遺伝学研究室
工樂研究室・分子生命史研究室
比較ゲノム解析研究室
3D Genome Constrains Breakpoints of Inversions That Can Act as Barriers to Gene Flow in the Stickleback
Yo Y. Yamasaki, Atsushi Toyoda, Mitsutaka Kadota, Shigehiro Kuraku, Jun Kitano
Molecular Ecology (2025), DOI:10.1111/mec.17814
遺伝子を互いに交換しないような生物を別種とするのが一般的ですが,実際の野外生物では,種分化が完成する前の段階,すなわち,遺伝子を部分的に交換している段階の若い種が多く存在します.例えば,人類も昔はネアンデルタール人と遺伝子を交換していたことが知られています.遺伝子が乗っている一つながりとなったDNA分子のことを染色体と呼びます.この染色体上のどこの遺伝子が種間で行き来をし,どこの遺伝子が行き来しないのかを解明することは,種分化がどのようにして完成するのかを理解する上で重要な課題です.
ところでDNAは長大な分子で,その総延長はヒトの場合約2mにも及びます.膨大な配列の中から必要な情報を効率的に取り出せるように,細胞核の中でDNAは高度に制御された形で折りたたまれた,3次元の構造を示します.ではこの「折りたたみ構造」というDNAの特性は2種間での遺伝子の行き来のしやすさに影響するのでしょうか?
生態遺伝学研究室の山﨑曜助教と北野潤教授,比較ゲノム解析研究室の豊田敦特任教授,分子生命研究室の工樂樹洋教授,理化学研究所の門田満隆博士らの研究チームは日本に分布する若い種のペアであるトゲウオ科イトヨ属の2種(ニホンイトヨ,イトヨ)の種分化を対象にこの課題に取り組みました.まずこの2種のDNA配列構造の違いを明らかにするために,染色体レベルで連続した高品質なDNA配列を新規に決定しました.その結果この2種の間には,配列が逆転している領域である逆位が多数見られることが分かりました.またニホンイトヨとイトヨは種間で交雑し遺伝子を交換し合うことが既に知られていましたが,これらの逆位領域では遺伝子の交換は起きていないか,その量がかなり低いようでした.つまりこれらの逆位領域の進化は種分化の完成に貢献していることが示唆されました.
次にDNAの3次元構造のひとつである,DNAが局所的に凝集したTopologically Associating Domain (TAD)と呼ばれる領域を,Hi-C法により特定しました.そして逆位の切断点(末端)はTADとTADの境界点と有意に重複する傾向が認められました.つまりTAD境界は頻繁なDNAの切断が生じることで「切れ目」のように働き,その後のDNA再結合時の配列の逆転を促進していることが示唆されました.以上の結果は,DNAの3次元構造が逆位の発生を通じて種分化に間接的に影響することを示唆しています.これはDNAの3次元構造と種分化の関係性を示した初めての研究です.今後は逆位生成以外にもどのような仕組みでDNAの3次元構造が種分化に影響するのかが解明されることが期待されます.
本研究は日本学術振興会科研費(22H04983,20J01503,21H02542,22KK0105,16H06279)およびJST CREST(JPMJCR20S2)の支援を受けて行われました.
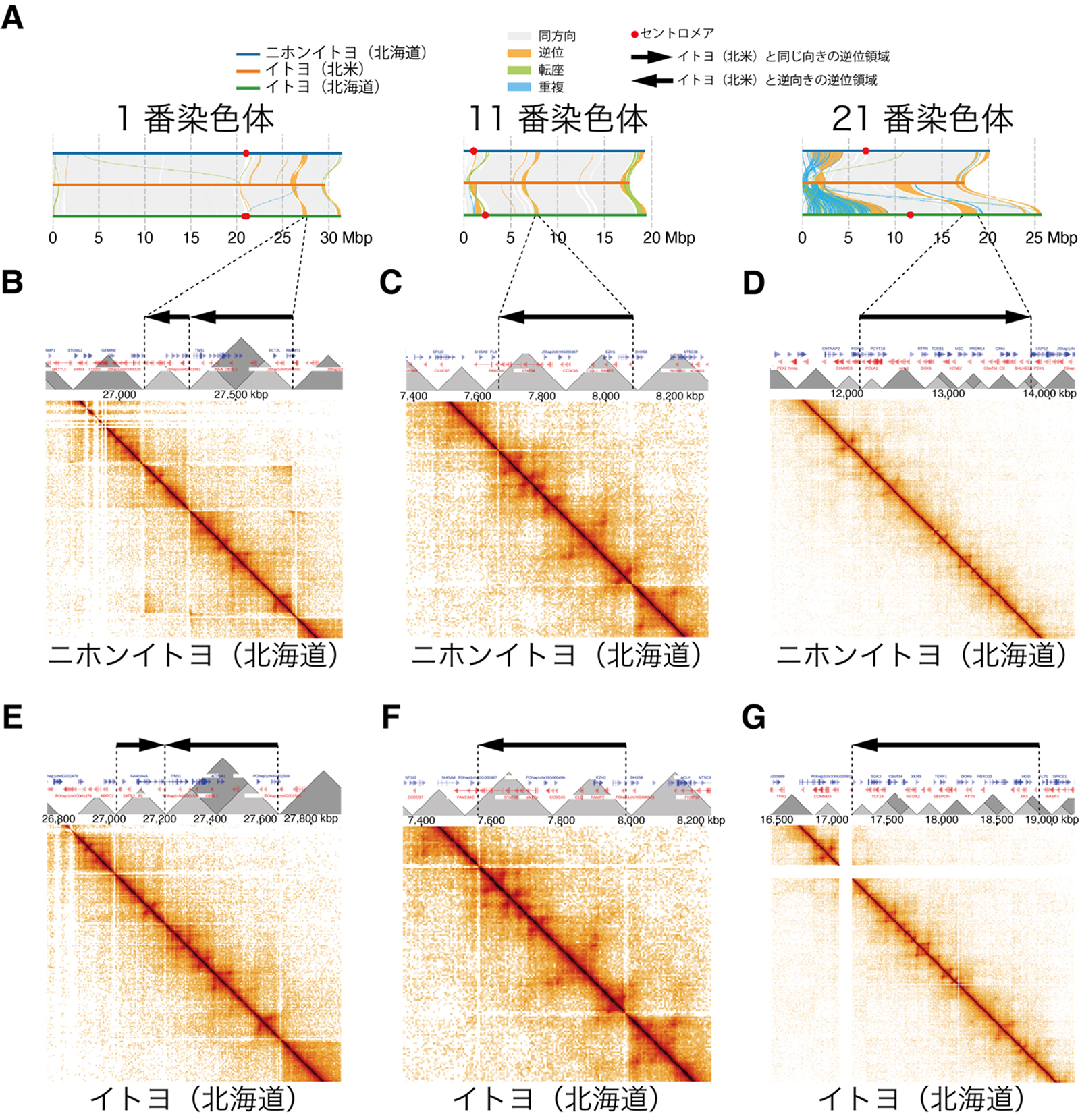
図:逆位領域の切断点(末端)とTAD(グレーの三角形)の境界の頻繁な一致を示す図.(A)ニホンイトヨ(北海道),イトヨ(北米),イトヨ(北海道)を比較した場合に見つかった代表的な4つの逆位を示す.ニホンイトヨ(北海道)(B-D),およびイトヨ(北海道)(E-G)におけるTAD構造と逆位の位置関係.ヒートマップはHi-C法により検出された,DNA領域間の物理的な接触頻度を示す.接触頻度が高い領域がTADとして推定される.
多階層感覚構造研究室 短時間雇用職員(技術補佐員)2名募集
多階層感覚構造研究室では以下の業務を担当していただける短時間雇用職員(技術補佐員)を2名募集いたします。
| 【採用時期】 | 2025年7月以降(応相談) |
| 【職務内容】 | 経理事務補佐(1名)及び英語の事務補佐(1名) |
| 【募集人数】 | 2名 |
| 【応募資格】 | 経験は不問 協調性と積極性のある方 英語の事務補佐については、基礎的な英語力のある方 |
| 【勤務地】 | 国立遺伝学研究所 多階層感覚構造研究室(変更の予定なし) |
| 【給与・待遇】 | 1,147円~1,438円(学歴・経験に応じ決定) |
| 【勤務時間】 | 9:00-16:00(昼休憩1時間)週3−5日勤務(応相談) |
| 【休日】 | 土曜、日曜、祝日、12/29〜1/3 |
| 【雇用期間】 | 年度更新。詳細については、「情報・システム研究機構 短時間雇用職員就業規則」 をご参照ください。 |
| 【応募】 | 封筒またはメール件名に「多階層感覚構造研究室 技術補佐員応募」と明記の上、履歴書(写真添付・メールアドレス記載)を下記宛先まで郵送またはメールでお送りください。 |
| 【応募締切】 | 適任者が見つかり次第、締め切ります。 |
| 【問合先・提出先】 | 〒411-8540 三島市谷田1111 大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所 多階層感覚構造研究室(055)981-6792 米原圭祐 (Email: ) |
細胞が光合成にかけるコスト
―光合成はできればサボりたい―
Costs of photosynthesis and cellular remodeling in trophic transitions of the unicellular red alga Galdieria partita
Shota Yamashita, Shunsuke Hirooka, Takayuki Fujiwara, Baifeng Zhou, Fumi Yagisawa, Kei Tamashiro, Hiroki Murakami, Koichiro Awai, and Shin-ya Miyagishima
Communications Biology (2025) 8, 891 DOI:10.1038/s42003-025-08284-5
多細胞生物の細胞分化に負けず劣らず、単細胞生物においても、周囲の環境や生活環に応じて細胞の形態や性質を大きく変化させる例が数多く知られています。なかでも単細胞藻類において、無機物しか利用できない条件では、緑色などの色素を用いて光を吸収し、光合成によって増殖する(独立栄養成長)一方で、環境中に利用可能な有機炭素源が存在すると、細胞が可逆的に白色化して光合成能力を失い、有機炭素源を利用して増殖する(従属栄養成長)種が、幅広い系統にわたって存在します。このような藻類の栄養性の切り替えは、のちに進化して現れた多細胞植物における(たとえば葉と根のような)細胞分化の起源である可能性も考えられます。しかし、これらの藻類は非モデル生物であり、栄養性の切り替えの生態学的意義やその分子メカニズムはこれまでほとんど明らかになっていませんでした。
このたび、国立遺伝学研究所の山下翔大博士研究員および宮城島進也教授らの研究チームは、静岡大学の粟井光一郎教授、村上博紀助教、琉球大学の八木沢芙美准教授らのチームと共同で、明瞭な栄養性の切り替え機構をもち、同研究グループが遺伝的改変技術を開発してきた単細胞紅藻ガルデリア(Galdieria partita)の独立栄養状態の緑色細胞、従属栄養状態の白色細胞、およびその遷移過程の細胞を、さまざまな手法を用いて比較解析しました。その結果、白色細胞では緑色細胞に比べて葉緑体(色素体)の体積および内部の膜構造が著しく縮退しており、光合成色素と光合成活性をほとんど失っている一方で、ミトコンドリアの体積と呼吸活性が増加し、緑色細胞の1.6倍の増殖速度を示すことがわかりました。また、細胞組成を比較したところ、緑色細胞は白色細胞よりも窒素を1.5倍、タンパク質を1.3倍、脂肪酸を1.7倍多く含んでおり、これらの物質の多くが光合成装置やそれを多数配置するための膜の合成に使われていることも明らかとなりました。さらに、ガルデリア細胞が白色化するかどうかは、細胞外に存在する糖の有無や種類によって決まり、光の有無は決定要因ではないこともわかりました。
これらの結果から、光合成を行うために必要な装置や膜構造の合成・維持は細胞にとって大きなコストとなっており、外部に利用可能な有機炭素源がある環境では、光が存在していても細胞はそれらの合成を停止し、従属栄養成長に切り替えることでより高い増殖速度を実現していることが示唆されました。
今後は、ガルデリアの遺伝的改変技術を活用した栄養性切り替え機構の分子レベルでの解明や、多細胞植物における細胞分化との共通点や進化的関連の解明が期待されます。
本研究は、日本学術振興会 科学研究費補助金(22K15166、24KJ0224、24H00579)および科学技術振興機構 未来社会創造事業(JPMJMI22E1)の助成を受けて実施されました。
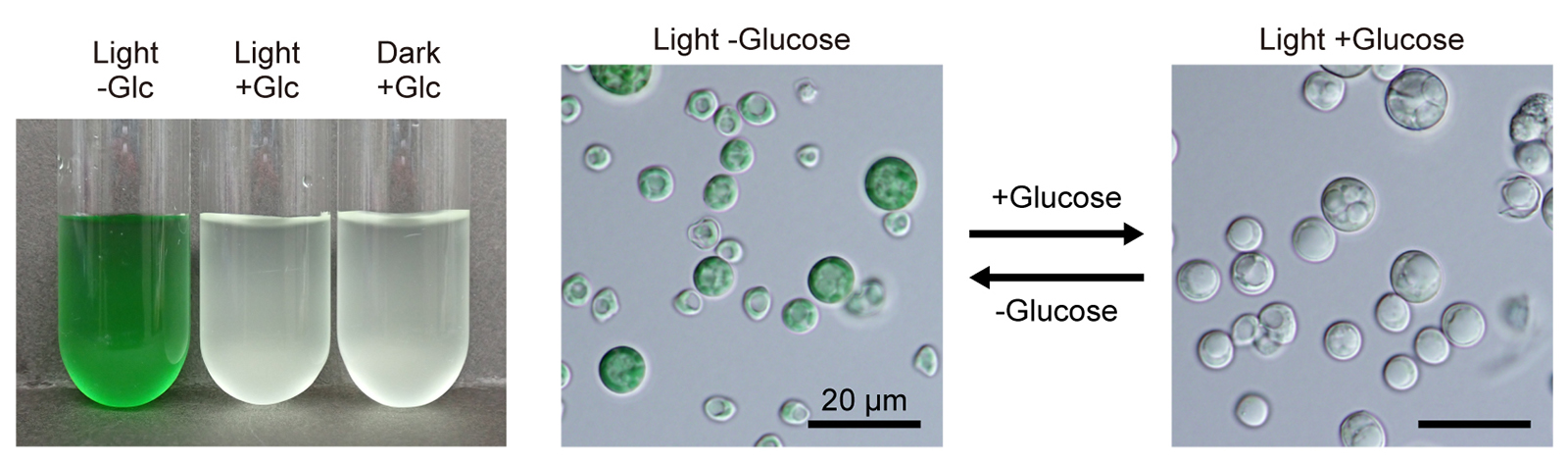
図:異なる条件下で培養したガルデリアの培養液の色(左)と細胞の顕微鏡写真(右)。培地に糖(glucose)を加えると、明暗条件にかかわらず細胞は光合成色素を失い白色化する。逆に糖を除くと細胞は緑色へと変化する。論文の図1A, Bより引用・改変。
















