Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
シースルー運動カラム
Kazuhide Asakawa, Gembu Abe, and Kawakami Koichi
Frontiers in Neural Circuits, 2013 May 28;7:100. DOI: 10.3389/fncir.2013.00100
私たちの行動は、600種類を超えるとも言われる大小様々な種類の筋肉が、特定の組み合わせでタイミングよく収縮・弛緩することで生まれます。この筋肉の収縮リズムを決めている脳や脊髄からの神経シグナルは、「運動ニューロン」と呼ばれる神経細胞を介して筋肉に伝えられます。このため、運動ニューロンの多様性や、筋肉との接続様式を明らかにすることは、行動のメカニズムを理解するのに必要なだけでなく、運動ニューロンの変性によって神経シグナルが筋肉に伝達されなくなってしまう疾患(運動ニューロン病)の病理を解明する上でもとても重要です。
我々は運動ニューロンの多様性や、筋肉との接続様式を明らかにする為に、左右およそ60個ずつの運動ニューロンを含む節(脊髄節)が30個連なってカラム構造を形成しているゼブラフィッシュ幼魚に着目しました。身体の透明性を活かして、幼魚を生かしたまま単一の脊髄運動ニューロンや、カラム構造全体を可視化する遺伝学的技術を開発することで、脊髄運動ニューロンの細胞形態と、体幹筋との位置的な対応関係を詳細に明らかにしました。本研究によって、脊椎動物の脊髄運動ニューロンのカラム構造の微細構造が明らかになっただけでなく、将来、仮想行動中の運動ニューロン群の活動リズムをリアルタイムで観察することや、病態生理学的解析に適した運動ニューロン病のモデルを構築することが実現すると期待されます。
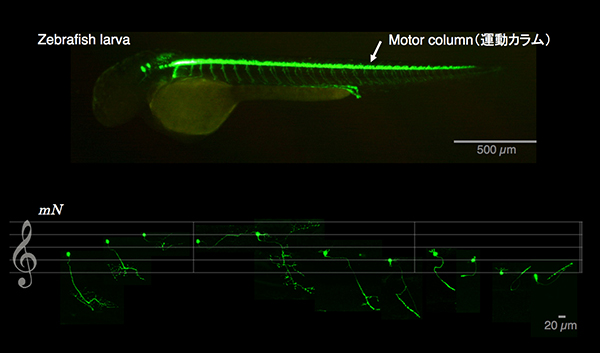
(上)ゼブラフィッシュ幼魚(zebrafish larva)の側面図。
(下)単一細胞染色によって同定された11種類の脊髄運動ニューロン。
これらの運動ニューロンの組み合わせで多様な運動リズムが生まれる。
日本産マウスのゲノム解読からみえてきた実験用マウス系統の起源
![]()
The ancestor of extant Japanese fancy mice contributed to the mosaic genomes of classical inbred strains
Takada, T., Ebata, T., Noguchi, H., Keane, K., Adams, D., Narita, T., Shin-I, T., Fujisawa, H., Toyoda, A., Abe, K., Obata, Y., Sakaki, Y., Moriwaki, K., Fujiyama, A., Kohara, Y. and Shiroishi, T.Genome Research, 2013 Aug;23(8):1329-1338. DOI: 10.1101/gr.156497.113
国立遺伝学研究所と理化学研究所からなる研究グループは、日本産マウス亜種(モロシヌス)由来の二つの系統、MSM/Ms(Mishima: MSM)及びJF1/Ms(Japan-Fancy 1: JF1)の全ゲノム解読を行い、 生物・医学研究分野で広く使われている標準的な実験用マウス系統のゲノム配列との比較解析を行いました。その結果、マウスゲノム多型情報が大幅に拡充されました。 さらに、この情報をもとに標準的な実験用マウス基準系統の成立史についての新知見が得られました。
MSM/Ms系統は静岡県三島市内で捕獲された日本産野生マウス亜種(モロシヌス)、また、JF1/Ms系統は25年ほど前にデンマークのペットショップで発見された日本産愛玩用マウスをもとにして、いずれも国立遺伝学研究所で樹立されました。 今回、これらのマウス系統の次世代シーケンサーによる全ゲノム解読を行い、C57BL/6 などの西ヨーロッパ産マウス亜種(ドメスティカス)由来である実験用マウスの基準系統の間で全ゲノム配列を比較解析しました。 この結果、両グループ間のゲノムの大半で1%程度のDNA配列上の違い(ゲノム多型)が見出されました。現在、多くの研究者がMSM/Ms、JF1/Msのゲノム多型性に起因する多様な形質の違い(表現型)の遺伝解析を進めています。 今回得られた日本産マウス亜種由来の両系統の全ゲノム配列情報や基準系統との間の多型情報は、マウス亜種間多型に基づくゲノム機能学を一層加速させるために重要な研究基盤となります。
さらに、実験用マウスの基準系統の比較ゲノム解析から、世界中で広く使用されている実験用マウス系統のゲノム中にJF1/Ms系統ときわめて類似度の高い配列が散在することを見出しました。 今回のゲノム解析の結果と日本やヨーロッパの古い文献の調査研究により、江戸末期に日本からヨーロッパに渡ったJF1/Msの祖先とヨーロッパ産愛玩用マウスの交配集団が、今日の実験用マウスの基準系統の起源となっていることがわかりました。 さらに、日本産マウスのゲノムが、実験用マウスの基準系統間の遺伝的多型に大きく貢献していることもわかりました。このように、本研究の成果によって、実験用マウス系統の成立に関する長い議論にも終止符を打つことができました。
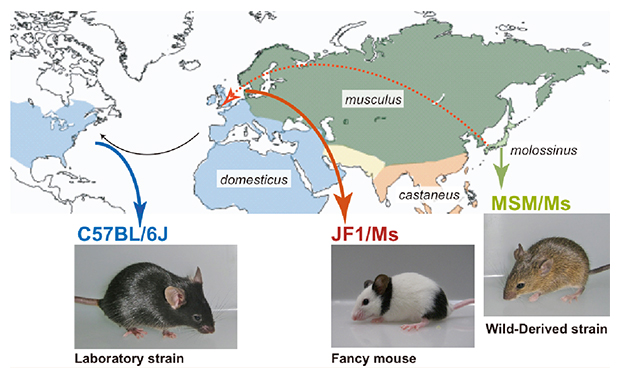
マウス亜種の世界的分布。実験用マウスの基準系統の成立に関与したとされる4つの亜種の分布域を地図上に色別してマップしました。 今回、日本産野生マウス由来のMSM/Ms系統および日本産愛玩用マウス由来のJF1/Ms系統をゲノム解読し、 それらの塩基配列を主に西ヨーロッパ産マウス亜種由来の実験用マウス系統であるC57BL/6Jの基準ゲノム配列と比較解析しました。
ヒト4番染色体長腕部分重複症の原因解明: Hand2遺伝子量効果による四肢・心臓の形態異常
Tamura, M., Hosoya, M., Fujita, M., Iida, T., Amano, T., Maeno, A., Kataoka, T., Otsuka, T., Tanaka, S, Tomizawa, S., and Shiroishi, T.
Human Molecular Genetics, 2013 Jun 15;22(12):2471-2481. DOI: 10.1093/hmg/ddt099
ダウン症候群などの染色体(部分)重複や欠損を伴う染色体異常疾患は、新生児の約1%に発症すると言われています。これらの疾患に特徴的な形態異常や神経症状は、遺伝子コピー数の変化によるものと考えられていますが、多くのケースではその原因遺伝子は特定されていません。
今回、哺乳動物遺伝研究室の田村勝助教(現理研バイオリソースセンター)、城石俊彦教授らのグループは、突然変異マウスRim4 がヒト染色体異常疾患である4番染色体長腕部分重複症のモデル動物であること、また多くの表現型を本疾患の患者さんと共有することを見出しました。更にRim4 とKnockoutマウスの交配実験による遺伝学的解析により、本疾患にみられる心臓中隔欠損や四肢形態異常が、bHLH型転写因遺伝子Hand2 の量的効果が原因であることを明らかにしました。この結果は、Hand2 の遺伝子量の形態形成への関与の解明に加えて、4番染色体長腕部分重複症表現型の分子メカニズムの理解や患者さんのQOL向上に貢献するものと期待されます。
本研究成果は、国立病院機構新潟病院富沢修一院長らのグループとの共同研究によるものです。
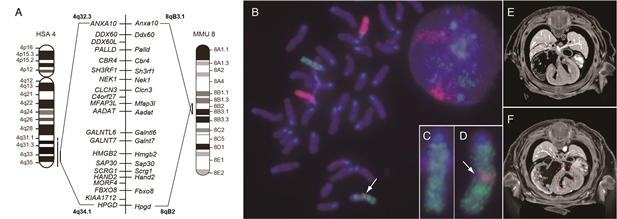
マウス変異Rim4にみられる染色体異常と心室中隔欠損
(A)ヒト4番染色体長腕 (HSA4) 4q32.3-34.1とマウス8番染色体 (MMU8) 8qB2-B3.1は、遺伝子の並びが良く保存されている。(B) Rim4/+マウスの染色体FISH像。6番染色体 (Chr6: 緑色)、8番染色体(Chr8: 赤色)。(C) 野生型Chr6。(D) Rim4 Chr6 の拡大像。矢印は挿入された8qB2-B3.1断片 。(E, F) 胸部micro-CT像。野生型 (E) にはみられない心室中隔欠損(点線丸)(F) がRim4/ Rim4では観察される。
イネの花粉形成遺伝子を同定
Kenji Ueda, Fumiaki Yoshimura, Akio Miyao, Hirohiko Hirochika, Ken-Ichi Nonomura, and Hiroetsu Wabiko
Plant Physiology, 2013 Jun;162(2):858-871. DOI: 10.1104/pp.113.216523
栽培イネのゲノムに含まれる約3万2千個の遺伝子のうち、2万以上の遺伝子が花粉を含む葯で発現するといわれています。しかし、花粉形成過程における機能が解明された遺伝子は限られています。今回の研究では、花粉形成過程で特異的な働きをするイネ遺伝子の同定に成功し、COLLAPSED ABNORMAL POLLEN1 (CAP1 )遺伝子と命名しました。
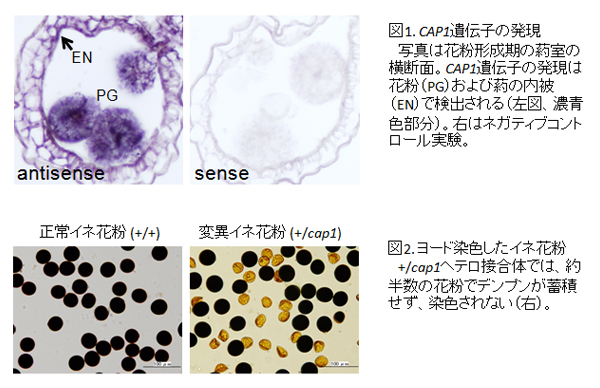
被子植物の花粉は、栄養細胞のなかに2つの精細胞がとりこまれた、3細胞からなる特殊な構造をしています。CAP1 遺伝子は、精細胞が分裂する前の二細胞花粉期の葯で最も強く発現していました(図1)。遺伝子機能が欠損した花粉は、ほとんどの細胞成分が失われて花粉外壁(エキシン)だけの構造になり(図2)、花粉管伸長能が失われます。花粉形成以外のイネの成長には全く影響しないことから、CAP1 の花粉特異的な機能が明らかとなりました。
イネCAP1タンパク質は、植物のL-アラビノキナーゼとよく似ており、細胞壁代謝の過程で生じるL-アラビノースを再利用のためリン酸化している可能性が示唆されました。イネcap1変異体では、アラビノースが再利用されずに花粉内に異常に蓄積する、あるいは花粉の細胞壁代謝が阻害されて崩壊すると予想されます。遺伝子発現パターンがシロイヌナズナのアラビノキナーゼ様遺伝子の1つと酷似することから、CAP1 機能が被子植物で広く保存されており、花粉形成過程において非常に重要な役割を果たすことが示唆されました。
本研究は、秋田県立大学および農業生物資源研究所との共同研究であり、遺伝研共同研究経費(共同研究A、B)の助成を受けて実施されました。
トミヨ隠蔽種間における生態的分化とその遺伝基盤の一端を解明
Ishikawa, A., Takeuchi, N., Kusakabe, M., Kume, M., Mori, S., Takahashi, H., and Kitano, J.
Journal of Evolutionary Biology, 2013 Jul;26(7):1417-1430. DOI: 10.1111/jeb.12146
トゲウオ科魚類は、生息場所によって外見や行動が種間や集団間で大きく異なっていることから、現在、このトゲウオの持つ「多様性」が大きく注目されており、生態学や進化生物学の最前線のモデル生物として世界中で活発に研究されています。今回、生態遺伝学研究室の石川麻乃研究員(学術振興会)や北野潤特任准教授らの研究グループは、北海道東部に生息するトミヨ隠蔽種(外見が似ていて容易に区分できない種)について、隠蔽種間の生殖的隔離、生態的分化、生理的分化等について体系的に解析を行いました。
エゾトミヨ、淡水トミヨ、汽水トミヨの隠蔽3種は遺伝的に明らかに異なっており、同所生息域でも淡水トミヨと汽水トミヨ間の雑種のみがごく稀に採集される程度でした。これら3種は河川の上流から下流にかけて生息域をうまく住み分けて共存しており、摂餌器官や浸透圧耐性能も大きく異ななっていました。一方で、鱗板(体の側面の骨化組織)の変異は、単純な上流-下流勾配にそった変異はみられず、また、その遺伝基盤は近縁のイトヨ属とは異なる遺伝子で決定されていることが明らかになりました。イトヨ属では、Eda遺伝子が鱗板をコントロールしていることが既に知られていますが、トミヨ属ではEda遺伝型と鱗板表現型に相関は見られませんでした。
これらの成果は、トミヨ属とイトヨ属の表現型進化の遺伝基盤が異なっていることを示しており、トミヨ属は、表現型進化の遺伝基盤の一般性を理解するためにイトヨと並び貴重な研究材料となることが示されました。
この研究は、新学術領域「ゲノム遺伝子相関」、JSTさきがけ、国立遺伝学研究所共同利用、日本学術振興会等の助成のもと行われました。

これら三種のトミヨは外見が似ていますが別種であり、うまく生息場所を住み分けて共存していることが分かりました。
脱分化と分化を制御する転写因子
Takafusa Hikichi, Ryo Matoba, Takashi Ikeda, Akira Watanabe, Takuya Yamamoto, Satoko Yoshitake, Miwa Tamura-Nakano, Takayuki Kimura, Masayoshi Kamon, Mari Shimura, Koichi Kawakami, Akihiko Okuda, Hitoshi Okochi, Takafumi Inoue, Atsushi Suzuki, and Shinji Masui
PNAS, 2013 Apr 16;110(16):6412-6417. DOI: 10.1073/pnas.1220200110
分化した細胞を転写因子Oct3/4、Sox2、Klf4、Myc(OSKM)の導入により脱分化させ、iPS化することはできるが、その効率は決して良いものではない。我々はこれが脱分化を阻害する転写因子の発現によるものと考え、ES細胞から分化した神経前駆細胞株において発現している転写因子遺伝子群の中から、ひとつひとつの遺伝子を過剰発現させることにより、iPS化の効率を減少させる少数の転写因子セットを同定した。これらはいずれも発生制御関連転写因子であり、それらをマウス胎児繊維芽細胞や肝芽細胞に導入したところ、直接神経前駆細胞の遺伝子発現プロファイルを誘導することがわかった。このように、本研究により、細胞の分化・脱分化状態が少数の転写因子の発現により制御されており、それらが発現誘導する遺伝子ネットワークのせめぎあいによって細胞の状態が決定していることが明らかとなった。
本研究成果は、京都大学iPS細胞研究所(CiRA)升井伸治博士との共同研究によるものである。
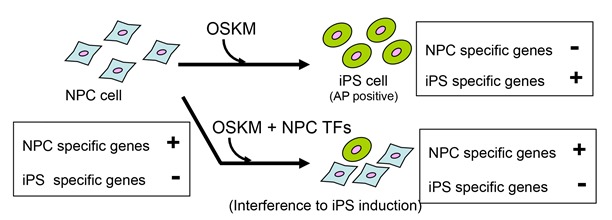
神経前駆細胞(NPC)は、OSKMの導入により脱分化しiPS細胞となる。この脱分化は、NPC特異的転写因子の発現により阻害された。















