ALSの病態の謎。 なぜ体の動きだけ奪われるのか?
プレスリリース
Intrinsically accelerated cellular degradation is amplified by TDP-43 loss in ALS-vulnerable motor neurons in a zebrafish model
Kazuhide Asakawa*, Takuya Tomita, Shinobu Shioya, Hiroshi Handa, Yasushi Saeki, Koichi Kawakami
*筆頭・責任著者
Nature Communications DOI:10.1038/s41467-025-65097-0
ALS(筋萎縮性側索硬化症、きんいしゅくせいそくさくこうかしょう)は、神経細胞が徐々に失われることで、全身の筋肉が衰える難病です。患者数が多いため、精力的に研究がおこなわれてきましたが、発病に至る原因が特定されておらず、有効な治療法も存在しません。この病気で不思議なのは、意識や五感に関わる神経細胞は保たれたまま、体を動かす神経細胞「運動ニューロン」だけが失われることです。さらに、運動ニューロンのなかでも、“大きいもの”(力強い動きを生む)が失われやすく、“小さいもの”(繊細な動きを生む)は影響を受けにくいことが知られています。このような「神経細胞の失われやすさの差」が生まれる仕組みは、ALSに特徴的な謎であり、解明されれば、病因の特定につながるかもしれません。
今回、国立遺伝学研究所の浅川和秀准教授らの研究グループは、ゼブラフィッシュ(生きたまま神経細胞を観察できる)を使った研究で、大型の運動ニューロンでのみ、オートファジー等の、不要なたんぱく質を分解する活性が極めて高いことを発見しました。不要分子の分解は、どの細胞にも起きる作用ですが、大型の細胞は大量のタンパク質分子を合成・分解する必要があるため、特にその負担が大きいのです。浅川准教授らは、ALSに関連する遺伝子変異を導入すると分解はさらに高まり、逆に分解を人工的に抑えると、神経と筋肉の接合が阻害されることも発見しました。これらの事実は、体の動きに関わる脳・脊髄・筋肉といった離れた器官を一本の細胞でつなぐ必要上、必然的に大きくならざるを得ない運動ニューロンが、その大きさゆえに大量のタンパク質を正しく合成・分解するという重い負担を抱えていることを示唆しています。その負担の大きさが、「神経細胞の失われやすさ」を決め、ALS特有の「体が動かなくなる」という症状となってあらわれる可能性が考えられます。
この研究は、情報・システム研究機構国立遺伝学研究所神経システム病態研究室(浅川和秀、塩谷しのぶ)、発生遺伝学研究室(川上浩一)東京大学医科学研究所タンパク質代謝制御分野(冨田拓哉、佐伯泰)、東京医科大学医学総合研究所分子薬理学部門(半田宏)の共同研究として行われました。
研究費:
「生命の彩」ALS研究助成基金研究助成
加藤記念難病研究助成基金研究助成
第一三共生命科学研究振興財団研究助成
武田科学振興財団研究助成
せりか基金研究助成
日本ALS協会「ALS基金」研究奨励金
JSPS科研費(JP22H04657, JP19K06933, JP22H02958, JP23H04266, JP21H02463, JP23H00375)
AMED-PRIME(JP23gm6410011h0003)
The National BioResource Project (NBRP) of the MEXT, Japan.
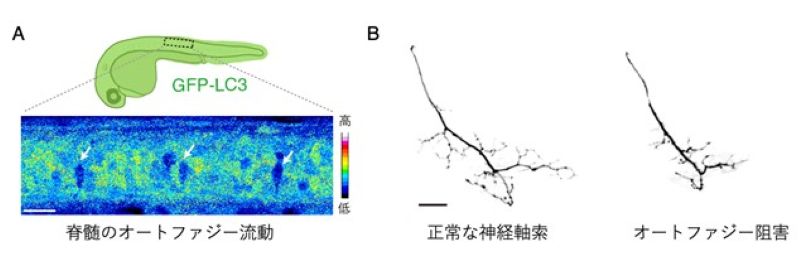
図:A) 大型の運動ニューロンでは、タンパク質を分解する活性(オートファジー流動)が高い。GFP-LC3はオートファジーにより分解される。矢印は、GFP-LC3の分解が活発な大型運動ニューロン。
B)オートファジーを阻害すると運動ニューロンの神経軸索の発達が阻害される(右)。スケールバーは20µm。















