小胞体内でタンパク質凝集を抑えるPIGNの新しい機能の発見
PIGN prevents protein aggregation in the endoplasmic reticulum independently of its function in the GPI synthesis
Shinji Ihara, Sohei Nakayama, Yoshiko Murakami, Emiko Suzuki, Masayo Asakawa, Taroh Kinoshita and Hitoshi Sawa
J Cell Sci 2017 130: 602-613; DOI:10.1242/jcs.196717
遺伝的変異や老化、様々なストレスによってタンパク質が正しい構造を獲得できないときに、不安定なタンパク質が凝集体を形成することが知られており、凝集体の形成は様々な神経変性疾患の発症に関わることが知られています。
私たちはC. elegansやヒト細胞を用いた解析から、小胞体に局在するPIGNタンパク質の異常によってタンパク質の凝集が引き起こされる事を見出しました。PIGNは糖脂質であるGPIアンカーの生合成に必要な酵素として知られていますが、我々は、PIGNがGPIアンカーの生合成に必要な酵素活性非依存的にタンパク質の凝集を抑える機能があること、すなわちPIGNがタンパク質の品質管理に関わること(非古典的機能と定義)を明らかにしました。またヒトではPIGN遺伝子の変異によってMultiple congenital anomalies-hypotonia-seizures syndrome1 (MCAHS1)と総称される知的障害・運動発達障害を示す遺伝子疾患を引き起こしますが、MCAHS1患者と同様の変異をCRISPR/Cas9 法によってC. elegansに導入したところ、タンパク質の凝集を引き起こすこともわかりました。この発見によって、タンパク質の凝集を抑える機構や遺伝子疾患の理解が更に進むものと期待できます。
本研究は、多細胞構築研究室にて伊原伸治助教が中心となり、鈴木えみ子准教授(遺伝子回路研究室)、大阪大学の木下タロウ教授、村上良子准教授の協力のもと行われました。
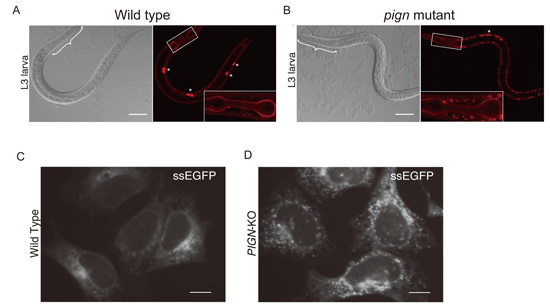
pign変異体で観察される凝集タンパク質
(A) 野生型線虫でのIV型コラーゲン(分泌タンパク質)の局在。(B) pign変異体で観察される凝集タンパク質。スケールバーは10um。凝集タンパク質は筋肉細胞内(白枠)にドット状に観察される。(CとD)分泌型EGFPを発現させた野生型HEK293細胞(C)とPIGN欠損HEK293細胞(D)。線虫のpign変異体と同様の凝集タンパク質が観察される。















