細胞のがん化によって変化するクロマチン動態
Aoi Otsuka, Masa A. Shimazoe, Shigeaki Watanabe, Katsuhiko Minami, Sachiko Tamura, Tohru Kiyono, Fumitaka Takeshita, and Kazuhiro Maeshima* (*Corresponding author)
Single-nucleosome imaging uncovers biphasic chromatin dynamics in inducible human transformed cells
Cell Structure and Function (2025) 先行オンライン公開 DOI:10.1247/csf.25147
真核細胞のゲノムDNAはヌクレオソームとして折りたたまれ、ユークロマチンとヘテロクロマチンを含む動的なドメインを形成します。がん細胞ではクロマチン状態や高次構造の変化が広く報告されていますが、がん化の進行に伴ってクロマチンの動態が時間的にどう変化するかは未解明でした。
ゲノムダイナミクス研究室の大塚碧 総研大生 (SOKENDAI特別研究員)、島添將誠 総研大生 (学振特別研究員DC1)、南克彦 特任研究員、田村佐知子 テクニカルスタッフ、前島一博 教授のグループは、国立がん研究センター 清野透 客員研究員 (公益財団法人 佐々木研究所 客員研究員併任)、渡邊重明 特任研究員、竹下文隆 部門長と協力し、ヒト上皮細胞に がん遺伝子として知られるヒトパピローマウイルス16 E6/E7、MYC、KRAS を導入し、ドキシサイクリンで誘導発現できる“EMR”細胞を樹立しました。このEMR細胞はがん遺伝子の誘導発現に伴い、がん様形質(増殖加速・接触阻害の回避・軟寒天内増殖・ヌードマウスでの腫瘍形成)を示します。生細胞1分子ヌクレオソームイメージングで、誘導後の日〜週スケールのクロマチン動態を追跡したところ、1–3日では変化がなく、5–7日に一過的に上昇し、4週には元のレベルへ戻る「二相性」の性質(図上段)が明らかになりました。また、動態上昇期にはヒストン H3/H4 アセチル化と転写が増加していました(図下段)。これらの結果から、がん遺伝子誘導が広範なアセチル化を伴う一時的なクロマチンの「ゆるみ」、転写活性化を引き起こし、クロマチンの再構築により動態が再安定化すると考えられます。
本研究は、がん化過程におけるクロマチンの物理的ふるまいが時間とともに再編成されることを1分子ヌクレオソームレベルで示し、クロマチン動態が細胞のがん化段階や適応状態を読み解く物理指標になり得ることを示しました。これらの知見はがん化に伴うクロマチン再編成の実体解明に役立つと考えられます。
本研究は、JSPSおよびMEXT KAKENHIの助成金(JP23K17398、JP24H00061、JP23KJ0998、JP24KJ1161)、JST のSPRING JPMJSP2104、および武田科学振興財団の助成を受けて実施されました。
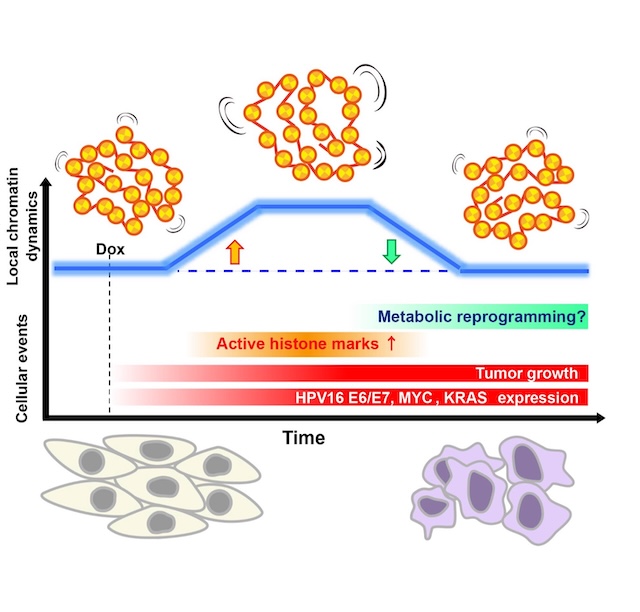
本研究結果のモデル図
EMR細胞のドキシサイクリン誘導によるがん化過程における局所クロマチン動態の二相性変化。ドキシサイクリン添加後、局所クロマチン動態(青の実線)が一過的に上昇(橙色矢印)し、その後、元のレベルへ戻る(緑色矢印)。上昇期には活性ヒストン修飾(H3/H4アセチル化など)と転写が増加する。時間経過とともに動態は再び安定化する一方、がん遺伝子の発現と腫瘍増殖は持続する。この過程には代謝リプログラミングが関与している可能性がある。















