第14回 Mcm8-9の役割: 抗ガン剤感受性、DNA組み替え修復、遺伝性ファンコニ貧血症の理解をつなぐ

テクノロジー開発と培養細胞を使った基礎研究の2本柱で染色体の複製・修復・組換えメカニズムの解明に挑む鐘巻研究室。
今回、京都大学、大阪大学、そして本研究所 堀川准教授(現・徳島大学特任教授)、深川教授との共同研究により、抗がん剤(シスプラチンやマイトマ イシンC)が引き起こすDNA鎖間架橋の修復に関係するタンパク質複合体を発見し、その内容がMolecular Cellに掲載された。
発見したのはMcm8、Mcm9からなる複合体。これらは、もともとDNA複製装置構成因子のファミリーとして同定されていたが、動物細胞内での機能がよく理解されていなかった因子だ。
2010年10月に遺伝研に参加されてから、まだ1年半という超速スピードで発表された論文の内容と発表までの苦労、研究のポイントにインタビューで迫った。
研究の天国、遺伝研だからできた研究
今回、この研究を始めた、Mcm8、Mcm9に着目したきっかけはなんですか?

(鐘)もともと僕らDNA複製のメカニズムに着目していたのです。
DNA複製に一番重要な因子というのは、結局、DNAを、2つに分けるという過程なんですね。
それはDNAヘリカーゼというMcm2-7からなるタンパク質群で構成されるリング状の酵素によって触媒されているんです。
もともとMcm8、9というのは、Mcm2-7に類似した因子として見つけれられていたんですよ。ところが、機能というのはあまりよく分かっていなくて、それを明らかにしたいっていうのが元々の始まりですね。
重要そうだけれども機能が分かっていない因子というきっかけで始めると、競争が激しいのではないでしょうか?
(鐘)もちろん、そう思う研究者も当然います。実際、この論文には海外に競争相手がいて。彼らの論文もMolecular Cellの同じ号に連載されると思います。
学会で彼らと話したときに、お互い同じことをやっているというのに気づいたのですが、情報交換できて有意義だった反面、ストレスに感じる部分も非常にありました。
今回、いままで用いてきた酵母ではなく、ニワトリ由来の培養細胞(DT40)をつかってますよね。遺伝研に移られて1年半で、新しい実験系を立ち上げ、論文にまとめるのは大変だと思うのですが?
(鐘)1つは、やっぱり、酵母での研究バックグラウンドがあったこと。解析方法は、生物が違っても共通に考えることができるので。
2つ目は、DT40細胞を非常に良く研究されている深川教授が近くにいらしたこと。実験手法を習いつつ、一緒にやっていった感じです。
最後は遺伝研の環境ですね。初めてやる実験ばかりで、自分のラボには機材もあまり無かったのですが、共通機器が充実していて、必要なときに、すぐ使えるような機器が周りにたくさんある環境は非常に良かったです。
あと、近い分野の研究者が沢山いることも良かったです。彼らとのコミュニケーションから得られるものはとても大きかったと思います。
僕らの研究室には大学院生が1人いるのですが、就職したいんだったら、たぶんここは別に良いところじゃないと思いますけれども、研究者になりたいんだったら、本当に研究に没頭したいと思うんだったら、ここは天国だと思います。
Mcm8-9で統一的に説明できるとひらめき始めたとき、かなり燃え上がった
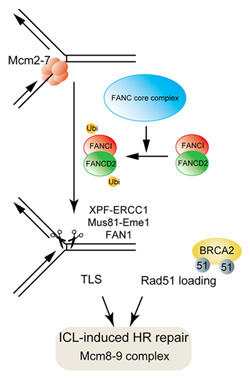
論文の一番のポイントはなんですか?
(鐘)この研究の中で重要なのは、MCM8,MCM9遺伝子を欠損した細胞が、特定の薬剤、つまりシスプラチンとマイトマイシンのようなDNA鎖架橋剤に非常に高い感受性を表すということです。
こういう感受性のパターンは、DNA鎖間架橋に非常に感受性が高い先天性の疾患、ファンコニ貧血症の患者の細胞に非常に類似しています。
この疾患の原因遺伝子は15種類同定されていて、みなDNA鎖間架橋修復に関わることが分かっています。僕らは、臨床をやっているわけではないので断言はできませんが、今回発見したMCM8とMCM9が原因遺伝子の可能性もある、と思っています。
では、今回の研究を行う際に、研究者として一番、面白かったところはどこですか?
(鐘)今までの結果が統一的に説明できるのではないかとひらめき始めたときです。 実は、過去に報告されたMcm8、Mcm9についての論文は、そのほとんどが複製に関わっているという内容なんです。その中に、いくつか不思議な報告、例えば、MCM8遺伝子を欠損したハエは減数分裂がおかしくなるという報告や、閉経が早い女性のゲノムにはMCM8遺伝子に変異があるという報告があったんです。
今回の僕らの発見、つまり、Mcm8-9は染色体組換え修復に関与しているという結果は、全てを統一的に説明できるかもしれないと思ってます。
DNA組換えは、DNA修復・減数分裂・免疫などさまざまな生命現象に関係しているのですが、みな独立に研究されています。Mcm8-9を切り口に、今までの結果が統一的に説明できるのではないかとひらめき始めたときは、かなり燃え上がりましたね。
(西)実験的には大きく3つあります。
まず1つ目は、ノックアウト細胞がつくれてしまったとき。
複製に関わる遺伝子をノックアウトすると細胞が死んでしまうのでノックアウト細胞はできないんです。僕らはMcm8-9の機能を複製だと思いこんでいたので、違う可能性を示唆するデータが出たときは大きな衝撃でした。
2つ目がシスプラチンとかマイトマイシンCという特殊な薬剤に対してのみ、感受性を示すことを見つけたとき。3つ目がMcm8-9の細胞内局在が見えたとき。
鐘巻さんは、修復に関わるなら「核内の特定の領域に局在するのが見えるはず」と言っていたのですが、僕は「そんなの見える訳ないだろ」って言ってたんで す。実験してみると、ダメージをいれたときだけドットが見えた。このとき「これは、絶対に修復に関係している」と確信しました。
高等生物の染色体の現象を遺伝学を使って統括的に理解したい
今後の予定を教えてください。
(鐘)最終的にはヒトレベルできれいな遺伝学的な解析をできるようにしたいというのが僕らの一番の使命です。
僕らは、ずっと、酵母で得られた知識を高等真核生物に応用したい、高等真核生物に挑戦したいと思っています。一方で、出芽酵母でやっていたように、目的の遺伝子を完全に欠損した細胞を使って、遺伝学的にきれいな研究することにもすごくこだわりがある。
実験を開始した2年前は、培養が非常に困難なES細胞を除けば、狙った遺伝子を欠損したり改変できる唯一の培養細胞は、今回使ったニワトリ由来のDT40だったので、DT40を使いましたが、やっぱり、ヒトの細胞でやりたいと思っています。
僕らは既にその準備として、いくつかの新しいテクノロジーを導入しています。それを使えばヒトの細胞でも特定の遺伝子を本当にきれいに遺伝子改変できる。siRNAのように分解するのではなく、本当に遺伝子を欠損した細胞というのを作れるようになってきました。
このほかにも僕らは、時期特異的に遺伝子を発現・分解することができる技術、AID法を持っています。僕らの興味の対象である、複製や組換えに関わる遺伝子を欠損させると細胞は死んでしまう。でも、AID法と遺伝子改変法を組み合わせれば、ヒトの細胞で自由にタンパク質の発現コントロールができる、そういう段階まできました。
多くの研究室では、DNA複製という現象は独立に研究されています。
でも、染色体という視点でみると、細胞は現象を区別してないと思うんです。例えば、複製しているときに、DNAに問題があれば修復する。そのとき、組換えを使うかもしれない。
僕は、複製・修復・組換えは、協調性を保って行われていると思っています。だから、コアな複製に囚われず、もう少し広い視点で他の染色体の現象を統括的に理解したいと思っています。
今回の発見は、低用量抗がん剤治療法の開発やファンコニ貧血症発症メカニズム解明、そして、生命の基本DNA複製、修復、組換えを理解する新たな知見をもたらすことになる。
テクノロジー開発と培養細胞での基礎研究。両輪で染色体の理解に挑む鐘巻研究室の活躍を今後も期待したい。
(2012.07.09 掲載)
掲載論文
Mcm8 and Mcm9 Form a Complex that Functions in Homologous Recombination Repair Induced by DNA Interstrand Crosslinks
Kohei Nishimura, Masamichi Ishiai, Kazuki Horikawa, Tatsuo Fukagawa, Minoru Takata, Haruhiko Takisawa, and Masato T. Kanemaki. Molecular Cell, Published online: 05 July 2012 DOI: 10.1016/j.molcel.2012.05.047
リストに戻る














